В химической промышленности вода используется в следующих направлениях:
- Для технологических целей в качестве:
- растворителя твердых, жидких и газообразных веществ;
- среды для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы и др.);
- промывной жидкости для газов;
- экстрагента и абсорбента различных веществ.
- Как теплоноситель (в виде горячей воды и пара) и хладоагента для обогрева и охлаждения аппаратуры.
- В качестве сырья и реагента для производства различной химической продукции (например, водорода, ацетилена, серной и азотной кислот и др.)
В химических производствах используются три схемы водооборота в зависимости от тех изменений, которые претерпевает вода в процессе производства:
- вода только нагревается и должна быть перед возвратом охлаждена в градирнях или бассейнах ;
- вода только загрязняется и должна быть перед возвратом очищена в специальных очистных сооружениях;
- вода нагревается и загрязняется. Этот тип водооборота представляет комбинацию водооборотов первого и второго типов.
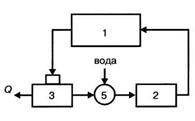
Цикл с охлаждением оборотной воды:
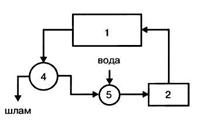
Цикл с очисткой оборотной воды:
- технологическая установка (цех);
- насосная станция;
- градирня (бассейн);
- очистные сооружения;
- камера для пополнения потерь воды
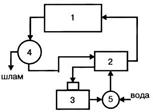
Цикл с очисткой и охлаждением оборотной воды:1 - технологическая установка (цех); 2 - насосная станция; 3 - градирня (бассейн); 4 - очистные сооружения; 5 - камера для пополнения потерь воды
Вода, используемая в химической промышленности (технологическая вода) должна удовлетворять по качеству определенным требованиям того или иного производства. Качество воды определяется совокупностью ее физических и химических характеристик, к которым относятся: цвет, прозрачность, запах, общее солесодержание, жесткость, окисляемость, реакция (рН), которые зависят от содержания в воде различных примесей. Для промышленных вод важнейшими из этих характеристик являются жесткость, окисляемость, реакция и содержание примесей различной дисперсности.
Жесткостью называется свойство воды, обусловленное присутствием в ней солей кальция и магния. В зависимости от природы анионов различают временную (устранимую, карбонатную) жесткость, зависящую от наличия в воде бикарбонат-ионов HCO3-, и постоянную (некарбонатную) жесткость, вызываемую присутствием хлорид-ионов Cl-, нитрат-ионов NO3- и сульфат-ионовSO42-. Сумма временной и постоянной жесткости называется общей жесткостью воды:
[TEX]Жо = Жп + Жв[/TEX].
Жесткость воды выражается суммой концентраций ионов кальция и магния, содержащихся в 1 литре воды, то есть в ммоль/л. По значению общей жесткости воды делятся на мягкую (Жо менее 2), средней жесткости ( Ж0 = 2-10 ммоль/л) и жесткую ( Жоболее 10).
Окисляемостью называется свойство воды, обусловленное присутствием в ней органических веществ, легкоокисляющихся соединений железа и сероводорода, способных окисляться различными окислителями. Так как состав этих примесей неопределенен, окисляемость воды выражается в количестве перманганата калия или эквивалентном ему количестве кислорода, затраченного на окисление 1 литра воды, то есть мг/л.
Активная реакция воды характеризует ее кислотность и щелочность. Она зависит от присутствия в воде некоторых газов, реагирующих с водой (хлор, оксид углерода и др.), растворимых гуминовых кислот и веществ, вносимых в водоем промышленными стоками. Для большинства природных вод активная среда характеризуется величиной рН=6,5-8,5.
Водоподготовкой называют комплекс операций по удалению из природной воды вредных для производства примесей, содержащихся в ней в виде взвесей, коллоидных частиц, растворенных солей и газов.
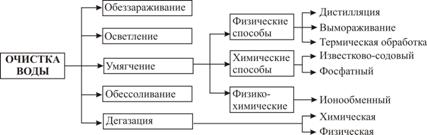
Схема промышленной водоподготовки
Одной из основных и обязательных операций водоподготовки технологической воды является ее умягчение.
Умягчением называется обработка воды для понижения ее жесткости, то есть уменьшения концентрации ионов Са+2 различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в их карбонаты, выпадающие в осадок:
- [TEX]Ca(HCO3)2 = CaCO3 + CO2 +H2O[/TEX]
Этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и известковосодовый, заключающиеся в обработке воды тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
- 2Na3PO4 + 3CaSO4 = Ca3(PO4)2 + 3Na2SO4
- .
Во втором случае протекают две реакции. Бикарбонаты кальция и магния реагируют с гидроксидом кальция, чем устраняется временная жесткость:
[TEX]Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O[/TEX]
а сульфаты, нитраты и хлориды — с карбонатом натрия, чем устраняется постоянная жесткость:
- [TEX]CaSO4 + Na2CO3 = CaCO3 + Na2SO4[/TEX]



