- Общие представления о дисперсных системах
- Получение и очистка коллоидных растворов
- Оптические свойства коллоидных растворов
- Мицелярная теория строения коллоидных систем
- Устойчивость и коагуляция коллоидных систем
Ключові терміни:
Поглощение света, агрегатная устойчивость, аддитивность, адсорбционный слой противоионов, антагонизм, гранула, двойной электрический слой ДЭС, диспергационные методы, дисперсионная среда, дисперсная фаза, дисперсная система, диффузный слой, золи, кинетическая (седиментационная) устойчивость, коагуляция, конденсационные методы, лиотропные ряды, мицелла, пена, пептизация, порог коагуляции, потенциалопределяющими, правило Шульца – Гарди, противоионы, рассеяние света, синергизм, суспензия, теория ДЛФО, уравнение Рэлея, электрокинетический ξ - потенциал, электролита-стабилизатора, эмульсия
Общие представления о дисперсных системах
Химическое взаимодействие в гомогенных реакций происходит при эффективных столкновениях активных частиц, а в гетерогенных – на поверхности раздела фаз при контакте реагирующих веществ, причем, скорость и механизм реакции зависят от площади поверхности, которая тем больше, чем сильнее развита поверхность. С этой точки зрения особый интерес представляют дисперсные системы, обладающие высокой удельной поверхностью.
Дисперсная система – это смесь, состоящая как минимум из двух веществ, которые не реагируют друг с другом химически и обладают практически полной взаимной нерастворимостью. Дисперсная система - это система, в которой очень измельченные частички одного вещества равномерно распределены в объеме другого.
Рассматривая дисперсные системы, различают два понятия: дисперсная фаза и дисперсионная среда (рис. 10.1).
Дисперсная фаза – это совокупность частиц диспергированного до мелких размеров вещества, равномерно распределенных в объеме другого вещества. Признаками дисперсной фазы является раздробленность и прерывистость.
Дисперсионная среда – это вещество, в котором равномерно распределены частицы дисперсной фазы. Признаком дисперсионной среды является ее непрерывность.
Дисперсную фазу можно отделить от дисперсионной среды физическим способом (центрифугированием, сепарированием, отстаиванием и т. п.).
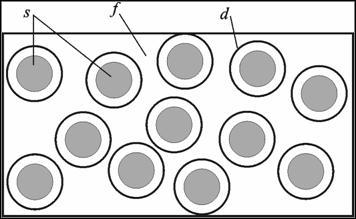
Рисунок 10.1 – Дисперсная система: частицы дисперсной фазы s (в виде мелких твердых частичек, кристалликов, капель жидкости, пузырьков газа, ассоциатов молекул или ионов), обладающие адсорбционным слоем d, распределены в однородной непрерывной дисперсионной среде f.
Дисперсные системы классифицируют по разным отличительным признакам: дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними, отсутствию или образованию структур в дисперсных системах.
Классификация по степени дисперсности
В зависимости от размеров частиц дисперсной фазы все дисперсные системы условно делятся на три группы (рис. 10.2).
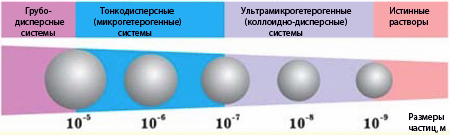
Рисунок 10.2 – Классификация дисперсных систем по размеру частиц (для сравнения приведены размеры частиц в истинных растворах)
1. Грубодисперсные системы, в которых размер частиц более 1мкм (10–5м). Для этой группы дисперсных систем характерны такие признаки: частицы дисперсной фазы оседают (или всплывают) в поле гравитационных сил, не проходят сквозь бумажные фильтры; их можно рассмотреть в обычном микроскопе. К грубодисперсным системам относятся суспензии, эмульсии, пыль, пена, аэрозоли и т.п.
Суспензия – это дисперсная система, в которой дисперсной фазой является твердое вещество, а дисперсионной средой – жидкость.
Примером суспензии может быть система, образующаяся при взбалтывании глины или мела в воде, краски, пасты.
Эмульсия – это дисперсная система, в которой жидкая дисперсная фаза равномерно распределена в объеме жидкой дисперсионной среды, т.е. эмульсия состоит из двух взаимно нерастворимых жидкостей.
В качестве примера эмульсий можно назвать молоко (в нем дисперсной фазой выступают капли жидкого жира, а дисперсионной средой – вода), сливки, майонез, маргарин, мороженое.
При отстаивании суспензии и эмульсии разделяются (расслаиваются) на составные части: дисперсную фазу и дисперсионную среду. Так, если энергично взболтать бензол с водой, то образуется эмульсия, которая спустя некоторое время разделяется на два слоя: верхний бензольный и нижний водный. Для предотвращения расслаивания эмульсий к ним прибавляют эмульгаторы – вещества, придающие эмульсиям агрегатную стабильность.
Пена – ячеистая грубодисперсная система, в которой дисперсной фазой является совокупность пузырьков газа (или пара), а дисперсионной средой – жидкость.
В пенах общий объем находящегося в пузырьках газа может в сотни раз превосходить объем жидкой дисперсионной среды, заключенной в прослойках между пузырьками газа.
2. Микрогетерогенные (или тонкодисперсные) промежуточные системы, в которых размер частиц колеблется в пределах 10–5–10–7м. К ним относятся тонкие взвеси, дымы, пористые твердые тела.
3. Ультрамикрогетерогенные (или коллоидно-дисперсные) системы, в которых частицы размером 1–100нм (10–9–10–7м) состоят из 103_109 атомов и отделены от растворителя поверхностью раздела. Коллоидные растворы характеризуются предельно-высокодисперсным состоянием, их обычно называют золи, или часто лиозоли, чтобы подчеркнуть, что дисперсионной средой является жидкость. Если в качестве дисперсионной средой взята вода, то такие золи называют гидрозолями, а если органическая жидкость — органозолями.
Для большинства тонкодисперсных систем присущи определенные особенности:
-
невысокая скорость диффузии;
-
частицы дисперсной фазы (т.е. коллоидные частицы) можно рассмотреть лишь с помощью ультрамикроскопа или электронного микроскопа;
-
рассеивание света коллоидными частицами, вследствие чего в ультрамикроскопе они приобретают вид световых пятен – эффект Тиндаля (рис. 10.3);
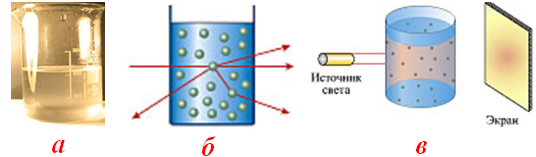
Рисунок 10.3 – Ультрамикрогетерогенная (тонкодисперсная) система: а) коллоидный раствор; б) схема отклонения узкого луча света при прохождении через коллоидный раствор; в) рассеивание света коллоидным раствором (эффект Тиндаля)
- на поверхности раздела фаз в присутствии стабилизаторов (ионов электролитов) образуется ионный слой или сольватная оболочка, способствующие существованию частиц в суспендированном виде;
- дисперсная фаза является либо совсем нерастворимой, либо незначительно растворимой в дисперсионной среде.
В качестве примеров коллоидных частиц можно привести крахмал, белки, полимеры, каучук, мыла, Алюминий и Ферум (III) гидроксиды.
Классификация дисперсных систем соотношению агрегатных состояний дисперсной фазы и дисперсионной среды
Данная классификация предложена Оставльдом (табл. 10.1). При схематической записи агрегатного состояния дисперсных систем первым указывают буквами Г (газ), Ж (жидкость) или Т (твердое) агрегатное состояние дисперсной фазы, а затем ставят тире (или знак дроби) и записывают агрегатное состояние дисперсионной среды.
Таблица 10.1 – Классификация дисперсных систем
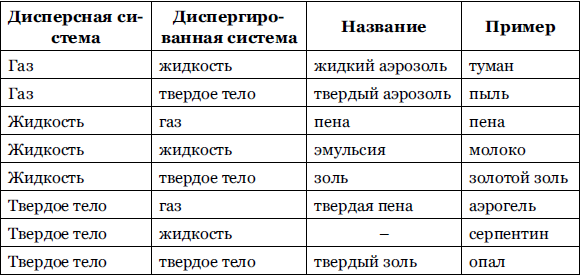
Классификация дисперсных систем по интенсивности молекулярного взаимодействия
Данная классификация предложена Г.Фрейндлихом и применяемая исключительно для систем с жидкой дисперсионной средой.
- Лиофильные системы, в которых дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться – это растворы коллоидных поверхностно-активных веществ (ПАВ), растворы высокомолекулярных соединений (ВМС). Среди разнообразных лиофильных систем наиболее важны в практическом отношении ПАВ, которые могут находиться как в молекулярно-растворенном состоянии, так и в виде агрегатов (мицелл), состоящих из десятков, сотен и более молекул.
- Лиофобные системы, в которых дисперсная фаза не способна взаимодействовать с дисперсионной средой и растворяться в ней. В лиофобных системах взаимодействие между молекулами различных фаз значительно слабее, чем в случае лиофильных систем; межфазное поверхностное натяжение велико, вследствие чего система проявляет тенденцию к самопроизвольному укрупнению частиц дисперсной фазы.
Классификация дисперсных систем по физическому состоянию
Автор классификации П.Ребиндером. По этой классификации дисперсная система обозначается дробью, в которой дисперсная фаза ставится в числителе, а дисперсионная среда – в знаменателе. Например: Т1/Ж2 обозначает дисперсную систему с твердой фазой (индекс 1) и жидкой дисперсионной средой (индекс 2). Классификация по Ребиндеру делит дисперсные системы на два класса:
1. Свободнодисперсные системы – золи, в которых дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов), обладает текучестью, а частицы дисперсной фазы не контактирует друг с другом, участвуя в беспорядочном тепловом движении и свободно перемещаясь под действием силы тяжести. К ним относятся аэрозоли, лиозоли, разбавленные суспензии и эмульсии.
Примеры свободнодисперсных систем:
- Дисперсные системы в газах с коллоидной дисперсностью (Т1/Г2– пыль в верхних слоях атмосферы, аэрозоли), с грубой дисперсностью (Т1/Г2 – дымы и Ж1/Г2 – туманы);
- Дисперсные системы в жидкостях с коллоидной дисперсностью (Т1/Ж2 – лиозоли, дисперсные красители в воде, латексы синтетических полимеров), с грубой дисперсностью (Т1/Ж2 – суспензии; Ж1/Ж2 – жидкие эмульсии; Г1/Ж2 – газовые эмульсии);
- Дисперсные системы в твердых телах: Т1/Т2 – твердые золи, например, золь желтого металла в стекле, пигментированные волокна, наполненные полимеры.
2. Связнодисперсные (или сплошные) системы. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры. Такие системы оказывают сопротивление деформации сдвига. Связнодисперсные системы твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки, ограничивающей текучесть дисперсной системы и придающей ей способность сохранять форму. Подобные структурированные коллоидные системы называют гелями.
Примеры связнодисперсных систем:
- Дисперсные системы с жидкой поверхностью раздела фаз (Г1/Ж2 – пены; Ж1/Ж2 – пенообразные эмульсии);
- Дисперсные системы с твердой поверхностью раздела фаз (Г1/Т2 – пористые тела, натуральные волокна, пемза, губка, древесные угли; Ж1/Т2 – влага в граните; Т1/Т2 – взаимопроникающие сетки полимеров).
Получение и очистка коллоидных растворов
Получение коллоидных растворов
Коллоидные растворы могут быть получены диспергационными или конденсационными методами.
1. Диспергационные методы — это способы получения лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров.
Механическое дробление грубодисперсных систем осуществляется путем: раздробления, удара, истирания, расщепления. Измельчение частиц до размеров в несколько десятков микрон осуществляется с помощью шаровых мельниц. Очень тонкое раздробление (до 0,1-1 микрона) достигается на специальных коллоидных мельницах с узким зазором между быстро вращающимся ротором (10-20 тыс.об/мин) и неподвижным корпусом, причем частицы разрываются или истираются в зазоре. Работами П. А. Ребиндера установлено явление понижения сопротивления твердых тел упругим и пластическим деформациям, а также механическому разрушению под влиянием адсорбции поверхностно-активных веществ. Поверхностно-активные вещества облегчают диспергирование и способствуют значительному повышению степени дисперсности.
2. Конденсационные методы - это способы получения коллоидных растворов путем объединения (конденсации) молекул и ионов в агрегаты коллоидных размеров. Система из гомогенной превращается в гетерогенную, т. е. возникает новая фаза (дисперсная фаза). Обязательным условием является пересыщенность исходной системы.
Конденсационные методы классифицируют по природе сил, вызывающих конденсацию, на физическую конденсацию и химическую конденсацию.
Физическая конденсация может осуществляться из паров или путем замены растворителя.
Конденсация из паров. Исходное вещество находится в паре. При понижении температуры пар становится пересыщенным и частично конденсируется, образуя дисперсную фазу. Таким путем получают гидрозоли ртути и некоторых других металлов.
Метод замены растворителя. Метод основан на изменении состава и свойств дисперсионной среды. Например, спиртовой раствор серы, фосфора или канифоли влить в воду, вследствие понижения растворимости вещества в новом растворителе раствор становится пересыщенным и часть вещества конденсируется, образуя частицы дисперсной фазы.
Химическая конденсация состоит в том, что вещество, образующее дисперсную фазу, получается в результате химической реакции. Чтобы в ходе реакции образовался коллоидный раствор, а не истинный раствор или осадок, необходимо соблюдение, по крайней мере, трех условий:
- вещество дисперсной фазы нерастворимо в дисперсионной среде;
- скорость образования зародышей кристаллов дисперсной фазы гораздо больше, чем скорость роста кристаллов; это условие выполняется обычно тогда, когда концентрированный раствор одного компонента вливается в сильно разбавленный раствор другого компонента при интенсивном перемешивании;
- одно из исходных веществ взято в избытке, именно оно является стабилизатором.
Методы очистки коллоидных растворов.
Полученные тем или иным способом коллоидные растворы обычно очищают от низкомолекулярных примесей (молекул и ионов). Удаление этих примесей осуществляется методами диализа,(электродиализ), ультрафильтрации.
Диализ – метод очистки с помощью полупроницаемой мембраной, которая отделяет коллоидный раствор от чистой дисперсионной среды. В качестве полупроницаемой (т.е. проницаемой для молекул и ионов, но непроницаемой для частиц дисперсной фазы) мембраны применяют пергамент, целлофан, коллодий, керамические фильтры и другие тонкопористые материалы. В результате диффузии низкомолекулярные примеси переходят во внешний раствор.
Ультрафильтрацией называется диализ, проводимый под давлением во внутренней камере. По существу, ультрафильтрация является не методом очистки золей, а лишь методом их концентрирования.
Оптические свойства коллоидных растворов
При падении света на дисперсную систему могут наблюдаться следующие явления:
- прохождение света через систему;
- преломление света частицами дисперсной фазы (если эти частицы прозрачны);
- отражение света частицами дисперсной фазы (если частицы непрозрачны);
- рассеяние света;
- абсорбция (поглощение) света дисперсной фазой.
Рассеяние света наблюдается для систем, в которых частицы дисперсной фазы меньше, или соизмеримы с длиной волны падающего света. Напомним, что размеры частиц дисперсной фазы в коллоидных растворах — 10-7-10-9 м. Следовательно, светорассеивание является характерным явлением для изучаемых нами коллоидных систем.
Теорию светорассеяния создал Рэлей. Он вывел уравнение, которое связывает интенсивность рассеянного света I с интенсивностью падающего света I0. справедливое при условии, что:
- частицы имеют сферическую форму;
- частицы не проводят электрический ток (т.е. являются неметаллическими);
- частицы не поглощают свет, т. е. являются бесцветными;
- коллоидный раствор является разбавленным в такой степени, что расстояние между частицами больше длины волны падающего света.
-
(10.1)
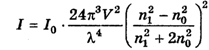
- где V — объем одной частицы, ,
- λ — длина волны;
- n1 — показатель преломления частицы;
- nо — показатель преломления среды.
Из уравнения Релея вытекают следующие выводы:
- Интенсивность рассеянного света тем больше, чем больше различаются показатели преломления частицы и среды (n1 - п0).
- Если показатели преломления п1 и n0 одинаковы, то светорассеяние будет отсутствовать и в неоднородной среде.
- Интенсивность рассеянного света тем больше, чем больше частичная концентрация v. Массовая концентрация c, г/дм3, которой обычно пользуются при приготовлении растворов, связана с частичной концентрацией выражением:
-
(10.2)
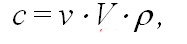
где ρ — плотность частицы.
Следует отметить, что эта зависимость сохраняется только в области малых размеров частиц. Для видимой части спектра это условие соответствует значениям 2•10-6см< r < 4•10-6 см. С увеличением r рост I замедляется, а при r > λ, рассеяние заменяется отражением. Интенсивность рассеянного света прямо пропорциональна концентрации.
4. Интенсивность рассеянного света обратно пропорциональна длине волны в четвертой степени.
Это означает, что при прохождении через коллоидный раствор пучка белого света преимущественно рассеиваются короткие волны — синей и фиолетовой частей спектра. Поэтому бесцветный золь в рассеянном свете имеет голубоватую окраску, а в проходящем свете — красноватую. Голубой цвет неба также обусловлен рассеянием света мельчайшими капельками воды в атмосфере. Оранжевый или красный цвет неба при восходе или заходе Солнца объясняется тем, что утром или вечером наблюдается, главным образом, свет, прошедший через атмосферу.
поглощение света. Уравнение Рэлея выведено для неокрашенных золей, т. е. не поглощающих свет. Однако многие коллоидные растворы имеют определенную окраску, т.е. поглощают свет в соответствующей области спектра — золь всегда окрашен в цвет, дополнительный к поглощенному. Так, поглощая синюю часть спектра (435-480 нм), золь оказывается желтым; при поглощении синевато-зеленой части (490-500 нм) он принимает красную окраску. Если лучи всего видимого спектра проходят через прозрачное тело или отражаются от непрозрачного, то прозрачное тело кажется бесцветным, а непрозрачное — белым. Если тело поглощает излучение всего видимого спектра, оно кажется черным. Оптические свойства коллоидных растворов, способных к поглощению света, можно характеризовать по изменению интенсивности света при прохождении через систему. Для этого используют закон Бугера-Ламберта-Бера:
-
(10.3)
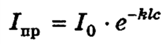
где I0 — интенсивность падающего света; Iпр — интенсивность прошедшего через золь света; k — коэффициент поглощения; l — толщина слоя золя; с — концентрация золя.
Если прологарифмировать выражение, получим:
-
(10.4)
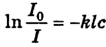
Величину ![]() называют оптической плотностью раствора. При работе с монохроматическим светом всегда указывают, при какой длине волны была определена оптическая плотность, обозначая ее Dλ.
называют оптической плотностью раствора. При работе с монохроматическим светом всегда указывают, при какой длине волны была определена оптическая плотность, обозначая ее Dλ.
Мицелярная теория строения коллоидных систем
Рассмотрим строение гидрофобной коллоидной частицы на примере образования золя AgI обменной реакцией
АgNO3 + KI → AgI + KNO3.
Если вещества берутся в эквивалентных количествах, то выпадает кристаллический осадок AgI . Но , если одна из исходных веществ будет в избытке , например КI , процесс кристаллизации AgI ведет к образованию коллоидного раствора - мицеллы AgI .
Схема строения мицеллы гидрозоля AgI показана на рис.10.4.
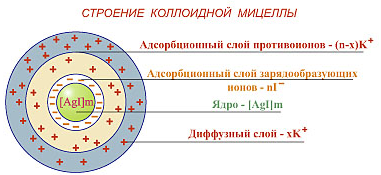
Рисунок 10.4 – Схема мицеллы гидрозоля AgI, образовавшейся при избытке KI
Агрегат молекул [ mAgI ] количеством 100-1000 ( микрокристаллов) – ядро, является зародышем новой фазы, на поверхности которого происходит адсорбция ионов электролита, находящихся в дисперсионной среде. Согласно правилу Панета - Фаянса лучше адсорбцируются ионы, одинаковы с ионами , которые входят в кристаллическую решетку ядра и достраивают эту решетку. Ионы, которые адсорбируются непосредственно на ядре, называются потенциалопределяющие, так как они определяют величину потенциала и знак заряда поверхности, а также и знак заряда всей частицы. Потенциалопределяющими ионами в данной системе являются ионы I-, которые находятся в избытке, входят в состав кристаллической решетки ядра AgI, выполняют роль стабилизаторов и составляют внутреннюю оболочку в жесткой части двойного электрического слоя ( ДЭС ) мицеллы. Агрегат с адсорбированными на нем ионами I- образует ядро мицеллы .
К отрицательно заряженной поверхности частиц AgI на расстоянии, близком к радиусу гидратированного иона, из раствора притягиваются ионы противоположного знака (противоионы) - положительно заряженные ионы К+. Слой противоионов - внешняя оболочка двойного электрического слоя (ДЭС), удерживается как электростатическими силами, так и силами адсорбционного притяжения. Агрегат молекул вместе с твердым двойным слоем называется коллоидной частицей - гранула.
Часть противоионов вследствие теплового движения размещается диффузно вокруг гранулы, и связаны с ней только за счет электростатических сил. Коллоидные частицы вместе с окружающим ее диффузным слоем называется мицелла. Мицелла электронейтральна, так как заряд ядра равен заряду всех противоионов, а гранула обычно имеет заряд, который называется электрокинетический или ξ - дзета - потенциал. В сокращенном виде схему строения мицеллы для данного примера можно записать в таком виде:
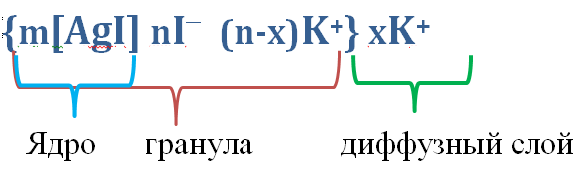
Одним из основных положений теории строения коллоидных частиц является представление о строении двойного электрического слоя (ДЭС). Согласно современным представлениям, двойной электрический слой ДЭС состоит из адсорбционного и диффузионного слоев. Адсорбционный слой состоит из:
- заряженной поверхности ядра мицеллы в результате адсорбции на ней потенциалопределяющих ионов, которые определяют величину потенциала поверхности и его знак;
- слоя ионов противоположного знака - противоионов, которые притягиваются из раствора к заряженной поверхности. Адсорбционный слой противоионов находится на расстоянии молекулярного радиуса от заряженной поверхности. Между этой поверхностью и противоионами адсорбционного слоя существуют как электростатические, так и адсорбционные силы, и поэтому эти противоионы связаны особенно прочно с ядром. Адсорбционный слой очень плотный, толщина его постоянная и не зависит от изменения внешних условий (концентрации электролита , температуры).
Вследствие теплового движения часть противоионов проникает вглубь дисперсионной среды, и их притяжение к заряженной поверхности гранулы осуществляется только за счет электростатических сил. Эти противоионы составляют диффузный слой, который менее прочно связан с поверхностью. Диффузный слой имеет переменную толщину, которая зависит от концентрации электролитов в дисперсионной среде.
При движении твердой и жидкой фаз друг относительно друга возникает разрыв ДЭС в диффузной части и на границе раздела фаз возникает скачок потенциала, который называют электрокинетическим ξ - потенциалом (дзета - потенциал). Его величина определяется разницей между общим количеством зарядов (φ) потенциалопределяющих ионов и количеством зарядов противоионов (ε), содержащиеся в адсорбционном слое, т.е. ξ = φ - ε. Падение межфазного потенциала при удалении от твердой фазы вглубь раствора показано на рис.10.5.
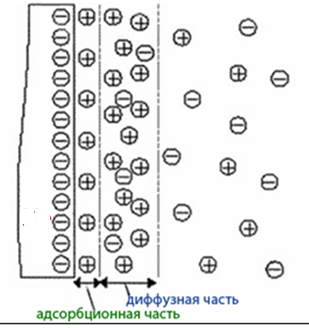
Рисунок 10.5 Строение ДЭС
Наличие разницы потенциалов вокруг частиц гидрофобного золя препятствует их слипанию при столкновении, то есть являются фактором агрегатной устойчивости золя. Если количество диффузных ионов уменьшается или стремится к нулю, то гранула становится электронейтральной (изоэлектрической состояние) и имеет наименьшую устойчивость.
Таким образом, величина электрокинетического потенциала определяет силы отталкивания, а следовательно и агрегатную устойчивость коллоидного раствора. Достаточная устойчивость коллоидного раствора обеспечивается при величине электрокинетического потенциала ξ = 0,07В, при значениях меньших ξ = 0,03В силы отталкивания слишком слабые, чтобы противостоять агрегации, а потому происходит коагуляция, которая неизбежно заканчивается седиментацией.
Величину электрокинетического потенциала можно определить с помощью прибора для электрофореза по формуле (10.5):
-
(10.5)
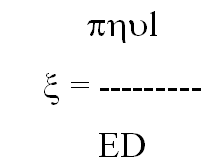
где η - вязкость; ϑ - скорость перемещения частиц; l - расстояние между электродами вдоль раствора; Е - электродвижущая сила, D - диэлектрическая постоянная.
Факторы, влияющие на ξ - потенциал:
- Наличие в растворе индифферентного электролита - электролита, который не содержит потенциалопределяющий ион.
- Индифферентный электролит содержит противоион. В таком случае происходит сжатие диффузионного слоя и падение ξ и как следствие - коагуляция.
- Индифферентный электролит содержит ион однознаковий с противоионом, но не сам противоион. В этом случае происходит ионный обмен: противоион замещается на ионы индифферентного электролита. Наблюдается падение ξ, но степень падения будет зависеть от природы иона - заместителя, его валентности, степени гидратованости. Лиотропные ряды катионов и анионов – ряды, в которых ионы располагаются по увеличении их способности сжимать диффузный слой и вызвать падение ξ - потенциала.
Li+ - Na+- NH4+ - K+- Rb+ - Cs+ - Mg2+ - Ca2+ - Ba2+…
CH3COO– - F– - NO3– - Cl– - I–- Br– - SCN– - OH– - SO42–
2. Добавление раствора электролита-стабилизатора – электролита, содержащего потенциалопределяемый ион, вызывает увеличение ξ - потенциала, а значить способствует устойчивости коллоидной системы, но до определенного предела.
Устойчивость и коагуляция коллоидных систем
Современную теорию устойчивости и коагуляции коллоидных систем создавали несколько известных ученых: Дерягина, Ландау, Фервей, Овербек и потому ее сокращенно называют теория ДЛФО. Согласно этой теории устойчивость дисперсной системы определяется балансом сил притяжения и отталкивания, возникающих между частицами при их сближении в результате броуновского движения. Различают кинетическую и агрегатную устойчивость коллоидных систем.
- Кинетическая (седиментационная) устойчивость - способность дисперсных частиц находиться во взвешенном состоянии и не оседать (не седиментировать). В дисперсных системах, как и в природных растворах, существует броуновское движение. Броуновское движение зависит от размеров частиц, вязкости дисперсной среды, температуры и т.д. Тонкодисперсные системы (золи), частицы которых практически не оседают под действием силы тяжести, относятся к кинетически (седиментационно) устойчивым. К ним также относятся гидрофильные золи - растворы полимеров, белков и т.д. Гидрофобные золи, грубодисперсные системы (суспензии, эмульсии) кинетически неустойчивы. В них достаточно быстро проходит разделение фазы и среды.
- Агрегатная устойчивость - способность частиц дисперсной фазы сохранять определенную степень дисперсности неизменной. В агрегатноустойчивых системах частицы дисперсной фазы при столкновения не слипаются и не образуют агрегатов. Но при нарушении агрегатной устойчивости коллоидные частицы образуют крупные агрегаты с последующим выпадением дисперсной фазы в осадок. Такой процесс называется коагуляцией, и протекает он самопроизвольно, так как при этом уменьшается свободная энергия системы ( Δ G <0) .
К факторам, которые влияют на стабильность коллоидных систем, относятся:
- Наличие электрического заряда дисперсных частиц. Дисперсные частицы лиофобных золей имеют одинаковый заряд , и поэтому при столкновении они будут отталкиваться друг от друга тем сильнее, чем выше дзета - потенциал. Однако электрический фактор не всегда является определяющим.
- Способность к сольватации (гидратации) стабилизирующих ионов. Чем больше гидратированные (сольватированы) противоионы в диффузном слое, тем больше общая гидратная (сольватная) оболочка вокруг гранул и тем стабильнее дисперсная система.
Согласно теории при броуновском движении коллоидные частицы свободно сближаются на расстояние до 10-5 см. Характер изменения ван-дер-ваальсовых сил притяжения (1) и электростатических сил отталкивания (2) между коллоидными частицами показан на рис. 10.6. Результирующая кривая (3) получена путем геометрического сложения соответствующих ординат. При минимальных и больших расстояниях, между частицами преобладает энергия притяжения (I и II энергетические минимумы). В II энергетическом минимуме энергия сцепления частиц недостаточна для удержания их в агрегатированном состоянии. На средних расстояниях, соответствующих толщине двойного электрического слоя, преобладает энергия отталкивания с потенциальным барьером AB, препятствующим слипанию частиц. Практика показывает, что при дзета-потенциале ξ = 70 мВ коллоидные системы характеризуются высоким потенциальным барьером и большой агрегативной устойчивостью. Для дестабилизации коллоидной системы, т.е. осуществления процесса коагуляции, необходимо снизить -потенциал до значений 0 - 3 мВ.
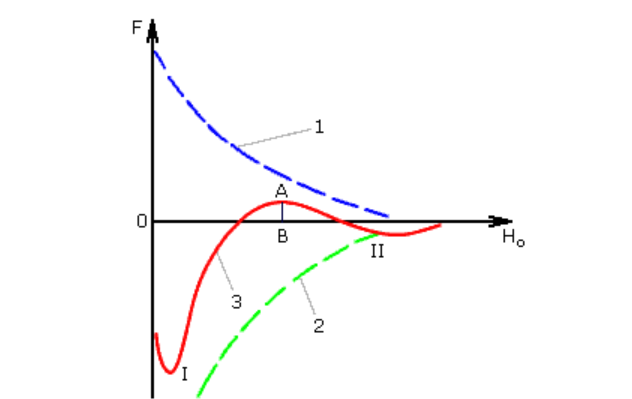
Рисунок 10.6. Потенциальные кривые взаимодействия коллоидных частиц
Коагуляция дисперсных систем
Коагуляция - процесс слипания коллоидных частиц. Данный процесс протекает сравнительно легко под действием самых различных факторов: введение электролитов, неэлектролитов, замораживание, кипячение, перемешивания, действия солнечного света и т.д.. В процессе электролитической коагуляции (под воздействием электролитов) часто наблюдается ионообменная адсорбция: ионы коагулянта с большей валентностью или большим адсорбционным потенциалом вытесняют противоионы сначала диффузного слоя, а затем и адсорбционного слоя. Обмен проходит в эквивалентном количестве, но замена противоионов приводит к тому, что при достаточной концентрации электролитов в дисперсной среде частицы теряют устойчивость и при столкновении слипаются.
Для электролитической коагуляции установлен ряд экспериментальных общих правил:
1. Коагуляцию лиофобных золей вызывают любые электролиты, но с заметной скоростью она наблюдается при достижении определенной концентрации электролита. Порог коагуляции (Ск) - это минимальная концентрация электролита необходимая для начала коагуляции золя. При этом наблюдаются внешние изменения, такие как помутнение раствора, изменение его окраски и т.д.
-
(10.6)
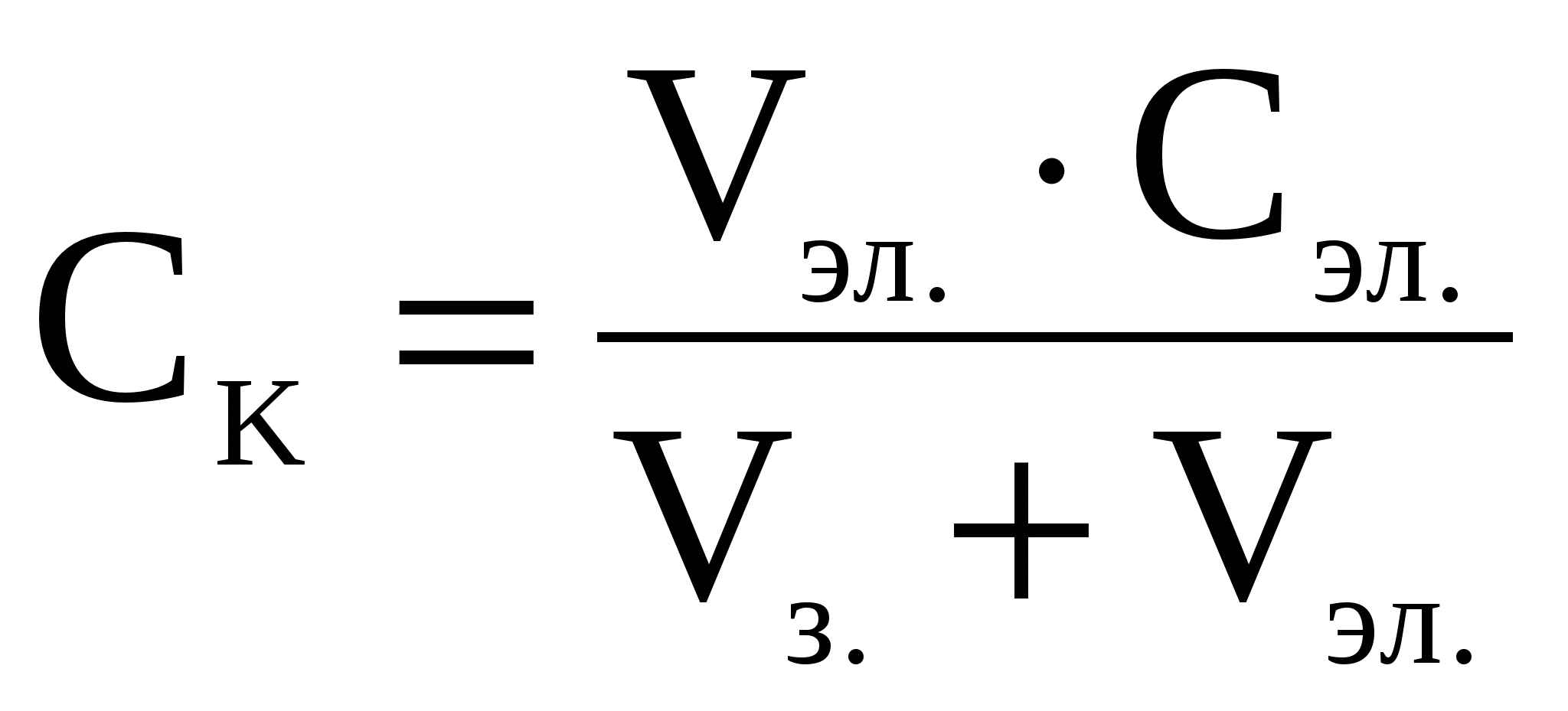
- где Сэл - молярная концентрация электролита, ммоль/л ;
- Vэл - объем раствора электролита, л;
- Vз - объем золя, л.
Величина, обратная порогу коагуляции, называется коагулирующей способностью () электролита:
-
(10.7)
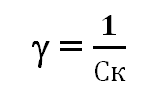
где Ск – порог коагуляции.
- коагулирующее действие проявляет тот ион, заряд которого по знаку противоположный заряду поверхности коллоидных частиц (заряду гранулы), причем это действие возрастает с увеличением валентности иона;
- коагулирующий влияние ионов многократно увеличивается с увеличением валентности ионов. Для одно - двух и трехвалентного ионов коагулирующее действие примерно относятся как 1: 50: 500.
Это объясняется тем, что многовалентные высокозарядных ионы коагулянтов значительно сильнее притягиваются заряженой поверхностью коллоидной частицы, чем одновалентные, и значительно легче вытесняют противоионы из диффузного и даже адсорбционного слоя.
3. Коагулирующее действие органических ионов значительно выше, чем неорганических. Это связано с их высокой адсорбционной способностью, возможностью адсорбироваться в надэквивалентном количестве, а также вызвать перезарядку поверхности коллоидных частиц.
4. В ряде неорганических ионов с одинаковыми зарядами коагулирующая способность зависит от радиуса иона - коагулянта: чем больше радиус, тем больше коагулирующая способность (см. лиотропные ряды). Это объясняется тем, что степень гидратации ионов уменьшается, например , от L + к Cs + , а это облегчает его внедрение в двойной ионный слой.
5. С наибольшей скоростью коагулируют электронейтральные частицы лиофобных коллоидных золей.
6. Явление привыкания золя. Если к золю быстро добавить коагулянт, то происходит коагуляция, если же медленно - коагуляция отсутствует. Это можно объяснить тем, что между электролитом и золем происходит реакция, в результате которой, образуются пептизаторы, которые стабилизируют дисперсную систему:
Fe (OH)3 + HCl →FeOCl + 2H2O ,
FeOCl → FeO + + Cl - ,
где FeO + - пептизатор для золя Fe (OH)3.
Коагулирующее действие смеси электролитов проявляется по-разному в зависимости от природы иона - коагулятора. В смеси электролитов действие может суммироваться с коагулирующем действием каждого электролита. Это явление называется аддитивность ионов (NaCl , KCl ). Если коагулирующее действие ионов электролита уменьшается при введении ионов другого электролита наблюдается антагонизм ионов ( LiCl , MgCl2 ). В случае, когда коагулирующее действие ионов электролита увеличивается при введении ионов другого электролита такое явление называется синергизм ионов.
Введение например 10 мл 10 % раствора NaCl в 10 мл золя Fe (OH)3 приводит к коагуляции этого золя. Но этого можно избежать, если дополнительно ввести в раствор золя одно из защитных веществ: 5 мл желатина, 15 мл яичного альбумина, 20 мл декстрина.
Защита коллоидных частиц
Коллоидная защита - повышение агрегатной устойчивости золя путем введения в него высокомолекулярного соединения (ВМС ). Для гидрофобных золей в качестве ВМС обычно используются белки , углеводы, пектины; для неводных золей - каучуки.
Защитное действие ВМС связано с образованием на поверхности коллоидных частиц определенного адсорбционного слоя (Рисунок 10.7). Явление обратное коагуляции называется пептизация.
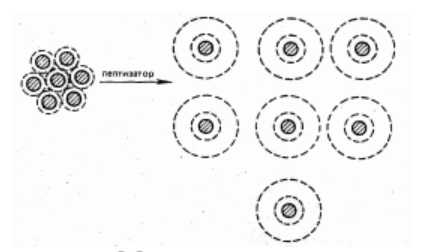
Рисунок 10.7 Механизм пептизации
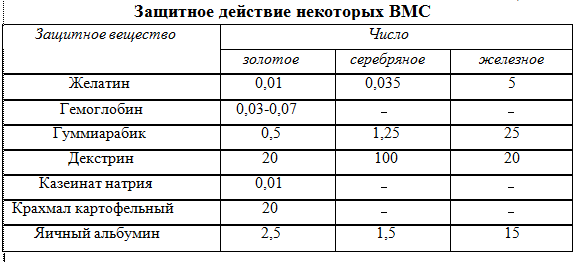
Для характеристики защитного действия различных ВМС Зигмонди предложил использовать золотое число. Золотое число - это количество миллиграммов ВМС, которое надо добавить к 10 см3 0,0006 % - го красного золя золота, чтобы предотвратить его посинение (коагуляцию) при добавлении к нему 1см3 10 % раствора NaCl. Иногда для характеристики защитного действия ВМС вместо золя золота используются коллоидные растворы серебра (серебряное число), гидроксида железа (железное число) и др. В таблице 10.2 приведены значения этих чисел для некоторых ВМС.
Таблица 10.2 Защитное действие ВМС