Ключові терміни:
абсолютна атомна маса, алотропи, алотропні модифікації, алотропія, атом, атомна одиниця маси, атомна частинка, бертоліди, відносна атомна маса, відносна густина, відносна молекулярна маса, дальтоніди, другий наслідок закону Авогадро, еквівалент, еквівалентна маса, еквівалентна маса бінарної сполуки, еквівалентна маса кислоти, еквівалентна маса оксиду, еквівалентна маса основи, еквівалентна маса складної сполуки, еквівалентна маса солі, еквівалентна маса іона, еквівалентний об’єм, електронна оболонка, закон Авогадро, закон Бойля-Маріотта, закон Гей-Люссака, закон Мозлі, закон Шарля, закон еквівалентів, закон збереження енергії, закон збереження маси , закон об'ємних співвідношень, закон сталості складу, класифікація хімічних елементів, кількість еквівалентів, кількість речовини, масове число, молекула, молекулярний іон, моль, моль еквівалентів, молярна маса, молярна маса еквівалента, молярний об’єм еквівалента, молярний об'єм, нейтрони, нормальні умови, об’єднаний газовий закон, перший наслідок закону Авогадро, принцип незнищуваності матерії, прості речовини, протони, рівняння Клапейрона, рівняння Менделєєва-Клапейрона, складні речовини, стала Авогадро, стехіометричні закони, структурні елементи речовини, субатомні частинки, універсальна газова стала, фактор еквівалентності, фундаментальні закони, хімічний елемент, ідеальний газ, ізобари, ізотопи1.1. Найважливіші поняття атомно-молекулярного вчення
Формулювання основних положень атомно-молекулярної теорії в різних літературних джерелах дещо відрізняються, але сучасним уявленням найбільшою мірою відповідають наступні тези.
- Речовини мають дискретну природу. Вони складаються з частинок, що об'єднують назвою структурні елементи речовини. Це – молекули, атоми, іони.
- Частинки речовин безперервно рухаються.
- Між частинками речовини діють сили взаємного притягання і відштовхування.
- Між складовими частинками речовини є відстані, розмір яких залежить від агрегатного стану.
- Молекули складаються із атомів.
- Молекули зберігаються при фізичних явищах і руйнуються під час хімічних реакцій.
- Атоми під час хімічних процесів залишаються неподільними, але перегруповуються, внаслідок чого утворюються нові сполуки.
- Різноманітність речовин у природі зумовлена різними сполученнями атомів, завдяки чому можуть виникати речовини з молекулярною або немолекулярною будовою.
Згідно з атомно-молекулярним вченням, головними об'єктами хімії є атоми, молекули, хімічні елементи, прості та складні речовини.
1.1.1. Атом
Відомо багато формулювань поняття «атом», найперше з них належить Канніццаро (1860р.).
Атом – це найменша частинка елемента в хімічних сполуках.
Досить відомим і поширеним є й інше визначення:
Атом – найменша частинка речовини, яка ніколи не руйнується під час хімічних реакцій.
Сучасне визначення ураховує будову атома:
Атом – це найменша, хімічно неподільна, електронейтральна частинка елемента, яка складається з позитивно зарядженого ядра і негативно зарядженої електронної оболонки.
Атом – реально існуючий матеріальний об'єкт, який характеризується певною масою, розміром, складом, зарядом ядра, будовою електронної оболонки та іншими властивостями. Атом являє собою складну систему, що складається з ядра і електронної оболонки. До складу атомного ядра, радіус якого у 10000разів менший (10–14–10–15 м) за радіус всього атома (~10–10 м), входять позитивно заряджені частинки – протони й електронейтральні частинки – нейтрони. Електронна оболонка, розмір якої визначає радіус усього атома, – це сукупність негативно заряджених електронів. Позитивний заряд ядра визначається кількістю протонів і дорівнює за абсолютною величиною негативному заряду електронної оболонки, який відповідає кількості електронів. Завдяки рівності за абсолютною величиною зарядів протонів і електронів атом є електронейтральним. Протони, нейтрони і електрони об'єднуються спільною назвою – субатомні частинки. Маси протону і нейтрону практично однакові, а маса електрона у 1836 разів менше, тому вся маса атома фактично зосереджена в його ядрі.
Кількісними характеристиками атома є заряд ядра і відносна атомна маса Аr. Ці величини зазначаються у періодичній таблиці елементів.
Заряд ядра атома дорівнює порядковому номеру елемента (закон Мозлі).
Абсолютна атомна маса mат (елемента) – це істинна маса атома елемента, виміряна в звичайних одиниця маси: г, кг.
Оскільки маси атомів дуже малі і оперувати їх абсолютними величинами при розрахунках незручно, в хімії впроваджена позасистемна одиниця вимірювання - атомна одиниця маси (а.о.м.), яка дорівнює одній дванадцятій маси атома ізотопу Карбону–12. Середня маса атома ізотопу Карбону-12 достатньо точно встановлена за допомогою сучасних методів дослідження речовини, вона дорівнює 19,92·10–27 кг.
- [TEX]1 а.о.м.=1/12m(атома ^{12}\text{C})=\frac{1}{12}19,92\cdot 10^{-27}кг=1,66 \cdot 10^{-27}кг[/TEX](1.1)
Відносна атомна маса Аr – це фізична величина, що дорівнює відношенню середньої маси атома елемента до однієї дванадцятої маси атома ізотопу Карбону-12:
- [TEX]A_r= \frac{m(атома \: ел-та)}{1/12m(атома ^{12}\text{C})}=\frac{m(ат. ел)}{1 а.о.м.}=\frac{m(ат. ел)}{1,66 \cdot 10^{-27}кг}[/TEX](1.2)
У системі вимірювань СI відносна атомна маса Аr – безрозмірна величина. Позасистемна одиниця вимірювання відносної атомної маси – а.о.м.
Абсолютна маса атома mат(Х) пов'язана з відносною атомною масою елемента Аr величиною атомної одиниці маси (яка дорівнює 1/12 маси атома ізотопу Карбону –12) залежністю:
- [TEX]m_{ат}(X)=A_r(X)\cdot1,66 \cdot 10^{-27}кг[/TEX](1.3)
Відносна атомна маса Ar показує, у скільки разів маса атома більше, ніж 1/12 частка маси атома ізотопу Карбону–12.
Атоми позначаються хімічними символами. Але поряд із поняттям «атом» у сучасній хімії використовується узагальнене поняття:
атомна частинка, під якою розуміють не лише ізольовані атоми, а й похідні частинки – атомні радикали, іони, іон-радикали, що утворюються при збудженні чи іонізації атома.
1.1.2. Молекула
Молекула – це найменша частинка речовини, яка здатна самостійно існувати і має всі хімічні властивості речовини.
Як матеріальні частинки молекули мають розміри і маси. Розміри молекул коливаються у межах 10–10–10–7 м. Маса окремої молекули надзвичайно мала. Так, маса молекули води складає 2,895·10–26 кг.
Молекули складаються з атомів, які сполучені між собою хімічними зв'язками у певній послідовності і певним чином орієнтовані у просторі. Кількість атомів у молекулі коливається від двох (Н2, О2, НСl) до декількох тисяч (вітаміни, гормони, білки). Атоми благородних газів (He, Ne, Ar, Kr, Xe, Rn) іноді називають одноатомними молекулами. Склад молекули – найважливіша характеристика молекули і речовини – описується хімічними формулами.
Усі молекули однієї речовини мають однакові склад, масу, розміри, властивості. Молекули різних речовин відрізняються одна від одної за усіма переліченими параметрами. Між молекулами є відстані, які зумовлені агрегатним станом речовини: у газах вони складають 10–8–10–7 м, у твердих тілах – приблизно 10–10 м.
Кількісною характеристикою молекули є відносна молекулярна маса Мr.
Відносна молекулярна маса Мr – це відношення середньої маси молекули речовини до 1/12 маси атома ізотопу Карбону–12.
- [TEX]M_r(B_xD_y)=\frac{m_{молекули}(B_xD_y)}{1/12m_{ат}(^{12}\text{C})}=\frac{m_{мол-ли}(B_xD_y)}{1 а.е.м.}[/TEX](1.4)
У системі СІ відносна молекулярна маса Mr – безрозмірна величина, а позасистемною одиницею її вимірювання є а.о.м.
Відносна молекулярна маса Мr визначається сумою відносних атомних мас Аr елементів, що входять до складу молекули, з урахуванням кількості атомів кожного елемента:
- [TEX]M_r(B_xD_y)=xA_r(B)+yA_r(D)[/TEX]
Наприклад, відносна молекулярна маса сульфур (IV) оксиду:
- [TEX]M_r(\text{SO}_2)=A_r(\text{S})+2A_r(\text{O})=32+2\cdot 16 = 64 а.о.м.[/TEX]
З сучасної точки зору молекула – це найменша електронейтральна замкнута сукупність атомів, що утворює певну структуру за допомогою хімічних зв'язків.
Система сполучених хімічними зв'язками атомів, яка має заряд, називається молекулярний іон.
1.1.3. Хімічний елемент
На теперішній час відомо 118 хімічних елементів: з них 89 виявлені у природі, а інші отримані штучно під час ядерних реакцій.
Хімічний елемент – це вид атомів з однаковим зарядом ядра.
Кожний елемент має свою назву і хімічний символ, який позначає, по-перше, назву елемента, по-друге, – один атом цього елемента при записах формул хімічних реакцій.
Останнім часом відповідно до Державного стандарту України (ДСТУ2439-94) українські назви хімічних елементів вживаються як похідні від латинських назв. Вони записуються з великої літери на відміну від назв простих речовин і атомів, наприклад: Гідроген Н, Карбон С, Оксиген О, Нітроген N – елементи; водень Н2, вуглець С, кисень О2, азот N2 – прості речовини чи атоми.
Носієм властивостей хімічних елементів є атом. Входячи до складу різних речовин, атоми кожного елемента надають їм певних властивостей.
Основною кількісною характеристикою елемента є заряд ядра його атомів Z, що збігається з порядковим номером елемента. У природі відсутні різні хімічні елементи, які мали б однаковий заряд ядра, тому можна однозначно визначити елемент за зарядом ядра його атома.
Відносна атомна маса Аr теж деякою мірою може правити кількісною характеристикою елемента, але не вичерпною, оскільки за величиною Аr неможливо визначити елемент. Це зумовлюється існуванням ізобарів та ізотопів.
Ізотопи – це атоми одного елемента, в ядрах яких міститься однакова кількість протонів, але різна кількість нейтронів, що зумовлює різні атомні маси у ізотопів одного елемента
Для позначення ізотопу використовують символ відповідного хімічного елемента, зазначивши знизу ліворуч заряд ядра і зверху праворуч – масове число (тобто відносну атомну масу ізотопу), а інколи обмежуються тільки записом масового числа.
Винятком є ізотопи елемента Гідрогену, для яких поряд з традиційною символікою допускаються й індивідуальні позначення: [TEX]\rm{_1^1{H}}[/TEX] – Протій, [TEX]\rm{_1^2{H}}[/TEX] (або 1D) – Дейтерій, [TEX]\rm{_1^3{H}}[/TEX](або 1Т) – Тритій.
Ізобари – це атоми різних елементів, які мають різні заряди атомних ядер (і різні порядкові номери), але однакові атомні маси Аr.
Кожний елемент має декілька ізотопів (природних чи штучних), тому в періодичній системі наводиться середня Аr з урахуванням розповсюдженості ізотопів у природі.
Всі елементи мають широкий спектр властивостей, тому класифікація хімічних елементів залежно від ознаки, що береться до уваги, може бути різною.
-
За електронною конфігурацією атомів елементи поділяються на електронні родини залежно від заповнення електронами валентних енергетичних підрівнів: s-, p-, d-, f-елементи.
-
За хімічними особливостями простих речовин, утворених елементами, вони умовно поділяються на:
- неметали, до яких належать 23 елементи: Не, Ne, Ar, Kr, Xr, Rn, F, Cl, Br, I, At, O, S, Se, Te, N, P, As, C, Si, B і Н;
- напівметали, для яких характерне утворення ковалентної кристалічної решітки та наявність металічної провідності. До напівметалів належать: Bi, Sn, Po, As, Te, Ge, Sb і алотропна модифікація Карбону – графіт;
- метали – решта елементів.
-
За походженням виділяють такі групи елементів:
- природні, які входять до складу природних сполук. Це елементи від Гідрогену (1Н) до Плутонію (94Рu);
- штучні, що утворюються внаслідок ядерних реакцій. Окрему групу складають радіоактивні елементи, яких відомо 27 % – це Технецій 43Тс, Прометій 61Рm, Полоній 84Ро та всі елементи, що розміщуються в періодичній системі за Полонієм.
-
За розповсюдженням у природі всі хімічні елементи можна поділити на три умовні групи:
- поширені – це, по-перше, вісім елементів (О, Si, Al, Fe, Ca, Na, K, Mg), що становлять 98,53% земної кори, а також Н, С, Zn, Cu, Mn, Cl, N, P, S, Ba, Sr та Cr. На всі інші елементи припадає лише 0,85%;
- рідкісні елементи – це малопоширені у природі або маловивчені елементи (Li, Rb, La, U, Re);
- розсіяні – це елементи, вміст яких у земній корі незначний і які не утворюють власних родовищ, а перебувають у якості домішок до мінералів інших елементів (In, Gf, Te, Tl, Ga, Cs).
Деякі групи елементів об'єднують спільними груповими назвами:
- галогени – F, Cl, Br, I, At – елементи VIIА-підгрупи;
- халькогени – O, S, Se, Te, Po – елементи VIА-підгрупи;
- лужні метали – Li, Na, K, Rb, Cs – елементи IА-підгрупи;
- лужноземельні метали – Ca, Sr, Ba, Ra – елементи IIА-підгрупи;
- благородні газі – He, Ne, Ar, Kr, Xe, Rn – елементи VIIІА-підгрупи;
- елементи родини заліза – Fe, Co, Ni;
- елементи родини платини – Ru, Os, Pd, Rh, Ir, Pt;
- лантаноїди – від 58Ce до 71Li;
- актиноїди – від 90Th до 103Lr.
1.1.4. Прості та складні речовини
Прості речовини – це сполуки, які складаються з атомів одного елемента, тобто прості речовини – це форма існування хімічного елемента у вільному стані.
Налічується понад 500 простих речовин, а елементів відомо усього 118. Той факт, що кількість простих речовин переважає кількість хімічних елементів, пояснюється явищем алотропії.
Алотропія – це здатність елемента утворювати декілька простих, відмінних за властивостями речовин, які називаються алотропні модифікації, або алотропи.
Наприклад, елемент Оксиген утворює два алотропи: кисень О2 і озон О3; елементи Фосфор Р, Сульфур S – по декілька алотропних модифікацій. Елемент Карбон С утворює такі алотропні модифікації: алмаз, графіт, карбін (ланцюжки типу ...–С≡С–С≡С–… чи ...=С=С=С=С=…) і фулерен С60, молекула якого схожа на футбольний м'яч, тому ця модифікація іноді називається букиболом.
Складні речовини – це сполуки, що містять атоми різних елементів, тобто це форма існування елементів у зв'язаному стані.
Складні речовини можуть мати як молекулярну будову (Н2S, CH4, HCl, H2O), так і немолекулярну: іонну (NaCl, Na2O, NaOH) чи металічну (Fe3C – ферум карбід).
1.2 Основні закони хімії
Фундаментальні закони – це найбільш загальні, універсальні закони природи, що розкривають причинно-наслідкові зв'язки між усіма формами руху матерії.
Фундаментальними законами вважаються: принцип незнищуваності матерії та руху, закони збереження маси та енергії, кількості руху і електричного заряду, періодичності розвитку.
Стехіометричні закони – це закони, які визначають кількісні співвідношення між елементами у сполуках чи між речовинами при їх взаємодії.
До стехіометричних належать закони сталості складу, еквівалентів, кратних відношень, а також газові закони, що описують поведінку речовин у газуватому стані. Це закони об'ємних співвідношень, Авогадро, ідеальних і реальних газів тощо.
1.2.1. Закон збереження маси і енергії
Відкритий Ломоносовим і Лавуазьє закон збереження маси можна сформулювати так:
Загальна маса речовин, що вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються внаслідок реакції.
Із закону збереження маси речовин випливає важливий наслідок:
кількість атомів кожного елемента до і після реакції залишається постійною.
Наприклад, внаслідок взаємодії кисню з воднем утворюється вода згідно з рівнянням, в якому над формулами сполук наведені відносні молекулярні маси Mr речовин:
[TEX]\overset{\color{red}{32}}{\text{O}}_2+\overset{\color{red}{2\;\cdot2}}{2\;\text{H}}_2\rightarrow \overset{\color{red}{2}}{2}\overset{\color{red}{\cdot\;18}}{\;\text{H}}_2\text{O}[/TEX]
Закон збереження енергії (Майєр, 1842 р.):
Енергія не виникає і не зникає безслідно, а лише перетворюється з однієї форми в іншу в еквівалентних кількостях.
Закони збереження маси і енергії відображають принцип незнищуваності матерії та руху, сутність якого у сучасному вигляді формулюється так:
В ізольованій системі сума мас і енергій є постійною, тобто сумарні маса і енергії речовин, що вступають у реакцію, дорівнює сумарним масам і енергіям продуктів реакції.
Закон збереження енергії як філософський принцип не виводиться із більш загальних постулатів. З фізичної точки зору він є наслідком однорідності часу, тобто того факту, що закони природи протягом часу не змінюються.
Енергія – це міра руху і взаємодії різних видів матерії. При будь-яких процесах в ізольованій системі енергія не виникає і не знищується, вона може тільки переходити із однієї форми в іншу. Наприклад, енергія хімічної взаємодії може перетворюватися в теплову енергію випромінювання.
Однією з форм енергії є так звана енергія спокою Е, яка пов'язана з масою m рівнянням Ейнштейна (1905 р.):
- [TEX]E=mc^2[/TEX],
- де с – швидкість світла у вакуумі; с = 3·108 м/с.
Інколи з рівняння Ейнштейна роблять невірний висновок щодо можливості перетворення енергії в масу. Насправді з нього випливає: будь-який матеріальний об'єкт, що змінює свою енергію [TEX](\Delta{E})[/TEX], одночасно в еквівалентній кількості змінює й свою масу [TEX](\Delta{m})[/TEX]:
- [TEX]\Delta{m}=\Delta{E}/c^2[/TEX].
Це співвідношення показує, що маса може перетворюватися в енергію – це явище спостерігається в ядерних реакціях і приводить до порушення закону збереження маси. У хімічних реакціях змінення маси, викликане виділенням або поглинанням енергії, дуже мале. Припустимо, тепловий ефект хімічної реакції дорівнює 100 кДж/моль (типова величина теплового ефекту), тоді змінення маси складає
- [TEX]\Delta{m}=\frac{\Delta{E}}{c^2}=\frac{100кДж}{(3\cdot{10^8})^2(м/с)^2}=10^{-12}кг/моль=10^{-9}\;г/моль[/TEX]
Зрозуміло, що таке мізерне змінення маси неможливо зареєструвати за допомогою сучасних терезів, точність яких не перевищує 1·10–7 г, тому закон збереження маси у хімічних реакціях виконується з високою точністю.
1.2.2. Закон сталості складу
Закон сталості складу (Пруст, 1801 р.) полягає в тому, що кожна хімічна сполука незалежно від способу й умов її добування має певний масовий склад. Початково закон сталості складу формулювався так:
Співвідношення між масами елементів, що входять до складу певної сполуки, є сталими і не залежать від способу одержання цієї сполуки.
Цей закон не має абсолютного узагальненого характеру, що було встановлено у ХХ ст., коли довели, що в природі є два типи сполук – зі сталим та зі змінним складом.
Сполуки, які мають сталий склад і цілочисельне атомне співвідношення компонентів, називаються дальтоніди.
Для дальтонідів характерний ковалентний зв'язок між атомами і молекулярна структура в тому чи іншому агрегатному стані. До них належать речовини, які за звичайних умов перебувають у газоподібному ([TEX]\rm{CO_2,\ NH_3,\ NO,\ HCl}[/TEX]) чи рідкому ([TEX]\rm{H_2O,\ C_6H_6}[/TEX]) стані або можуть бути легко переведені в них, а також кристалічні речовини з молекулярною структурою ([TEX]\rm{I_2}[/TEX], лід).
Сполуки змінного складу, в яких стехіометричні співвідношення компонентів не відповідають цілим числам, називаються бертоліди.
Уперше речовини із змінним складом були відкриті при дослідженні сплавів деяких металів. Так, сплав вісмуту з телуром має змінний склад [TEX]\rm{TiBi_{1,24-1,82}}[/TEX]. Пізніше були знайдені й неметалічні сполуки змінного складу, наприклад, модифікації оксидів титану – рутилу [TEX]\rm{TiO_{1,9-2,0}}[/TEX] і анатазу [TEX]\rm{Ti_2O_{2,92-3,12}}[/TEX].
Бертоліди не мають молекулярної структури. До них належить переважна більшість кристалічних сполук перехідних d- i f-елементів: оксиди, гідриди, нітриди, сульфіди, карбіди та інші бінарні сполуки. Слід зауважити, що на сталість складу впливає й ізотопний склад, наприклад, у звичайній воді [TEX]\rm{H_2O}[/TEX] і у важкій воді [TEX]\rm D_2O[/TEX] масові частки Оксигену різняться:
- [TEX]\omega{(\text{O}\ в\ \text{H}_2\text{O})}=\frac{A_r(\text{O})}{M_r(\text{H}_2\text{O})}=\frac{16}{18}=0,89[/TEX],
- [TEX]\omega{(\text{O}\ в\ \text{D}_2\text{O})}=\frac{A_r(\text{O})}{M_r(\text{D}_2\text{O})}=\frac{16}{20}=0,80[/TEX].
Отже, склад хімічних сполук залежить від типу хімічного зв'язку, агрегатного стану речовин, ізотопного складу та умов їх добування і може бути як сталим, так і змінним. Тому в сучасне формулювання закону сталості складу внесені деякі уточнення:
Якщо хімічна сполука має молекулярну структуру, то незалежно від умов добування склад її залишається сталим. Склад хімічної сполуки, що не має молекулярної структури, може змінюватися в певних межах залежно від умов добування.
1.2.3. Закон об'ємних співвідношень Гей-Люссака
Співвідношення між об'ємами газів встановлює закон об'ємних співвідношень Гей-Люссака (1808 р.):
Співвідношення об'ємів газів, що вступають у реакцію та утворюються внаслідок неї, є співвідношенням простих цілих чисел, які кратні стехіометричним коефіцієнтам, що стоять у рівнянні реакції перед формулами відповідних газів.
Цей закон справедливий тільки у тому випадку, коли об'єми газів виміряні за однакових умов.
Із закону Гей-Люссака випливає:
стехіометричні коефіцієнти в рівнянні реакції є кратними до об'ємів газів, що взаємодіють між собою і утворюються після реакції та виміряні за однакових умов.
1.2.4. Закон Авогадро
Одним з найважливіших газових законів є закон Авогадро:
У рівних об'ємах різних газів за однакових умов міститься однакова кількість молекул.
Математичний вираз закону Авогадро записують так:
N = const, якщо Р,V,T = const,
де N – кількість молекул, Р – тиск, V – об'єм, T – температура.
Але оскільки число молекул у реальних зразках речовини дуже велике, то було введено універсальну кількісну характеристику – кількість речовини, що описує чисельний стан речовин.
Кількість речовини [TEX]\nu [/TEX] (або n) – це фізична величина, що визначається числом частинок – структурних елементів речовини: молекул, атомів, іонів, іонних асоціатів тощо.
Одиницею її вимірювання є [моль] – одна з основних одиниць CI.
Моль – це кількість речовини, що містить стільки ж структурних елементів речовини (атомів, молекул, іонів тощо), скільки атомів міститься в ізотопі Карбону-12 масою 12·10–3кг.
Експериментально встановлено, що маса одного атома ізотопу Карбону-12 складає 19,92·10–27 кг. Тоді число атомів [TEX]N_A[/TEX] в 12·10–3 кг дорівнює
- [TEX]N_A=\frac{12\cdot{10^{-3}кг}}{19,92\cdot{10^{-27}кг}}=6,02\cdot{10}^{23}[/TEX]
Число, що дорівнює 6,02·1023 мол–1 називається стала Авогадро, позначається [TEX]N_A[/TEX] і вказує на число частинок – структурних елементів речовини, кількість якої становить 1 моль і тому має розмірність [моль–1].
Один моль будь-яких структурних елементів – це така кількість речовини, що містить 6,02·1023 частинок.
Кількість речовини пов'язана з довільним числом частинок N і сталою Авогадро [TEX]N_A[/TEX] залежністю:
- [TEX]\nu =N/N_A[/TEX].(1.5)
Маса одного моля речовини називається молярною масою цієї речовини, вона позначається через М.
Молярна маса – це фізична величина, що визначається відношенням маси m речовини до кількості речовини [TEX]\nu [/TEX], яка відповідає цій масі:
- [TEX]M=m/\nu [/TEX].(1.6)
Одиницею вимірювання молярної маси в системі СІ є [кг/моль], але в хімії частіше користуються позасистемною величиною [г/моль], або [г·моль–1].
Молярна маса М пов'язана з відносною молекулярною масою Mr і сталою Авогадро [TEX]N_A[/TEX] залежністю
[TEX]M=M_r\cdot{N_A}\cdot{1а.о.м.}[/TEX]
Тобто молярна маса тільки чисельно співпадає з відносною молекулярною масою (але не дорівнює їй: Мr ≠ М), оскільки має зовсім інший фізичний зміст: Мr характеризує масу однієї молекули, а М – масу одного моля, тобто 6,02·1023 молекул.
Перший наслідок закону Авогадро:
Один моль будь-якого газу за нормальних умов (н.у.) займає об'єм приблизно 22,4 л (або 0,0224 м3).
Ця величина називається молярний об'єм, позначається VM і вимірюється у [л/моль] або [м3/моль] .
Нормальні умови вважаються такими:
Тиск: Р = 101325 Па (~105 Па) = 1 атм = 760 мм рт. ст.,
Температура: Т = 273,15 К, або t = 0 °С.
Молярний об'єм – це емпірично встановлена величина на основі співвідношень:
- [TEX]V_M=\frac{M}{\rho } [/TEX](1.7)
- де [TEX]\rho [/TEX] – густина газу, [г/л], або [кг/м3].
З розрахунків молярних об'ємів різних газів для кількості речовини [TEX]\nu [/TEX] = 1 моль за формулою (1.7: [TEX]V_M=M/\rho [/TEX]) випливає, що середня величина молярного об'єму будь-якого газу за н.у. складає:
VM ~ 22,4 л/моль.
Молярний об'єм на відміну від молярної маси не є постійною величиною, а залежить від умов (Р, Т), тому VM як поняття вживають найчастіше для газів саме за н.у.
Молярний об'єм пов'язаний з іншими величинами (об'ємом V, кількістю речовини [TEX]\nu [/TEX], молярною масою М, густиною [TEX]\rho [/TEX], числом Авогадро NA і кількістю частинок N) співвідношеннями:
- [TEX]V_M=\frac{V}{\nu},\ V_M=\frac{M}{\rho},\ V_M=\frac{V\cdot{N_A}}{N}[/TEX](1.8)
Другий наслідок закону Авогадро:
Відношення густини одного газу [TEX]\rho_1[/TEX] до густини іншого газу [TEX]\rho_2[/TEX] за однакових умов дорівнює відношенню їх молярних мас М або відносних молекулярних мас Мr.
Ця величина називається відносна густина одного газу за іншим і позначається буквою d або D:
- [TEX]d_2(1)=\frac{\rho_1}{\rho_2}=\frac{M_1}{M_2}=\frac{M_{r1}}{M_{r2}} [/TEX](1.9)
Звідки легко можна знайти густину [TEX]\rho_1[/TEX], молярну масу М1 (а, отже, і відносну молекулярну масу Мr1) деякого газу, якщо відома відносна густина цього газу за іншим d2(1), а також відповідні величини ([TEX]\rho_1[/TEX], М1, Мr1) іншого газу:
- [TEX]\rho_1=\rho_2\cdot{d_2};\ \ \rho_2=\rho_1/d_2[/TEX](1.10)
- [TEX]M_1=d_2(1)\cdot{M_2};\ \ M_2=M_1/d_2(1)[/TEX](1.11)
Відносна густина d – це величина безрозмірна, вона показує, наскільки один газ важче за інший.
1.2.5. Основні газові закони
Стан газу характеризується його об'ємом V, тиском P і температурою T. Між цими величинами експериментально були встановлені такі закони:
-
Закон Бойля-Маріотта – ізотермічний:
За умови постійної температури і маси газу добуток його тиску на об'єм є постійним.
Математичний вираз закону Бойля-Маріотта записується так:
при Т = const
- [TEX]P_1\cdot V_1=P_2\cdot V_2[/TEX] або [TEX]P\cdot V=const[/TEX](1.12)
-
Закон Гей-Люссака – ізобаричний:
При постійному тиску об'єм постійної маси газу пропорційний абсолютній температурі Т.
Математично закон Гей-Люссака виражається так:
при Р = const
- [TEX]\frac{V_1}{T_1}=\frac{V_2}{T_2}[/TEX], [TEX]\frac{V}{T}=const [/TEX](1.13)
-
Закон Шарля – ізохоричний:
Тиск фіксованої маси і фіксованого об'єму газу прямо пропорційний абсолютній температурі газу.
Математичний вираз закону Шарля записується так:
при V = const
- [TEX]\frac{P_1}{T_1}=\frac{P_2}{T_2} [/TEX], або [TEX]P_1T_2=P_2T_1[/TEX], або [TEX]P/T=const[/TEX](1.14)
Важливо уточнити, що в наведених законах газ розглядається як ідеальний. Ідеальний газ – це гіпотетична математична модель, що виходить з таких припущень: 1) потенційною енергією взаємодії між молекулами газу можна знехтувати порівняно з кінетичною енергією їх руху; 2) сумарним об'ємом молекул газу можна знехтувати порівняно з об'ємом всього газу; 3) між молекулами не діють сили притягання або відштовхування; 4) зіткнення молекул між собою і зі стінками посудини є абсолютно пружними, а час взаємодії між молекулами дуже малий в порівнянні з середнім часом між зіткненнями.
Насправді, реальні гази тією чи іншою мірою відрізняються від ідеального, причому, чим більшою є молярна маса газу, тим помітніша ця відмінність.
Із сполучення трьох законів стану ідеального газу
[TEX]P=const\Rightarrow \frac{V}{T}=const[/TEX] – закон Гей-Люссака
[TEX]V=const\Rightarrow \frac{P}{T}=const[/TEX] – закон Шарля
[TEX]T=const\Rightarrow P\cdot{V}=const[/TEX] – закон Бойля-Маріотта
випливає об'єднаний газовий закон – його описує рівняння Клапейрона:
- [TEX]\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2} [/TEX], або [TEX]\frac{PV}{T}=const[/TEX](1.15)
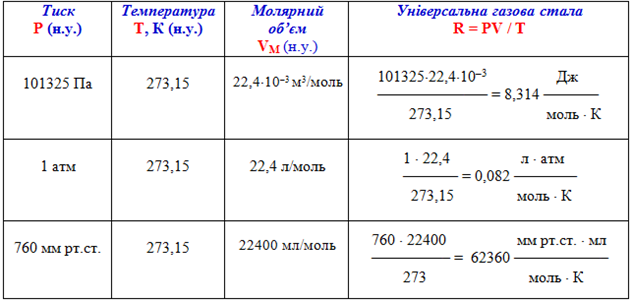
Залежність для одного моля газу була виведена Менделєєвим, тому має назву рівняння Менделєєва-Клапейрона. В ньому міститься постійна величина – універсальна газова стала R (табл. 1.5):
- [TEX]\frac{PV}{T}=R[/TEX] або [TEX]PV=RT[/TEX](1.16)
Для довільної кількості газу рівняння Менделєєва-Клапейрона має вигляд:
- [TEX]PV=\nu{RT}[/TEX], або [TEX]PV=\frac{m}{M}RT[/TEX].(1.17)
Таблица 1.5 – Розрахунки значень універсальної газової сталої R
1.2.6. Закон еквівалентів
Еквівалент – це умовна чи реальна частинка речовини, яка може приєднувати, заміщати, віддавати або іншим чином взаємодіяти з одним іоном Гідрогену Н+ чи гідроксилу ОН– у кислотно-основних (або іонообмінних) реакціях чи з одним електроном в окисно-відновних реакціях.
Наприклад, еквівалентом нітратної (азотної) кислоти в іонообмінних реакціях є реальна частинка – молекула [TEX]\rm{HNO_3}[/TEX], що містить один іон Н+. У той же час у відновному процесі
- [TEX]\rm{NO_{3}^-+6H_2O+8ē\rightarrow NH_3+9OH{^-}}[/TEX]
за еквівалент нітратної кислоти виступає вже умовна частинка, яка складає 1/8 іона [TEX]\rm{NO_3^–}[/TEX], тому що відбувається приєднання восьми електронів і на один електрон припадає усього восьма частка молекули [TEX]\rm{HNO_3}[/TEX].
Як приклад змінення еквівалента складної речовини залежно від особливостей реакції розглянемо нейтралізацію ортофосфатної (фосфорної) кислоти лугом, що може проходити відповідно до однієї з схем:
- [TEX]\rm{1)\ H_3PO_4+3KOH\rightarrow K_3PO_4+3H_2O}[/TEX],
- [TEX]\rm{2)\ H_3PO_4+2KOH\rightarrow K_2HPO_4+2H_2O}[/TEX],
- [TEX]\rm{3)\ H_3PO_4+1KOH\rightarrow KH_2PO_4+H_2O}[/TEX].
В реакції (1) [TEX]\rm{H_3PO_4}[/TEX] поводить себе як триосновна кислота (заміщуються металом всі три атоми Н). Отже, еквівалент ортофосфатної кислоти в цьому випадку – це умовна частинка, яка відповідає 1/3 молекули [TEX]\rm{H_3PO_4}[/TEX] (на долю одного іона Н+ припадає саме третя частина молекули [TEX]\rm{H_3PO_4}[/TEX]). В реакції (2) [TEX]\rm{H_3PO_4}[/TEX] реагує як двохосновна кислота, тому її еквівалент – умовна частинка, що відповідає 1/2 молекули [TEX]\rm{H_3PO_4}[/TEX], а в реакції (3) еквівалентом є реальна частинка – молекула [TEX]\rm{H_3PO_4}[/TEX], оскільки заміщується тільки один атом Н.
Еквіваленти елементів також можуть бути різними – залежно від валентності елемента в сполуці. Так, еквівалент елемента S у сірководні – умовна частинка, що відповідає 1/2 молекули [TEX]\rm{H_2S}[/TEX], а еквівалентом S у гідроген персульфіді є реальна частинка – молекула [TEX]\rm{H_2S_2}[/TEX].
Таким чином, еквівалент – це фактично одна частка молекули, що відповідає одному атому Н чи одному іону Н+.
Число, що показує, яка частка молекули чи іншої частинки речовини відповідає еквіваленту, називається фактор еквівалентності fЕ.
Оскільки еквіваленти елемента і еквіваленти складної сполуки можуть бути різними, то як наслідок, і фактор еквівалентності теж буде мати різні значення, для обчислення якого існують прості формули (табл. 1.6).
Таблиця 1.6 – Розрахунки фактора еквівалентності
|
Частинка |
Фактор еквівалентності |
Приклади |
|
Елемент |
|
[TEX]f_E(\text{P}\ в\ \text{P}_2\text{O}_5)=1/5[/TEX]; |
|
Проста сполука |
|
[TEX]f_E(\text{H}_2)=1/(2\cdot{1})=1/2[/TEX]; |
|
Оксид |
|
[TEX]f_E(\text{Cr}_2\text{O}_3)=1/(2\cdot{3})=1/6[/TEX]; |
|
Кислота |
|
Якщо основність H2SO4 у реакції дорівнює 1, то
або: якщо основність H2SO4 дорівнює 2 , то:
|
|
Основа |
|
Якщо кислотність Cu(OH)2 у реакції дорівнює 1, то:
або: якщо кислотність Cu(OH)2 у реакції дорівнює 2, то
|
|
Сіль |
або:
або:
|
Розрахунок по металу:
або розрахунок по кислотному залишку:
|
|
Іон |
|
[TEX]f_E(\text{SO}_4^{2–})=1/2[/TEX]; |
|
Частинка в |
|
Окиснення: [TEX]\rm{Fe^0–2ē\rightarrow{Fe^{2+}}}[/TEX], Відновлення: [TEX]\rm{CrO_4^{2–}+8H^++3ē\rightarrow{Cr^{3+}+4H_2O}}[/TEX], |
Для характеристики еквівалента користуються величинами:
- еквівалентна маса mекв (точніше: mекв – молярна маса еквівалента);
- кількість еквівалентів nекв.
Еквівалентна маса елемента (чи молярна маса еквівалента) – це маса одного моль еквівалентів (тобто 6,02·1023 еквівалентів), яка дорівнює відношенню молярної маси елемента до його валентності в сполуці (або добутку фактора еквівалентності на молярну масу елемента):
- [TEX]m_{екв.елемента}=\frac{M_{елемента}}{Валентність}[/TEX](1.18)
Або:
- [TEX]m_{екв.елемента}=f_E\cdot{M_{елемента}}[/TEX](1.19)
Якщо хоч одна речовина перебуває у газуватому стані, то зручніше використовувати поняття молярний об'єм еквівалента (чи просто – еквівалентний об'єм), який за розраховують за формулою
- [TEX]V_{екв.газу}=\frac{V_{М}}{ч\cdot{В}} [/TEX](1.20)
- де VМ – молярний об'єм газу (VМ = 22,4 л/моль (н.у.),
- ч – кількість атомів елемента,
- В – валентність.
Кількість еквівалентів nекв – це кількість речовини еквівалентів, що визначається відношенням маси речовини mреч до молярної маси еквівалента mекв або відношенням об'єму газу Vгазу до його еквівалентного об'єму Vекв.газу:
- [TEX]n_{екв}=m_{речовини}/m_{екв}[/TEX](1.21)
- [TEX]n_{екв}=V_{газу}/V_{екв.газу}[/TEX](1.22)
Молярна маса еквівалента mекв (еквівалента маса) має розмірність [г/моль], молярний об'єм еквівалента Vекв.газу – [л/моль], а кількість еквівалентів nекв – [моль], (інколи [моль-екв]).
Моль еквівалентів – це така кількість сполуки, яка взаємодіє без залишку з 1 моль еквівалентів атомів Гідрогену або в загальному випадку – з 1 моль еквівалентів будь якої речовини.
Поняття кількості еквівалентів і еквівалентних мас поширюється і на складні речовини. Для визначення еквівалентної маси складної сполуки використовують найпростіші правила, в яких для порівняння згадуються і фактори еквівалентності відповідних сполук:
-
Еквівалентна маса оксиду дорівнює відношенню його молярної маси М до добутку валентності елемента В на число атомів елемента ч:
- [TEX]f_{E_{оксиду}}=\frac{1}{ч\cdot{В}},\ m_{екв.оксиду}=\frac{M_{оксиду}}{ч\cdot{В}} [/TEX].(1.23)
-
Еквівалентна маса кислоти дорівнює відношенню її молярної маси М до основності – кількості атомів Н, здатних заміщуватися атомами металу:
- [TEX]f_{E_{кислоти}}=\frac{1}{Основність},\ m_{екв.\ кислоти}=\frac{M_{кислоти}}{Основність} [/TEX].(1.24)
-
Еквівалентна маса основи дорівнює відношенню її молярної маси М до кислотності – кількості гідроксильних груп ОН, що заміщуються на кислотний залишок:
- [TEX]f_{E_{основи}}=\frac{1}{Кислотність},\ m_{екв.\ основи}=\frac{M_{основи}}{Кислотність} [/TEX](1.25)
-
Еквівалентна маса солі дорівнює відношенню її молярної маси М до добутку валентності В металу на кількість його атомів ч:
- [TEX]f_{E_{солі}}=\frac{1}{ч\cdot{В}},\ m_{екв.\ солі}=\frac{M_{солі}}{ч\cdot{В}} [/TEX](1.26)
-
Еквівалентна маса іона дорівнює відношенню його молярної маси М до абсолютної величини заряду |z|:
- [TEX]f_{E_{іона}}=\frac{1}{|z|},\ m_{екв}=\frac{M_{іона}}{|z|}[/TEX](1.27)
Наприклад, фактори еквівалентності та еквівалентні маси іонів [TEX]\rm{VO^{3+}}[/TEX] і [TEX]\rm{SO_4^{2–}}[/TEX] дорівнюють:
- [TEX]f_E(\text{VO}^{3+})=\frac{1}{3},\ m_{екв}(\text{VO}^{3+})=\frac{67}{3}=22,3\ г/моль[/TEX]
-
Еквівалентна маса бінарної сполуки будь-якого елемента з Гідрогеном дорівнює відношенню молярної маси цієї сполуки до валентності елемента, наприклад:
- [TEX]f_E(\text{SiH}_4)=\frac{1}{4},\ m_{екв}(\text{SiH}_4)=\frac{32}{4}=8\ г/моль[/TEX]
-
Еквівалентна маса складної сполуки дорівнює сумі еквівалентних мас її складових частин. Наприклад,
- еквівалентна маса оксиду:
- [TEX]m_{екв.оксиду}=m_{екв.елемента}+ m_{екв.оксигену}[/TEX].
- еквівалентна маса основи:
- [TEX]m_{екв.основи}=m_{екв}(Me)+m_{екв}(\text{OH}^–)[/TEX].
- еквівалентна маса кислоти:
- [TEX]M_{екв.кислоти}=m_{екв}(\text{H}^+)+m_{екв.аніона}[/TEX].
- еквівалентна маса солі:
- [TEX]M_{екв.солі}=m_{екв}(Me)+m_{екв. аніона}[/TEX].
- еквівалентна маса оксиду:
Закон еквівалентів був експериментально встановлений Ріхтером і остаточно сформульований Дальтоном:
Хімічні сполуки реагують між собою в еквівалентних співвідношеннях:
З цього випливає, що для двох будь-яких речовин однієї хімічної реакції (вихідних реагентів чи продуктів) закон еквівалентів математично виражається рівністю кількостей еквівалентів цих речовин:
- [TEX]n_{екв1}=n_{екв2}[/TEX](1.28)
Підставивши у математичний вираз закону еквівалентів (1.28) рівняння (1.21:[TEX] n_{екв}=m_{речовини}/m_{екв}[/TEX]) і (1.22: [TEX]n_{екв}=V_{газу}/V_{екв.газу}[/TEX]), одержимо ще два математичних вирази закон еквівалентів:
- [TEX]\frac{m_1}{m_{екв1}}=\frac{m_2}{m_{екв1}} [/TEX](1.29)
- [TEX]\frac{V_{газу1}}{V_{екв.газу\ 1}}=\frac{V_{газу2}}{V_{екв.газу\ 2}} [/TEX](1.30)
Якщо тільки одна сполука перебуває у газоподібному стані, звертаються до іншого виразу закон еквівалентів:
- [TEX]\frac{m_1}{m_{екв1}}=\frac{V_{газу2}}{V_{екв.газу\ 2}} [/TEX](1.31)
При практичних розрахунках іноді зручніше користуватися таким формулюванням закон еквівалентів:
маси речовин (об'єми газів), що взаємодіють між собою, пропорційні їх еквівалентним масам (об'ємам газів):
- [TEX]\frac{m_1}{m_2}=\frac{m_{екв\ 1}}{m_{екв\ 2}} [/TEX], або [TEX]\frac{V_1}{V_2}=\frac{V_{екв\ 1}}{V_{екв\ 2}}[/TEX](1.32)



