- 5.1. Загальні уявлення про дисперсні системи
- 5.2. Істинні розчини. Основні поняття
- 5.3. Утворення розчинів
- 5.4. Концентрація розчинів
- 5.5. Розчинність
Ключові терміни:
аерозоль, азеотроп, азеотропний розчин, грубодисперсні системи, гідратація, гідрати, гідрозолі, децимолярний розчин, децинормальний розчин, дисперсна система, дисперсна фаза, дисперсійне середовище, еквівалент, екстракція, емульсія, ефект Тіндаля, закон Генрі, закон еквівалентів, закон розподілу Нернста-Шилова, золі, коефіцієнт розчинності, концентрація розчинів, кристалогідрати, кристалосольвати, критична температура розчинення, ліозолі, масова кристалізація, масова частка, мольна частка, моляльна концентрація, моляльність, молярна концентрація, молярна концентрація еквівалента, молярність, насичений розчин, ненасичений розчин, нормальна концентрація, нормальність, органозолі, пересичений розчин, правило Менделєєва, піна, розчин, розчинність, сантимолярний розчин, сантинормальний розчин, сольватація, сольвати, суспензія, титр, тонкодисперсні (мікрогетерогенні) системи, ультрамікрогетерогенні (колоїдно-дисперсні) системи, істинний розчин5.1. Загальні уявлення про дисперсні системи
Дисперсна система – це гетерогенна суміш речовин, що складається як мінімум з двох фаз, що мають сильно розвинену поверхню поділу, хімічно не взаємодіють одна з одною і відрізняються практично повною взаємною нерозчинністю.
Дисперсна система містить щонайменше два компоненти, тому розрізняють два поняття: дисперсна фаза і дисперсійне середовище.
Дисперсна фаза – це диспергована речовина (у вигляді дрібних твердих кристаликів, крапель рідини, бульбашок газу, асоціатів молекул чи іонів) – тобто та частина дисперсної системи, яка рівномірно розподілена в об’ємі іншої речовини.
Дисперсійне середовище – це неперервне середовище, в якому рівномірно розподілені дисперговані частинки дисперсної фази.
Дисперсну фазу можна відділити від дисперсійного середовища будь-яким фізичним способом: фільтруванням, центрифугуванням, сепаруванням, відстоюванням тощо.
Дисперсні системи значно поширені в природі, техніці та в повсякденному побуті. Широко відомими прикладами дисперсних систем є суспензії, емульсії, піни, аерозолі.
Суспензія – це дисперсна система, в якій дисперсною фазою є тверда речовина, а дисперсійним середовищем – рідина.
Емульсія – це дисперсна система, в якій рідка дисперсна фаза рівномірно розподілена в об’ємі рідкого дисперсійного середовища, тобто емульсія складається з двох взаємно нерозчинних рідин.
Піна – комірчаста дисперсна система, в якій дисперсною фазою є сукупність бульбашок газу (чи пари), а дисперсійним середовищем – рідина чи тверде тіло.
Аерозоль – дисперсна система, що складається з дрібних твердих або рідких частинок дисперсної фази, рівномірно розподілених по газовому дисперсійному середовищу (найчастіше по повітрю).
Природні аерозолі поділяються на такі різновиди:
1) Туман – аерозольна дисперсна система, що складається з рідкої дисперсної фази (краплі рідини 10 мкм) і газового дисперсійного середовища.
2) Дим – аерозольна дисперсна система, що складається з твердої дисперсної фази (частинки 0,1-5 мкм) і газового дисперсійного середовища.
3) Смог – аерозольна дисперсна система, що складається з суміші твердої і рідкої дисперсних фаз (частинки 0,1-50 мкм) і газового дисперсійного середовища.
4) Пил – аерозольна дисперсна система, що складається з твердої дисперсної фази (частинки 10-100 мкм) і газового дисперсійного середовища.
Різноманітність і численність дисперсних систем вимагає їх всебічної класифікації за різними ознаками.
I. Класифікація за ступенем дисперсності. Залежно від розмірів частинок дисперсної фази дисперсні системи умовно поділяються на три групи.
- Грубодисперсні системи, в яких розмір частинок перебільшує 10–5 м. Ця група дисперсних систем характеризується певними ознаками: частинки дисперсної фази осідають (або спливають) у полі гравітаційних сил, не проходять крізь паперові фільтри; їх можна роздивитися у звичайному мікроскопі. До них належать суспензії, емульсії, пил, піна тощо.
- Тонкодисперсні (або мікрогетерогенні) системи з розміром частинок 10–5–10–7 м. До них належать тонкі зависі, дими, поруваті тверді тіла.
-
Ультрамікрогетерогенні (або колоїдно-дисперсні) системи, в яких частинки розміром 10–9–10–7 м утворюють асоціати з 103_109 атомів, завдяки чому між ними і розчинником виникає поверхня поділу. Колоїдні розчини характеризуються гранично-високодисперсним станом, їх звичайно називають золі, або часто ліозолі, щоб підкреслити, що дисперсійним середовищем є рідина (ліос – рідкий). Якщо дисперсійним середовищем є вода, такі золі називають гідрозолі, а якщо органічна рідина — органозолі.
Для більшості колоїдних розчинів притаманні такі ознаки:- невелика швидкість дифузії та відсутність здатності проходити через напівпроникні мембрани;
- частинки дисперсної фази (колоїдні частинки) можна роздивитися лише за допомогою ультрамікроскопа чи електронного мікроскопа;
- розсіювання променів світла колоїдними частинками, внаслідок чого в ультрамікроскопі вони мають вигляд світних цяток, що перебувають у безперервному хаотичному русі – ефект Тіндаля;
- присутність стабілізаторів (іонів електролітів), які утворюють на поверхні поділу фаз іонний шар або сольватну оболонку, що забезпечує існування частинок у суспендованому стані та перешкоджає їхньому злипанню;
- дисперсна фаза має малу розчинність у дисперсійному середовищі.
II. Класифікація дисперсних систем за співвідношенням агрегатних станів дисперсної фази і дисперсійного середовища. Відповідно до такої класифікації при умовному запису дисперсних систем спочатку зазначають агрегатний стан дисперсної фази за допомогою букв: Г (газ), Р (рідина) чи Т (тверда фаза), а потім після тире (чи через косу риску) – агрегатний стан дисперсійного середовища, наприклад, для дисперсної системи «газ у рідині» прийнято позначення Г/Р.
5.2. Істинні розчини. Основні поняття
Якщо дисперсна фаза подрібнена до розмірів молекул та іонів (менш 10–9 м), між частинками дисперсної фази і дисперсійного середовища зникає поверхня поділу, система стає гомогенною, – утворюється істинний розчин, або просто розчин.
Розчин – це гомогенна термодинамічно стійка система змінного складу, яка містить декілька компонентів: розчинник, розчинену речовину (одну чи декілька) та продукти їх взаємодії.
Звичайно розчинником вважається компонент, який у вільному вигляді перебував у тому ж агрегатному стані, що й утворений розчин. Однак якщо до розчинення обидва компоненти знаходилися в однаковому агрегатному стані, то за розчинник приймають речовину, кількість якої у розчині суттєво більша. Винятком з цього правила вважаються розчини, одним з компонентів якого є вода – такі розчини звичайно називають водними, навіть при меншій кількості води порівняно з кількістю інших компонентів.
Розчини належать до рівноважних однорідних систем, які досягли мінімуму енергії Гіббса за рахунок усіх можливих типів взаємодії між складовими частинками. Відмінними ознаками істинних розчинів є відсутність поверхні поділу між компонентами, що зумовлює прозорість і високу стійкість розчинів, тому вони самочинно не розділяються на складові частини протягом тривалого часу.
Залежно від агрегатного стану розчини поділяються на три групи, кожна з яких має свої особливості.
1. Газоподібні розчини – це суміші газів, що не взаємодіють між собою, наприклад, повітря (суміш N2, O2, CO2 та ін.), природний газ.
2. Рідкі розчини – це однофазні гомогенні системи, що утворюються при розчиненні газоподібних, рідких або твердих речовин у рідкому розчиннику, роль яких можуть відігравати неорганічні речовини (найчастіше – це вода, рідкий амоніак, безводна сульфатна чи оцтова кислоти) або органічні сполуки (метанол, інші спирти, ацетон, бензен, тетрахлорометан тощо).
3. Тверді розчини, які можуть утворюватися солями, металами чи оксидами. Тверді розчини поділяються на два типи:
- Тверді розчини заміщення, компоненти яких мають однотипну кристалічну решітку і близькі розміри частинок;
- Тверді розчини вкорінення утворюються внаслідок закріплення молекул, атомів чи іонів однієї речовини у пустотах кристалічної решітки іншої речовини.
5.3. Утворення розчинів
Фізична теорія розчинів (Вант-Гофф, Арреніус) розглядає процес розчинення як простий розподіл (диспергування) однієї речовини по всьому об’єму іншої, а розчинник – індиферентне середовище, в якому хаотично розподілені частинки розчиненої речовини. Згідно з цією теорією властивості розчинів повинні залежати лише від концентрації розчиненої речовини.
Хімічна теорія розчинів (Д.І.Менделєєв) розглядає розчин як динамічну систему, між рівноцінними компонентами якої – розчинником і розчиненою речовиною – відбувається хімічна взаємодія.
Сучасна теорія розчинів (Каблуков, Кістяковський) є поєднанням фізичної і хімічної теорій. Відповідно до неї процес розчинення вважається складною сукупністю фізико-хімічних явищ, серед яких виділяють три основні етапи.
- Руйнування структури речовини, що розчиняється. На руйнування хімічних і міжмолекулярних зв’язків необхідно витратити певну енергію, тому цей етап супроводжується поглинанням теплоти і зростанням ентальпії: ΔHруйн > 0.
-
Хімічна взаємодія розчинника з частинками речовини – так звана сольватація (або гідратація, якщо розчинником є вода). При цьому утворюються сольвати (або гідрати) – нестійкі хімічні сполуки частинок розчиненої речовини з молекулами розчинника (або води).
Завдяки виникненню нових зв’язків у процесі сольватації, енергія вивільняється, тому спостерігається виділення теплоти, а ентальпія системи зменшується: ΔНсольв < 0. Слід зазначити, що зменшення ентальпії системи помітно залежить від розмірів іонів, які піддаються сольватації: чим меншим є радіус іона, тим сильніше він сольватується.
Утворення сольватів супроводжується зовнішніми ознаками.
Кристалосольвати – тверді сполуки, у кристалічній решітці яких міститься деяка кількість молекул розчинника. Якщо розчинником є вода, такі кристалосольвати називаються кристалогідрати. -
Самочинний процес рівномірного розподілення сольватів (гідратів) у розчиннику, що пов’язаний з дифузією і вимагає витрати енергії. Ентальпія системи при цьому зростає: ΔНдиф > 0. Сумарний тепловий ефект процесу розчинення
[TEX]\Delta{H}=\Delta{H_{руйн}}+\Delta{H_{сольв}}+\Delta{H_{диф}}[/TEX]
може бути додатним (ендотермічне розчинення) чи від’ємним (екзотермічне розчинення).
5.4. Концентрація розчинів
Концентрація розчинів – це величина, що характеризує кількісний склад розчину і визначає відносну кількість розчиненої речовини, яка міститься у певній кількості розчину або припадає на певну кількість розчинника.
Для якісної оцінки концентрації розчину використовують терміни: розведений і концентрований, однак межі між ними досить умовні. Для точного вираження концентрації розчину застосовують декілька способів.
-
Масова частка ω – це величина, яка визначається відношенням маси розчиненої речовини (mреч) до маси всього розчину (mрозч) і вимірюється у частках одиниці:
- [TEX]\omega =\frac{m_{реч}}{m_{розч}}.[/TEX](5.1)
Однак іноді масову частку виражають у відсотках – у цьому випадку її можуть називати відсотковою концентрацією, або масовою часткою у відсотках:
- [TEX]\omega =\frac{m_{реч}}{m_{розч}}\cdot 100\%[/TEX].(5.2)
З рівняння (5.2) зрозуміло, що відсоткова концентрація показує, скільки грамів розчиненої речовини mреч міститься у кожних 100 г розчину.
-
Молярна концентрація, або молярність СМ – це величина, що дорівнює відношенню кількості розчиненої речовини [TEX](\nu_{реч})[/TEX] до об'єму розчину (Vрозч), виміряному в літрах:
- [TEX]C_M=\frac{\nu_{реч}}{V_{розч}}=\frac{m_{реч}}{M_{реч}\cdot V_{розч}}[/TEX].(5.3)
Молярна концентрація СМ показує, яка кількість розчиненої речовини
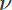 реч (моль) міститься у кожному літрі розчину.
реч (моль) міститься у кожному літрі розчину.Молярність розчину виражається у [моль/л], але замість цієї розмірності дозволено позначати її великою літерою М, наприклад, записи 2 моль/л H2SO4 і 2М H2SO4 є рівноцінними. Вони вказують на розчин сульфатної кислоти, в одному літрі якого міститься 2 моль H2SO4. Розчин, в 1 л якого міститься 0,1 моль розчиненої речовини називається децимолярний розчин, якщо кількість розчиненої речовини складає 0,01 моль речовини, то це сантимолярний розчин.
-
Молярна концентрація еквівалента, або нормальна концентрація, або нормальність СN – це величина, що визначається відношенням кількості еквівалентів (nекв) розчиненої речовини до об'єму розчину (Vрозч), виміряному в літрах:
- [TEX]C_N=\frac{n_{екв}}{V_{розч}}[/TEX].(5.4)
Нормальна концентрація, або нормальність СN показує, яка кількість еквівалентів розчиненої речовини mреч (моль-екв) міститься у кожному літрі розчину, тому виражається у [моль-екв/л], чи просто [моль/л]. По аналогії з молярною концентрацією нормальність позначають буквою N (рідше – н), наприклад, запис 0,25 N (0,25 н) тотожний запису 0,25 моль-екв/л.
Розчин називають децинормальний і сантинормальний, якщо вони містять відповідно 0,1 моль і 0,01 моль еквівалентів розчиненої речовини в одному літрі.
Еквівалент – це така реальна або умовна частка речовини, яка в обмінних реакціях може заміщувати, приєднувати або вивільняти 1 атом чи 1 іон Гідрогену.
За допомогою нормальної концентрації можна виразити окремий випадок закон еквівалентів щодо обмінних реакцій у розчинах:
взаємодія між розчинами відбувається в об'ємних співвідношеннях, обернено пропорційних їх нормальностям (тобто молярним концентраціям еквівалентів):
- [TEX]\frac{V_1}{V_2}=\frac{C_{N_2}}{C_{N_1}}, \;\; або \;\; C_{N_1}\cdot V_1=C_{N_2}\cdot V_2[/TEX].(5.5)
Вираз закону еквівалентів (5.5) дозволяє робити певні обчислення і за відомими даними однієї сполуки знаходити невідому величину іншої (наприклад, нормальність CN2 чи об’єм V2), з якою перша сполука пов’язана стехіометричним співвідношенням:
- [TEX]C_{N_2}=\frac{C_{N_1}\cdot V_1}{V_2} \;\; і \;\; V_2=\frac{C_{N_1}\cdot V_1}{C_{N_1}}[/TEX].(5.6)
-
Моляльна концентрація, або моляльність Сm – це величина, яка визначається відношенням кількості розчиненої речовини (
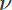 реч) до маси розчинника (mрозч-ка), виміряної у кілограмах:
реч) до маси розчинника (mрозч-ка), виміряної у кілограмах:- [TEX]C_m=\frac{\nu \cdot 1000}{m_{розч-ка}}[/TEX].(5.7)
Моляльність Сm показує число молів розчиненої речовини, що приходиться на 1 кг (1000 г) розчинника, тому вона виражається у [TEX][моль/кг][/TEX]. Як правило, в більшості стехіометричних розрахунків кількість речовини (
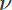 реч) звичайно вимірюють у г/моль, а масу розчинника (mрозч–ка) – у грамах, тому для приведення моляльної концентрації до відповідної розмірності у числівнику рівняння (5.7) необхідно ставити число 1000. Якщо ж маса розчинника буде виміряною у кг, тоді перемножувати числівник на 1000 не потрібно.
реч) звичайно вимірюють у г/моль, а масу розчинника (mрозч–ка) – у грамах, тому для приведення моляльної концентрації до відповідної розмірності у числівнику рівняння (5.7) необхідно ставити число 1000. Якщо ж маса розчинника буде виміряною у кг, тоді перемножувати числівник на 1000 не потрібно. -
Мольна частка
 – це величина, що визначається відношенням кількості розчиненої речовини
– це величина, що визначається відношенням кількості розчиненої речовини 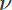 1 до загальної кількості всіх речовин у розчині (тобто суми числа молів розчиненої речовини
1 до загальної кількості всіх речовин у розчині (тобто суми числа молів розчиненої речовини 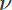 1 і числа молів розчинника
1 і числа молів розчинника 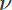 2). Раніше мольна частка позначалася великою літерою [TEX]N[/TEX], але в останній час уведене нове позначення – грецькою буквою
2). Раніше мольна частка позначалася великою літерою [TEX]N[/TEX], але в останній час уведене нове позначення – грецькою буквою  (хі), тому необхідно брати до уваги обидва варіанти:
(хі), тому необхідно брати до уваги обидва варіанти:-
 1[TEX] =N_1=\frac{\nu_1}{\nu_1\ +\ \nu_2}[/TEX].(5.8)
1[TEX] =N_1=\frac{\nu_1}{\nu_1\ +\ \nu_2}[/TEX].(5.8)
-
-
Титр Т – це величина, що визначається відношенням маси розчиненої речовини до об’єму розчину, виміряному у літрах.
- [TEX]T=\frac{m_{реч}\cdot1000}{V_{розч}}[/TEX].(5.9)
Інакше кажучи, титр Т показує, скільки грамів розчиненої речовини міститься в 1 мл розчину, тому вимірюється в [TEX][г/мл][/TEX]. Відносно формули (5.9) знов необхідно привести деякі пояснення. Число 1000 у числівнику ставиться у тому випадку, коли об’єм розчину виміряний у літрах. Якщо об’єм виражається у мл, то числівник на 1000 перемножувати не слід.
5.5. Розчинність
Терміну «розчинність» у хімії прийнято надавати подвійного змісту. З одного боку, під розчинністю розуміють здатність речовини у вигляді найдрібніших структурних одиниць (сольватованих молекул, іонів тощо) рівномірно розподілятися по всьому об’єму розчинника, а з іншого – кількісний показник, пов’язаний з максимальною за даних умов концентрацією розчиненого компонента у розчині.
За розчинністю у воді усі речовини поділяються на три групи: добре розчинні, малорозчинні, нерозчинні.
Кількісною характеристикою розчинності можуть виступати дві характеристики: коефіцієнт розчинності ![]() , яким найчастіше користуються в інженерних розрахунках, і власно розчинність s, до якої зазвичай звертаються у розрахунках з аналітичної хімії.
, яким найчастіше користуються в інженерних розрахунках, і власно розчинність s, до якої зазвичай звертаються у розрахунках з аналітичної хімії.
Коефіцієнт розчинності ![]() – це величина, що показує, скільки грамів речовини може максимально розчинитися у 100 г розчинника при даній температурі.
– це величина, що показує, скільки грамів речовини може максимально розчинитися у 100 г розчинника при даній температурі.
Наприклад, запис ![]() 18Pb(NO3)2 = 51,7 означає, що при 18 °С у 100 г води може максимально розчинитися 51,7 г солі Pb(NO3)2. Якщо у такий розчин внести ще декілька кристаликів Pb(NO3)2, то вони за даної температури розчинятися не будуть, а залишаються в осаді. Але між осадом і розчиненою речовиною у розчині встановлюється динамічна рівновага: одночасно здійснюється часткове розчинення осаду і кристалізація речовини із розчину, причому обидва процеси відбуваються з однаковими швидкостями.
18Pb(NO3)2 = 51,7 означає, що при 18 °С у 100 г води може максимально розчинитися 51,7 г солі Pb(NO3)2. Якщо у такий розчин внести ще декілька кристаликів Pb(NO3)2, то вони за даної температури розчинятися не будуть, а залишаються в осаді. Але між осадом і розчиненою речовиною у розчині встановлюється динамічна рівновага: одночасно здійснюється часткове розчинення осаду і кристалізація речовини із розчину, причому обидва процеси відбуваються з однаковими швидкостями.
Розчин, в якому за даної температури речовина більш не розчиняється і встановлюється динамічна рівновага між розчиненою речовиною у розчині та її осадом, називається насичений розчин.
Молярна концентрація розчиненої речовини в насиченому розчині називається розчинність s:
[TEX]s=C_{M(насич)}[/TEX].
Оскільки розчинність s визначає молярну концентрацію, то одиницею її вимірювання є [моль/л], цю величину використовують для розрахунків поряд із коефіцієнтом розчинності ![]() .
.
Розчин, який містить менше розчиненої речовини, ніж необхідно для його насичення, і в якому може розчинятися додаткова кількість речовини, називається ненасичений розчин.
У ненасиченому розчині відбувається самочинний процес розчинення твердої фази, внаслідок якого вся речовина опиняється у розчині. Деякі речовини можуть утворювати так звані пересичені розчини, в яких концентрація розчиненої речовини перебільшує величину розчинності s.
Розчин, в якому при певній температурі міститься більше розчиненої речовини, ніж це зумовлено межею розчинності, називається пересичений розчин.
- [TEX]C_{M(пересич)}>s[/TEX].
Існування пересичених розчинів зумовлюється кінетичними чинниками процесу кристалізації, які ускладнюють окремі етапи утворення осаду: виникнення центрів кристалізації (так званих «зародків кристалізації»), побудову кристалічної решітки і зростання окремих кристалів. Проте на відміну від термодинамічно стійких ненасичених і насичених розчинів, пересичений розчин є метастабільною (тобто термодинамічно нестійкою) системою. Тому навіть при незначному зовнішньому втручанні надлишкова кількість речовини (відносно значення розчинності s) миттєво випадає в осад, а розчин при цьому перетворюється на насичений. Пересичені розчини одержують за допомогою спеціальних методів, наприклад, при дуже повільному і обережному охолодженні насичених розчинів.
Масова кристалізація – одночасне виникнення в об’ємі всього пересиченого розчину великої кількості кристалів речовини.
На розчинність речовин впливають інші зовнішні умови, а також співвідношення між хімічною природою речовини і розчинника. Тут діє відома закономірність, яку звичайно називають правило Менделєєва: подібне розчиняється в подібному. Це означає, що речовини з неполярним ковалентним зв’язком краще розчиняються в неполярних розчинниках і, навпаки, речовини з полярним ковалентним або іонним зв’язком краще розчиняються в полярних розчинниках. Так, кисень, в молекулах якого здійснюється неполярний ковалентний зв’язок, добре розчиняється у неполярному бензені і погано – у полярному розчиннику воді. І, навпаки, кристали натрій хлориду NaCl з іонним зв’язком дуже легко розчиняються у воді, молекули яких є полярними, і зовсім погано – у малополярних органічних розчинниках.
5.5.1 Розчинність газів
Взаємна розчинність газів є необмеженою. Це означає, що при змішуванні декількох газів вони утворюють гомогенну газову суміш, незалежно від їх кількісного співвідношення. До речі, такі процеси дуже часто спостерігаються у повсякденному житті, наприклад, швидке поширення запахів у приміщенні.
Розчинність газів у рідинах залежіть від природи газу і розчинника, тиску, температури і виражається кількістю літрів (а інколи кількістю грамів) розчиненого газу в 1 л розчинника. Наприклад, при кімнатній температурі в 1 л Н2О розчиняється близько 700 л NH3 і лише 0,02 л N2. Необхідно додати, що розчинність газів в органічних рідинах помітно перебільшує розчинність їх у воді.
Хімічна природа газу і розчинника виявляється у можливості взаємодії між розчинником. Так, за однакових зовнішніх умов розчинності N2 i NH3 у воді неоднакові, оскільки молекулярний азот з водою не реагує, у той час як амоніак утворює гідрат NH3 · H2O (інакше кажучи – гідроксид амонію NH4OН), що відповідно до принципу Ле Шательє сприяє зміщенню рівноваги у правий бік, тобто посилює розчинність амоніаку:
[TEX]\rm NH_3 + H_2O \Leftrightarrow NH_3 \cdot H_2O[/TEX],
[TEX]\rm N_2 + H_2O \rightarrow [/TEX] реакція не проходить.
Залежність розчинності газів від тиску виражає закон Генрі:
розчинність газу в рідині за умов сталої температури прямо пропорційна його парціальному тиску
- [TEX]m=k\cdot P'[/TEX],(5.10)
- де m – маса газу, що розчиняється в 1 л розчинника, Р' – тиск газу (або парціальний тиск, коли має місце суміш газів), k – коефіцієнт, що характеризує природу розчину.
А за умови сталого тиску розчинність газів зменшується з підвищенням температури (рис. 5.20) – відповідно до принципу Ле Шательє, оскільки розчинність газів належить до екзотермічних процесів (ΔH < 0).
Завдяки зменшенню розчинності газів при підвищення температури кип’ятіння розчину дає змогу практично повністю позбутися розчинених у воді газів. Проте є випадки, коли цього досягти неможливо. Так, при нагріванні розчину хлоридної (соляної) кислоти з масовою часткою HCl 37-38% спочатку виділяється газоподібний хлороводень, а після досягнення концентрації 20,2% при температурі 110 °С починає кипіти нероздільна суміш HCl i H2O.
Розчин, що не розділяється на компоненти при температурі кипіння, називається азеотропний розчин, або азеотроп.
5.5.2 Розчинність рідин
При змішуванні двох рідин може спостерігатися декілька випадків.
1. Рідини розчиняються одна в одній в будь яких масових чи об’ємних співвідношеннях.
2. Рідини, здатні до обмеженої взаємної розчинності за певної температури. При змішуванні таких рідин відбувається їх розшаровування на дві фази, причому рідина з більшою густиною буде знаходитися знизу. Кожний шар в цій двохфазній системі уявляє собою насичений розчин однієї рідини в іншій, а на поверхні їх поділу встановлюється фазова рівновага. При нагріванні розчинність рідин збільшується і при деякій температурі настає необмежена взаємна розчинність компонентів системи.
Температура, при якій обмежена розчинність рідких компонентів переходить у необмежену, називається критична температура розчинення.
3. Рідини практично не розчиняються одна в одній. До таких систем належать системи: вода–бензен, вода–ртуть, вода–циклогексан та ін. Для цього випадку часто виникає цікаве явище: різна розчинність третього компоненту одночасно в двох рідинах, які перебувають у контакті, але не змішуються між собою. Це явище описує
закон розподілу Нернста-Шилова: при сталій температурі незалежно від кількості внесеної речовини в систему, що складається з двох взаємно нерозчинних рідин, відношення рівноважних концентрацій цього третього компонента між двома рідинами, які не змішуються, є сталою величиною:
- [TEX]K_{розп}=C_A/C_B,[/TEX](5.11)
-
де Крозп – коефіцієнт розподілу, який показує, в скільки разів розчинність третього компонента більша у фазі А, ніж у фазі В; СА і СВ – молярні концентрації третього компоненту в рідинах (фазах) А і В.
-
Найважливішим наслідком закону розподілу є можливість вилучення розчиненої речовини з розчину (наприклад, з водного) шляхом додавання до розчину іншого, органічного розчинника, що не змішується з водою – саме тому в нього і переходить речовина, що витягується з води. Такий процес називається екстракцією.
Екстракція – метод вилучення речовини з розчину за допомогою відповідного розчинника (екстрагенту), який не змішується з цим розчином.
Екстракція базується на різниці коефіцієнтів розподілу речовини між двома різними фазами: двома рідинами, що не змішується, рідиною та твердим тілом, рідиною та газом. Екстракція тим ефективніше, чим більше коефіцієнт розподілу відрізняється від одиниці на користь другого компонента, що додається, – розчинника. Ефективність процесу екстракції посилюється також шляхом проведення її в багатоступінчастому вигляді.
5.5.3 Розчинність твердих речовин
Тверді речовини подібно до газів і рідин за розчинністю у воді поділяються на три класифікаційні групи:
-
нерозчинні, для яких значення розчинності є найменшим (s < 0,001 моль/л). До них належать (за винятком відповідних сполук лужних і деяких лужноземельних металів):
- сульфіди (Me2Sy),
- гідроксиди (Me(OH) y),
- сульфіти (Me2(SO3)y),
- хромати (Me2(CrO4)y),
- середні карбонати (Me2(CO3)y),
- фосфати (Me3(PO4)y);
-
розчинні, для яких значення розчинності s > 0,1 моль/л. До цієї групи входять такі солі металів і амонію:
- майже всі ацетати загального складу (CH3COO)yMe і CH3COONH4,
- нітрати Me(NO3)y і NH4NO3,
- тіоціанати (Me(CNS)y і NH4CNS),
- галогеніди (хлориди, броміди, йодиди) загального складу MeHaly, за винятком галогенідів плюмбуму (ІІ) PbHal2, купруму (І) CuHal і аргентуму (I) AgHal,
- сульфати Me2(SO4)y, і (NH4)2SO4, за винятком сульфатів деяких лужноземельних металів (SrSO4 і ВаSO4), Ag2SO4, і PbSO4;
- малорозчинні, для яких значення розчинності (моль/л) 0,001 < s < 0,1. До них належать СаSO4, Li3PO4, LiF.
Розчинність різних твердих речовин в одному і тому ж розчиннику може змінюватися у широких межах. При підвищенні температури здебільшого розчинність твердих тіл зростає, проте для деяких сполук вона може зменшуватися. Зменшення розчинності з підвищенням температури характерне для речовин, розчинення яких супроводжується виділенням теплоти. У деяких випадках змінення розчинності при підвищенні температури зумовлене зміною складу твердої фази, що насичує розчин.
Дані щодо розчинності індивідуальних солей при різних температурах наводяться у спеціальних довідниках. Залежність розчинності твердих речовин від температури покладено в основу метода очищення сполук перекристалізацією.



