- 7.1 Іонообмінні реакції
- 7.2 Зміщення рівноваги дисоціаціі
- 7.3 Добуток розчинності
- 7.4 Електролітична дисоціація води. Водневий показник
- 7.5 Буферні розчини
- 7.6 Гідроліз солей
Ключові терміни:
автопротоліз води, буферна ємність, буферні розчини, водневий показник, гідроксильний показник, гідроліз за аніоном, гідроліз за катіоном, гідроліз солей, добуток розчинності, кислотний буферний розчин, основний буферний розчин, рівняння Гендерсона-Гассельбаха, ступінь гідролізу, сумісний необоротний гідроліз, індикатор, іони гідроксонію, іонний добуток води, іонний добуток води у логарифмічному вигляді
7.1 Іонообмінні реакції
Реакції між іонами у розчинах відбуваються тільки у тому випадку, якщо внаслідок їх взаємодії утворюється осад, летка сполука або слабкий електроліт, що зумовлює зміщення рівноваги у бік прямої реакції.
Умови перебігу іонних реакцій:
1. Утворення осаду;
2. Утворення леткої речовини;
3. Утворення малодисоційованої сполуки внаслідок перебігу таких процесів:
- Реакцій нейтралізації, в яких утворюється вода. Реакції нейтралізації можуть відбуватися при взаємодії різних вихідних речовин, наприклад: кислота і основа, кисла сіль і луг; основна сіль і кислота; кислотний оксид і луг; основний оксид і кислота;
- Реакції, в яких утворюється слабка кислота;
- Реакції утворення слабкої основи;
- Реакції утворення комплексних іонів.
7.2 Зміщення рівноваги дисоціаціі
Обов'язковою умовою перебігу реакцій між електролітами є видалення із розчину тих чи інших іонів, тобто реакції в розчинах електролітів завжди напрямлені у бік утворення найменш дисоційованих або найменш розчинних речовин.
Якщо у розчин слабкого електроліту ввести інший електроліт, який має з першим загальний іон, то ступінь дисоціації слабкого електроліту стає ще меншим, оскільки рівновага зміщується у бік зворотної реакції згідно з принципом Ле-Шательє.
Введення однойменних іонів у розчин слабкого електроліту зменшує його ступінь дисоціації.
Це явище використовується при одержанні буферних розчинів, в яких зберігається постійна концентрація іонів Н+ навіть при додаванні до них невеликих кількостей кислот або лугів.
7.3 Добуток розчинності
Речовини з обмеженою розчинністю схильні до утворення систем, в яких осад малорозчинної сполуки перебуває в стані рівноваги з її насиченим розчином. Завдяки динамічному характеру рівноваги швидкість розчинення осаду дорівнює швидкості зворотного процесу – кристалізації осаду з насиченого розчину. Наприклад, якщо помістити у воду осад малорозчинного електроліту КtxAny(кр), відбувається його часткове розчинення і в розчин переходить невелика кількість катіонів (Kty+(р-н)) і аніонів (Anx–(р-н)). Після досягнення насичення розчину, починається зворотний перехід іонів з насиченого розчину в осад. У якийсь момент встановлюється динамічна рівновага між обома процесами:
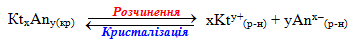
Для загального випадку константа рівноваги має вигляд:
- [TEX]\rm K=\dfrac{[Kt^{y+}]^x\cdot [An^{x-}]^y}{[Kt_xAn_y]} .[/TEX]
Однак концентрація твердої речовини вважається постійною ([KtxAny]кр = const), тому вона вводиться у константу:
- [TEX]\rm [Kt^{y+}]^x\cdot [An^{x–}]^y=K\cdot [Kt_xAn_y].[/TEX]
Добуток К · [Ktх[TEX]\cdot [/TEX]Anу] називається добутком розчинності і позначається ДР:
- [TEX]\rm ДР_{Kt_xAn_y}=[Kt^{y+}]^x\cdot [An^{x–}]^y.[/TEX]
Добуток розчинності – це стала за даної температури величина, що кількісно характеризує здатність малорозчинних електролітів до розчинення і визначається добутком концентрацій іонів у насиченому розчині, піднесених до відповідних степенів.
Чим менша величина добутку розчинності ДР солі, тим гірше ця сіль розчиняється у воді.
7.4 Електролітична дисоціація води. Водневий показник
Хімічно чиста вода є дуже слабким електролітом, оскільки її дисоціація пригнічується дією водневих зв'язків, завдяки чому окремі молекули Н2О сполучаються в асоціати. З іншого боку, значна полярність ковалентних зв'язків О–Н деякою мірою спричиняє електролітичну дисоціацію (точніше – іонізацію):
- [TEX]\rm H_2O\leftrightarrow H^++OH^-.[/TEX]
Завдяки надзвичайно малим розмірам та великій поляризувальній здатності іонів Н+, вони піддаються миттєвій гідратації з утворенням іонів складу Н3О+, які називаються іони гідроксонію, за схемою:
- [TEX]\rm H^++H_2O\rightarrow H_3O^+,[/TEX](7.1)
- або [TEX]\rm H_2O+H_2O\leftrightarrow H_3O^++OH^-.[/TEX]
Доведено, що гідратація іонів Н+ – це необоротний процес з константою рівноваги приблизно 10146, тобто іони Н+ гідратуються практично повністю.
Реакція, що відповідає рівнянню [TEX]\rm 2H_2O\leftrightarrow H_3O^++OH^-[/TEX], називається автопротоліз води, під час якого одна молекула води відщеплює іон Н+ (протон) і відіграє роль кислоти, а друга, яка приєднує протон з утворенням Н3О+, – роль основи.
Однак для зручності при запису дисоціації води користуються скороченим рівнянням:
- [TEX]\rm H_2O\leftrightarrow H^++OH^-.[/TEX](7.2)
На основі експериментальних досліджень встановлено, що при температурі 22°С ступінь дисоціації води дуже малий: [TEX]\alpha_{\text{H}_2\text{O}}=1,8\cdot 10^{–9}[/TEX], тобто на іони розпадається тільки одна молекула із приблизно 1800000000 молекул води. Зрозуміло, що вода належить до надзвичайно слабких електролітів і підлягає дії закону діючих мас. Тому для неї можна записати вираз константи дисоціації:
- [TEX]\rm K_{дис}=\dfrac{[H^+]\cdot [OH^-]}{H_2O} ,[/TEX]
- або [TEX]\rm [H^+]\cdot [OH^-]=K_{дис}\cdot [H_2O].[/TEX](7.3)
Невелике значення ступеня дисоціації води ([TEX]\alpha_{\text{H}_2\text{O}}=1,8\cdot 10^{–9}[/TEX]) свідчить про сильне зміщення рівноваги дисоціації вліво, тому концентрацію H2O при постійній температурі можна вважати постійною. Отже, добуток постійних величин у правій частини рівняння (7.3) – теж величина стала (К · [H2O] = const). Тоді сталим є і добуток концентрацій іонів Н+ і ОН– в лівій частині рівняння. Цей добуток ([H+] · [OH–]) одержав назву іонний добуток води:
- [TEX]\rm \color{red} {[H^+]\cdot [OH^-]=K_{H_2O},}[/TEX]
- де [TEX]\rm K_{H_2O}[/TEX] – іонний добуток води, для якого прийняті й інші позначення: Кв, або Кw.
Константа дисоціації води, визначена експериментально, при 22°С дорівнює: Кдис = 1,8 · 10–16, а концентрацію недисоційованих молекул води [H2O] практично можна вважати рівною її загальній концентрації. З рівняння дисоціації води ([TEX]\rm H_2O\leftrightarrow H^++OH^-[/TEX]) видно, що концентрації катіонів Гідрогену і гідроксильних аніонів однакові і одночасно дорівнюють концентрації тієї частини води, яка піддалася дисоціації і яка визначається добутком [TEX]\rm \alpha \cdot [H_2O][/TEX]:
- [TEX]\rm [H^+]=[OH^–]=\alpha\cdot [H_2O].[/TEX]
Молярна концентрація води обчислюється за відношенням кількості речовини([TEX]\nu =m/M[/TEX]) до об’єму [TEX]V[/TEX]:
- [TEX]C_{M(\text{H}_2\text{O})}=[\text{H}_2\text{O}]=\dfrac{\nu (\text{H}_2\text{O})}{V(\text{H}_2\text{O})}=\dfrac{m(\text{H}_2\text{O})}{M_{\text{H}_2\text{O}}\cdot V_{\text{H}_2\text{O}}} .[/TEX]
Беручи до уваги, що 1 л води при 22°С має масу приблизно 1000 г, одержимо молярну концентрацію води:
- [TEX][\text{H}_2\text{O}]=m / M\cdot V=1000 / 18\cdot 1= 55,56 [/TEX] моль/л.
Тоді концентрації іонів Гідрогену і гідроксид-іонів складають
- [TEX]\rm [H^+]=[OH^–]=\alpha\cdot [H_2O] = 1,8 \cdot 10^{–9} \cdot 55,56 = 1 \cdot 10^{–7}[/TEX] моль/л,
звідки іонний добуток води дорівнює:
- [TEX]\rm \color{red} {K_{H_2O}=[H^+]\cdot [OH^-]=1\cdot 10^{-7}\cdot 1\cdot 10^{-7}=10^{-14}} \;(при\;22^°C)[/TEX]
Іонний добуток води є сталою величиною за умов постійної температури. При підвищенні температури КН2О збільшується. Це зумовлено тим, що дисоціація води є ендотермічним процесом, який згідно з принципом Ле Шательє посилюється із зростанням температури і послаблюється під час охолодження.
Для води і розведених водних розчинів за умов постійної температури добуток концентрацій іонів Гідрогену і гідроксид-іонів є величиною сталою:
- [TEX]\rm K_{H_2O}=[H^+]\cdot [OH^-]=10^{-14}(22^°C)[/TEX](7.4)
Таке саме значення [TEX]\rm K_{H_2O}[/TEX] при 22 °С мають і розведені водні розчини кислот і основ. Тому, якою б великою не була концентрація іонів Н+, концентрація іонів ОН– не буде дорівнювати нулю або навпаки. На основі рівняння (7.4) легко обчислити концентрацію [Н+] чи [OH–] , якщо одна з цих величин відома:
- [TEX]\rm [H^+]=\dfrac{10^{-14}}{[OH^-]}[/TEX] і [TEX]\rm [OH^-]=\dfrac{10^{-14}}{[H^+]}.[/TEX](7.5)
Проте, вести розрахунки концентрацій [H+] i [OH–] через від'ємний ступінь не зовсім зручно, тому за пропозицією Серенсена використовується інша величина – водневий показник, який позначається символом рН.
Водневий показник рН – це величина, що характеризує кислотність середовища і дорівнює від'ємному десятковому логарифму концентрації іонів Гідрогену [H+]:
- [TEX]\rm pH=-lg[H^+].[/TEX](7.6)
По аналогії з ним було введено і гідроксильний показник рОН:
- [TEX]\rm pOH = – lg[OH^–]. [/TEX](7.7)
Логарифмуючи рівняння (7.4: [H+] · [OH–] = 10–14), одержимо:
- [TEX]\rm lg [H^+] + lg [OH^–] = –14.[/TEX]
Якщо перемножити всі члени в останньому рівнянні на –1, то:
- [TEX]\rm \color{blue} {-lg[H^+]-lg[OH^-]=14,}[/TEX](7.8)
або з урахуванням (7.6) і (7.7):
- [TEX]\rm \color{blue} {pH+pOH=14.}[/TEX](7.9)
Рівняння (7.8) і (7.9) – це іонний добуток води у логарифмічному вигляді. Розглянемо можливі межі змінення водневого (pH) і гідроксильного (pOH) показників залежно від реакції середовища у розчині.
- У нейтральному середовищі концентрації іонів Гідрогену і гідроксил-іонів однакові: [H+] = [OH–] = 10–7, тому водневий показник :
- [TEX]\rm pH = –lg[H^+]=–lg10^{–7}=7.[/TEX]
- У кислому середовищі концентрація іонів Гідрогену завжди вища, ніж концентрація гідроксильних іонів: [H+] > [OH–], тому
- [TEX]\rm [H^+]>10^{–7}, pH<7.[/TEX]
- У лужному середовищі, навпаки, переважає концентрація гідроксильних іонів: [H+] < [OH–] i тому
- [TEX]\rm [H^+]<10^{–7},\;pH>7.[/TEX]
Розчини, значення рН яких змінюється від 0 до 3, вважаються сильнокислими, а при рН = 4-6 – слабкокислими. В слабколужних розчинах водневий показник коливається в межах рН = 8-10, а в сильнолужних – рН = 11-14.
Якщо [H+] > 1 моль/л, то рН набуває від'ємних значень. Так, при [H+] = 2 моль/л водневий показник рН = –lg2 = –0,3.
Якщо [H+] < 10–14 моль/л, рН > 14, наприклад, при концентрації іонів Гідрогену [H+] = 0,5 · 10–14 моль/л, водневий показник рН = 14,3.
Точне значення рН розчинів можна розрахувати або експериментально визначити за допомогою спеціальних електрохімічних методів. Однак для наближеного знаходження величини рН користуються індикаторами (від лат.слова indicator – той, хто вказує).
Індикатор – це хімічна сполука, яка дозволяє візуалізувати досягнення системою певного стану з відповідною величиною рН середовища, що виявляється у виникненні помітної ознаки (змінення забарвлення, випадіння осаду, поява люмінісценції тощо).
Існує декілька груп індикаторів, кожна з яких має своє призначення. Так, для визначення рН розчину використовують здебільшого кислотно-основні індикатори – найчастіше це складні органічні кислоти чи основи, які змінюють своє забарвлення залежно від реакції середовища. Інтервал значень pH (інтервал переходу), в якому спостерігається змінення забарвлення, пов'язаний з константою дисоціації індикатору (pK) співвідношенням pH = pK ± 1. Для проведення аналізу індикатор вибирають таким чином, щоб інтервал переходу кольору включав те значення pH, яке розчин має у точці еквівалентності.
Величина pH істотно впливає на особливості перебігу хімічних реакцій, що відбуваються як у промислових процесах, так і в процесах життєдіяльності живих організмів.
7.5 Буферні розчини
Буферні розчини – це розчини з певною стійкою концентрацією іонів Н+, яка практично не змінюється при додаванні до них невеликих кількостей сильних кислот, лугів або при розведенні чи концентруванні.
Для забезпечення сталого значення pH буферний розчин повинен містити дві сполуки: одну, яка б перешкоджала зменшенню концентрації іонів H3O+ (або спрощено – іонів Гідрогену H+), іншу – яка б перешкоджала її збільшенню; при цьому вони не повинні нейтралізувати одна одну. Типово використовується пара сполук: слабка кислота – донор протонів H+ (або точніше H3O+) і сіль цієї кислоти – акцептор протонів – у приблизно однакових концентраціях. Значно рідше застосовують іншу пару: слабка основа і сіль, що має з основою однойменний катіон. Буферні розчини поділяються на кислотні та основні.
-
Кислотний буферний розчин – це суміш слабкої кислоти і солі, утвореної цією кислотою. Механізм дії кислотного буферу можна навести у загального вигляді. Нехай буферна система містить приблизно рівні концентрації слабкої кислоти (позначимо HAn) та її солі (An–) – сильного електроліту, який перебуває у розчині в іонній формі. Слабка кислота під впливом полярних молекул води піддається дисоціації з утворенням іонів гідроксонію (H3O+) і кислотних залишків – аніонів слабкої кислоти
- [TEX]\rm HAn + H_2O \leftrightarrow H_3O^+ + An^–,[/TEX]
або у спрощеному вигляді:
- [TEX]\rm HAn \leftrightarrow H^+ + An^–. [/TEX]
У свою чергу сіль, яка має зі слабкою кислотою однаковий аніон, належить до сильних електролітів і перебуває у розчині в іонній формі (позначимо An–), теж взаємодіє з водою
- [TEX]\rm An^– + H_2O \leftrightarrow HAn + OH^–.[/TEX]
При додаванні до буферного розчину сильної кислоти, що є донором іонів H+, останні зв'язуватимуться з кислотними залишками солі:
- [TEX]\rm H^+ + An^– \rightarrow HAn,[/TEX]
а при додаванні невеликої кількості лугу, що постачає у розчин іони OH–, в реакцію вступає слабка кислота:
- [TEX]\rm OH^– + HAn \rightarrow H_2O + An^-.[/TEX]
Ці дві реакції і забезпечують буферні властивості розчину: додавання до розчину іонів H+ чи OH– має наслідком зміну співвідношення концентрацій слабкої кислоти та солі, і зовсім незначний зсув pH.
Для розрахунку значення рН кислотного буферного розчину застосовують рівняння Гендерсона-Гассельбаха.
- [TEX]\text{pH}=\text{pK}_{кислоти}+\text{lg}\frac{C_{солі}}{С_{кислоти}}[/TEX], (7.10)
- де рКкислоти – від’ємний десятковий логарифм константи дисоціації слабкої кислоти (рКкислоти = –lgКкислоти); Скислоти, Ссолі, – відповідно рівноважні концентрації слабкої кислоти і солі цієї кислоти.
Загальний висновок щодо дії кислотного буферу: при додаванні до нього сильної кислоти або лугу концентрація іонів Н+, а отже і рН розчину, практично не змінюється за рахунок утворення слабких електролітів: в першому випадку – слабкої кислоти, а в другому – води.
-
Основний буферний розчин – це суміш слабкої основи та її солі, утвореної сильною кислотою, наприклад, амоніачний буфер, що складається з суміші слабкої основи NH4OH та солі NH4Cl, яка має з основою однаковий катіон. В такому буфері дисоціація слабкої основи відбувається частково, а дисоціація солі – повністю:
- [TEX]\rm NH_4OH \color{red}\leftrightarrow NH_4^+ + OH^-,[/TEX]
- [TEX]\rm NH_4Cl \color{red}\rightarrow NH_4^+ + Cl^-.[/TEX]
При додаванні до амоніачного буферу невеликої кількості сильної кислоти (HCl) відбувається її взаємодія з основою буферу, внаслідок чого утворюється сіль, а рН розчину майже не змінюється:
- [TEX]\rm HCl + NH_4OH\rightarrow NH_4Cl + H_2O,[/TEX]
- [TEX]\rm H^+ + \underline{Cl}^- + NH_4OH\rightarrow NH_4^+ + \underline{Cl}^- + H_2O,[/TEX]
- [TEX]\rm H^+ + NH_4OH\rightarrow NH_4^+ + H_2O,[/TEX]
При додаванні лугу (NaOH) в реакцію, навпаки, вступає сіль буферу:
- [TEX]\rm NaOH+NH_4Cl\rightarrow NH_4OH + NaCl,[/TEX]
- [TEX]\rm \underline{Na}^+ + OH^- +NH_4^+ +\underline{Cl}^- \rightarrow NH_4OH + \underline{Na}^+ + \underline{Cl}^-,[/TEX]
- [TEX]\rm OH^- + NH_4^+ \rightarrow NH_4OH.[/TEX]
Для визначення pH в основних буферних розчинах рівняння Гендерсона-Гассельбаха має вигляд:
- [TEX]\text{OH} =14 - \text{pK}_{основи} - \text{lg} \frac{C_{основи}}{C_{солі}} [/TEX] (7.11)
У виразі (7.11) рКоснови = –lgКдис.осн, Ссолі і Соснови – позначені відповідно молярні концентрації солі та основи.
Висновок: додавання сильної кислоти або лугу до основного буферу практично не впливає на концентрацію іонів Н+, тому рН середовища майже не змінюється за рахунок утворення слабких електролітів: води та основи. Зверніть увагу, що при додаванні кислоти до такого буферу концентрація основи NH4OH буде зменшуватися, а концентрація солі NH4Cl – зростати, а при додаванні лугу – навпаки, концентрація солі зменшується, а основи – збільшується.
Здатність буферного розчину зберігати величину рН у міру додавання сильної кислоти або лугу приблизно на постійному рівні обмежена так званою буферною ємністю В, яка характеризує здатність буферного розчину протидіяти зсуву реакції середовища при додаванні сильних кислот або сильних основ.
Буферна ємність В – величина, що характеризує здатність буферного розчину протидіяти зміненню рН середовища і визначається кількістю еквівалентів сильної кислоти чи лугу, яку необхідно додати до 1 л буферного розчину, щоб змінити його рН на одну одиницю.
Буферна ємність визначається відносно кислоти чи лугу за рівняннями:
- [TEX]B_{кисл} = \dfrac{C_{сильн.кисл} \cdot V_{кисл}}{\Delta \text{pH} \cdot V_{буф.розчину}}[/TEX], (7.12)
- [TEX]B_{лугу} = \dfrac{C_{лугу} \cdot V_{лугу}}{\Delta \text{pH} \cdot V_{буф.розчину}}[/TEX], (7.13)
- де Ссильн.кислоти і Слугу – еквівалентні (нормальні) концентрації, ΔрН – зміщення рН буферного розчину.
Буферна ємність не є сталою величиною, вона залежить, по-перше, від концентрації компонентів у розчині, а по-друге, від їх взаємного співвідношення.
7.6 Гідроліз солей
Гідроліз солей – це взаємодія складових частин солі з водою, яка приводить до утворення слабкого електроліту: кислоти чи основи, кислої чи основної солі.
Гідроліз являє собою реакцію обмінного розкладу солі водою, тобто процес, який є зворотним відносно реакції нейтралізації. Гідроліз – рівноважна реакція, тому можна зміщувати рівновагу в бажаний бік, створивши такі умови, за яких сіль або піддається повному гідролізу, або, навпаки, зовсім не буде гідролізуватися.
Якщо розглядати солі як продукти взаємодії кислот з основами, то в залежності від сили кислот і основ розрізняють чотири типи солей:
- солі, що утворені сильною кислотою і сильною основою;
- солі, що утворені слабкою кислотою і сильною основою;
- солі, що утворені сильною кислотою і слабкою основою;
- солі, що утворені слабкою кислотою і слабкою основою.
Солі, утворені сильною основою та сильною кислотою, гідролізу не піддаються. При гідролізі солей інших типів у розчині спостерігається змінення реакції середовища.
7.6.1 Гідроліз солей за аніоном
Першим типом гідролізу солей є гідроліз за аніоном, при якому аніон (кислотний залишок), що входить до складу солі, взаємодіє з водою, утворюючи слабкий електроліт: слабку кислоту чи сіль слабкої багатоосновної кислоти. Такому гідролізу піддаються солі, утворені сильними основами і слабкими кислотами, наприклад: Na2CO3, CH3COONa, KCN, K3PO4, Na2S та інші.
Якщо сіль містить однозарядний кислотний залишок, то реакція гідролізу відбувається в одну стадію, наприклад, гідроліз натрій ацетату:
[TEX]\rm \color{green}{CH_3COO}Na+H_2O\leftrightarrow \color{green}{CH_3COO}H+NaOH[/TEX]
[TEX]\rm \color{green} {CH_3COO^-}+Na^++H_2O\leftrightarrow \color{green} {CH_3COO}H+Na^++OH^-[/TEX]
[TEX]\rm \color{green} {CH_3COO^-}+H_2O\leftrightarrow \color{green} {CH_3COO}H+OH^-[/TEX]
Якщо у складі солі є багатозарядний аніон слабкої кислоти, то така сіль гідролізується ступінчасто, причому, на першому ступені утворюються кислі солі, Наприклад:
І ступінь: [TEX]\rm Na_2\color{green} {CO_3}+H_2O\leftrightarrow Na\color{green}{HCO_3}+NaOH[/TEX]
[TEX]\rm 2Na^++\color{green}{CO_3^{2-}}+H_2O\leftrightarrow Na^++\color{green}{HCO_3^-}+Na^++OH^-[/TEX]
[TEX]\rm \color{green}{CO_3^{2-}}+H_2O\leftrightarrow \color{green} {HCO_3^-}+OH^-[/TEX]
ІІ ступінь: [TEX]\rm Na\color{green}{HCO_3}+H_2O\leftrightarrow \color{green}{H_2CO_3}+NaOH[/TEX]
[TEX]\rm Na^++\color{green}{HCO_3^{-}}+H_2O\leftrightarrow \color{green}{H_2CO_3}+Na^++OH^-[/TEX]
[TEX]\rm \color{green}{HCO_3^{-}}+H_2O\leftrightarrow \color{green}{H_2CO_3}+OH^-[/TEX]
Завдяки наявності незв’язаних іонів ОН– у розчини цієї солі встановлюється лужне середовище, рН > 7.
Із розглянутих прикладів випливає висновок щодо І типу гідролізу:
cіль, утворена сильною основою і слабкою кислотою, гідролізується за аніоном, при цьому утворюється слабка кислота (чи кисла сіль), а розчин набуває лужної реакції середовища (рН > 7). Вираз константи гідролізу за І типом доводить: чим менше значення константи дисоціації кислоти (тобто чим слабкіша кислота), тим більша величина Кгідр і тим сильніше гідролізується сіль.
- [TEX]\rm \color{green}{K_{гідр}}=\dfrac{\color{blue}{K_{H_2O}}}{\color{red}{K_{дис.кисл}}}[/TEX]. (7.18)
7.6.2 Гідроліз солей за катіоном
Другий тип гідролізу відноситься до солей, утворених слабкими основами і сильними кислотами, тобто це гідроліз за катіоном, при якому з водою взаємодіє катіон металу Mex+ (чи амоній-катіон NH4+), що входить до складу солі. Прикладами таких солей є: NH4NO3, FeCl2, FeCl3, Al(ClO4)3, CuSO4 та ін. При однозарядному катіоні гідроліз відбувається в одну стадію. Наприклад, при гідролізі амоній хлориду NH4Cl катіон NH4+ утворює з водою слабку основу – NH4ОН, внаслідок чого в розчині накопичуються незв’язані іони Н+:
[TEX]\rm \color{red} {NH_4}Cl+H_2O\leftrightarrow \color{red} {NH_4}OH+HCl[/TEX]
[TEX]\rm \color{red} {NH_4^+}+Cl^-+H_2O\leftrightarrow \color{red} {NH_4}OH+H^++Cl^-[/TEX]
[TEX]\rm \color{red} {NH_4^+}+H_2O\leftrightarrow \color{red}{NH_4}OH+H^+[/TEX]
Якщо сіль має багатозарядний катіон, гідроліз відбувається ступінчасто:
I ступінь: [TEX]\rm CuCl_2 + H_2O \leftrightarrow CuOHCl + HCl,[/TEX]
- [TEX]\rm Cu^{2+} + 2Cl^- +H_2O \leftrightarrow CuOH^+ + Cl^- + H^+ + Cl^-,[/TEX]
- [TEX]\rm Cu^{2+} + H_2O \leftrightarrow CuOH^+ + H^+;[/TEX]
- II ступінь: [TEX]\rm CuOHCl +H_2O \leftrightarrow Cu(OH)_2 + HCl,[/TEX]
- [TEX]\rm CuOH^+ + Cl^- +H_2O \leftrightarrow Cu(OH)_2 + H^+ + Cl^-,[/TEX]
- [TEX]\rm CuOH^+ +H_2O \leftrightarrow Cu(OH)_2 + H^+.[/TEX]
Оскільки [TEX]\rm K_{дис\;Cu(OH)_2}>K_{дис\;CuOH^+}[/TEX], то КгідрІ > КгідрІІ, тобто за першим ступенем сіль гідролізується значно більше, ніж за другим.
Висновок: сіль, утворена слабкою основою і сильною кислотою, гідролізується за катіоном, при цьому утворюється слабка основа (чи основна сіль), а розчин набуває кислої реакції середовища, рН < 7.
Вираз константи гідролізу показує: чим слабкішою є основа (або чим менше значення Кдис.осн), тим більша константа гідролізу і тим сильніше гідролізується сіль
- [TEX]\rm \color{green}{K_{гідр}}=\dfrac{\color{blue}{K_{H_2O}}}{\color{red}{K_{дис.основи}}}[/TEX]. (7.21)
7.6.3 Гідроліз солей за катіоном і аніоном
Третій тип гідролізу – це гідроліз солей, утворених слабкими кислотами і слабкими основами, який відбувається одночасно за катіоном і за аніоном. Гідроліз третього типу протікає досить повно, а іноді й необоротно, оскільки внаслідок нього утворюються дві малодисоційовані, леткі чи малорозчинні сполуки. Реакція середовища в розчині солей, утворених слабкими кислотами і слабкими основами, найчастіше буває нейтральною (рН = 7), але може бути слабкокислою (рН ≤ 7) чи слабколужною (рН ≥ 7).
Розглянемо кожний з таких випадків.
Гідроліз ацетату амонію СН3СООNH4 – солі, утвореною слабкою основою (NH4ОН) і слабкою кислотою (СН3СООН) – проходить одночасно за катіоном NH4+ і аніоном СН3СОО– відповідно до рівняння:
[TEX]\rm \color{green}{CH_3COO} \color{blue}{NH_4}+H_2O\leftrightarrow \color{green}{CH_3COO}H+\color{blue}{NH_4}OH[/TEX]
[TEX]\rm \color{green}{CH_3COO^-}+ \color{blue}{NH_4^+}+H_2O\leftrightarrow \color{green}{CH_3COO}H+\color{blue}{NH_4}OH[/TEX]
[TEX]\rm \color{green}{CH_3COO^-}+ \color{blue}{NH_4^+}+H_2O\leftrightarrow \color{green}{CH_3COO}OH+\color{blue}{NH_4}OH[/TEX]
Внаслідок гідролізу ацетату амонію утворюється слабка кислота CH3COOH і слабка основа NH4OH. Для того, щоб зробити висновок про рН розчину солі СН3СООNH4, необхідно порівняти сили обох слабких електролітів за їх константами дисоціації:
- [TEX]\rm K_{дис.CH_3COOH}=1,74 \cdot 10^{-5}; \;\;\;\;\;\; K_{дис.NH_4OH}=1,76 \cdot 10^{-5}.[/TEX]
Обидві константи практично однакові, тому розчин солі СН3СООNH4 має нейтральну реакцію середовища, рН = 7.
Для цього типу солей константа гідролізу ураховує константи дисоціації як кислоти, так і основи:
- [TEX]\rm K_{гідр.CH_3COOH_4}=\dfrac{K_{H_2O}}{K_{дис.CH_3COOH}\cdot K_{дис.NH_4OH}}.[/TEX]
Прикладом другого випадку, при якому розчин набуває слабкокислого середовища, є гідроліз меркурій (ІІ) ціаніду Hg(CN)2:
- І ступінь: [TEX]\rm Hg(CN)_2 + H_2O \leftrightarrow HgOHCN + HCN,[/TEX]
- [TEX]\rm Hg^{2+} + 2CN^- + H_2O \leftrightarrow HgOH^+ + CN^- + HCN,[/TEX]
- [TEX]\rm Hg^{2+} + H_2O \leftrightarrow HgOH^+ + HCN[/TEX]
- І ступінь: [TEX]\rm HgOHCN + H_2O \leftrightarrow Hg(OH)_2 + HCN,[/TEX]
- [TEX]\rm HgOH^+ + CN^- + H_2O \leftrightarrow Hg(OH)_2 + HCN,[/TEX]
- [TEX]\rm HgOH^+ + CN^- + H_2O \leftrightarrow Hg(OH)_2 + HCN.[/TEX]
Порівняємо константи дисоціації відповідних електролітів:
- [TEX]\rm K_{дис.Hg(OH)_2}=5 \cdot 10^{-11}, \;\;\; K_{дис.HgOH^+}=3,6 \cdot10^{-14}, \;\;\; K_{дис.HCN} = 5\cdot 10^{-10}.[/TEX]
Величина Кдис.HCN на порядок перебільшує [TEX]\rm K_{дис.Hg(OH)_2}[/TEX], а це свідчить, що основа Hg(OH)2 по силі електроліту слабкіша, ніж електроліт HCN. З цієї причини гідроліз за катіоном певною мірою переважає над гідролізом за аніоном, зв’язування іонів ОН– відбувається значніше, тому реакція середовища – слабкокисла і рН ≤ 7.
Слабколужне середовище може утворюватися, наприклад, при гідролізі солі плюмбум (ІІ) ацетату Pb(CH3COO)2:
- І ступінь: [TEX]\rm Pb(CH_3COO)_2 + H_2O \leftrightarrow (PbOH)(CH_3COO) + CH_3COOH,[/TEX]
- [TEX]\rm Pb^{2+} + 2CH_3COO^- + H_2O \leftrightarrow PbOH^+ + CH_3COO^- + CH_3COOH,[/TEX]
- [TEX]\rm Pb^{2+} + CH_3COO^- + H_2O \leftrightarrow PbOH^+ + CH_3COOH;[/TEX]
- ІІ ступінь: [TEX]\rm (PbOH)(CH_3COO) + H_2O \leftrightarrow Pb(OH)_2 + CH_3COOH,[/TEX]
- [TEX]\rm PbOH^+ + CH_3COO^- + H_2O \leftrightarrow Pb(OH)_2 + CH_3COOH.[/TEX]
Для визначення рН порівняємо константи дисоціації відповідних електролітів:
- [TEX]\rm K_{PbOH^+} = 9,6 \cdot 10^{–4}; \;\;\; K_{CH_3COOH} = 1,74 \cdot 10^{–5}.[/TEX]
Оскільки кислота є значно слабшим електролітом ніж основа, то реакція середовища у розчині солі Pb(CH3COOН)2 слабколужна, рН ≥ 7.
На підставі розглянутих прикладів III типу гідролізу солей можна зробити загальний висновок:
сіль, утворена слабкою основою та слабкою кислотою, гідролізується одночасно за катіоном і за аніоном, при цьому продуктами є слабка основа (або основна сіль) і слабка кислота (або кисла сіль).
Реакція середовища у розчині може бути:
- нейтральною (рН = 7), якщо слабкі основа і кислота мають близькі значення констант дисоціації (Кдис.кислоти ≈ Kдис.основи);
- слабкокислою (рН ≤ 7), якщо основа є слабкішим електролітом у порівнянні з кислотою (Кдис.кислоти > Kдис.основи);
- слабколужною (рН ≥ 7), якщо кислота є слабкішим електролітом, ніж основа (Кдис.кислоти < Kдис.основи). Константа гідролізу визначається константами дисоціації як слабкої кислоти, так і слабкої основи:
- [TEX]\rm \color{green}{K_{гідр}}=\dfrac{\color{blue}{K_{H_2O}}}{\color{red}{K_{дис.кислоти}K_{дис.основи}}}[/TEX]. (7.22)
Деякі солі, що утворені дуже слабкими кислотами і дуже слабкими основами, гідролізуються не ступінчасто, а одразу піддаються повному необоротному гідролізу. Наприклад, алюміній сульфід, утворений слабкою амфотерною основою Al(OH)3 і слабкою сульфідною кислотою H2S, гідролізується майже миттєво навіть у невеликій кількості води, причому, гідроліз одночасно протікає і за катіоном, і за аніоном:
[TEX]\rm \color{blue}{Al}_2\color{green}{S}_3+6H_2O\rightarrow 2\color{blue}{Al}(OH)_3\downarrow +3H_2\color{green}{S}[/TEX]
Кількісною мірою гідролізу, крім константи гідролізу, може бути й інша характеристика – ступінь гідролізу h.
Ступінь гідролізу [TEX]h[/TEX] – це відношення концентрації гідролізованої солі до її загальної концентрації:
- [TEX]h = C_{гідр.} /C_{заг.}[/TEX] (7.23)
Для дуже розведених розчинів солей виконується залежність, аналогічна рівнянню Оствальда, яка пов’язує ступінь гідролізу з концентрацією солі та константою гідролізу:
- [TEX]K_{гідр.}=Ch^2 \;\;\; i \;\;\; h=\sqrt{\dfrac{K_{гідр.}}{C}}.[/TEX](7.24)
7.6.4 Зміщення гідролітичної рівноваги
Чинники, що впливають на ступінь гідролізу h і зміщення гідролітичної рівноваги.
-
Природа солі: чим слабкіша кислота, аніон якої входить до складу солі, тим повніше відбувається гідроліз; чим слабкішою є основа, катіон якої входить до складу солі, тим більшою є величина ступеню гідролізу h.
-
Концентрація солі. Ця характеристика безпосередньо зв'язана з кількістю води в розчині. Більш розведені розчини містять води набагато більше, ніж у концентровані. А згідно з принципом Ле Шательє збільшення кількості води (розведення розчину) зміщує гідролітичну рівновагу вправо. Звідси випливає загальний висновок: при розведенні розчину гідроліз солей посилюється і ступінь гідролізу h зростає, а при концентруванні – гідроліз послаблюється.
-
Температура. Оскільки реакція гідролізу належить до ендотермічних процесів, то підвищення температури зміщує гідролітичну рівновагу вправо і ступінь гідролізу зростає.
-
Змінення реакції середовища шляхом додавання до розчину солі сильної кислоти (+Н+) чи лугу (+ОН–). При гідролізі за аніоном, в результаті якого відбувається накопичення у розчині незв'язаних іонів ОН–, додавання лугу відповідно до принципу Ле Шательє зміщує гідролітичну рівновагу вліво і гідроліз пригнічується. А підкислення розчину такої солі (введення додаткових іонів Н+) зв’язує вільні гідроксильні іони в малодисоційовану сполуку (Н+ + ОН– → Н2О) і зміщує гідролітичну рівновагу вправо, прискорюючи перебіг гідролізу. Наприклад, якщо розчин солі Na2CO3, що створює лужну реакцію середовища за рахунок незв'язаних іонів ОН–, підкислити, то гідроліз посилюється, а якщо долити трохи лугу – послаблюється. Для солей, які гідролізуються за катіоном і створюють в розчині кисле середовище, справедливою є зворотна залежність: підкислення пригнічує гідроліз, а додавання лугу – посилює.
-
Додавання інших солей. Якщо до розчину солі, що гідролізується, долити розчин іншої солі, гідроліз якої відбувається за тим же типом і створює таке ж середовище (кислотне чи лужне), то спостерігається взаємне пригнічування гідролізу, оскільки обидві солі збільшують концентрацію однакових продуктів реакції (Н+ чи ОН–), а це призводить до зміщення гідролітичної рівноваги вліво у бік зворотної реакції.
А при зливанні розчинів двох солей, які гідролізуються за різними типами (тобто гідроліз однієї солі сприяє накопиченню надлишку іонів Н+, а гідроліз другої – надлишку іонів ОН–), відбувається взаємне посилення гідролізу. Зміщення гідролітичної рівноваги вправо, у бік прямої реакції, особливо помітно в достатньо розведених розчинах – в цьому випадку відбувається сумісний необоротний гідроліз, який, як правило, не обмежується першою стадією, а відбувається повністю, до утворенні кінцевих продуктів. Наприклад, при змішуванні розведеного розчину хром (Ш) сульфату Cr2(SO4)3, який гідролізується за катіоном (Cr3+), і натрій сульфіду Na2S, гідроліз якого відбувається за аніоном (S2–), починається сумісний необоротний гідроліз обох солей, причому і катіон, і аніон гідролізуються до кінця, тому в рівнянні реакції сумісного необоротного гідролізу ставлять стрілку (→):
[TEX]\rm \color{blue}{Cr}_2(SO_4)_3+3Na_2\color{green}{S}+6H_2O\rightarrow 2\color{blue}{Cr}(OH)_3\downarrow +3H_2\color{green}{S}+2Na_2SO_4[/TEX]
[TEX]\rm 2\color{blue}{Cr^{3+}}+3SO_4^{2-}+6Na^++6H_2O\rightarrow 2\color{blue}{Cr}(OH)_3\downarrow +3H_2\color{green}{S}+6Na^++SO_4^{2-}[/TEX]
[TEX]\rm 2\color{blue}{Cr^{3+}}+3\color{green}{S^{2-}}+6H_2O\rightarrow 2\color{blue}{Cr}(OH)_3\downarrow +3H_2\color{green}{S}[/TEX]
Як видно з рівнянь гідролізу, іони Н+ і ОН– сполучаються у міцні недисоційовані сполуки (осад Cr(OH)3 і летка речовина H2S), тому реакція середовища нейтральна і рН = 7.
Гідроліз відіграє важливу роль при здійсненні багатьох процесів. Наприклад, вилучення солей Феруму з води методом аерації при очищенні питної води. При насиченні води киснем ферум (II) гідрогенкарбонат, що міститься у воді, окислюється до солі феруму (III), який сильніше піддається гідролізу. У результаті відбувається повний гідроліз і залізо відокремлюється у вигляді осаду ферум (III) гідроксиду. На цьому засновано й застосування солей Алюмінію в якості коагулянтів при очищенні питної води. Солі Алюмінію в присутності гідрогенкарбонат-іонів повністю гідролізуються, утворюючи драглистий осад алюміній гідроксиду, який при коагуляції захвачує в осад ще й інші домішки.



