- 2.1. Класифікація органічних сполук
- 2.2. Класифікація вуглеводнів
- 2.3. Номенклатура органічних сполук
- 2.4. Основні поняття замісникової номеклатури
- 2.5. Утворення назв органічних сполук згідно з замісниковою номенклатурою IUPAC
2.1. Класифікація органічних сполук
Надзвичайно велику кількість органічних сполук вдалося вивчити лише базуючись на їх класифікації, тобто на віднесенні кожної окремої речовини до певного класу чи типу за наявністю в її будові та властивостях характерних родових ознак, притаманних даній групі сполук.
При класифікації органічних сполук за основу беруть три найважливіші ознаки:
- Будова карбонового ланцюгу, за якою органічні сполуки поділяються на такі групи:
- ациклічні сполуки (або аліфатичні сполуки), головною ознакою яких є незамкнутий карбоновий ланцюг нормальної чи розгалуженої структури;
- карбоциклічні сполуки, в яких карбоновий скелет утворює цикл (кільце). Залежно від будови циклу карбоциклічні сполуки поділяються на аліциклічні та ароматичні сполуки. Аліциклічні сполуки мають замкнутий ланцюг, що утворений атомами Карбону, сполученими між собою σ- чи σ+π-зв’язками. Ароматичні сполуки містять стійке циклічне угрупування – бензенове кільце, що утворене шістьма sp2-гібридизованими атомами Карбону;
- гетероциклічні сполуки, які містять у циклі атоми не тільки Карбону, але й інших елементів (N, S, O);
- Характер зв’язків між атомами Карбону, які здатні сполучатися між собою ковалентними зв’язками різної кратності, залежно від чого органічні сполуки поділяються на ряди:
- насичені сполуки, (або граничні сполуки), в яких між атомами Карбону утворюються прості (одинарні) ковалентні σ-зв’язки С–С;
- ненасичені сполуки, в карбонових ланцюгах яких містяться подвійні чи потрійні зв’язки;
- Природа функціональних груп. Функціональна група – це група атомів чи окремий атом, що має невуглеводневу природу і надає речовині певних властивостей, специфічних для даного класу органічних сполук. Залежно кількості та складу функціональних груп органічні речовини бувають такими:
- монофункціональні сполуки, до складу яких входить лише одна функціональна група;
- поліфукціональні сполуки, які містять декілька однакових функціональних груп;
- гетерофукціональні сполуки, що мають у своєму складі дві чи більше різних функціональних груп.
Залежно від наявності чи відсутності функціональних груп органічні речовини відносять відповідно або до певного класу органічних сполук або до вуглеводнів. Скорочений перелік найважливіших функціональних груп у порядку зменшення їх старшинства наведений у табл. 2.1.
Таблиця 2.1 — Функціональні групи (у порядку зменшення старшинства)
| Функціональна група |
Назва групи | Префікс (якщо група поступається старшістю) |
Суфікс (якщо група є старшою) |
Клас сполук, Загальна формула |
|---|---|---|---|---|
| –(С)ООН* будова: |
Карбоксильна | – | -ова кислота, -карбонова кислота |
Моно- і дикарбонові кислоти R–COOH, HOOC–R–COOH |
| –СООН | Карбокси- | – | Полікарбонові кислоти R(COOH)n | |
| –SO3H | Сульфогрупа | – | -сульфонова кислота |
Сульфонові кислоти, сульфокислоти. R–SO3H |
| Сульфо- | – | Сульфопохідні інших класів органічних сполук | ||
| –(С)ООМ* будова: |
Карбоксильна | – | -оат катіона М+ | Солі карбонових кислот R–COOMe, R–COONH4 |
| –СООМ | Металкарбокси- (або амоній- карбокси-) |
-карбоксилат катіона М+ |
Карбоксилатні похідні | |
|
будова: |
Ангідридна | – | -овий ангідрид | Ангідриди кислот |
| –(С)ООR* будова: |
Естерна | – | -оат** | Естери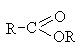
|
| –(C)OHal* будова: |
Галоген- ангідридна |
– | -оїлгалогенід | Галогенангідриди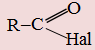
|
| –(C)ONH2* будова: |
Амідна (карбамідна) |
– | -оїламід | Аміди кислот |
| –(С)≡N* | Ціаногрупа | – | –нітрил | Нітрили R–C≡N |
| Ціано- | – | Ціанопохідні інших класів органічних сполук | ||
| –(С)Н=О* будова: |
Карбонільна (альдегідна) |
– | -аль | Альдегіди |
| Оксо- | – | Оксопохідні інших класів органічних сполук | ||
| –СН=О будова: |
Форміл- | -карбальдегід | ||
| >(C)=O* будова: |
Карбонільна (кетонова) |
– | -он | Кетони |
| >С=О | Оксо- | – | Оксопохідні інших класів органічних сполук | |
| –OH | Гідроксильна | – | -ол | Спирти R–OH |
| Гідрокси- | – | Гідроксипохідні інших класів орг. сполук | ||
| – | -фенол | Феноли Ar–OH | ||
| Гідрокси-*** | – | Гідроксипохідні ароматичних сполук | ||
| –SH | Тіольна | Меркапто- | -тіол | Тіоспирти (меркаптани) R–SH |
| –NH2 | Аміногрупа | Аміно- | -амін | Аміносполуки R–NH2, R2NH, R3N |
| –NO2 | Нітрогрупа | Нітро- | Суфікси не передбачені |
Нітросполуки R–NO2 |
| –OCnH2n+1 | Алкоксильна | Алкокси- | Етери R–OCnH2n+2 | |
| –F, –Cl, –Br, –I (–Hal) |
Галогени | Флуоро-, хлоро-, бромо-, йодо- |
Галогенопохідні R–Hal |
*Атом Карбону в дужках входить до складу головного ланцюгу, саме з нього розпочинається нумерація.
**Перед коренем дається назва радикалу R.
*** Якщо гідроксильна група безпосередньо сполучена з ароматичним кільцем, така сполука належить до класу фенолів, у всіх інших випадках – до класу спиртів.
2.2. Класифікація вуглеводнів
Класифікація, і утворення назв переважної кількості серед безлічі органічних сполук базується на основі класифікації та номенклатури вуглеводнів.
Вуглеводні – це органічні сполуки, молекули яких складаються з атомів двох елементів – Карбону і Гідрогену.
Кожний тип вуглеводнів утворює свій гомологічний ряд – послідовність подібних за будовою і властивостями сполук, склад якої відображається спільною загальною формулою.
За будовою карбонового ланцюгу вуглеводні поділяються на такі групи:
- Аліфатичні вуглеводні (інша назва – ациклічні вуглеводні), які мають незамкнуту структуру – нормальну чи розгалужену;
-
Циклічні вуглеводні, в основі структури яких лежить замкнутий ланцюг. В свою чергу, циклічні вуглеводні включають:
- Карбоциклічні вуглеводні (або аліциклічні вуглеводні), замкнутий ланцюг яких може бути насиченим чи ненасиченим;
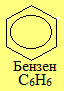
- Ароматичні вуглеводні, в основі будови яких лежить бензенове кільце складу С6Н6.
Залежно від характеру хімічних зв’язків між атомами Карбону аліфатичні вуглеводні можуть бути такими (рис. 2.1):
- Насичені вуглеводні, в яких атоми карбону сполучені одинарними σ-зв’язками;
- Ненасичені вуглеводні, що містять кратні зв’язки – подвійні (один σ- і один π-), потрійні (один σ- і два π-зв’язки) чи їх комбінацію.
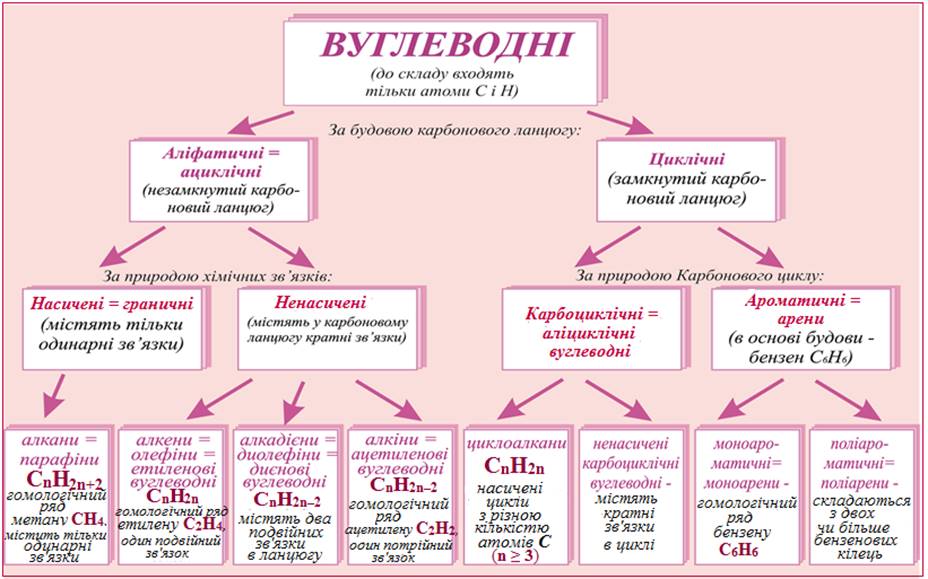
Рисунок 2.1 — Класифікація вуглеводнів за будовою карбонового ланцюгу і характером зв’язків між атомами карбону
2.3. Номенклатура органічних сполук
Тривіальна номенклатура (від лат. trivialis – звичайний) – це історично складені назви, що вказують на джерела добування органічних речовин чи на яскраві риси їх властивостей. Проте при розгляданні величезної сукупності різних класів органічних речовин необхідна об’єднувальна міжнародна систематична номенклатура, або номенклатура IUPAC, яка об’єднує принципи і правила відносно назв органічних сполук. Згідно із положеннями IUPAC для утворення назви розроблено вісім способів, але найвідомішими є чотири з них.
-
Замісниковий метод номенклатури IUPAC, в якому основою назви найчастіше є відповідний вуглеводень, а всі інші фрагменти в структурі молекули розглядаються як замісники атомів Гідрогену; наприклад, похідні бензену С6Н6 і метану СН4, в яких функціональними групами (Br і NH2) заміщено по одному атому Н:
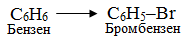
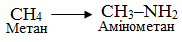
-
Сполучальний метод номенклатури IUPAC, згідно із яким назва сполуки складається з декількох рівноправних частин молекули; наприклад:
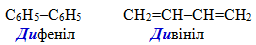
-
Радикально-функціональний метод номенклатури IUPAC, при якому до назви радикалу додається назва функціональної групи; наприклад:
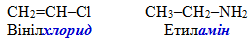
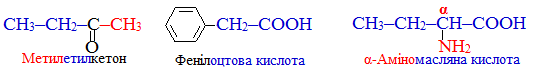
-
Замінювальний метод номенклатури IUPAC – для сполук, що містять гетероатоми в аліфатичному чи циклічному ланцюгу. Наприклад:
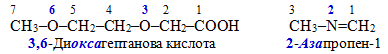
2.4. Основні поняття замісникової номеклатури
Для застосування замісникової номенклатури необхідно знати назви родопочаткових структур і замісників.
Родоначальна структура – це основа будови молекули, від кореня назви якої утворюється назва сполуки. Родоначальною структурою для аліфатичних (незамкнутих) вуглеводнів вважається головний карбоновий ланцюг, а для карбо- і гетероциклічних сполук – цикл. Назви більшості головних карбонових ланцюгів і циклів формуються на основі номенклатури алканів – насичених аліфатичних вуглеводнів загального складу СnН2n+2 (табл. 2.2).
Таблиця 2.2 — Назви алканів – насичених аліфатичних вуглеводнів нормальної (нерозгалуженої) будови відповідно до замісникової номенклатури IUPAC
| Склад | Раціональна структурна формула алкану нормальної будови |
Назва алкану з нерозгалуженим ланцюгом |
|---|---|---|
| СН4 | СН4 | Метан |
| С2Н6 | СН3–СН3 | Етан |
| С3Н8 | СН3–СН2–СН3 | Пропан |
| С4Н10 | СН3–(СН2)2–СН3 | Бутан |
| С5Н12 | СН3–(СН2)3–СН3 | Пентан |
| С6Н14 | СН3–(СН2)4–СН3 | Гексан |
| С7Н16 | СН3–(СН2)5–СН3 | Гептан |
| С8Н18 | СН3–(СН2)6–СН3 | Октан |
| С9Н20 | СН3–(СН2)7–СН3 | Нонан |
| С10Н22 | СН3–(СН2)8–СН3 | Декан |
| С11Н24 | СН3–(СН2)9–СН3 | Ундекан |
| С12Н26 | СН3–(СН2)10–СН3 | Додекан |
| С20Н42 | СН3–(СН2)18–СН3 | Ейкозан |
| С30Н62 | СН3–(СН2)28–СН3 | Триаконтан |
| С40Н82 | СН3–(СН2)38–СН3 | Тетраконтан |
| С100Н202 | СН3–(СН2)98–СН3 | Гектан |
У назвах сполук з більш довгим ланцюгом перед суфіксом (через дефіс) необхідно вказувати локант – номер атома Карбону, від якого починається кратний зв’язок, чи номер атома Карбону, сполученого із замісником.
За наявності двох чи декількох кратних зв’язків, застосовують множувальні частки (ди-, три-, тетра-, пента- та інші похідні від грецьких числівників), за допомогою яких позначають кількість кратних зв’язків чи замісників. Використовуючи множувальні частки, у назві сполуки необхідно приводити і відповідну кількість локаутів, наприклад:
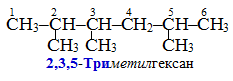
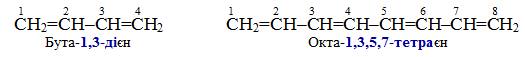
Замісник – це будь-який атом чи група атомів, які заміщують атом Гідрогену в родопочатковій структурі.
В якості замісника може виступати вуглеводневий радикал чи функціональна група, старша з яких визначає клас органічної сполуки.
Вуглеводневий радикал – це залишок молекули вуглеводню, який містить на один чи декілька атомів Гідрогену менше, ніж у вихідній молекулі.
Залежно від кількості втрачених атомів Гідрогену, вуглеводневі радикали можуть бути одновалентними і двохвалентними (табл. 2.3). Насичені одновалентні радикали мають загальну назву алкіли (позначаються Alk чи R). Назви одновалентних насичених радикалів утворюються шляхом заміни суфікса -ан на -ил (-іл) в назві вихідного алкану, наприклад: з алканів метану СН4 і етану С2Н6 утворюються радикали метил СН3– і етил С2Н5–.
Назви одновалентних ненасичених аліфатичних радикалів складаються із назви вихідного вуглеводню, до якого додається закічення -ил (-іл); при цьому вказують положення (локант) кратного зв’язку, а нумерацію починають від атома Карбону з вільною валентністю. Інколи для деяких з них використовують індивідуальні назви: вініл, аліл тощо.
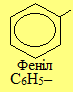
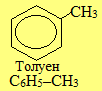
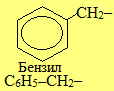
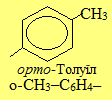
Загальна назва ароматичних радикалів – арили (позначаються символом Ar). Серед них найважливішими є феніл С6Н5–, бензил С6Н5–СН2– і три його ізомери загального складу СН3–С6Н4–, до кореня назв яких (толіл, або толуїл) додаються спеціальні префікси (орто-, мета-, пара-).
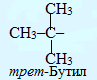
Для називання розгалужених радикалів вживаються додаткові префікси (ізо-, втор- і трет-), які визначаються особливостями будови атома Карбону з вільною валентністю: у випадку його сполучення лише з одним іншим атомом карбону, він вважається первинним, з двома сусідніми атомами карбону – вторинним, з трьома – третинним і з чотирма – четвертинним:
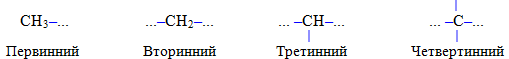
У назвах двохвалентних вуглеводневих радикалів використовується додатковий суфікс -иліден (-іліден), якщо атоми Гідрогену відщеплені від одного і того ж атома Карбону (винятком є назва двохвалентного радикалу метилену –СН2–).
Таблиця 2.3 — Номенклатура одновалентних вуглеводневих радикалів
| Вихідний вуглеводень |
Радикал, утворений з вуглеводню |
Вихідний вуглеводень |
Радикал, утворений з вуглеводню |
|---|---|---|---|
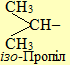 |
|||
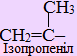 |
|||
 |
 |
||
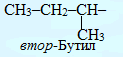 |
|||
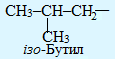 |
 |
|
|
 |
2.5. Утворення назв органічних сполук згідно з замісниковою номенклатурою IUPAC
Для утворення назв органічних сполук згідно з замісниковою номенклатурою IUPAC застосовують такий алгоритм.
- Встановлюють характеристичну групу (табл. 2.1), оскільки саме вона зумовлює подальший вибір родоначальної структури та нумерацію атомів С головного ланцюгу.
- Визначають родоначальну структуру – головний аліфатичний ланцюг чи циклічну систему. Для обрання родоначальної структури керуються такими критеріями (у порядку зменшення їх питомої ваги):
- наявність характеристичної групи;
- найбільша кількість функціональних груп;
- найбільша кількість кратних зв’язків;
- найбільша довжина карбонового ланцюгу – саме кількість атомів Карбону є основою назви родопочаткової структури;
- найбільша кількість вуглеводневих радикалів.
- Нумерують атоми Карбону в складі родоначальної структури, починаючи від старшої характеристичної групи. Якщо це правило не дозволяє однозначно вибрати напрямок нумерації, то ланцюг нумерують таким чином, щоб замісники чи кратні зв’язки одержали найменші номери.
- В алфавітному порядку називають ті замісники, що позначаються префіксами, із попереднім вказуванням їх локантів. При наявності декількох однакових замісників користуються множувальними частками (множувальні частки не входять в алфавітну послідовність), а цифри-локанти повторюється стільки разів, скільки є замісників. Цифри записують перед префіксами і перед суфіксами. При цьому цифри одна від одної відокремлюється комою, а цифра від букви – дефісом, наприклад: 2,2,3-триметил..., 3,4-дибромо-1,1,1-трихлоро....
- Називають родоначальну структуру з урахуванням відповідних суфіксів (для позначення характеру і кратності зв’язків, а також природи характеристичної групи) і множувальних часток; перед суфіксами через дефіс записують цифри-локанти, кількість яких повинна відповідати множувальним часткам: ... -1,3,5-триєн-8-ін, ... -1,2,3-триол.



