4.1. Природа хімічного зв'язку
Однозначно встановлено, що будь-який хімічний зв’язок має електричну природу. Це означає, що при його утворенні найбільш суттєву роль відіграють сили взаємодії між електричними зарядами, носіями яких є негативно заряджені електрони й позитивно заряджені ядра атомів. Суть взаємодії полягає у відштовхуванні однойменно заряджених частинок (ядро-ядро, електрон-електрон) і притяганні різнойменно заряджених (ядро-електрон). Зрозуміло, що система буде стійкою, якщо сили притягання переважають над силами відштовхування.
Зростання сил притягання при утворенні молекули з ізольованих атомів супроводжується виділенням енергії, внаслідок чого енергія системи зменшується порівняно з загальної енергією окремих атомів. Отже, рушійною силою утворення хімічного зв’язку є прагнення ізольованих атомів до виграшу в енергії, який досягається при їх об’єднанні в систему; стійкість системи забезпечується виникненням області підвищеної густини негативного електричного заряду в між’ядерному просторі, яка притягує до себе позитивно заряджені ядра атомів.
При утворенні хімічного зв’язку найважливішими є електрони зовнішнього шару, тобто валентні електрони, які утримуються ядром найменш міцно. Відповідно до запропонованого Льюїсом правило октету: Найбільш стабільними й енергетично вигідними є зовнішні оболонки атомів, які мають електронні конфігурації благородних газів, тобто такі, що містять два (у випадку найближчого до ядра енергетичного рівня) або вісім електронів.
Згідно з правилом октету при утворенні молекул атоми задовольняють свою потребу в досягненні енергетично вигідного стану шляхом набуття на зовнішньому рівні двохелектронної структури – електронний дублет (для елементів, розташованих на початку періодичної системи) чи восьмиелектронної структури – електронний октет для елементів, що мають більш віддалені від ядра електронні шари. Тому при сполученні атомів, в яких зовнішні електронні шари є незавершеними, їх оболонки зазнають перегрупування.
Будь-який хімічний зв’язок утворюється, якщо це енергетично вигідно – лише тоді, коли зближення ізольованих атомів приводить до зменшення повної енергії системи, яка складається з кінетичної і потенціальної енергій ядер атомів і електронів.
Для характеристики енергії системи, що містить два ізольованих атоми, які наближуються один до одного, застосовують так звані потенціальні криві (рис. ).
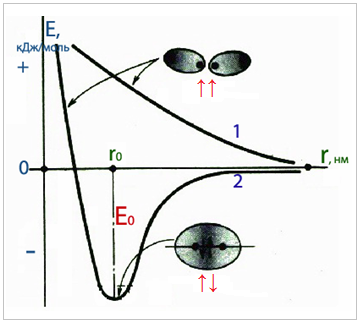
Рисунок — Загальний вигляд потенціальних кривих для характеристики змінення енергії системи з двох атомів залежно від відстані між ядрами
Верхня потенціальна крива 1 відображає збільшення загальної енергії системи у міру зменшення відстані r між двома атомами, оскільки при зближенні атомів з паралельними спінами (↓ і ↓) переважають сили відштовхування між їх електронними оболонками. При цьому зв’язок не утворюється. Нижня потенціальна крива 2 показує зменшення енергії системи у випадку зближення атомів, що мають антипаралельні спіни (↓ і ↑), на певну відстань – довжину зв’язку r0, на якій відбувається утворення хімічного зв’язку. Мінімум на потенціальній кривій 2 визначає енергію зв’язку Е0. При подальшому зближенні атомів починають переважати сили відштовхування між їх ядрами, тому загальна енергія системи зростає.
Енергія зв’язку – це міра міцності зв’язку, що визначається кількістю енергії, яка виділяється внаслідок утворення зв’язку. Довжина зв’язку – це відстань між ядрами хімічно сполучених атомів.
Одиниці вимірювання енергії зв’язку: [кДж/моль] або – рідше – [еВ]. Енергія зв’язку характеризує його міцність: чим більше енергія зв’язку, тим він міцніший. Довжину зв’язку вимірюють частіше у нанометрах [нм], пікометрах [пм], але інколи – в ангстремах [Å] (1 нм = 10–9 м, 1 пм = 10–12 м, 1Å = 10–10 м). Зі збільшенням радіусів атомів, між якими виникає зв’язок, зростає його довжина. Наприклад, довжини зв’язків у ряду гідрогенгалогенідів складають (нм): НF – 0,092; НCl – 0,128; HBr – 0,141; HI – 0,162.
Довжина зв’язку завжди менше суми радіусів двох сполучених атомів, оскільки утворення молекули супроводжується, крім зміни енергії, й зміною густини електронних хмар. Це свідчить про перекривання електронних хмар ізольованих атомів, що відбувається при утворенні зв’язку, тобто в молекулі змінюється густина і форма електронних хмар порівняно з ізольованими атомами.
4.2. Ковалентний зв'язок
Зв’язок атомів за допомогою спільних електронних пар називається ковалентний зв’язок. Для скорочення спільні пари електронів позначаються рискою між символами атомів відповідних елементів: С–Н, С–С, С–Cl.
Для пояснення особливостей хімічного зв’язку Льюїс запропонував розглядати ковалентний зв’язок як наслідок виникнення спільної для двох атомів електронної пари. Для цього кожний атом надає однакову кількість електронів і намагається оточити себе октетом або дублетом електронів, характерним для зовнішньої електронної конфігурації інертних газів.
Перша квантово-механічна теорія ковалентного зв’язку була створена Гейтлером і Лондоном для опису молекули водню, а потім застосована Полінгом до багатоатомних молекул. Ця теорія одержала назву методу валентних зв’язків (ВЗ). Паралельно Маллікеном і Гундом розвивався інший підхід для пояснення ковалентного зв’язку – метод молекулярних орбіталей (МО).
Основне положення, на якому ґрунтуються обидва методи, полягає в тому, що багатоелектронна хвильова функція для молекули утворюється як лінійна комбінація одноелектронних функцій, кожна з яких описує відповідний електрон. У цих методах використовуються різні підходи до побудови вихідної хвильової функції та різні уявлення про електронну будову молекул. В методі МО молекула розглядається як єдине ціле, де кожний електрон рухається в полі інших електронів і ядер, а її стан описується сукупністю електронних молекулярних орбіталей. Метод ВЗ дає більш наочне уявлення про будову молекули і характерні особливості ковалентного зв’язку, тому він частіше застосовується для якісного вирішування питань хімічного зв’язку.
4.2.1. Метод валентних зв'язків
Сутність ковалентного зв’язку пояснюється досить складними теоріями, серед яких найбільш доступною є модель валентних зв’язків (так званий метод ВЗ). Основні положення методу ВЗ стисло можна викласти так:
- Кожна пара атомів у молекулі утримується разом за допомогою однієї або декількох спільних електронних пар; при цьому електронні орбіталі сполучених атомів перекриваються;
- Міцність зв’язку залежить від ступеня перекривання електронних орбіталей: чим більша область перекривання, тим стійкіший зв’язок;
- Умовою утворення ковалентного зв’язку є анти-направленість спінів електронів (↑↓); завдяки цьому виникає узагальнена електронна орбіталь з найбільшою електронною густиною в між’ядерному просторі, яка забезпечує притягання позитивно заряджених ядер і зменшує загальну енергію системи.
4.2.2. Механізм утворення ковалентного зв'язку
Виникнення спільної електронної пари зв’язку може проходити за різними механізмами: частіше – за обмінним, а інколи – за донорно-акцепторним.
Обмінний механізм утворення ковалентного зв’язку полягає в тому, що кожний із взаємодіючих атомів постачає на утворення спільних двохелектронних хмар однакову кількість електронів з антипаралельними спінами. Наприклад, утворення спільної електронної пари (або спільної двохелектронної хмари) при сполученні двох атомів Н:
![]()
Донорно-акцепторний механізм утворення ковалентного зв’язку реалізується при взаємодії різних частинок, одна з них – донор (А:) – має незв’язувальну, неподілену пару електронів (тобто таку, що належить тільки одному атому), а інша акцептор (![]() ) – має вакантну орбіталь.
) – має вакантну орбіталь.
Частинка, яка надає для зв’язку двохелектронну хмару (неподілену пару електронів), називається донор, а частинка з вільною орбіталлю, яка приймає цю електронну пару, – акцептор. Механізм утворення ковалентного зв’язку за рахунок двохелектронної хмари одного атома і вакантної орбіталі іншого називається донорно-акцепторним.
В органічній хімії донорно-акцепторний зв’язок частіше називається семиполярний зв’язок (тобто напівполярним), оскільки на атомі-донорі виникає частковий ефективний позитивний заряд δ+ (за рахунок відхилення від нього його неподіленої пари електронів), а на атомі-акцепторі – частковий ефективний негативний заряд δ– (завдяки зміщенню в його бік неподіленої електронної пари донора).
Найпростіший акцептор електронної пари – катіон Гідрогену Н+, утворений при втраті атомом Гідрогену електрона (Н0 – 1ē → Н+). Він може бути акцептором і надавати свою вакантну орбіталь для неподіленої пари донора, який має неподілену електронну пару. Наприклад, при взаємодії іона ![]() з молекулою амоніаку NH3, центральний атом якої має неподілену електронну пару (:N), утворюється комплексний іон амонію NH4+ з позитивним зарядом.
з молекулою амоніаку NH3, центральний атом якої має неподілену електронну пару (:N), утворюється комплексний іон амонію NH4+ з позитивним зарядом.
Як приклад найпростішого донора електронної пари можна навести гідрид-іон Н¯, утворений внаслідок приєднання електрона до атома Гідрогену (Н0 + 1ē → Н¯). За рахунок неподіленої електронної пари іон Н¯ може відігравати роль донора при взаємодії з частинкою-акцептором, на центральному атомі якої є вільна орбіталь. Наприклад в молекулі ВН3 атом Бору має вакантну орбіталь (![]() ), на яку поступає неподілена електронна пара гідрид-іона Н¯. При цьому утворюється складний комплексний іон ВН4¯ з негативним зарядом (Н¯ +
), на яку поступає неподілена електронна пара гідрид-іона Н¯. При цьому утворюється складний комплексний іон ВН4¯ з негативним зарядом (Н¯ + ![]() Н3 → [ВН4]¯).
Н3 → [ВН4]¯).
4.3. Властивості ковалентного зв'язку
Властивості ковалентного зв’язку – це такі характеристики: валентний кут, довжина і енергія зв’язку, напрямленість, насичуваність, кратність, поляризація та поляризованість тощо.
-
Напрямленість ковалентного зв’язку – це таке розміщення електронної густини між атомами, яке забезпечує максимальне перекривання електронних орбіталей.
Оскільки електронні орбіталі мають різні форму і орієнтацію у просторі, то область їх взаємного перекривання може локалізуватися різним чином відносно уявної лінії, що з’єднує два ядра, яка називається вісь зв’язку. Залежно від цього розрізняють окремі типи зв’язків, які позначають грецькими буквами σ, π, τ, δ. В органічних сполуках найчастіше зустрічаються σ- і π-зв’язки, значно рідше – τ-зв’язки і тільки у виключних випадках – δ-зв’язки.
Сигма-зв’язок (σ-зв’язок) – це таке перекривання електронних орбіталей, при якому максимальна електронна густина концентрується у між’ядерному просторі вздовж вісі зв’язку. Ознакою сигма-зв’язку є наявність однієї області перекривання, зосередженої між ядрами атомів.
Пі-зв’язок (π-зв’язок) – це перекривання електронних орбіталей, при якому максимальна електронна густина концентрується з обох боків від вісі, що з’єднує ядра атомів.
Тау-зв’язок (τ-зв'язок) – це таке перекривання sp3-гібридизованих орбіталей, при якому максимальна електронна густина зосереджується не на вісі зв'язку, а з одного боку іззовні неї.
- Насичуваність ковалентного зв’язку – це здатність атома утворювати лише певну кількість зв'язків, яка залежить від числа неспарених електронів, що є в атомі. Наприклад, атом Карбону ву збудженому стані має чотири неспарених електрони, тому може утворювати не більше як чотири ковалентні зв’язки.
-
Кратність ковалентного зв’язку – це характеристика, яка визначається числом спільних електронних пар, що сполучають атоми. Ковалентний зв’язок за кратністю може бути одинарним (простим), подвійним і потрійним.
Зв’язок між двома атомами за допомогою однієї спільної електронної пари називається одинарний зв’язок (простий), двох електронних пар – подвійний зв’язок, трьох електронних пар – потрійний зв’язок.
Кратність зв’язку впливає на його енергію: з підвищенням кратності зростає міцність зв’язку. Підвищення кратності приводить до зменшення між’ядерної відстані (довжини зв’язку) і збільшення енергії зв’язку.
-
Полярність – це властивість ковалентного зв’язку, яка характеризує відносну відстань області найщільнішої електронної густини від ядер обох сполучених атомів. Залежно від неї розрізняють полярний і неполярний ковалентні зв’язки.
Неполярний зв’язок (або гомеополярний зв’язок) – це зв’язок, при якому область перекривання електронних орбіталей розміщується симетрично відносно ядер сполучених атомів і однаковою мірою належить обом атомам. Полярний зв’язок (або гетерополярний зв’язок) – це зв’язок, при якому область перекривання електронних орбіталей несиметрична і зміщена до одного з атомів.
Щоб визначити, в який бік буде зміщуватися електронна густина полярного ковалентного зв’язку, необхідно порівняти електронегативність обох атомів.
Електронегативність (позначається грецькою буквою χ) – це узагальнена функція, що характеризує здатність атома даного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів тієї самої сполуки.
За зростанням електронегативності (позначається грецькою буквою χ) найбільш поширені хімічні елементи розміщуються у такій послідовності:

- Поляризованість – зміна полярності зв’язку молекули внаслідок зміщення електронної густини під дією зовнішнього електричного поля іншої молекули (або атома чи атомної групи). Поляризованість молекули залежить від напрямленості зовнішнього поля і від здатності електронних хмар деформуватися. Під дією зовнішнього поля неполярні молекули стають полярними, а полярні – ще більш полярними, тобто в молекулах індукується диполь, який називається наведений диполь, або індукований диполь. На відміну від постійних індуковані диполі виникають лише при дії зовнішнього електричного поля.



