- 1.1 Питання 1. Фізичний (агрегатний) стан речовини
- 1.2 Питання 2. Фізико-хімічні властивості газів і їх сумішей
Ключові терміни:
Абсолютна вологість, Агрегатний стан, Відносна вологість, Газ, Густина, Кінематична в'язкість, Об'єм, Питомий об'єм, Речовина, Рідина, Сировина, Стисливість, Твердий агрегатний стан, Температура, Тиск, Хімічний склад, Чиста речовина, динамічна в'язкість, зріджений, пара, пружність, пружністю, температура фазового переходу, точкою росиВідомо, що агрегатний стан будь-якої речовини визначається його молекулярним складом і будовою, а також термодинамічними параметрами стану, найважливішими з яких є температура і тиск. Цілеспрямовано управляючи параметрами стану речовини, газ переводять в рідину або тверду речовину, минувши рідкий стан (процес газової кристалізації), або тверде з'єднання переводять в газоподібне, минувши рідке - процес сублімації. Відкриття законів технічної термодинаміки і використання їх у виробничих цілях дозволило протягом короткого часу перевести спочатку в рідкий, а потім і в твердий стан всі відомі в природі гази, а для деяких з них, зокрема для водень, передбачити, а потім експериментально підтвердити придбання їм металевих властивостей при високому тиску.
1.1 Питання 1. Фізичний (агрегатний) стан речовини
Речовина – складна фізико-хімічна система, продукт визначених фізико-хімічних природних або штучних процесів, що характеризується визначеним хімічним складом і певним типом фазового стану.
Сировина – речовина природного або штучного походження певного хімічного складу, що переробляється в будь-якому технологічному процесі на кінцевий виріб, напівфабрикат або продукт.
Хімічний склад - одна з основних конститутивних характеристик речовини, яка визначає його будову, фізичні і фізико-хімічні властивості. Властивості газових і рідких багатокомпонентних сумішей залежать від індивідуальних властивостей і концентрації вхідних в них компонентів, а також від температури і тиску.
Агрегатний стан є найважливішою фізико-хімічною характеристикою речовини і визначається хімічним складом і внутрішньою будовою, характером міжмолекулярних зв'язків, а також зовнішніми фізичними умовами - температурою і тиском. Останні з названих параметрів дозволяють перетворити графіт на алмаз, а водню додати властивості, характерні для металів. Агрегатний стан речовин, що переробляються, визначає не тільки швидкість їх фізико-хімічної взаємодії в технологічному процесі, але робить вплив на пристрій і конструктивні особливості апарату, його габаритні розміри.
Агрегатний стан речовини, характеризується певними якісними властивостями: здатністю або нездатністю зберігати об’єм і форму, наявністю або відсутністю далекого і ближнього порядку та іншими. Зміна агрегатного стану може супроводжуватися стрибкоподібною зміною вільної енергії, ентропії, густини та інших основних фізичних та термодинамічних властивостей.
Температура - найважливіший технологічний параметр стану, який визначає ступінь нагріву середовища і впливає на швидкість взаємодії фаз, по цьому параметру процеси розрізняють низько- і високотемпературні, які протікають з поглинанням тепла - ендотермічні або з виділенням тепла - екзотермічні.
Тиск визначає умову рівноваги у фазах і величину рушійної сили процесів, по величині вживаного тиску процеси можуть відбуватися під розрідженням (вакуумом), при атмосферному або надмірному (підвищеному або високому) тиску.
Об'єм є кількісною мірою вимірювання стану індивідуальної речовини в даній системі при заданому тиску і температурі, тим самим об'єм є також мірою вимірювання виконаної роботи в даній системі. Для індивідуальних газів параметром стану також є питомий об'єм - простір, який займається 1 кіломолем газу за нормальних умов (тиску 760 мм рт. ст. і температурі 0оС).
Газ - неконденсований агрегатний стан - характеризується повною відсутністю порядку у взаємному розташуванні атомів і молекул, які відзначаються хаотичним переміщенням на всіх напрямках.
Характерною властивістю газів є пружність - здатність стискатися і розширятися під впливом тиску і температури, і отже, ці чинники є визначальними параметрами стану газу. Слабка міжмолекулярна взаємодія речовини в газоподібному стані обумовлює прагнення газу до нескінченного розширення з підвищенням температури. Вельми важливою властивістю газів є їх здатність змішуватися в будь-яких умовах, утворюючи при цьому однорідну - гомогенну суміш.
Підвищення тиску зменшує відстань між частинками, сприяючи утворенню нових фізико-хімічних зв'язків і придбанню системою нових фізичних властивостей. У міру збільшення тиску газу відмінності у властивостях стислого газу і рідини зменшуються.
Підвищення температури приводить до збільшення кінетичної енергії молекул і в певному температурному інтервалі приводить до розриву хімічних зв'язків і до підвищення хімічної активності. При температурах вище 5000оС газів іонізується і переходить в плазмовий стан (четвертий агрегатний стан речовини). При пониженні температури зменшується кінетична енергія молекул, що сприяє переходу від газоподібного до рідкого, а потім і до твердого агрегатного стану.
На відміну від газу, пара є агрегатним станом, який конденсується і легк переходить в рідину при незначних змінах параметрів стану - пониженні температури або підвищенні тиску.
Параметром, що визначає стан газу або пари відомої речовини при постійному тиску, є температура фазового переходу - температура конденсації. Якщо температура пари вища за температуру конденсації, то таку пару називають сухою перегрітою і його властивості, до певної міри, співставні з властивостями ідеального газу. Якщо пара знаходиться в рівновазі з рідиною і має з нею однакову температуру і тиск, то таку пару називають насиченою, якщо в парах присутні навіть в невеликій кількості мікрокраплі рідини, то таку пару називають вологою і по суті вона представляє механічну суміш сухої насиченої пари з деякою кількістю мікрокрапель рідини.
Звичне відношення маси мікрокрапель диспергованої рідини, що знаходиться в 1 кг вологої пари, називають вогкістю пари, а відношення маси сухої пари, що знаходиться в 1 кг вологої пари, називають ступенем сухості пари.
Переведення газу (пари) в зріджений агрегатний стан пов'язано зі зміною параметрів стану (пониженням температури і підвищенням тиску), а також зі значними енергетичними витратами.
Рідина – агрегатний стан речовини, який конденсується і володіє рядом індивідуальних властивостей. Рідина характеризується тим, що молекули в ній певним чином впорядковані поблизу один від одного і в них відсутня дальня (гратчаста) впорядкованість молекул, властива твердим кристалічним речовинам.
Фізичні властивості і структура рідин залежить від хімічної будови молекул і характеру їх взаємодії між собою. Рідинам властиво властивість текучості. Рідина займає певний об'єм, на відміну від газів рідини мало пружні і отже середовища, що слабо стискаються. Тепловий рух молекул рідини включає коливання їх біля положень рівноваги, у міру збільшення температури амплітуда коливань зростає і, нарешті, при виході за межі дії сил молекулярного тяжіння, речовина переходить в пароподібний стан.
Для переведення одиниці маси речовини з рідкого стану в пароподібний необхідно витратити енергію на подолання сил взаємного притягання молекул. Цю енергію називають питомою теплотою фазового переходу (теплотою випаровування), при зворотному переході з парового в рідкий стан ця енергія виділяється у формі питомої теплоти конденсації (теплоти конденсації). При однакових умовах (температурі і тиску) питомі теплоти випаровування і конденсації рівні. З підвищенням тиску питома теплота фазового переходу практично для всіх рідин зменшується.
Умови рівноважного існування різних АС для конкретної речовини визначаються різноманітного роду діаграмами фазового стану в залежності від її природи, будови, температури і тиску.
Твердий агрегатний стан речовини характеризується певною впорядкованою, періодично повторюється внутрішньою структурою взаємного розташування частинок. У кристалічному твердому тілі частинки строго впорядковані і утворюють кристалічні грати, параметри яких фіксовані і визначають форму кристалів і фізичні властивості речовини. Для кристалічних тіл характерною є дальня впорядкованість частинок кристалічних решіток.
У загальному випадку форма кристалів залежить від хімічної будови речовини, температури і тиску. Властивість кристалів однакової хімічної будови змінювати свою форму під впливом температури і тиск називають поліморфізмом, властивість кристалів різних по хімічному складу речовин утворювати кристали однакової форми, називають ізоморфізмом. Властивість атомів однієї і тієї ж речовини утворювати кілька простих речовин, називається алотропією (кисень - озон, алмаз - графіт - карбін та ін.
Тверді кристалічні речовини мають фіксовану температуру плавлення при постійному тиску, при підвищенні тиску, як правило, підвищується температура плавлення, а також може змінюватися структура кристалічних решіток, відповідно речовина може придбавати інші фізичні властивості.
За типом частинок, що утворюють кристалічні решітки, розрізняють іонні, атомні, молекулярні і металеві структури.
У аморфному твердому тілі блоки мікрокристалічних частинок розташовані хаотично, температура плавлення аморфного тіла не має фіксованого значення. На структуру аморфного тіла дуже впливає швидкість охолодження. Речовини аморфної структури в основному отримують при високих швидкостях охолодження розплавів. При повільному охолодженні, підбираючи відповідні умови, майже всі аморфні речовини отримують в кристалічному стані.
Більшість газів (азот, водень, кисень і ін.), а також пари органічних сполук, переходячи в твердий стан, утворюють молекулярні кристалічні грати і характеризуються низькою температурою плавлення.
Серія рисунків (рисунок 1.1) ілюструє зміну атомної будови трьох агрегатних станів: газу, рідини та твердого тіла.
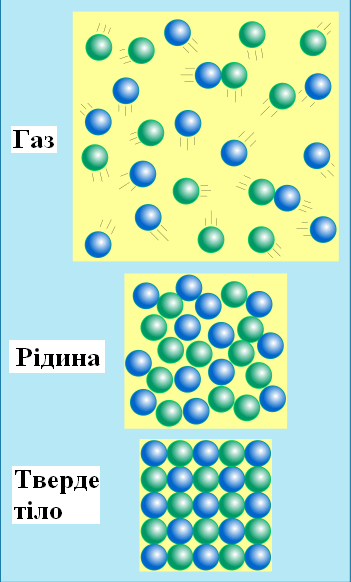

Рисунок 1.1 - Зміна атомної будови трьох агрегатних станів
 |
 |
| a | б |
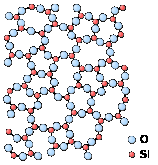
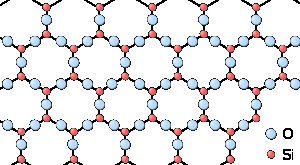
Рисунок 1.2 - Схематичне зображення атомної структури невпорядкованого аморфного (зліва) та впорядкованого кристалічного (справа) твердого тіла.
Чиста речовина - система, однорідна по складу і незмінна в хімічному відношенні. Перехід чистої речовини з одного агрегатного стану в інший супроводжується певним тепловим ефектом. Кількість тепла, що виділяється під час переходу одиниці маси речовини з газового або рідкого стану в твердий, називається питомою теплотою кристалізації, відповідно при зворотному переході з твердого стану в рідкий (або газоподібне) витрачається питома теплота плавлення. Для однієї і тієї ж речовини при певному тиску питомі теплоти фазового переходу чисельно рівні.
Для оцінки впливу властивостей і параметрів стану на умови існування фаз однокомпонентної чистої речовини побудовані діаграми стану, що звичайно представляються в прямокутній плоскій (двопараметричній) або просторовій об'ємній (трипараметричній) системі координат. Наприклад, для трипараметричної (об'ємної) діаграми стану по осі ординат відкладають значення тиску Р, по осі абсцис - молярний об'єм V, по третій осі - значення температури Т.
На такій діаграмі можна відобразити умови сумісного існування фаз у вигляді деякої поверхні, званої полем існування фаз.
Так як просторові діаграми громіздкі і незручні в практичних розрахунках, то користуються плоскими двокоординатні діаграмами, які представляють собою проекції повної об'ємної діаграми на одну з трьох площин. Зв'язок між параметрами фазового рівноважного стану системи встановлюється експериментально для індивідуальних газів і наноситься у вигляді прикордонних кривих на діаграму у відповідній системі координат.
На будь-якій діаграмі фазового стану завжди можна виділити робочу точку (в курсі фізичної хімії її прийнято називати фігуративною точкою), що враховує робочі параметри (мінімум два) системи. Якщо в реальному процесі відбувається зміна параметрів, то відповідно переміщатиметься робоча точка, при цьому в системі буде звершуватись певна робота. Хід процесу зміни параметрів виразиться у вигляді лінії або кривої, є геометричним місцем робочої точки, що переміщається, при поступовій зміні параметрів стану системи.
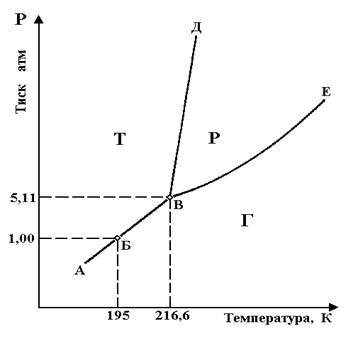
Рисунок 1.3 - Фазова діаграма стану діоксиду вуглецю в координатах Р -Т: Фази: Т - тверда; Р - рідка; Г – газова
Однією з найбільш часто використовуваних є діаграма стану індивідуальної речовини в координатах тиск - температура (Р-Т), на якій відображені умови рівноважного існування фаз.
Як приклад на рисунку 1.3 представлена діаграма стану двоокису вуглецю в координатах Р - Т (без дотримання масштабу).
Положення фігуративної точки В відображає умову одночасного існування трьох фаз: твердої (Т), рідкої (Р) та газоподібної (Г), її стан відповідає тиску Р = 5,11 ат і температурі 216,6 К (-56,55 оС).
Лінія АВ розділяє область існування твердої і газоподібної фаз і одночасно є лінією рівноваги в системі між твердою і газоподібною фазою. Підвищення температури при постійному тиску викликає перехід твердої фази в газоподібну (процес сублімації), зниження температури викликає перехід газоподібної фази в тверду (процес кристалізації), минаючи рідкий стан.
Прикордонна лінія ВД є рівноважною лінією одночасного існування твердої і рідкої фаз, при цьому вона розділяє області існування твердої і рідкої фаз. Будь-яке зниження температури (при постійному тиску) або підвищення тиску зміщують фазову рівновагу в бік утворення твердої фази (кристалізації вуглекислоти), підвищення температури зміщує фазову рівновагу в бік утворення рідкої фази. Прикордонна лінія ВЕ є рівноважною для одночасного існування рідкої і газової фаз, відповідно вона розділяє області існування рідкої і газоподібної фаз. Підвищення температури або зниження тиску в системі для робочої точки, розташованої на кривій ВЕ, змістить рівновагу системи в бік утворення газоподібної фази, викликаючи випаровування рідини, зниження температури і підвищення тиску змістять рівновагу в бік утворення рідкої фази, сприяючи конденсації газоподібної фази.
Подібного вигляду або дещо відмінні діаграми побудовані для багатьох індивідуальних речовин і дозволяють визначити напрям зміни параметрів стану системи для переходу речовини в бажаний агрегатний стан або навіть здійснити процеси отримання алотропних модифікацій речовини (наприклад, як теоретично встановлено і експериментально реалізовані процеси отримання алмазу з вуглецю або придбання воднем металевих властивостей при дуже високому тиску).
1.2 Питання 2. Фізико-хімічні властивості газів і їх сумішей
Технологічний розрахунок хіміко-технологічних процесів і обладнання практично неможливий без попереднього визначення фізико-хімічних властивостей середовищ та взаємодіючих речовин і фаз, а також їхньої зміни в технологічному процесі. Часто ця частина розрахунків створює чималі труднощі й потребує пильної уваги, щоб у подальшому не припуститися значних похибок у визначенні конструктивних розмірів обладнання.
Залежно від походження розрізняють природні і штучно одержані гази і газові суміші. У основу розрахунків фізико-хімічних властивостей газів і газових сумішей встановлені індивідуальні властивості речовин, параметри стану і газові закони.
Індивідуальною характеристикою властивостей газу (речовини) є його хімічний склад - виражений формулою, відповідно до якої за допомогою спеціальних хімічних символів, затверджених міжнародною Асоціацією наукової освіти (ASE), відображаються назва і число вхідних в хімічну формулу атомів кожного елементу. Хімічна формула дозволяє визначити молекулярну масу речовини, виражену через суму відносних (по відношенню до вуглецю, що містить 12 атомних одиниць маси) одиниць атомної маси вхідних у формулу елементів. Використання структурних формул дозволяє встановити будову речовини залежно від зв'язку атомів між собою.
Масу певної кількості речовини виражають через молярну масу і число молів співвідношенням
- [TEX]m=n\cdot{M}[/TEX](1.1)
- де [TEX]m[/TEX] - маса речовини, кг;
- [TEX]М[/TEX] - молярна маса, кг/кмоль.
Густина - маса речовини, укладена в одиниці його об'єму
- [TEX]\rho=m/V[/TEX](1.2)
Питомий об'єм - об'єм, який займає один кілограм речовини, при цьому
- [TEX]{{v}_{y}}=\frac{V}{m}=\frac{1}{\rho}[/TEX](1.3)
У основу розрахунків індивідуальних властивостей газів і їх сумішей узяті основні газові закони, що виражають співвідношення між температурою, тиском і об'ємом газів. Газові закони були вперше встановлені для ідеального газу і не враховували вплив сил взаємного тяжіння і відштовхування між молекулами.
Об'єднаний газовий закон (Бойля-Маріотта і Гей-Люссака) для ідеального газу записують у формі залежності
- [TEX]\frac{{{P}_{o}}\cdot{{V}_{o}}}{{{T}_{o}}}=\frac{{{P}_{1}}\cdot{{V}_{1}}}{{{T}_{1}}}[/TEX](1.4)
з якої витікає
- [TEX]{{V}_{1}}={{V}_{o}}\frac{{{P}_{o}}\cdot{{T}_{1}}}{{{P}_{1}}\cdot{{T}_{o}}}={{V}_{o}}\frac{(273+{{t}_{1}}){{P}_{o}}}{273{{P}_{1}}}[/TEX](1.5)
- де [TEX]{P}_{0}[/TEX] і [TEX]{P}_{1}[/TEX] - тиск за нормальних (t0=0oC, P0=760 мм рт. ст. = 1,013 бар) і робочих умов відповідно, бар, (Па, ат);
- [TEX]{V}_{0}[/TEX], [TEX]{V}_{1}[/TEX] - об'єм газу за нормальних і робочих умов відповідно, м3;
- [TEX]{Т}_{0}[/TEX], [TEX]{Т}_{1}[/TEX] - абсолютна температура газу за нормальних і робочих умов відповідно, К.
Відома також інша форма рівняння стану ідеальних газів, відповідно до якого
- [TEX]{P}_{1}\cdot{{V}_{1}}=n\cdot{R}\cdot{T}_{1}[/TEX] або [TEX]{P}_{1}\cdot{{V}_{1}}=\frac{m}{M}\cdot{R}\cdot{T}_{1}[/TEX](1.6)
- де [TEX]n[/TEX] - число кіломолів газу;
- [TEX]m[/TEX] - маса газу, укладена в певному об'ємі [TEX]{V}_{1}[/TEX], кг;
- [TEX]M[/TEX] - відносна молярна маса газу, кг/кмоль;
- [TEX]R[/TEX] - універсальна газова постійна, R=8,314 кДж/(кмоль·К).
Враховуючи, що густина газу визначається рівнянням (1.2), з рівняння (1.6) для різних станів газу за нормальних і робочих умов відповідно знайдено:
- [TEX]{{\rho }_{o}}=\frac{m}{{{V}_{o}}}=\frac{M}{R}\cdot \frac{{{P}_{o}}}{{{T}_{o}}}[/TEX] [TEX]{{\rho}_{1}}=\frac{m}{{{V}_{1}}}=\frac{M}{R}\cdot\frac{{{P}_{1}}}{{{T}_{1}}}[/TEX](1.7)
З сумісного рішення рівнянь (1.7) одержана залежність зміни густини газу від тиску і температури
- [TEX]{{\rho }_{1}}={{\rho}_{0}}\cdot\frac{{{T}_{0}}}{{{T}_{1}}}\cdot\frac{{{P}_{1}}}{{{P}_{0}}}[/TEX](1.8)
Відповідно до закону Авогадро один кіломоль будь-якого газу містить однакове число молекул (N=6,022·1026 1/кмоль) і займає за нормальних умов один і той же об'єм, рівний 22,405 м3, на цій підставі було одержане рівняння Клапейрона - Менделєєва, згідно якому знаходять густину газу за робочих умов
- [TEX]{{\rho}_{1}}=\frac{M}{22,4}\cdot\frac{273,15\cdot{{P}_{1}}}{(273,15+{{t}_{1}})\cdot{{P}_{0}}}[/TEX](1.9)
Молярну масу індивідуальних речовин підраховують по хімічних формулах з урахуванням атомних мас елементів, що входять до складу молекули.
Рівняння (1.5) і (1.9) застосовні як для розрахунків об'єму і густини окремих газів в робочих умовах, так і для розрахунків об'єму і густини пари індивідуальних речовин, що утворюються при випаровуванні рідини при певному тиску і температурі.
Газові закони і рівняння стану ідеальних газів застосовні також для газових сумішей, при цьому широко використовують правило адитивності (властивість величин, що характеризують об'єкт в цілому рівно сумі значень величин, відповідних його частинам).
Закон Дальтона. Загальний тиск суміші газів рівний сумі парціального тиску компонентів, що становлять суміш, тобто
- [TEX]P=\sum\limits_{1}^{n}{{{p}_{i}}}[/TEX](1.10)
- де [TEX]{р}_{i}[/TEX] - парціальний тиск індивідуальних компонентів суміші;
- [TEX]n[/TEX] - число компонентів газової суміші.
Із закону Дальтона виходить, що парціальний тиск індивідуального компоненту пропорційний загальному тиску і його молярній (об'ємної) частці в газовій суміші
- [TEX]{p}_{i}=P\cdot{y}_{i}[/TEX](1.11)
- де [TEX]{у}_{i}[/TEX] - молярна (об'ємна) частка індивідуального компоненту.
Згідно закону Амага, об'єм газової суміші при даній температурі і тиску рівний сумі парціальних об'ємів вхідних в суміш компонентів
- [TEX]V=\sum\limits_{1}^{n}{{{V}_{i}}}[/TEX](1.12)
відповідно, парціальний об'єм компоненту суміші рівний
- [TEX]{V}_{i}=V\cdot{y}_{i}[/TEX](1.13)
- де [TEX]{у}_{i}[/TEX] - молярна (об'ємна) частка компоненту;
- [TEX]{V}_{i}[/TEX] - парціальний об'єм компоненту;
- [TEX]n[/TEX] - число компонентів суміші.
Молекулярна маса газової суміші визначається по залежності
- [TEX]{M}_{{сум}}=\sum\limits_{1}^{n}{{{M}_{i}}\cdot{y}_{i}}[/TEX](1.14)
- де [TEX]{М}_{i}[/TEX] - молярна маса індивідуальних компонентів газової суміші;
- [TEX]{у}_{i}[/TEX] - відповідні молярні (об'ємні) частки компонентів.
Густина суміші газів також з достатньою точністю може бути визначена згідно правилу аддитивності, при цьому
- [TEX]{\rho}_{{сум}}={{\rho}_{1}}\cdot{{}_{1}}+{{\rho}_{2}}\cdot{{}_{2}}+...=\sum\limits_{1}^{n}{{{\rho}_{i}}\cdot{y}_{i}}[/TEX](1.15)
- де [TEX]{у}_{1}[/TEX], …, [TEX]{у}_{i}[/TEX] - молярні (об'ємні) частки компонентів газової (паровий) суміші;
- [TEX]{\rho}_{1}[/TEX],.., [TEX]{\rho}_{i}[/TEX] - відповідна густина компонентів суміші за робочих умов.
Густина газів (пари індивідуальних речовин) при атмосферному тиску в інтервалі температур 20 - 100оС приблизно в 300 - 1000 разів менше густини рідин.
Властивості реальних газів відрізняються від властивостей ідеальних газів перш за все наявністю сил в’язкісного тертя, а також сил взаємного тяжіння і відштовхування молекул, що впливає на стисливість реальних газів.
Найважливішою властивістю газового або рідкого середовища є динамічна в'язкість - здатність середовища чинити опір при русі її частинок щодо одна одної, тим самим в'язкість характеризує сили внутрішнього тертя в рухомому середовищі.
На основі рівняння Ньютона знайдено
- [TEX]\mu=\frac{F}{S\cdot({dw}/{dn)}}[/TEX](1.16)
- де [TEX]m[/TEX] - динамічна в'язкість, Н·c/м2 = Па·с;
- [TEX]{dw}/{dn}[/TEX] - градієнт швидкості, що характеризує зміну швидкості потоку з розрахунку на одиницю відстані між шарами середовища, що переміщається.
Кінематична в'язкість виражається відношенням динамічної в'язкості до густини середовища
- [TEX]\nu=\mu/\rho[/TEX](1.17)
В'язкість є індивідуальною характеристикою середовища і залежить від конститутивних властивостей речовини (будови і розміру його молекул), температури і тиску, при цьому із збільшенням температури і тиск в'язкість газів (пари) і газових (парових) сумішей зростає.
У області помірного тиску (до 5-6 МПа) в'язкість газу практично не залежить від тиску. У області високого тиску в'язкість газів з достатньою точністю можна визначити за допомогою розрахункових залежностей і номограм.
Зміна динамічної в'язкості газів залежно від температури найчастіше враховується формулою
- [TEX]{{\mu}_{t}}={{\mu}_{0}}\left(\frac{273+C}{T+C}\right)\cdot{{\left(\frac{T}{273}\right)}^{1,5}}[/TEX](1.18)
- де [TEX]{m}_{о}[/TEX] - в'язкість газу за нормальних умов 0оС і Р=760 мм рт. ст.;
- [TEX]С[/TEX] - постійна Сатерленда, що враховує властивості газів.
Для наближених розрахунків динамічної в'язкості газових сумішей використовують рівняння
- [TEX]{\mu}_{сум}={M}_{сум}/{\sum\limits_{1}^{n}{\left({{\text{}}_{i}}\cdot{{y}_{i}}/{\mu}_{i}\right)}}[/TEX](1.19)
- де [TEX]{М}_{i}[/TEX], [TEX]{М}_{{сум}}[/TEX] - молярна маса окремих компонентів і газової суміші в цілому;
- [TEX]{у}_{i}[/TEX] - об'ємні частки компонентів газової суміші;
- [TEX]{m}_{i}[/TEX] - відповідні динамічні коефіцієнти в'язкості компонентів
Природний газ у пластових умовах насичений парами води, які при русі газу конденсуються, збираються в низьких місцях газопроводів, порушуючи технологічний режим транспортування газу. Сполучення води з кислими газами сприяє інтенсивній корозії обладнання. Крім того, при певних тисках у присутності вологи в газі утворюються - кристалогідрати, які закупорюють прохідний переріз газопроводу й арматури, що може призвести до аварійної ситуації.
Наявність вологи в газі характеризується абсолютною і відносною вологістю.
Абсолютна вологість характеризує вміст водяних парів в одиниці об'єму газу в г/м3 або кг/1000 м3.
Відносна вологість — відношення абсолютної вологості при даних тиску і температурі до його вологоємності, тобто до кількості вологи в одиниці об'єму газу, що міститься при умовах насичення. Відносна вологість вимірюється в частках одиниці або відсотках. Відносна вологість газу, насиченого парами води, дорівнює 100 %.
Вологовміст природних газів залежить від тиску, температури, складу газу й води, характеристики середовища контакту і визначається по номограмі (рисунок 1.4).

Рисунок 1.4 - Номограма для визначення вологовмісту природного газу
Температура, при якій газ повністю насичений водяними парами, називається точкою роси даного газу.
Тиск насичених парів вуглеводнів є функцією температури. При підвищенні температури рідини тиск збільшується за рахунок переходу частини рідини в пароподібний стан. При рівновазі парової і рідкої фаз парціальний тиск компонента в паровій фазі (над рідиною) і в рідкій фаз (в рідині) буде однаковим.
Тиск, при якому рідина при даній температурі знаходиться в стані рівноваги зі своїми парами, називається пружністю насичених парів рідини. Залежність пружності парів вуглеводневих газів показана на рисунку 1.5.
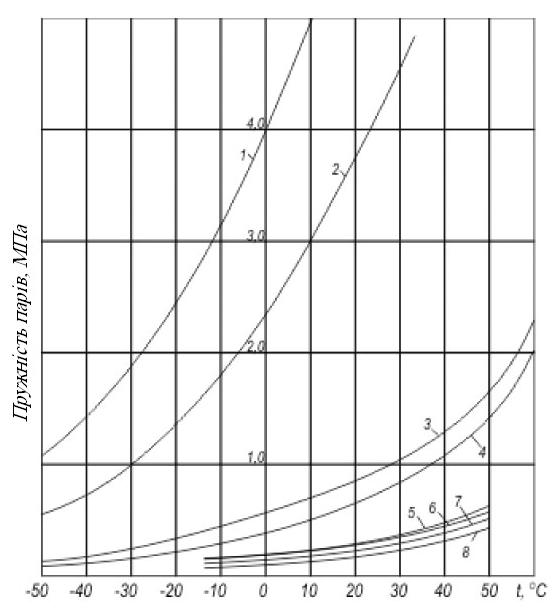
Рисунок 1.5 - Пружність насичених парів зріджених вуглеводневих газів: 1 — С2Н4; 2 — С2Н6; 3 — С3Н6; 4 — С3Н8; 5 — і-C4H10; 6 — і-C4H8; 7 — н-С4Н8; 8 — н-С4Н10).
Стисливість газу характеризує відхилення властивостей реальних газів від законів ідеального газу. Об'єм реальних газів змінюється не пропорційно його тиску й температурі і при однакових умовах стискується більше або менше, ніж ідеальний газ на величину Z — коефіцієнт стисливості, який визначають експериментально або по номограмі залежно від приведених температури й тиску газу (рисунок 1.6).
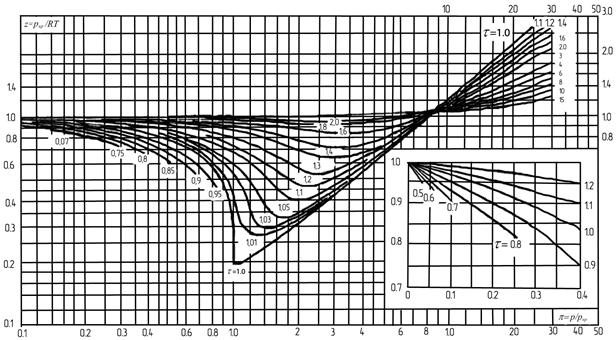
Рисунок 1.6 - Залежність коефіцієнта стисливості [TEX]z[/TEX] від зведених температури [TEX]t[/TEX] та тиску [TEX]\pi[/TEX]



