Ключові терміни:
нукліди
3.1 3.1 Атом – складна система
Слово атом у буквальному перекладі означає «неподільний». Вперше воно було застосовано давньогрецьким філософом Демокритом (приблизно 300р. до н.е), який вважав атоми найдрібнішими матеріальними частинками, що не піддаються ніякій зовнішній дії та ніколи не змінюються. І хоча завдяки численним науковим дослідженням с тих пір встановлено, що атом є складною системою, яка містить велику кількість елементарних і субелементарних частинок (більше 300 різновидів), термін атом зберігся, але набув зовсім нових ознак для його характеристики.
Складність будови атома була доведена експериментальними і теоретичними роботами багатьох науковців. Першою передумовою встановлення подільності атома стали дослідження електричного струму. Найяскравішими з них є досліди Фарадея при пропусканні електрики через рідини та відкриття Круксом невидимих катодних промінів, що прямолінійно розповсюджуються у вакуумі від катода до анода і викликають флюоресценцію (свічення) скла навколо анода.
Виходячи з таких фактів, Стоуні (1874р.) висловив ідею, що електрика складається з елементарних зарядів – електронів, пов’язаних з атомом. Пізніше Томсон (1897р.) обчислив відношення заряда електрона до його маси і довів, що електрони є складовою частиною атомів.
Електрон – це елементарна частинка з найменшим негативним електричним зарядом (1,602⋅10-19Кл) и масою, яка дорівнює 9,1095⋅10-28г, що приблизно у 1840 разів менша за масу атома Гідрогену.
Вивчення катодного випромінювання допомогло Рентгену (1895р.) відкрити новий вид випромінювання – Х-проміні (або рентгеновські проміні), які мають велику прониклу здатність і викликають флюоресценцію різних речовин
Іншою важливою подією у череді доказів щодо подільності атома вважається відкриття явища радіоактивності Беккерелем і досліди Кюрі та Склодовської-Кюрі, які встановили, що солі Урану і Торію випромінюють особливі проміні, які призводять до почорніння фотопластинки. Наслідком їх роботи стало відкриття двох нових елементів – Полонію та Радію
Радиоактивністю називається здатність атомів деяких елементів самочинно випромінювати невидимі проміні, які проходять через речовини, викликають почорніння фотопластинок та йонізують повітря.
3.1.1 Перші моделі атома
Експериментальні докази складної природи атома та встановлення його подільності спонукали вчених до створення теорії – так званої моделі атома, яка була би здатною описати властивості атомів, виходячи з теоретичних обrрунтувань їх будови. Найбільш відомими теоріями будови атома стали: пудингова модель У.Томсона-Кельвіна (рис. 3.1), модель Хантаро Нагаока (рис. 3.2), модель Дж.Томсона (рис. 3.3), модель Ленарда (рис. 3.4).
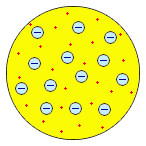
Рис. 3.1 – Модель будови атома У.Томсона-Кельвіна (1902р.),
згідно з якою атом – це зосередження позитивно зарядженої матерїї, всередені якої рівномірно розподілені електрони, подібно родзинкам у пудінгу, тому ця модель і отримала назву пудингової моделі.
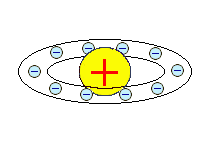
Рис. 3.2 – Модель будови атома Х. Нагоака (1904р),
відповідно до якої позитивно заряджене ядро атома, яке займає більшу частину об’єму, уподоблювалося планеті Сатурн, а електрони розташовувалися подібно до супутників Сатурна, утворюючи його кільця.
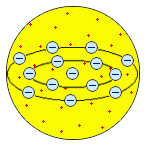
Рис. 3.3 – Модель будови атома Дж.Томсона (1904р.)
Електрони всередені позитивно зарядженої кулі розміщуються в одній площині і утворюють концентричні кільця. Дж. Томсон запропоновував спосіб визначення кількості електронів в атомі, припустив, що число електронів в атомі безперервно збільшується при переході від елемента до елемента і вперше спробував зв’язати будову атома з періодичністю властивостей елементів.
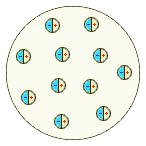
Рис. 3.4 – Модель будови атома Ленарда (1904р.),
яка заперечувала роздільне існування протилежних зарядів, а припускала, що атом складається з нейтральних частинок – електричних дуплетів, які містять одночасно і позитивний і негативний заряди і мають надзвичайно малі розміри, а отже більша частина атомного об’єму уявляє собою пустоту.
Слід підкреслити що зазначені моделі були виключно гіпотетичними та якісними, тобто не обrрунтовувалися математичними розрахунками. І тільки Резерфорд, відшукуючи експериментальне підтвердження моделі Томсона, зпирався на точні досліди і обчислення (рис. 3.5).
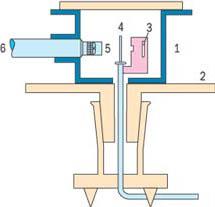
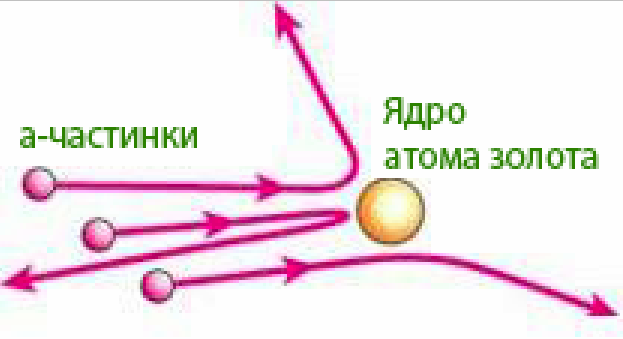
Рис. 3.5 – Дослід Резерфорда
В камері 1, закріпленій на поворотному диску 2, знаходиться радиоактивний препарат Радію 3, що випромінює альфа-частинки, які бомбардують тонку золоту фольгу 4. Альфа-частинки, що пролітають через фольгу зі швидкістю 10000км/с, відхиляються атомами золота на різні кути і потрапляють на екран 5, на якому виникають сцинтиляції (вспишки). Кількість вспишок реєструється за допомогою мікроскопу 6. Протягом досліду було зафіксовано більше 100 тисяч сцинтиляцій і встановлено, що на кут 180о (тобто у зворотньому напрямку відносно альфа-випромінювання) відображалася тільки одна частинка із 8 тисяч. Дослід підтвердив, що альфа-частинка відштовхується ядром згідно із законом Кулона.
Результатом числених дослідів стала планетарна модель будови атома Резерфорда (1911р.), яка базується на таких твердженнях:
-
всередені атома знаходиться позитивно заряджене ядро, радіус якого складає мізерну частину радіусу всього атома;
-
весь позитивний заряд і майже вся маса атома зосереджені в його ядрі;
-
навколо ядра обертаються негативно заряджені електрони, кількість яких дорівнює позитивному заряду ядра.
Досліди Резерфорда дали можливість встановити фундаментальну залежність – закон Мозлі:
Заряд ядра атома дорівнює порядковому номеру елемента в Періодичній системі Менделєєва.
Отже, основним наслідком створення перших моделей стало визначення атома як матеріальної частинки:
Атом – електронейтральна система, що складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки .
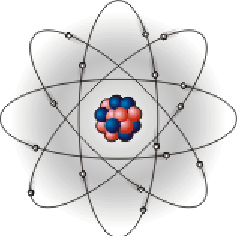
Рис.3.6 – Схема будови атома
Електронейтральність атома забеспечується тим, що заряд ядра і загальний заряд електронної оболонки є однаковими за величиною, але протилежними за знаками. Радіус атома приблизно в 100000 разів більший за радіус ядра .
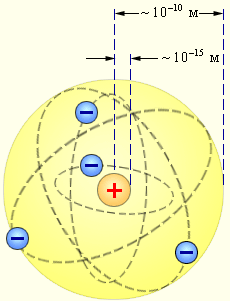
Рис. 3.7 – Розміри атома і ядра
Атом може втратити один чи декілька електронів чи навпаки – захопити чужі електрони. В таких випадках атом набуває відповідно позитивного чи негативного заряду і стає йоном.
3.1.2 Ядро атома
У центрі атома знаходиться ядро, що складається із нуклонів – субатомних частинок, зв'язаних між собою силами обмінної взаємодії. Субатомні, або ядерні, частинки – протони і нейтрони об’єднуються спільною назвою – нуклони (табл.3.1). Оскільки маса електрона у 1836 разів менша за масу протона, то зрозуміло, що сукупна маса електронної оболонки є дуже незначною порівняно із масою усього атома, а майже вся маса атома зосереджена в його ядрі. При цьому розміри атомних ядер, навпаки, надзвичайно малі і складають близько 10–15–10–14м. Це зумовлює фантастично велику густину речовини в ядрі – приблизно 1013–1014г/см3. Для порівняння: сірниковий коробок, наповнений речовиною такої густини, мав би масу 2,5міліарди тон.
Таблиця 3.1 – Субатомні частинки
|
Частинка |
Заряд |
Маса частинки: |
|
|
кг |
а.о.м. |
||
|
Протон |
+1 |
1,67·10– 27 |
1,00728 |
|
Нейтрон |
0 |
1,67·10–27 |
1,00867 |
|
Електрон |
– 1 |
9,11·10–31 |
0,000549 |
Протон (позначається так: ![]() ) – це елементарна субатомна частинка, яка фактично є ядром атома Протію (ізотоп Гідрогену 1Н), тому маса протона дорівнює 1 а.о.м., а заряд +1. Загальна кількість протонів – так зване протонне число Z – визначає заряд ядра атома, відповідає порядковому номеру елемента в Періодичній системі та співпадає з кількістю електронів на електронній оболонці атома.
) – це елементарна субатомна частинка, яка фактично є ядром атома Протію (ізотоп Гідрогену 1Н), тому маса протона дорівнює 1 а.о.м., а заряд +1. Загальна кількість протонів – так зване протонне число Z – визначає заряд ядра атома, відповідає порядковому номеру елемента в Періодичній системі та співпадає з кількістю електронів на електронній оболонці атома.
Крім протона, до складу атомних ядер (за виключенням ізотопу Протію 1Н) входять нейтрони (позначаються ![]() ), які не мають заряду, а за масою майже не відрізняються від протонів (табл.3.1). Загальна кількість нейтронів називається нейтронним числом N.
), які не мають заряду, а за масою майже не відрізняються від протонів (табл.3.1). Загальна кількість нейтронів називається нейтронним числом N.
Маса атома складається із суми мас всіх елементарних частинок: протонів, нейтронів, електронів. Однак беручи до уваги мізерну масу електрона, нею при розрахунках нехтують. Суму протонного Z і нейтронного N чисел називають масовим числом А:
А = Z+N.
В ядрі відбувається взаємне перетворення «протон↔нейтрон» за рахунок випускання та поглинання нуклонами особливих частинок π-мезонів.
Приклад 3.1. Визначити кількість протонів, нейтронів і електронів в атомі елемента №37 у Періодичній системі елементів.
Розв’язок. Елементом з порядковим номером 37 є Рубідій Rb.
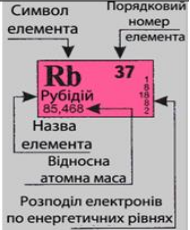
- Кількість протонів Z і електронів відповідає номеру елемента і дорівнює 37 Для визначення кількості нейтронів N необхідно від округленої відносної атомної маси елемента відняти кількість протонів. Ar (Rb) = 85,468 ≈ 85 а.о.м. Кількість нейтронів N = А – Z = 85 – 37 = 48. Відповідь: Z = 37; N =48;
 = 37.
= 37.
У природі атоми одного і того ж елемента можуть мати різні масові числа. Ядра таких атомів містять однакове число протонів, але різну кількість нейтронів – їх називають ізотопи. Отже,
ізотопи – вид атомів одного елемента з однаковим зарядом ядра, зумовленим однаковою кількістю протонів, та різною масою за рахунок різної кількості нейтронів.
У теперешній час відомо понад 1000 різних ізотопів. Ізотопи як правило позначають символом елемента з двома числами: знизу зліва – порядковий номер елемента (заряд ядра), угорі зліва – масове число (рис.3.11). До винятків належать ізотопи Гидрогену, кожний з яких має власну назву. Найпоширенішим (99,9%) є ізотоп Протій, що не містить нейтронів, а його ядро складається всього лише з одного протону. Дейтерій (0,02%) – другий ізотоп Гідрогену містить в ядрі один протон і один нейтрон. Тритій – ізотоп Гідрогену має два нейтрони і один протон.
Аналогічна форма запису поширюється й на інші елементарні частинки: β-проміні, які уявляєть собою потік електронів і мають мізерно малу масу (їм приписують масове число, що дорівнює А = 0), тому їх позначають символом ![]() . Альфа-частинки (позитивні двохзарядні ядра Гелію) позначають символом
. Альфа-частинки (позитивні двохзарядні ядра Гелію) позначають символом ![]() , а нейтрон і протон, як вже згадувалося – відповідно символами
, а нейтрон і протон, як вже згадувалося – відповідно символами ![]() і
і ![]() .
.
Слід зазначити, що види атомів, які відрізняються чи масовим (А), чи протонним (Z) числом, чим тим та іншим одночасно часто називають нукліди. Отже, ізотопи – це нукліди з різним значенням А, але однаковим Z на відміну від ізобарів (Див. розд. 1.3), які мають однакові А, однак різні Z.
З огляду на ізотопний склад випливає, що атомна маса елемента – це середнє значення масових чисел його ізотопів з урахуванням масової частки кожного ізотопа в земній корі (див. Розд. 1.3). Ізотопи одного елемента займають одне місце в Періодичній системі Д.І. Менделєєва.
Елемент – це сукупність ізотопів з однаковим зарядом ядра і, отже, з однаковим порядковим номером.
Існують стабільні і радіоактивні ізотопи. Стабільними вважаються ізотопи, ядра яких не розпадаються протягом дуже довгого часу, сумірного з існуванням Землі (близько 10 млрд. років). Радіоактивними називаються ізотопи, у результаті розпаду яких утворюються спочатку інші радіоактивні ізотопи з меншим масовим числом, а потім – і стабільні елементи.
Усі відомі елементи і штучні ізотопи можуть бути тим чи іншим шляхом перетворені в ізотопи сусідніх елементів внаслідок ядерних реакцій, при яких змінюється склад атомних ядер. Першу ядерну реакцію здійснив Резерфорд (1919р.) у дослідах по знаходженню протона у продуктах розпаду атомних ядер. При бомбардуванні атомів Нітрогену α-частинками (тобто ядрами атомів Гелію) проходила ядерна реакція за схемою:
|
|
З наведеного рівняння видно, що під час ядерних реакцій не тільки не змінюється сума масових чисел зліва і справа (14+4=17+1), але й витримується принцип рівності зарядів (7+2=8+1). Таким чином, при складанні рівнянь ядерних реакцій слід пам’ятати, що сума масових чисел (цифри, що стоять угорі зліва від символів атомних елементів) вихідних речовин повинна дорівнювати сумі масових чисел продуктів. Одночасно алгебраїчні суми зарядів (цифри внизу зліва поруч із символами) у лівій і правій частинах рівняння теж повинні бути однаковими.
Приклад 3.2. Ізотоп елемента №101 – Менделєєвій -256 одержали при бомбардуванні α-частинками атомних ядер Ейнштейнію-253. Скласти рівняння відповідної ядерної реакції та записити його у скороченій формі.
Розв’язок. Оскільки за допомогою ядерних реакцій з атомів одних елементів отримують ізотопи інших, зазначену ядерну реакцію можна виразити рівнянням:
25399Es + 42He → 256101Md +10n.
У скороченній формі рівняння ядерної реакції спочатку записують символ ізотопу, який піддають бомбардуванню, на кінці – символ ізотопа, що утворюється, не зазначаючи їх заряди. Між ними у дужках вказують частинку, якою бомбардують вихідний ізотоп, а потім через кому – частинку, що утворюється:
253Es (α,n) 256Md
При цому слід взяти до уваги, що у скороченній формі рівняння ядерної реакції частинки 42He, 11H, 21D, 10n позначають відповідно через α, p, d, n.
Радіоактивні ізотопи отримані для всіх хімічних елементів. Для їх добування використовують частинки високих енергій, які створюються у спеціальних прискорювачах – циклотронах. Радіоактивні та стабільні ізотопи мають однакові хімічні властивості. Синтез нових елементів з великими порядковими номерами – одна з проблем сучасної ядерної фізики. Під час ядерних реакцій виділяється велика кількість енергії. Наприклад, при самочинному розпаді Урану масою усього 1г за схемою
23592 U→9236Kr + 14156Ba+2 10n
виділяється понад 83млн кДж енергії. Це еквівалентно теплоті згоряння 2млн. кг високоякісного вугілля.
Ядерна реакція може відбуватися при зіткненні ядер елементів з нейтронами. Так при бомбардуванні нейтроном ядер Урану-235 вивільнюється два чи три нових нейтрони, які попадають на ядра інших атомів Урану і спричиняють їх розділення:
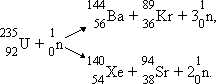
На цьому етапі утворюється вже від 4 до 9 нових нейтронів, здатних викликати нові розпади ядер Урану – такий лавиноподібний процес називається ланцюговою ядерною реакцією .
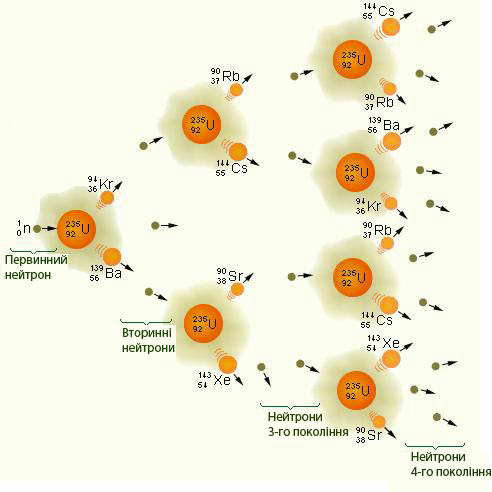
Рис. 3.8 – Схема розвитку ланцюгової реакції Урану-235
Таким чином, заряд ядра може змінюватися тільки при протіканні ядерних процесів, а при хімічних реакціях він залишається незмінним, але електронна оболонка піддається перегрупуванню.
3.2 3.2 Властивості електрона в атомі
Фізичні та хімічні властивості сполук, у тому числі й їх реакційна здатність, зумовлюються у першу чергу електронними оболонками атомів. Тому для розуміння сутності хімічних перетворень необхідно досконало уявляти природу електрона і електронну структуру атомів. Розглянуті раніше (див. Розд. 3.1) спроби науковців пояснити ці аспекти базувалися на законах класичної фізики, які є справедливими для об’єктів макросвіту, однак не виконується, коли йдеться про об’єкти мікросвіту – елементарні частинки. Особливу увагу привертав електрон, який поводив себе як матеріальна частинка, а інколи виявляв сугубо хвильові властивості (інтерференція, дифракція). Зрозуміло, що для пояснення цих властивостей був необхідний якісно інший підхід, який почав розвиватися на початку ХХст. і поступово сформувався у сучасну науку – квантову механіку, що rрунтується на зовсім нових поглядах на природу мікросвіту.
У 1913р. Н.Бор спробував обґрунтувати планетарну модель атома, запропоновану Резерфордом, з урахуванням квантової природи випромінювання. Він розглядав електрон як частинку з визначеною масою і визначеним зарядом, що рухається навколо ядра по виключно колових траєкторіях .
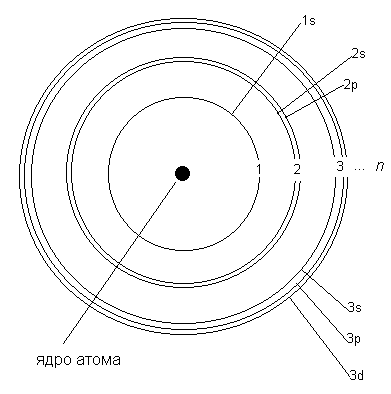
Рис. 3.9 – Схематичне зображення будови електронної облонки атома згідно з моделлю Бора
Бор висунув наступні бездоказові положення – постулати.
-
Електрон при обертанні навколо ядра може рухатися тільки по колових визначених орбітах без випромінювання чи поглинання енергії. Ці орбіти були названі стаціонарними, або борівськими. Радіус орбіти r і швидкість електрона v пов’язані квантовим співвідношення Бора
mvr = nh/2π,
де m – маса електрона; n – номер орбіти; h –стала Планка (h = 6,626 ⋅ 10-34 Дж ⋅с). Бор обчислив радіуси стаціонарних орбіт і встановив, що вони співвідносяться між собою як квадрати їх номерів (r1 : r2 : r3 : … : rn=12 : 22 : 32 : … : n2), а швидкості електрона на стаціонарних орбітах оберненопропорційні номерам орбіт (v1 : v2 : v3 : … vn ~ 1/1 : ½ : 1/3 : … : 1/n).
-
Електрон здатний переходити з однієї стаціонарної орбіти на іншу, що супроводжується поглинанням чи випромінюванням енергії у вигляді кванта електромагнітного випромінювання, енергія якого визначається різницею енергій атома у вихідному Е1 і кінцевому Е2 станах: Е = Е2 – Е1.
Стан електрона, в якому енергія електронів найменша, називають основним, або нормальним. У цьому стані електрон найміцніше зв’язаний з ядром, тому атом у такому енергетично вигідному стані може знаходитись тривалий час. Для переведення електрона на більш віддалену орбіту необхідно витрати певну енергію, щоб подалати його притягування до позитивно зарядженого ядра. Цей процес супроводжується поглинанням кванта енергії, внаслідок чого енергія атома зростає і він переходить у збуджений стан. Збудження може відбуватися при нагріванні, поглинанні світлової енергії тощо. В збудженому стані атом перебуває дуже короткий час, наприклад, термін існування атома Гідрогену в збудженому стані не перевищує 10– 8 сек.
Теорія Бора щодо будови атома Гідрогену виявилася наочною та зручною. Вона пояснила багато експериментальних фактів (наприклад, лінійчасту природу атомних спектрів як результат переходу електрона з однієї стаціонарну орбіту на іншу), а також надала теоретичних основ, щоб передбачити невідомі на той час спектральні лінії водню в ультрафіолетовій та інфрачервоній областях спектра. Однак у той же самий час теорія Бора не була позбавлена внутрішніх протиріч, головним з яких вважається застосування законів класичної фізики для об’єктів мікросвіту, які підлягають зовсім іншим законам.
Згадане протиріччя усунув Де Бройль (1924р.), припустивши наявність у електрона хвильових властивостей, однозначно пов’язаних з його масою та енергією. Де Бройль вважав, що руху електрона відповідає деяка хвиля матерії λБ подібно до того, як руху світлового кванта відповідає світлова хвиля. З таких позицій пояснювалися квантові умови постулатів Бора: з геометричних міркувань хвиля, що рухається навколо ядра може бути тільки стаціонарною хвилею, а довжина хвилі повинна бути кратною цілому числу напівхвиль .
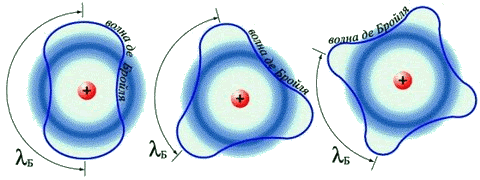
Рис. 3.10 – Хвилі Де Бройля для електрона з номерами орбіт n = 2,3 і 4
Отже, за Де Бройлем, електрон в атомі має двоїсту природу: подібно до будь-якої частинки (тобто корпускули) він характеризується певною масою m і швидкістю v, але у той же час при русі виявляє і властивості хвилі (довжина хвилі λ, частота коливань). Ця залежність називається корпускулярно-хвильовим дуалізмом електрона і виражається рівнянням Де Бройля:
[TEX]\lambda =\frac{h}{mv} [/TEX].
Порівняння хвильових (λ) і корпускулярних (m) властивостей електрона (λ:m = 0,332⋅10-9:9,1095⋅10-31~ 3,7⋅1020) свідчить о значній (приблизно ~ 20 порядків) перевазі його хвильових властивостей над корпускулярними. Саме на цьому базується принцип невизначенності Гейзенберга (1927р.):
Неможливо одночасно і точно встановити положення електрона в атомі (тобто його координати) і швидкість, або імпульс.
Математичний вираз принципу невизначенности має вигляд:
ΔхΔр ≥ h/2π,
де Δх, Δр, Δv – відповідно невизначенності у координаті, імпульсі та швидкості, (h –стала Планка, h = 6,626 ⋅ 10-34 Дж ⋅с).. З принципа невизначенності випливає: чим точніше встановлена координата (тобто положення) електрона в атомі, тим більшою буде похибка при знаходженні його швидкості (імпульсу). Наприклад, розраховано, якщо координата електрона обчислена з точністю до 10-12м, то невизначенність у швидкості складатиме 58000000 м/с (при середній швидкості електрона 2,187⋅106 м/с).
З огляду на корпускулярно-хвильову двоїстіть природи електрона в атомі квантова механіка замінила борівський термін «стаціонарна орбіта», під яким розуміється певна і цілком визначена траекторія руху електрона навколо ядра, сурово математичним поняттям «орбіталь», яке характеризує лише імовірність перебування електрона у той чи іншій точці атомного простору. Іноді поряд з цим використовують поняття «електронна хмара», розуміюючи її як фізичну модель математичного поняття «орбіталь».
Орбіталь – простір навколо ядра, в якому перебування електрона є найбільш імовірним.
Електронна хмара – простір навколо ядра, електронна густина в якому пропорційна імовірності перебування в ньому електрона.
3.3 Практична частина
Приклад 3.3. Визначити кількість протонів, нейтронів, електронів в атомі елемента №31 Періодичної системи елементів.
Розв’язок. Елемент № 31 – це Галій Ga.
|
31 Ga Ar = 69,72 галій |
Кількість протонів Z і електронів (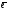 ) відповідає номеру елемента =_____________
) відповідає номеру елемента =_____________
Для визначення кількості нейтронів (нейтронного числа) N необхідно від масового числа А (округленого значення відносної атомної маси елемента) відняти кількість протонів.
Відносна атомна маса Ar (Ga) = 69,72а.о.м. Масове число А ≈ _______ .
Кількість нейтронів (нейтронне число N) = __________________________ .
Відповідь: __________________________________________________
Приклад 3.4. Визначити відносну атомну масу елемента Сульфуру, якщо відомо, що у природі зустрічаються два його ізотопи: 3216S з масовою часткою 94%, i 3316S з масовою часткою 6%.
Розв’язок. Відносна атомна маса елемента ураховує поширенність у природі його ізотопів та їх масові числа
Аr (елемента) = ω1 ⋅ А1+ ω2 ⋅ А2 + ... + ωn ⋅ Аn...,
де значення ω береться не у відсотках, а в частках одиниці.
Тоді відносна атомна маса елемента Сульфуру:
Аr (S) = 32⋅____ + 33 ⋅_______= __________ а.о.м.
Відповідь: ___________________________
Приклад 3.5. Визначити відсотковий вміст ізотопів елемента Натрію, якщо відомо, що у природі зустрічаються два його ізотопи: 2211Na i 2311Na, а середня відносна атомна маса Натрію = 22,99 а.о.м.
Розв’язок. Позначимо ω(2211Na) = х, тоді ω(2311Na) = (1 – х). Підставимо невідомі у вираз для розрахунку відносної атомної маси:
Аr (Na) = 22⋅ x + 23 ⋅(1 – x) = 22,99 а.о.м.
Розв’язуємо рівняння відносно х.
Помноживши одержані величини на 100%, маємо відсотковий зміст ізотопів елемента Натрію.
Відповідь:ω(2211Na) _______%, ω(2311Na) _______%
Приклад 3.6. Визначити елемент, приблизне значення відносної атомної маси якого дорівнює Аr (елемента) = 56а.о.м. Визначити протонне і нейтронне число, а також кількість електронів в атомі даного елемента.
Розв’язок. Згідно із Періодичною таблицею Менделєєва елемент, що має відносну атомну масу Аr =56а.о.м., – це Ферум Fe.
Протонне число Z=_________ .
Кількість електронів (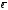 ) дорівнює Z і відповідає номеру елемента =_____________ .
) дорівнює Z і відповідає номеру елемента =_____________ .
Кількість нейтронів – нейтронне число N =___________________________________ .
Відповідь:__________________________________________________



