- Тема 1. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
Ключові терміни:
Алотропія, Атом, Відносна атомна маса Аr, Відносна молекулярна маса Мr, Кількість речовин, Молекула, Моль, Нуклід, Хімічний елемент, валентність, сталою АвогадроТема 1. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
Хімія як наука бере початок з другої половини ХVII ст., коли були застосовані кількісні методи дослідження хімічних реакцій. За допомогою кількісних методів протягом ХVIII-XIX ст. були встановлені основні поняття і закони хімії, що зумовило подальший розвиток хімії як точної природничої науки.
ХІМІЯ – це наука про склад, властивості та будову речовин, їх перетворення, а також про залежність властивостей речовин від складу і будови, взаємодію, добування та використання
1.1 1.1 Найважливіші поняття атомно-молекулярного вчення
Згідно з атомно-молекулярним вченням, головними об’єктами хімії є атоми, молекули, хімічні елементи, прості та складні речовини.
Атом – це найменша частинка елемента у хімічних сполуках (визначення Канніцаро, 1860 р.).
Атом – це найменша частинка речовини, яка ніколи не змінюється при хімічних реакціях.
Сучасне визначення атома враховує його будову.
Атом – це хімічно неподільна електронейтральна система, яка складається з позитивно зарядженого ядра і негативно зарядженої електронної оболонки.
Атом – реально існуючий матеріальний об’єкт з певною масою (від 1,67 ⋅ 10-27 до 4,42 ⋅ 10-25 кг), розміром (r=10-10м), складом, зарядом ядра, будовою електронної оболонки та іншими властивостями.
Кількісними характеристиками атома є заряд ядра і відносна атомна маса Аr. Ці величини вказуються у періодичній системі елементів. Заряд ядра атома дорівнює порядковому номеру елемента.
Атом – це система, що складається з протонів, нейтронів і електронів
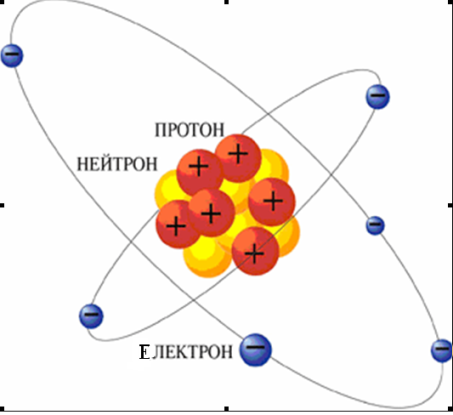
Рис. 1.1 – Схематичне зображення атома
Протони і нейтрони знаходяться в ядрі, радіус якого приблизно в 10000 разів менше (10-14 – 10-15м) за радіус атома. Електрони утворюють електронну оболонку, розмір якої зумовлює розмір атома.
Позитивний заряд ядра визначається кількістю протонів і дорівнює за абсолютною величиною негативному заряду електронної оболонки, який у свою чергу відповідає кількості електронів. Внаслідок цього атом електронейтральний. Атоми – хімічно неподільні частинки, що зберігаються під час хімічних реакцій (не виникають і не руйнуються). Але при цьому може змінюватися будова електронної оболонки, внаслідок чого утворюються йони або змінюється ступінь окиснення. Одночасно руйнуються одні комбінації атомів і утворюються інші, тобто має місце перегрупування атомів у нові речовини.
Оскільки маси молекул і атомів надзвичайно малі і оперувати їх абсолютними величинами при розрахунках дуже незручно, в хімії і фізиці впроваджена позасистемна одиниця вимірювання, яка називається атомною одиницею маси (а.о.м.) і дорівнює одній дванадцятій маси атома ізотопу Карбону – 12:
1 а.о.м. = 1/12 m (ат.12С) = 1:12 ⋅ 19,92⋅10-24 г = 1,66⋅10-24 г.
Відносна атомна маса Аr – це фізична величина, що дорівнює відношенню середньої маси атома елемента до однієї дванадцятої маси атома ізотопу Карбону-12.
![]()
Наприклад, відносні атомні маси елементів Гідрогену і Урану дорівнюють:
![]()
![]()
Молекула – це найменша частинка речовини, яка здатна самостійно існувати і має всі хімічні властивості речовини.
Молекули складаються з атомів – одного чи декількох; інколи до складу молекул входять сотні і навіть тисячи атомів (наприклад, високомолекулярні органічні сполуки сполуки природного походженння). Молекули однієї речовини однакові, а молекули різних речовин мають різний склад, різну будову і різні властивості. При фізичних явищах молекули зберігаються, а при хімічних перетвореннях – руйнуються, тобто розпадаються на атоми або групи атомів, які сполучаються в інші комбінації, утворюючи нові речовини.
Кількісною характеристикою молекули є відносна молекулярна маса Мr .
Відносна молекулярна маса Мr – це відношення середньої маси молекули речовини до 1/12 маси атома Карбону –12.
Відносна молекулярна маса Мr дорівнює сумі відносних атомних мас Аr елементів, що входять до складу молекули, з урахуванням кількості атомів кожного елемента.
Наприклад:
Mr (SO2) = Ar (S) + 2 Ar (O) = 32 + 2⋅ 16 = 64 а.о.м.⋅
Абсолютна маса молекули m визначається як добуток Мr на атомну одиницю маси:
m (молекули SO2 ) = Mr (SO2) ⋅ 1,66 ⋅10-24 = 64⋅ 1,66 ⋅10-24 г
Хімічний елемент – це вид атомів з однаковим зарядом ядра і певною сукупністю властивостей.
Останнім часом відповідно до Державного стандарту України (ДСТУ 2439-94) українські назви хімічних елементів вживаються як похідні від латинських назв. Вони записуються з великої літери на відміну від назв простих речовин і атомів.
Наприклад: Гідроген (Н), Карбон (С), Нітроген (N) – елементи; а для простих речовин чи окремих атомів вживаються старі назви: водень (Н2), вуглець (С), азот (N2).
Ідея хімічної символіки належить Берцеліусу (1814р.), який запропонував позначати елемент першою буквою його латинської назви.
Отже, носієм хімічних властивостей елемента є атом.
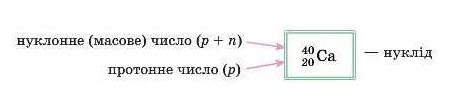
Нуклід — це різновид атомів, у яких до складу ядра входить чітко визначене число протонів і нейтронів.
Але у атомів одного елемента можуть бути різні маси внаслідок явища ізотопії – існування атомів одного елемента з різними Аr – ізотопів, наприклад: ізотопи елемента Гідрогену: протій H, дейтерій D, тритій T. Інколи всі ізотопи позначаються символом Н, але при цьому обов’язково вказують їх масові числа, як це показано на рис. 1.2
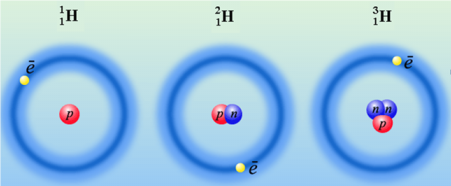
Рис. 1.2 – Протій, дейтерій, тритій
Для кожного елемента в періодичній системі вказується середня відносна атомна маса Аr, яка деякою мірою може вважатися кількісною характеристикою елемента, але не вичерпною, оскільки за величиною Аr неможливо визначити елемент завдяки явищу ізобарії – існуванню атомів різних елементів з однаковими атомними масами Аr, які називаються ізобарами, наприклад, ізотоп Калію-40 (порядковий номер 19) та ізотоп Кальцію-40 (порядковий номер 20) є ізобарами.
Кожний елемент має декілька ізотопів, тому в періодичній системі наводиться середня Аr з урахуванням поширеності ізотопів. Так, Хлор має два ізотопи, тому відносна атомна маса елемента Хлору з урахуванням процентного вмісту ізотопів дорівнює:
![]()
Класифікація хімічних елементів може проводитися за різними ознаками: за будовою атомів; за хімічними властивостями; за походженням; за поширенням у природі. Крім зазначених типів класифікацій, існують ще інші, спеціальні.
-
За ознакою будови
Ця залежність показує, які саме валентні енергетичні підрівні забудовуються в атомах елементів
s-елементи (H, He, Li, Be, Na, K, Rb, Cs, Mg, Ca, Sr та ін.);
p-елементи (O, N, P, C, Si, Cl, As, Pb, Br, S та ін.);
d-елементи (Zn, Ag, Cu, Fe, Cr, Mn, Ag, Au, Pt, Os та ін.);
f-елементи (U, Sm, Np, Cf та ін.).
2. За хімічними властивостями елементи поділяються на металічні, неметалічні та напівметали, а також на такі родини:
* лужні метали (Li, Na, K, Rb, Cs, Fr);
* лужноземельні (Са, Ва, Sr, Ra);
* лантаноїди (від 58Ce до 71Li);
* актиноїди (від 90Th до 103Lr);
* родина заліза (Fe, Co, Ni);
* платинові (Ru, Rh,Pd,Os, Ir, Pt);
* халькогени (S, Se, Te);
* галогени (F, Cl, Br, I);
* благородні (або інертні) гази (Не, Ne, Ar, Kr, Xe, Rn).
3. За походженням виділяють природні та штучні елементи.
* Природні – це елементи, що існують у природі в складі простих або складних сполук. До природних належать елементи від Гідрогену (1Н) до Плутонію (94Рu).
* Штучними є елементи, що утворюються під час перебігу ядерних реакцій.
4. За розповсюдженням у природі розглядають такі групи елементів:
Поширені – це, вісім елементів (О, Si, Al, Fe, Ca, Na, K, Mg), які займають 98,53 % земної кори, а також Н, С, Zn, Cu, Mn, Cl, N, P, S, Ba, Sr та Cr.
Рідкісні – це малопоширені у природі або маловивчені елементи (Li, Rb, La, U, Re).
Розсіяні – це елементи з незначним вмістом у земній корі, вони не мають власних родовищ, а зустрічаються як домішки до мінералів інших елементів (In, Gf, Te, Tl, Ga, Cs).
Незалежно від того, до якого типу чи групи належать елементи, всі вони характеризується своїм вмістом у природі
1.2 Прості та складні речовини. Алотропія
Оскільки речовина – це будь яка сукупність атомів чи молекул, то за складом усі сполуки можна поділити на прості і складні.
Простими називаються речовини, які складаються з атомів одного елемента.
Налічується більш 500 простих речовин, а елементів близько 110. Той факт, що кількість простих речовин переважає кількість хімічних елементів, пояснюється явищем алотропії.
Алотропія – це здатність одного елемента утворювати декілька простих речовин, які називаються алотропними модифікаціями, або алотропами.
Наприклад, елемент Оксиген (О) утворює два алотропи: кисень О2 і озон О3; елемент Фосфор (Р) – декілька алотропних модифікацій: чорний, білий, червоний і жовтий фосфор; елемент Карбон (С) – алмаз, графіт, карбін (...–С≡С-С≡С–…) і фулерен С60, молекула якого схожа на футбольний м’яч, тому ця модифікація іноді називається букиболом.
Складними називаються речовини, що містять атоми різних елементів.
Складні речовини можуть мати як молекулярну будову (Н2S, CH4, HCl, H2O), так і немолекулярну: йонну (NaCl, Na2O, NaOH) чи металічну (Fe3C – карбід заліза).
Склад речовин виржають за допомогою формул, в яких окремі атоми позначається хімічними символами елементів, а кількість атомів кожного виду – індексами, тобто цифрами, що записується унизу справа від хімічного символа, наприклад: запис N2O5 показує, що до складу молекули входять два атоми елемента Нітрогену і п’ять атомів елемента Оксигену.
1.3 Основні положенння атомно-молекулярного вчення
Формулювання основних положень атомно-молекулярної теорії у різних літературних джерелах дещо відрізняються, але сучасним уявленням у найбільшій мірі відповідають наступні тези.
-
Речовини мають дискретну природу. Це означає, що вони складаються з окремих частинок (структурних елементів речовини) – молекул, атомів, йонів.
-
Частинки речовин безперервно рухаються.
-
Між частинками речовини діють сили взаємного притягання і відштовхування.
-
Між складовими частинками речовини є відстані, розмір яких залежить від агрегатного стану.
-
Молекули складаються із атомів.
-
Молекули зберігаються при фізичних явищах і руйнуються при хімічних реакціях.
-
Атоми при хімічних процесах залишаються незмінними і неподільними, але піддаються перегрупуванню, внаслідок чого утворюються нові сполуки.
-
Різноманітність речовин у природі обумовлена різними сполученнями атомів; при цьому можуть виникати речовини з молекулярною або немолекулярною будовою.
1.4 Стехіометрична валентність
Стехіометрична валентність, або просто валентність – це здатність атомів елемента сполучатися з певною кількістю атомів іншого елемента.
Валентність є важливою кількісною характеристикою, яка показує, скільки хімічних зв’язків може утворювати атом елемента. Атоми деяких елементів здатні утворювати строго визначену кількість зв’язків – такі елементи мають постійну валентність, наприклад:
|
Одновалентні елементи |
H, Li, Na, K, Rb, Ag, Cs, F |
|
Двохвалентні елементи |
O, Ca, Ba, Mg, Sr, Zn, Cd, Hg |
|
Тривалентні елементи |
Al, B |
Атоми більшості елементів можуть утворювати різну кількість зв’язків, тому ці елементи мають змінну валентність. Валентність записують римськими цифрами над хімічними символами елементів:
|
|
|
|
1.4.1 Визначення валентностей та складання формул за валентностямями елементів
Для визначення валентності всіх елементів в складних сполуках існує певний алгоритм, який зручно розглядати на загальних і конкретних прикладах.
У загальному випадку для бінарної сполуки Аx Вy позначимо індекси буквами x i y, а валентності атомів – буквами m i n. Тоді розрахунок валентності одного з елементів виконується на підставі рівняння mx = ny, виходячи з відомої валентності іншого елемента.
|
m n Аx Вy |
Доречі, у конкретних сполуках валентність слід вказувати римськими цифрами над символами хімічних елементів.
Приклад 1.1. Визначити валентності Хрому в таких оксидах: CrO, Cr2O3, CrO3.
Визначення валентностей та складання формул по валентностям.
1. Визначити валентності всіх елементів в сполуках.
Для бінарної сполуки
|
m n Аx Вy |
де x i y – індекси, m i n – валентності - справедливе рівняння mx = ny
|
Приклад 1. Визначити валентності хрому в його оксидах: CrO, Cr2O3, CrO3.
Розв’язок.
- CrO - індекси(x i y) = 1; валентність Оксигену постійна =2, тоді: m× 1=2 × 1 отже m=2
|
ІІ ІІ Cr O |
-Cr2O3, - індекси x =2 i y = 3; валентність Оксигену постійна =2, тоді: m× 2=2 × 3 отже m=3
|
ІІІ ІІ Cr2 O3 |
CrO3, - індекси x =1 i y = 3; валентність Оксигену постійна =2, тоді:m× 1=2 × 3 отже m=6
|
VI II Cr O3 |
2. Скласти формулу сполуки по відомих валентностях.
Припустимо, що в сполуці АВ валентність елемента А =3 , а валентність В =2. Знайдемо найменше спільне кратне їх валентностей. Найменше спільне кратне між 2 і 3 = 6
|
ІІІ 6 ІІ А В |
Послідовно поділимо найменше спільне кратне 6 на відповідні валентності, а результат запишемо у вигляді індексів
|
ІІІ 6 ІІ А2 В3 |
Таким чином формула буде мати вигляд А2В3
Наступний тип задач – складання формули речовини, якщо вона містить три елемента з відомими валентностями, один з яких Оксиген: АxВyОz.
Припустимо, що в сполуці АВО валентність елемента А дорівнює ІІ, а валентність В – ІV.
Сумарна валентність всіх атомів Оксигену дорівнює сумарній валентності атомів інших двох елементів (ІІ∙z = ІІ∙х + ІV∙y)Для визначення шуканих індексів у сполуці вигляду Аx Вy Оz застосуємо правило:
Припускаємо, що індекси біля перших двох елементах однакові і дорівнюють 1. Тоді х = у = 1. Отже, сумарна валентність на першому елементі А буде (ІІ∙1=2), а на елементі В (ІV∙1=4) Їх сума ІІ∙1 + ІV∙1 =6.
Значить і сумарна валентність на Оксисені також має бути 6, тоді z =3
Формула такої сполуки має вигляд: АВО3
Приклад 1.3. Скласти формулу сполуки KxMnyOz , якщо валентність Мангану дорівнює VII.
Розв’язок. Валентності елементів К і О – постійні і дорівнюють відповідно: для Калію – І , для Oксигену – ІІ.
|
|
Тоді при мінімальних значеннях х і у (припустимо що вони дорівнюють 1) одержимо 1 + 7 = 2⋅ z ; 8 = 2⋅ z ; z = 4 . Формула : KMnO4
|
1.5 Фізичні одиниці в хімії
Кількість речовини ( ν або n) – це фізична величина, що визначається числом часток – структурних елементів речовини: молекул, атомів, йонів тощо.
Одиницею вимірювання кількості речовини є моль – одна з основних одиниць CI.
Моль – це кількість речовини, що містить стільки ж структурних елементів речовини (атомів, йонів, молекул), скільки атомів міститься в ізотопі Карбону-12 масою 12г.
Встановлено, що маса атома ізотопу Карбону-12 складає 19,92 ⋅ 10-24г. Тоді число атомів N в 12г дорівнює
![]()
Число, що дорівнює 6,02 ⋅ 1023 моль-1 називається сталою Авогадро (NA).
Наприклад: 1 моль Н2О містить 6,02 ⋅ 1023 молекул води, що складається з 2 моль (або 2 ⋅ 6,02 ⋅1023) атомів Н і 1 моль (або 6,02 ⋅ 1023) атомів О; 1 моль SO42– містить 6,02 ⋅ 1023 йонів SO42–, у тому числі 1 моль (6,02 ⋅ 1023) атомів S і 4 моль (4 ⋅ 6,02 ⋅ 1023) атомів О.
Кількість речовини пов’язана з числом часток N і сталою Авогадро NA залежністю:
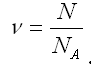
Отже, моль будь-яких структурних елементів – це така кількість речовини, що містить 6,02 ⋅ 1023 структурних часток цієї речовини.
Маса одного моль речовини є її молярною масою, вона позначається через М.
Молярна маса (М) – це фізична величина, що визначається відношенням маси речовини до кількості речовини, яка відповідає цій кількості:
![]() , тоді
, тоді ![]() .
.
Одиницею вимірювання молярної маси в системі СІ є кг/кмоль, але в хімії частіше користуються позасистемною величиною г/моль .
Молярна маса М пов’язана з відносною молекулярною масою Mr і сталою Авогадро NA залежністю
М = Мr ⋅ NA ⋅ 1 а.о.м.
Наприклад: відносна молекулярна маса Карбон (ІV) оксиду дорівнює Мr(CO2) = 12 + 2 ⋅ 16 = 44, а атомна одиниця маси складає 1 а.о.м. = 1,66 ⋅ 10-24г, тоді молярна маса буде:М(СО2) = 44 ⋅ 6,02 ⋅ 1023 ⋅ 1,66 ⋅ 10-24 = 44 г/моль.
Тобто молярна маса чисельно дорівнює відносній молекулярній масі, але має зовсім інший фізичний зміст: Мr характеризує масу однієї молекули, а М – масу одного моля, тобто 6,02 ⋅ 1023 молекул.
1.6 1.6. Практична частина
Розрахунки за хімічними формулами
Приклад 1.4. Розрахувати кількість речовини і число молекул в сульфатній (сірчаній) кислоті масою 49 г, а також масу однієї молекули Н2SO4.
Розв’язок: Відносна молекулярна і молярна маси Н2SO4дорівнюють:
Мr(H2SO4) = 2 ⋅ 1 + 32 ⋅ 4 ⋅ 16 = 98, М(H2SO4) = 98 г/моль.
Тоді кількість речовини і число молекул в сульфатній кислоті масою 49г становить:
![]()
N = ν ⋅ NA = 0,5 моль ⋅ 6,02 ⋅ 1023 молекул/моль = 3,01 ⋅ 1023 молекул.
Маса однієї молекули Н2SO4 визначається відношенням молярної маси, яка характеризує масу одного молю, до числа Авогадро, що вказує на кількість молекул в одному молі речовини:
N = М / NA = 98 / 6,02 ⋅ 1023 = 5,9 ⋅ 10-21г.
Приклад 1.5. В якій масі NH3 міститься стільки молекул, скільки їх в 10 г СаСО3.
Розв’язок:
Мr(СаСО3) = 40 + 12 + 16 ⋅ 3 = 100, М(СаСО3) = 100 г/моль; Мr(NH3) = 14 + 1 ⋅ 3 = 17, М(NH3) = 17 г/моль.
![]()
Згідно з умовою задачі ν(CaCO3) = ν(NH3). Отже, якщо ν(NH3)= 0,1 моль ,
тоді: m(NH3)= M(NH3)⋅⋅= 17г/моль ⋅ 0,1 моль = 1,7 г.