- Тема 7. Окисно-відновні реакції
Ключові терміни:
Вищий (максимальний) ступінь, Нижчий (мінімальний) ступінь, Окисно-відновні реакції, Ступінь окиснення, відновлення, окиснення, окисно-відновна двоїстість, проміжний ступінь окисненняТема 7. Окисно-відновні реакції
7.1 Ступінь окиснення. Загальні уявлення про окисно-відновні процеси
У природі та техніці більшість реакцій супроводжується зміщенням чи повним передаванням електронів від одних взаємодіючих частинок до інших. Ці процеси мають надзвичайно важливе значення і являють собою особливий вид хімічної взаємодії – окисно-відновні реакції.
Окисно-відновні реакції – це хімічні реакції, які відбуваються зі зміною ступенів окиснення у атомів одного чи декількох елементів.
Як приклад природних окисно-відновних реакцій можна навести процеси фотосинтезу, дихання та метаболізму, що відбуваються в живих організмах. У промисловості на основі окисно-відновних процесів базується безліч технологічних операцій, а саме: добування металів, виробництво кислот, лугів, солей та інших неорганічних і органічних сполук. Окисно-відновні реакції є невід’ємною складовою частиною електрохімічних процесів, що буде розглянуто окремо. Однак, крім позитивного, окисно-відновні реакції можуть інколи мати і негативне значення і бути причиною великих збитків. Наприклад, корозія металів, лісові пожежі, утворення шкідливих і токсичних речовин внаслідок згоряння палива при роботі ТЕЦ і двигунів внутрішнього згоряння, виробництві певних речовин.
Під час окисно-відновних реакцій змінюється валентний стан взаємодіючих атомів завдяки перерозподілу електронної густини при утворенні хімічних зв’язків. Внаслідок цього змінюються ступені окиснення атомів.
Ступінь окиснення – це умовний заряд атома в молекулі, який визначається, виходячи з припущення, що молекула складається з одноатомних іонів.
При цьому знак заряду гіпотетичного іона встановлюється з урахуванням полярності ковалентного зв’язку та зміщення спільних електронних пар у бік атома більш електронегативного елемента, який набуває від’ємного ступеня окиснення, а атом з меншою електронегативністю – додатного. Ступінь окиснення записується арабськими цифрами угорі над символом хімічного елемента з попереднім знаком « +» або «–»,наприклад,
![]()
Слід зазначити, що заряди іонів у сполуках на відміну від ступеня окиснення записуються арабськими цифрами із знаком «+» або «–» після цифри і розміщуються угорі праворуч від символів хімічних елементів, наприклад, Mg2+, Cl–, PO43–.
Визначаються ступені окиснення атомів у сполуках, виходячи з певних правил.
- Атоми елементів у простій сполуці мають ступінь окиснення, який дорівнює 0:

- Cтупінь окиснення оксигену у складних сполуках дорівнює –2, за винятком пероксидів (Н2О2–1, Na2O2–1), озонідів (КО3–1/3), надпероксидів (К2О4–1/2), оксиген фторидів (O+2F2, O2+1F2).
- Гідроген у складних сполуках має ступінь окиснення +1, крім гідридів активних металів:
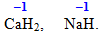
- Флуор, як найбільш електронегативний елемент, у складних сполуках завжди виявляє ступінь окиснення –1.
- Ступінь окиснення лужних металів у складних сполуках дорівнює +1, а лужноземельних – +2.
- У нейтральних молекулах та кристалах алгебраїчна сума ступенів окиснення всіх атомів дорівнює нулю (рис.7.1а), а у будь-якому іоні – заряду іона (рис.7.1б). Виходячи з цього, визначаються ступені окиснення атомів усіх елементів у молекулі або іоні. Наприклад, ступені окиснення атомів S і Cr в молекулі BaSO4 та іоні Cr2O72– можна обчислити за методом простих алгебраїчних рівнянь з одним невідомим:
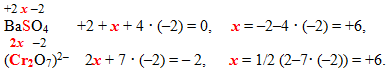
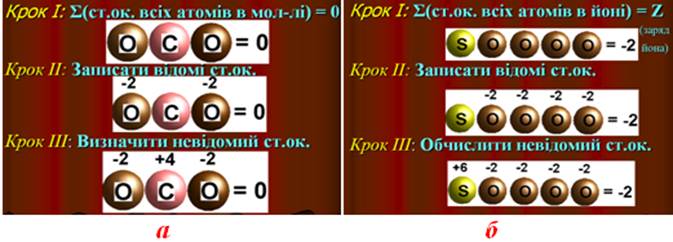
Рисунок 7.1 – Схема алгоритму визначення невідомого ступеню окиснення на прикладі молекули СО2 та іона SО42–
-
Вищий (максимальний) ступінь окиснення для більшості елементів, за невеликим винятком (елементи VІІІ групи, F, O, Br) , визначається за номером групи періодичної системи: max.ст.ок.= № групи. Наприклад, елементи N, Mn, Ge, Se, Cr і Ga розміщуються відповідно у VA-, VIIВ-, IVA-, VIA-, VIB- і IIIA-підгрупах, тому для кожного з них максимальний ступінь окиснення є таким:
Однак цьому правилу не підкоряється частина d-елементів (рис.9.2), а також такі р-елементи, над символами яких зазначений максимальний ступінь окиснення: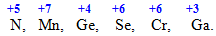
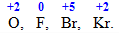
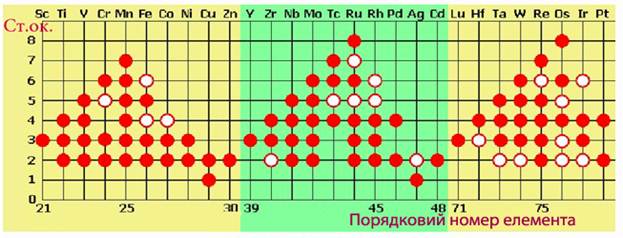
Рисунок 7.2 – Ступені окиснення d-елементів
-
Нижчий (мінімальний) ступінь окиснення для атомів елементів ІVА-VІІА-підгруп розраховується із співвідношення: min.ст.ок. = (№ групи – 8), наприклад, селен є елементом VІА-підгрупи, тому його нижчий ступінь окиснення: 6–8=–2. Для d-елементів нижчий ступінь окиснення дорівнює нулю. Приклади мінімальних ступенів окиснення деяких елементів:
Розглянемо особливості визначення ступеня окиснення на прикладі сполук NH3 i NO2. В амоніаку нітроген має негативний ступінь окиснення як більш електронегативний елемент порівняно з гідрогеном (значення електронегативностей цих елементів складають: [TEX]{\chi}_N=3,0[/TEX] і [TEX]{\chi}_H=2,1[/TEX]). У нітроген (ІV) оксиді більш електронегативним є оксиген [TEX]\left({\chi}_o=3,5, {\chi}_N=3,0\right)[/TEX], тому атом N набуває вже позитивного ступеня окиснення: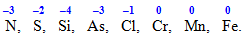
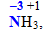
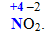
У цілому ступінь окиснення атомів у сполуках може бути позитивним, негативним, дорівнювати нулю, набувати цілочислових або дробових значень, наприклад:
Ступінь окиснення не слід ототожнювати з валентністю атомів навіть тоді, коли їх абсолютні значення випадково збігаються. Валентність визначається кількістю зв’язків, якими даний атом сполучається з іншими атомами, тому вона не може мати від’ємних значень або дорівнювати нулю. Наприклад, чотиривалентний атом карбону виявляє різні ступені окиснення у сполуках
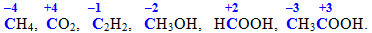
Ступінь окиснення також не має нічого спільного з дійсним, або ефективним зарядом атомів у сполуках. Наприклад, у сполуках Cr+3Cl3 і K2Cr+6О4 атоми хрому (+3) і хрому (+6) мають ефективні заряди відповідно +1,2 і 0,2.
Необхідно пам’ятати, що ступінь окиснення є поняттям умовним і певною мірою формальним, однак широко використовується при вивченні окисно-відновних властивостей речовин і при розрахунках коефіцієнтів у окисно-відновних реакціях.
В окисно-відновних реакціях змінювання ступенів окиснення зумовлене зміщенням електронів від атомів одного елемента до атомів іншого, але формально це зміщення може вважатися повним переходом електронів від атомів одного елемента до атомів іншого, наприклад:
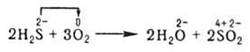 .
.
Розглянемо горіння металевого магнію за рівнянням
[TEX]2Mg+O_2\longrightarrow 2MgO,[/TEX]
яке супроводжується переходом двох електронів атома магнію до атома оксигену, внаслідок чого утворюються негативно заряджені іони оксигену, які набувають стабільної електронної конфігурації 2s22p6:
О0 + 2ē → O2–.
Атом магнію після віддавання двох 4s-електронів теж набуває стабільної електронної конфігурації (2s22p6), перетворюючись у позитивний іон:
Mg0 – 2ē → Mg2+.
Процес віддавання атомом електронів, що супроводжується підвищенням ступеня окиснення, називається окиснення , а процес приєднання електронів, при якому ступінь окиснення зменшується, – відновлення .
Атом, який приєднує електрони і зменшує свій ступень окиснення, називається окисник, а атом, що віддає електрони і підвищує свій ступінь окиснення, називається відновник.
Терміни «окисник» і «відновник» поширюються і на сполуки, що містять відповідно атоми-окисники і атоми-відновники.
Для розглянутої реакції горіння магнію речовиною-окисником є кисень, якій відновлюється внаслідок реакції, а речовиною-відновником – магній, який піддається окисненню:
Окисник: [TEX]O_2^0+4\bar{e}\longrightarrow 2O^{-2}[/TEX] – відновлення,
Відновник: [TEX]Mg^0-2\bar{e}\longrightarrow Mg^{+2}[/TEX] – окиснення.
Підвищення ступеню окиснення при віддаванні електронів і зниження ступеню окиснення при їх приєднанні зручно уявити, користуючись графічною шкалою (рис.7.3) і пам’ятаючи про негативний заряд самих електронів.
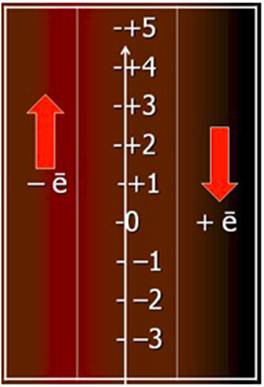
Рисунок 7.3 Підвищення та зниження ступеню окиснення
Терміни «окиснення» і «відновлення» зберігаються і в тому випадку, коли електрони лише зміщуються від якогось атома (процес окиснення) або до нього (процес відновлення). Обидва процеси є обов’язковими та взаємозалежними складовими однієї загальної реакції і відбуваються одночасно, тому неможливий перебіг відновлення без окиснення і навпаки (рис.7.4).
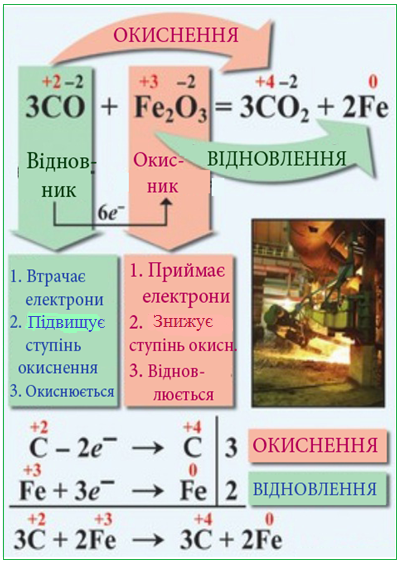
Рисунок 7.4 Взаємозалежність процесів окиснення та відновлення
7.2 Відновлювальна і окиснювальна здатність речовин
Окисно-відновні властивості речовин залежать від багатьох чинників: будови атомів і положення елементів у періодичній системі, а також від значення ступеня окиснення елементів, що входять до складу сполуки.
У малих періодах із зростанням порядкового номера елемента зменшується атомний радіус, а кількість валентних електронів на зовнішньому шарі збільшується, тому послаблюється здатність атома віддавати електрони і, навпаки, посилюється здатність приєднувати їх, тобто відновні властивості зменшуються, а окисні – зростають.
У головних підгрупах у міру збільшення заряду ядра зростає як кількість електронних шарів, так і радіус атома, зовнішні електрони розміщуються все далі від ядра і дужче екрануються внутрішніми електронними шарами. Через те полегшується віддавання електронів (отже, посилюється відновна активність) і ускладнюється їх приєднання (послаблюються окисні властивості атомів елементів).
7.2.1 Типові відновники
До типових відновників належать такі групи сполук.
-
Нейтральні атоми, на зовнішньому рівні яких міститься невелика кількість електронів (1-4): метали та деякі неметали (Н2, В, С, Si). У цій групі відновників особливо важливими є метали ІА-, ІІА-підгруп, Al, Zn, Fe, а також лантаноїди і актиноїди. Відновні властивості металів у реакціях, що протікають у водних розчинах, зменшуються від початку до кінця ряду напруг металів:

У хімічних реакціях неметали Е0 і метали Ме0 віддають електрони і окиснюються за схемою:
Е0 – nē → E+n.
Ме0 – nē → Ме+n.
-
Негативно заряджені іони неметалів En–, які здатні віддавати не тільки надлишкові електрони, але і власні електрони зі свого зовнішнього електронного шару. Наприклад, сульфід-іон може окиснюватися до вільної сірки і до більш високих ступенів окиснення:
При однаковому негативному заряді відновна властивість іонів зростає із збільшенням атомного радіуса. Так, серед галогенід-іонів відновні властивості посилюються в ряді: Cl–1, Br–1, I–1. Фторид-іон F–1 відновних властивостей взагалі не виявляє. До цієї ж групи відновників належать також гідриди лужних та лужноземельних металів (NaH, CaH2), що містять гідрид-іон Н–1, який легко окиснюється: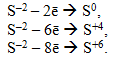
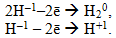
-
іони деяких металів у низьких ступенях окиснення, які здатні виявляти і більш високі ступені окиснення, наприклад:
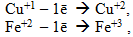
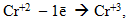
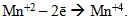
-
Cкладні іони або молекули, що містять атоми у проміжних ступенях окиснення, теж виявляють відновні властивості, наприклад:
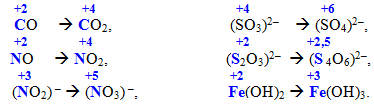
7.2.2 Типові окисники
До типових окисників належать такі групи сполук.
-
Нейтральні атоми і молекули неметалів. Найсильніші окисники серед простих речовин містяться у VІІА- і VІА-підгрупах (атоми цих елементів можуть приєднувати відповідно один або два електрони), а найслабкіші – атоми елементів ІVА-підгрупи, яким до набуття стабільної електронної конфігурації необхідно приєднати аж чотири електрони. У межах однієї підгрупи із зростанням порядкового номера окисні властивості зменшуються, тому найактивнішим окисником є фтор.
F20 + 2ē → 2F–1,
O20 + 4ē → 2O–2,
C0 + 4ē → C– ,
Cl20 + 2ē → 2Cl–1.
-
Позитивно заряджені іони металів, які здатні приєднувати електрони і відновлюватися. Окисні властивості іонів металів у реакціях, що перебігають у водних розчинах, зменшуються від кінця ряду напруг до його початку, тобто найсильнішим окисником серед позитивно заряджених іонів металів є катіони ауруму (+3):
Au+3 + 3ē → Au0,
Cu+2 + 2ē → Cu0.
Якщо металу притаманні змінні ступені окиснення, то його окиснювальна властивість тим сильніша, чим вищий ступінь окиснення виявляють атоми метала. Наприклад, Cu3+ є більш сильним окисником, ніж Cu2+. -
Позитивно заряджені іони гідрогену Н+, що містяться у розчинах неокиснювальних кислот (наприклад: H2SO4(розв), H3РO4, HCl, HBr, H2S, органічні кислоти), виявляють окисні властивості, тому можуть окиснювати метали, які стоять у ряді напруг до водню, а самі при цьому відновлюються:
2Н+1 + 2ē → H20.
-
Складні молекули чи іони, що містять атоми елементів у максимальному (або достатньо високому) ступені окиснення: концентровані H2SO4 i HNO3 та їх солі; сполуки, до складу яких входять іони ClО3–, MnО4–, MnО42–, CrО42–, Cr2O72– тощо. При цьому глибина і характер відновлення залежать від умов реакції: типу відновника, концентрації реагенту, середовища, природи розчинника, температури. Наприклад, концентрована сульфатна кислота може відновлюватися різним чином залежно від положення металу в ряді напруг: чим активніший метал і чим вища концентрація H2SO4, тим глибше її відновлення, яке відбувається за однією із схем:
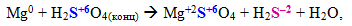
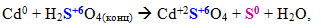
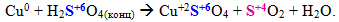
Розведена нітратна кислота теж може відновлюватися металами до різних продуктів, що містять атоми нітрогену в невисоких ступенях окиснення, наприклад: N+2O, N+12O, N02, N–3H3 (або N–3H4N+5O3, якщо HNO3 береться у надлишковій кількості). У цьому випадку спостерігається зворотна залежність: чим активніший метал і чим сильніше розведена кислота HNO3, тим глибше вона відновлюється.
Характер відновлення перманганат-іону залежить від середовища (рис.7.5): в кислому MnО4– відновлюється до Mn+2, у нейтральному – до Mn+4, у лужному – до Mn+6.
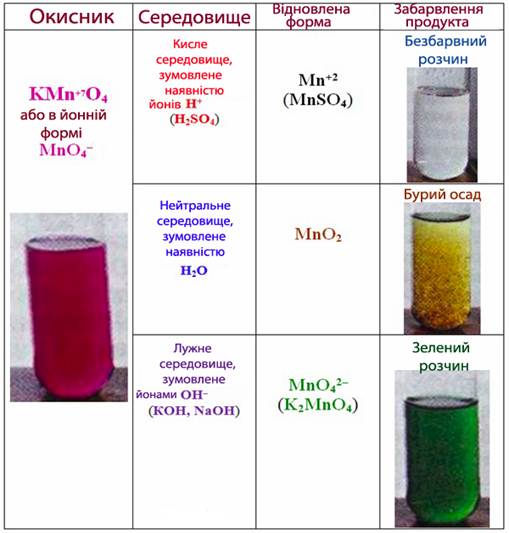
Рисунок 7.5 – Характер відновлення калій перманганату КMnО4 залежно від кислотності середовища у розчині
7.2.3 Окисно-відновна двоїстість
Ступінь окиснення атомів певного елемента у конкретній сполуці суттєво впливає на окисно-відновні властивості. При підвищенні ступеня окиснення збільшується окиснювальна здатність атомів елемента, а при зниженні – навпаки, посилюються відновлювальні властивості. Для прикладу розглянемо ряд нітрогеновмісних сполук:
![]()
Нітратна кислота HNO3, в якій нітроген (+5) виявляє максимальний ступінь окиснення, характеризується лише окисними властивостями і може тільки відновлюватися за однією із схем:
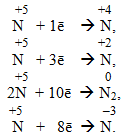
Амоніак NH3 містить атоми нітрогену (–3) у мінімальному ступені окиснення, тому він може бути лише відновником і здатний тільки окиснюватися, наприклад:
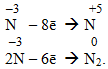
Сполуки, в яких N перебуває у проміжних ступенях окиснення (від +4 до –2), залежно від умов можуть виявляти як окисний, так і відновний характер, тобто окисно-відновну двоїстість:
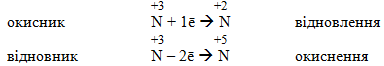
Деякі речовини, що містять атоми елементів у проміжному ступені окиснення, залежно від характеру сполуки, з якою вони взаємодіють, можуть виявляти відновні або окисні властивості. Наприклад, Н2О2 та інші пероксиди з більш сильними відновниками поводять себе як окисники і відновлюються внаслідок реакції:
![]()
а з більш сильними окисниками – як відновники, що окиснюються під час реакції:
![]()
Аналогічні властивості характерні і для багатьох інших сполук:
- нітритна (азотиста) кислота HNO2 та її солі нітрити, до складу яких входить нітрит-іон NO2–, наприклад:
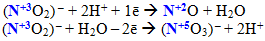
- сульфітна кислота H2SO3 та її солі сульфіти, що містять сульфіт-аніон SO32–:
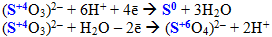
- вільні галогени хлор, бром, йод (крім фтору F2), наприклад, йод:
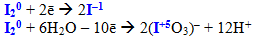
- фосфор:
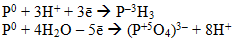
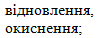
- сірка:
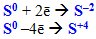
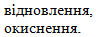
Підсумовуючи розглянуті відомості про окисники та відновники, можна зробити загальний висновок:
Атоми елементів, що мають вищий (максимальний) ступінь окиснення, можуть лише приймати електрони і тому в окисно-відновних реакціях виявляють виключно окиснювальні властивості.
Наприклад:
HN+5O3, HCl+7O4, H2S+6O4 KMn+7O4, K2Cr+62O7
Атоми елементів що мають нижчий (мінімальний) ступінь окиснення, можуть лише віддавати електрони і тому виявляють тільки відновлювальні властивості.
Наприклад:
Mg0, Al0, Fe0, N–3H3, H2S–2, HCl–1.
Атоми елементів, які мають проміжний ступінь окиснення, можуть як приєднувати електрони, так і віддавати їх, тому залежно від умов здатні виявляти як окиснювальні, так і відновлювальні властивості - окисно-відновна двоїстість.
Наприклад:
[TEX]{\stackrel{\color{navy}{+2}}{\color{navy}{N}O}, \color{navy}{\stackrel{0}{N_2}}, \stackrel{\color{navy}{+4}}{\color{navy}{N}O_2}, \stackrel{\color{navy}{+4}}{H_2\color{navy}{S}O_3}, \stackrel{\color{navy}{-1}}{H_2\color{navy}{O_2}}}.[/TEX]
7.3 Рівняння окисно-відновних реакцій
Будь-який окисно-відновний процес можна умовно поділити на дві напівреакції: окиснення і відновлення. Для складання рівнянь окисно-відновних реакцій необхідно оцінити окисно-відновні властивості реагентів і визначити речовину-окисник, до складу якої входять атоми елемента у максимальному (або близькому до нього) ступені окиснення, та речовину-відновник, що містить атоми елемента в низькому ступені окиснення. Далі виходячи з хімічного характеру кожного з цих елементів, слід спрогнозувати склад сполук, що утворюються внаслідок напівреакцій окиснення та відновлення, а також склад побічних продуктів, і розставити коефіцієнти.
При складанні окисно-відновних реакцій застосовують два методи: електронного балансу та іонно-електронний. Обидва методи ґрунтуються на умові: в окисно-відновних реакціях кількість електронів, що віддає відновник, повинна дорівнювати кількості електронів, яку приймає окисник.
7.3.1 Метод електронного балансу
Досить велику кількість окисно-відновних реакцій неможливо урівняти простим підбором коефіцієнтів, тому частіше звертаються до метода електронного балансу. Для прикладу запишемо схему взаємодії між алюмінієм і киснем:
Al + O2 → Al2O3.
Оскільки баланс – це рівність, необхідно зрівняти кількість електронів, що віддає відновник, з кількістю електронів, що приєднує окисник. Для цього спочатку визначають ступені окиснення елементів до і після реакції:
![]()
З порівняння ступенів окиснення видно, що атоми Al віддають електрони і набувають позитивного ступеня окиснення, а атоми О, навпаки, приєднують електрони і набувають негативного ступеня окиснення. Щоб одержати ступінь окиснення +3, атом алюмінію повинний віддати три електрони, а двом атомам оксигену для досягнення ступеня окиснення –2 необхідно прийняти чотири електрони, як показано на схемі:
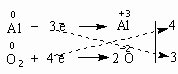
Щоб кількості прийнятих і відданих електронів зрівнялися, кожний член першої напівреакції необхідно помножити на 4, а другої – на 3, внаслідок чого кількість електронів в обох випадках стає рівною 12:
4Al0 – 12ē → 4Al+3
3О20 + 12ē → 6О–2
Отже, електронний баланс досягнуто і одночасно зрівнялися кількості атомів кожного елемента до і після реакції. Після цього одержані коефіцієнти переносять у рівняння реакції:
4Al + 3O2 = 2Al2O3.
Алгоритм методу електронного балансу розглянемо докладніше на іншому прикладі – взаємодії калій дихромату з концентрованою соляною (хлоридною) кислотою.
- Записують у молекулярній формі реагуючі речовини, вказуючи ступені окиснення всіх елементів:
К2+1Cr2+6O7–2 + H+1Cl–1 → …
- Визначають, яка сполука виступатиме у ролі окисника, а яка – відновника. У наведеному прикладі К2Cr2O7 містить хром (+6) у максимальному ступені окиснення, тому він може бути тільки окисником, який у кислому середовищі звичайно відновляється до Cr+3. А сполука HCl, в якій хлор (–1) виявляє мінімальний ступень окиснення, буде відновником. Найімовірніше, що хлор (–1) окиснюється до вільного хлору. Очевидно, що продуктами реакції будуть такі речовини:
К2Cr2+6O7 + H+1Cl–1 → Cr+3Cl3–1 + Cl20 + K+1Cl–1 + H2O.
- Зазначають елементи із змінними ступенями окиснення, вказуючи елемент-окисник і елемент-відновник. При цьому враховують кількість атомів кожного елемента, що міститься у сполуці. Оскільки К2Cr2O7 має два атоми хрому (+6), то згідно із законом збереження маси і утворюватися будуть два атоми хрому, але вже в іншому ступені окиснення, що обов’язково відображається коефіцієнтами. Подвоєння кількості атомів за допомогою індексів застосовується тільки у випадку простої речовини:
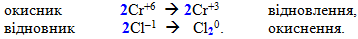
- Розраховують загальні кількості електронів, що приймають атоми окисника і віддають атоми відновника:
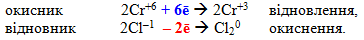
- Підбирають множники (основні коефіцієнти) для обох напівреакцій так, щоб після множення на них кількість електронів, які приймає окисник, дорівнювала кількості електронів, які віддає відновник. У схемі електронного балансу ці множники записуються за вертикальною рискою напроти відповідних напівреакцій:
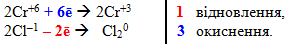
- Помножують кожний член обох напіреакцій на знайдені основні коефіцієнти. Після цього складають рівняння напівреакцій та скорочують кількість електронів:
2Cr+6+ 6e + 6Cl–1– 6ē → 2Cr+3 + 3Cl20,
2Cr+6 + 6Cl–1 → 2Cr+3 + 3Cl20.
- Переносять одержані коефіцієнти у схему окисно-відновної реакції:
K2Cr2O7 + 6HCl → 2CrCl3 + 3Cl2 + KCl + H2O.
- Визначають коефіцієнти для тих речовин, атоми яких не змінили своїх ступенів окиснення. Слід звернути увагу, що не всі атоми хлору хлоридної кислоти відновлюються до Cl2, частина їх витрачається на утворення солей CrCl3 i KCl, тому коефіцієнт перед HCl повинен ураховувати й ті атоми хлору, які не змінили ступеня окиснення:
K2Cr2O7 + 14HCl → 2CrCl3 + 2Cl3 + 2KCl + 7H2O.
7.4 Приклади розв’язання типових задач
Приклад 1. Визначити ступені окиснення елементів в сполуках: NH3, NO2, HNO3, Na3HP2O7.
Розв’язок. В амоніаку NH3 атоми гідрогену виявляють ступінь окиснення +1, отже, сумарний ступінь окиснення на всіх атомах гідрогену в сполуці дорівнює: +1.3=+3. Щоб молекула в цілому була електронейтральною, атом нітрогену повинний мати ступінь окиснення –3.
Маємо:
N–3H+13.
У нітроген (IV) оксиді NO2 ступінь окиснення оксигену дорівнює –2, тоді в сумі на двох атомах оксигену буде –2×2 = –4, а на нітрогені – такий же за абсолютною величиною, але протилежний за знаком ступінь окиснення, тобто +4.
Отже:
N+4O2-2.
В нітратній кислоті HNO3 ступені окиснення гідрогену і оксигену дорівнюють відповідно +1 і –2, а ступінь окиснення нітрогену позначимо через х: H+1NхO–23. Сумарний ступінь окиснення на трьох атомах оксигену дорівнює: –2×3= –6, тоді підрахуємо ступінь окиснення нітрогену: +1+x–6=0, звідки х=+5.
Одержали:
H+1N+5O–23.
У натрій гідрогендифосфаті Na3HP2O7 постійні ступені окиснення виявляють елементи Na (+1),H (+1), О (–2). У атомів Р повинний бути такий ступінь окиснення, який забезпечує електронейтральність всієї молекули. Складаємо просте алгебраїчне рівняння, позначивши через х ступінь окиснення атома Р: 3·(+1) + 1·(+1) + 2х + 7·(–2) = 0, звідки 2х = +10, х = +5.
Отже, маємо:
Na3+1H+1P2+5O7–2.
Приклад 2. Визначити ступені окиснення елементів у іонах: NH4+, NO3–, Р2О74–.
Розв’язок. При обчисленні невідомого ступеня окиснення в іоні необхідно виходити з правила: алгебраїчна сума ступенів окиснення всіх атомів у іоні дорівнює його заряду.
Тоді для NH4+ маємо:
х + 4×(+4) = +1, звідки х = –3.
Аналогічно знаходимо ступені окиснення в інших іонах. В NO3–: х + 3·(–2) = –1, звідки х = +5.
В Р2О74–: 2 х + 4·(–2) = –4, звідки 2х = +5, х = +5.
Таким чином одержали:
(N–3H4+1) +, (N+5O3–2)–, (Р2+5О7–2)4–.
Приклад 3. Який процес – окиснення чи відновлення – відбувається внаслідок перетворення I2 →IO65–?
Розв’язок. Для відповіді визначаємо ступені окиснення йоду в I2 та іоні IO65–. Вони дорівнюють відповідно 0 і +7. Видно, що атоми йоду підвищили ступень окиснення, отже, I2 окислився і втратив електрони. Зважаючи на кількість атомів у простій речовини, при складанні напівреакції необхідно подвоїти кількість електронів і кількість атомів йоду в продукті.
I20 – 14ē → 2I+7 (процес окиснення).
Приклад 4. Заповнити пропуски у напівреакціях: а) As+3 …ē → As–3; б) 2Br–1 – 2ē → ....
Розв’язок. а) У правій та лівій частинах електронного рівняння (As+3 …ē → As–3) кількість атомів арсену однакова, а ступінь окиснення знижується (від +3 до –3). Це відбувається у випадку приєднання електронів (процес відновлення). Кількість прийнятих електронів визначаємо з урахуванням ступенів окиснення атомів As до і після реакції: +3 + хē = –3, звідки хē = –6, а х = 6. Тоді задана схема має вигляд:
As+3 + 6ē → As–3 (процес відновлення).
б) В лівій частині схеми (2Br–1 – 2ē → ...) знаходяться два атоми брому, тому і в правій теж повинно бути стільки ж. Але втрата двох електронів двома атомами Br–1 (процес окиснення) свідчить про те, що тепер вони набули нульового ступеня окиснення, а це відповідає утворенню простої речовини Br20. Отже, схема напівреакції:
2Br–1 – 2ē → Br20 (процес окиснення).
Приклад 5. На основі обчислень ступенів окиснення телуру в сполуках MgTeO4, H2Te, TeO2 встановити, яка з наведених сполук може бути тільки окисником, яка– тільки відновником, а яка здатна до диспропорціонування. Відповідь підтвердити за допомогою електронних рівнянь.
Розв’язок. В зазначених сполуках телуру ступені окиснення інших елементів дорівнюють: Н+1, О–2, Mg+2 (оскільки магній є елементом ІІА-підгрупи і має постійний ступень окиснення). Тоді з урахуванням того, що сума ступенів окиснення атомів усіх елементів у нейтральній сполуці повинна дорівнювати нулю, ступені окиснення телуру будуть такими: MgTe+6O4, H2Te–2, Te+4O2. Телур знаходиться у головній підгрупи шостої групи періодичної системи, тому для нього мінімальним є ступінь окиснення –2, а максимальним – +6.
У максимальному ступені окиснення (Te+6) атоми елемента можуть бути тільки окисниками, тобто лише приєднувати електрони і відновлюватися за однією з таких схем:
Te+6 + 2ē → Te+4 (відновлення),
Te+6 + 6ē → Te0 (відновлення),
Te+6 + 8ē → Te–2 (відновлення).
У мінімальному ступені окиснення (Te–2), навпаки, атоми елемента можуть бути тільки відновниками – лише віддавати електрони і окиснюватися за однією з таких схем:
Te–2 – 2ē → Te0 (окиснення),
Te–2 – 6ē → Te+4 (окиснення),
Te–2 – 8ē → Te+6 (окиснення).
У проміжному ступені окиснення (Te+4) атоми елемента можуть бути залежно від умов як окисниками, так і відновниками, та можуть піддаватися реакції диспропорціонування, тобто одночасно окиснюватися
Te+4 – 2ē → Te+6 (окиснення)
і відновлюватися:
Te+4 + 4ē → Te0 (відновлення),
Te+4 + 6ē → Te–2 (відновлення).
Приклад 6. Які з наведених речовин: ![]() ,
, ![]() ,
, ![]() та чому можуть виявляти а) тільки окисні властивості; б) тільки відновні властивості; в) окисно-відновну двоїстість?
та чому можуть виявляти а) тільки окисні властивості; б) тільки відновні властивості; в) окисно-відновну двоїстість?
Розв’язок. а) Визначаємо ступені окиснення атомів елементів у сполуці:
![]() .
.
Елемент Mn перебуває у вищому ступені окиснення, який більше не може підвищуватися. Тому атоми Mn+7 не спроможні віддавати електрони, але здатні приєднувати їх, тобто речовина KMnO4 за рахунок Mn+7може виявляти тільки окисні властивості;
б) визначаємо ступені окиснення елементів в сполуці:
![]() .
.
Елемент Mn в сполуці MnO2 виявляє проміжний ступінь окиснення, тому він здатний як віддавати, так і приєднувати електрони. Отже, ця речовина за рахунок Mn+4може виявляти окисно-відновну двоїстість;
в) визначаємо ступені окиснення елементів у сполуці:
![]() .
.
Атоми елемента І знаходяться у нижчому ступені окиснення, тому не можуть знижувати його ще сильніше за рахунок приєднання електронів, але здатні підвищувати ступінь окиснення внаслідок віддавання електронів. Таким чином, речовина КІ за рахунок І–1може виявляти тільки відновні властивості.
Приклад 7. Розставити коефіцієнти і визначити тип окисно-відновної реакції, що проходить за схемою
HClO2 + HCl → Cl2 + H2O
Розв’язок. Спочатку визначимо ступені окиснення всіх елементів в сполуках:
![]()
Ступені окиснення змінили атоми одного елемента, що входили до складу різних речовин: Cl+3 (у сполуці HClO2) та Cl–1 (у сполуці HCl). Вони разом утворили один продукт – Cl02, тому запропонована реакція належить до типу міжмолекулярної конмутації.
Розставимо коефіцієнти вже відомим методом електронного балансу. Відновник (Cl–1), щоб набути нульового ступеня окиснення, віддає один електрон. Але оскільки внаслідок реакції утворюється проста сполука (Cl02), то кількість вихідних атомів і кількість електронів подвоюється: 2Cl–1–2ē→Cl02. Аналогічно необхідно провести подвоювання і в напівреакції відновлення (HCl+3O2) і додати не 3електрони, а 6, тобто: 2Cl+3+6 ē→Cl02.
Для знаходження множників у електронному балансі, які зрівнюють загальні кількості відданих (2) і приєднаних (6) електронів, визначаємо найменше спільне кратне: 6. Коефіцієнти дорівнюють частці від ділення найменшого спільного кратного на кількість електронів. Для відновника (HCl–1) маємо: 6/2 =3, для окисника (HCl+3O2): 6/6 = 1. Початкова схема електронного балансу матиме вигляд:

А сумарне рівняння після перемноження кожного члена на відповідні множники і складання напівреакцій виглядає так:
![]()
У правій частині продукт повторюється двічі (3Cl02 + Cl02), тому необхідно скласти його і скоротити електрони:
6Cl–1 + 2Cl+3 → 4Cl02.
Очевидно, що одержані коефіцієнти потребують скорочення на два:
3Cl–1 + 1Cl+3 → 2Cl02.
Виходячи з наведених викладок, можна прийти до висновку: якщо окисненню та відновленню піддаються атоми одного елемента, що входять до складу різних вихідних реагентів, але утворюють внаслідок реакції єдиний спільний продукт, то немає необхідності подвоювати кількість атомів в рівняннях електронного балансу. Тому правильнішим буде складання кожної напівреакції з розрахунку тільки на один атом:
![]()
Визначені таким шляхом коефіцієнти переносимо у рівняння окисно-відновної реакції. При цьому коефіцієнт 1 не ставиться, а решту коефіцієнтів (перед формулою H2O) знаходять методом підбору, аналізуючи кількості атомів Н і О до і після реакції:
HClO2 + 3HCl → 2Cl2 + 2H2O.
Приклад 8. Виходячи із ступенів окиснення атомів елементів у запропонованих схемах, визначити, до якого типу окисно-відновних реакцій належить кожна з них:
а) K3[Cr(OH)6] + K2O2 → K2CrO4 + KOH + H2O;
б) NH4NO3 → N2O + H2O;
в) Au(NO3)3 → Au + NO2 + O2;
г) H2S + SO2 → S + H2O;
д) H3PO3 → PH3 + H3PO4.
Розв’язок. Для встановлення належності окисно-відновної реакції до певного типу необхідно визначити ступені окиснення елементів і проаналізувати, до складу яких речовин входять атоми елементів, що змінили свої ступені окиснення. Для спрощення ходу розв’язування завдань далі будуть вказані ступені окиснення тільки для елементів-окисників і елементів-відновників.
а) Елемент-окисник (O–1) і елемент-відновник (Cr+3) входять до складу молекул різних сполук – K2O2 і K3[Cr(OH)6], тому тип реакції – міжмолекулярна ОВР:
![]()
![]()
б) Елемент-окисник (N+5) і елемент-відновник (N–3) мають різні ступені окиснення, але входять до складу однієї речовини (NH4NO3), тому реакція проходить за типом внутрішньомолекулярної конмутації:
![]()
![]()
в) Елементи-окисники (Au+3 і N+5) і елемент-відновник (O–2) входять до складу однієї сполуки (Au(NO3)3), але належать до різних елементів, тому тип реакції – внутрішньомолекулярна ОВР:
![]()
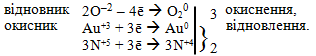
г) Атоми окисника (S+4) і атоми відновника (S–2) входять до складу різних сполук, але належать одному елементу – сульфуру, тому реакция протікає за типом міжмолекулярної конмутації:
![]()
![]()
д) Атоми окисника (P+3) і атоми відновника (P+3) не тільки входять до складу однієї сполуки (H3PO3) і належать до одного елемента – фосфору, але й виявляють однаковий ступінь окиснення (+3), тому тип цієї ОВР – диспропорціонування:
![]()
![]()



