Ключові терміни:
Змішані солі, Кислі солі, Комплексні солі, Основні солі, Подвійні солі,, Середні солі, Солі
СОЛІ
Солі – це сполуки, які можна розглядати як продукт повного чи часткового заміщення атомів Гідрогену в кислоті на метал (чи групу NH4+) або як продукт заміщення гідроксильних групп в основі на кислотний залишок.
Солі здебільшого належать до йонних сполук, за виключенням деяких галогенідів (наприклад, HgCl2, Hg2Cl2). Зв’язок між атомами металу і кислотним залишком йонний, а між атомами елементів, що входять до складу кислотного залишку, – ковалентний полярний. У вузлах кристалічної решітки солей знаходяться не молекули, а йони.
З погляду теорії електролітичної дисоціації солі – це електроліти, які у водному розчині дисоціюють, утворюючи катіони металу (або амоній-катіони NH4+) і аніони кислотних залишків. Наприклад: КСІ → К+ + СІ–.
11.1 Класифікація та номенклатура солей
Залежно від особливостей складу і хімічних властивостей солі найчастіше поділяються на такі найважливіші типи: середні, кислі та основні (рис. 11.1). Але крім названих, існують ще й інші різновиди солей: подвійні, змішані, гідратні, комплексні та оксосолі.
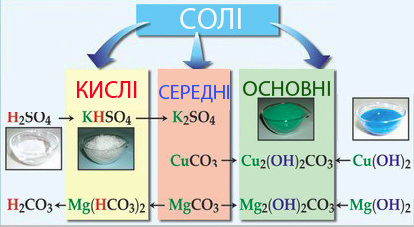
Рисунок 11.1 – Спрощена класифікація солей
– Середні солі – це продукт повного заміщення йонів Гідрогену в кислоті катіонами металу чи амоній-катіоном NH4+, наприклад: КСl, Na2SO4, (NH4)3PO4. Назви середніх солей складаються з назви металу у називному відмінку і назви кислотного залишку (табл. 11.1). Якщо метал виявляє різні ступені окиснення, то після його назви вказується ступінь окиснення арабською цифрою з позначкою «+» або валентність римською цифрою, наприклад, сіль складу FeCl3 можна назвати Ферум(+3) хлорид, або Ферум (ІІІ) хлорид. Для кислотних залишків безоксигенових кислот вживаються суфікси -ид.
– Кислі солі – це продукти неповного заміщення йонів Гідрогену в багатоосновній кислоті на катіони металів. Інакше кажучи, до складу кислих солей входять атоми Гідрогену – один чи декілька, наприклад: Са(НСО3)2, NaHSO4. Кислі солі дисоціюють ступінчасто: спочатку відщеплюють йони металу, а потім йони Гідрогену:
КНСО3 →K+ + HCO3–,
HCO3– →H+ + CO32–.
Назви кислих солей складаються з назви середньої солі, до якої додають префікс гідроген-: КНСО3 – Калій гідрогенкарбонат (табл. 11.1).
Таблиця 11.1 – Номенклатура кислотних залишків
|
Кислотний залишок |
Назва |
Кислотний залишок |
Назва |
|
F– |
Фторид |
NO3– |
Нітрат |
|
Cl– |
Хлорид |
NO2– |
Нітрит |
|
Br– |
Бромід |
PO43– |
Ортофосфат |
|
I– |
Йодид |
HPO42– |
Гідрогенортофосфат |
|
CN– |
Ціанід |
H2PO4– |
Дигідрогенортофосфат |
|
S2– |
Сульфід |
PO3– |
Метафосфат |
|
HS– |
Гідргенсульфід |
MnO4– |
Перманганат |
|
SO32– |
Сульфіт |
SiO32– |
Силікат |
|
HSO3– |
Гідрогенсульфіт |
CO32– |
Карбонат |
|
SO42– |
Сульфат |
HCO3– |
Гідрогенкарбонат |
|
HSO4– |
Гідрогенсульфат |
Сr2O72– |
Дихромат |
– Основні солі – це продукти неповного заміщення гідроксид-йонів у багатокислотних основах кислотними залишками; основні солі містять одну чи декілька гідроксильних груп ОН–, наприклад: Mg(OH)Cl, (CuOH)2CO3. Однокислотні основи основних солей не утворюють. Основні солі теж дисоціюють ступінчасто, при цьому спочатку відщеплюються кислотні залишки, а далі – гідроксид-йони:
Mg(OH)Cl → Mg(OH)+ + Cl–.
Mg(OH)+ → Mg2+ + ОН–.
Назви основних солей складаються з назви середньої солі і префікса гідроксо-, який ставиться перед назвою металу: Са(ОН)СІ – Гідроксокальцій хлорид.
– Подвійні солі, в яких атоми двох різних металів сполучені з аніонами однієї кислоти, наприклад: Магній-Кальцій карбонат, склад якого можна виразити формулою CaMg(CO3)2, або CaCO3.MgCO3; Калій-Алюміній сульфат складу KАl(SO4)2. Розчинні подвійні солі дисоціюють відразу на всі складові частини:
KAl(SO4)2 → К+ + Аl3+ + 2 SO42–.
– Змішані солі, до складу яких входять два різних кислотних залишка, сполученних з катіоном одного металу, наприклад: сіль Кальцій хлорид-гіпохлорит CaOCl2, (або Ca(ClO)Cl), в якій катіон Кальцію одначасно зв’язаний з двома кислотними залишками – хлоридної та гіпохлоритної кислот – HCl і HСlO відповідно. При дисоціації вони дають один катіон металу і два аніони кислотних залишків:
CaOCl2 →Ca2+ + Cl–+ ClO–.
– Гідратні солі, в кристалічній решітці яких міститься певна кількість молекул води, наприклад: Купрум сульфат пентагідрат CuSO4 .5H2O, Натрій сульфат декагідрат Na2SO4 .10H2O. При розчиненні таких солей у воді кристалізаційна вода вимивається з кристалічної решітки і приєднується до розчинника.
– Комплексні солі – це сполуки, які містять складні (комплексні) йони, здатні до самостійного існування у розчинах чи розплавах, наприклад наприклад: Калій тетрагідроксоалюмінат К[AI(OH)4], Калій гексаціаноферат (+2) K3[Fe(CN)6], Калій гексаціаноферат (+3) K4[Fe(CN)6]. У розчинах чи розплавах вони розщеплюються на комплексний йон та протийон:
К[Al(OH)4] → К+ + [Al(OH)4] –,
K4[Fe(CN)6] → 4K++ [Fe(CN)6]4–,
K3[Fe(CN)6] → 3K+ + [Fe(CN)6] 3–.
– Оксосолі – це різновид солей, до складу яких входить оксокатіон, що містить атом металу в максимальному чи досить високому ступені окиснення, сполученого з одним чи двома атомами Оксигену. Оскількі програмою не передбачено вивчення цього типу солей, ми не будемо розглядати їх докладно, тільки наведемо декілька прикладів: оксотітан (+4) сульфат TiOSO4, диоксованадій (+5) сульфат (VO2)2SO4, оксованадій (+5) нітрат VO(NO3)3, диоксохром (+6) хлорид CrO2Cl2.
Необхідно взяти до уваги, що багато солей мають тривіальні назви (табл. 11.2), які корисно знати.
Таблиця 11.2 – Тривіальні назви солей
|
Формула солі |
Тривіальна назва |
Формула солі |
Тривіальна назва |
|
CaSO4 .0,5H2O |
Алебастр |
(CuOH)2CO3 |
Малахіт |
|
KAl(SO4)2 .12H2O |
Алюмокалієвий галун |
CuSO4 .5H2O |
Мідний купорос |
|
NH4NO3 |
Амонійна селітра |
NaNO3 |
Натронна (чилійська) селітра |
|
Ba(NO3)2 |
Баритова селітра |
NH4Cl |
Нашатир |
|
CaOCl2 |
Белільне вапно |
SnCl4 |
Олов’яна олія |
|
KClO3 |
Бертолетова сіль |
NaНCO3 |
Питна сода |
|
Na2B4O7 .10H2O |
Бура |
CaF2 |
Плавиковий шпат |
|
CaSO4 .2H2O |
Гіпс |
NaCl |
Поварена сіль |
|
MgSO4 .7H2O |
Гірка сіль |
К2СО3 |
Поташ |
|
Na2SO4 .10H2O |
Глауберова сіль |
Pb(CH3COO)2 |
Свинцевий цукор |
|
MgCO3. CaCO3 |
Доломит |
(PbOH)2CO3 |
Свинцеві білила |
|
K4[Fe(CN)6] |
Жовта кров’яна сіль |
KCl . NaCl |
Сильвініт |
|
FeSO4 .7H2O |
Залізний купорос |
HgCl2 |
Сулема |
|
КNO3 |
Калійна (індійська) селітра |
Cu(H2PO4)2 .H2O |
Суперфосфат подвійний |
|
Hg2Cl2 |
Каломель |
SnCl2 |
Сусальне золото |
|
Na2CO3 |
Каустична сода |
KCr(SO4)2 .12H2O |
Хромокалієвий галун |
|
HgS |
Кіновар |
K2Cr2O7 |
Хромпик |
|
Na2CO3 .10H2O |
Кристалічна сода |
K3[Fe(CN)6] |
Червона кров’яна сіль |
|
AgNO3 |
Ляпіс |
|
|
11.2 Хімічні властивості солей
Хімічні властивості солей зумовлюються як катіоном, так і аніоном, які входять до складу кожної окремой солі. Основні хімічні властивості солей наводяться у табл. 11.2
Таблиця 11.2 – Хімічні властивості солей
|
Взаємодія з металлами Для визначення можливості взаємодії солі з тим чи іншим металом доречно ще раз згадати ряд напруг металів: Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb 2H Cu Hg Ag Pt Au <— Зростання активності металу Зменшення активності металу → |
|
|
Солі вступають у реакцію тільки з більш активними металлами, що стоять у ряді напруг ліворуч від того металу, що входить до складу солі. Слід пам’ятати, що дуже активні метали (Na, K, Ba) теж не взаємодіють з розчином солі малоактивного металу, оскільки майже миттєво починається їх реакція з водою. Однак у випадку розплавів активні метали витісняють менш активні з розплавів їх солей |
CuSO4 + Fe → Cu + FeSO4, однак Cu + FeSO4 → реакція не проходить. Na(тв.) + SnSO4(розплав) →t Na2SO4 + Sn, 2Na+ 2H2O+ [SnSO4(тв.)]→2NaOH+ H2+ [SnSO4(тв.)] |
|
Відношення до нагрівання |
|
|
Більшість солей виявляє стійкість до високих температур. Однак солі амонію, а також солі малоактивних металів, слабких кислот чи кислот, в яких елементи перебувають у високому чи низькому ступені окиснення, при нагріванні розкладаються. Так, карбонати лужних, активних і малоактивних металів поводять себе при нагріванні згідно з прикладами 1–3, кислі і основні карбонати – відповідно до рівнянь 4 і 5, амонійні солі – за прикладами 6–10, нітрати амонію та металів різної активності – за схемами 10–13, сульфати – 14–16, при цьому одна й та сама сіль може розкладатися по-різному залежно від температури (приклади з FeSO4). Цікаво також порівняти розкладання KClO3 (приклади 17 і 18), яке залежно від умов проходить з утворенням різних продуктів |
1) Na2CO3(твердий) →t Na2CO3(розплав), 2) MgCO3 →t MgO + CO2, 3) 2Ag2CO3 →t 4Ag + 2CO2 +O2, 4) 2NaHCO3 →t Na2CO3 + H2O, 5) (CuOH)2CO3 →t 2CuO + CO2 + H2O; 6) NH4Cl →t NH3 + HCl, 7) (NH4)3PO4 →t 3NH3 + H3PO4, 8) NH4NO2 →t N2 + 2H2O, 9) (NH4)2Cr2O7 →t Cr3O3 + N2 + 4H2O, 10) NH4NO3 →t N2O + 2H2O, 11) 2KNO3 →t 2KNO2 + O2, 12) 2Cu(NO3)2 →t 2CuO + 4NO2 + O2, 13) 2AgNO3 →t 2Ag + 2NO2 + O2; 14) 2BaSO4 →t 2BaO + 2SO2 + O2, 15) 2FeSO4 →t Fe2O3 + SO2 + SO3, 16) 4FeSO4 →t 2Fe2O3 + 4SO2 + O2; 17) 2KClO3(katMnO2) →t 2KCl + 3O2, 18) 4KClO3 →t KCl + 3KClO4; 19) 2KMnO4 →t K2MnO4 + MnO2 + O2 |
|
Відношення до води Всі розчинні і малорозчинні солі, за винятком тих, що утворені сильною кислотою і сильною основою, вступають в обмінну взаємодію з водою – реакцію гідролізу. |
|
|
Солі, утворені сильною основою і слабкою кислотою (І тип гідролізу), при взаємодії з водою дають лужну реакцію середовища (pH < 7) |
СН3СООNa + H2O ⇔ CH3COOH + NaOH, СН3СОО– + Na++ H2O ⇔ CH3COOH + Na+ + OH–, СН3СОО– + H2O ⇔ CH3COOH + OH– |
|
Солі, утворені слабкою основою і сильною кислотою (ІІ тип гідролізу), при взаємодії з водою дають кислу реакцію середовища (pH > 7) |
NH4Сl+ H2O ⇔ NH4OH + HCl, NH4+ + Сl– + H2O ⇔ NH4OH + H+ + Cl–, NH4+ + H2O ⇔ NH4OH + H+ |
|
Солі, утворені слабкою основою і слабкою кислотою (ІІІ тип гідролізу), при взаємодії з водою дають нейтральну реакцію середовища (pH = 7) |
СН3СООNH4 + H2O ⇔ CH3COOH + NH4OH, СН3СОО– + NH4+ + H2O ⇔ CH3COOH + NH4OH, CH3COO– + NH4+ + H2O ⇔ CH3COOH + NH4OH |
|
Реакція з кислотами |
|
|
Взаємодія відбувається, якщо внаслідок реакції утворюється слабкий електроліт – газ, осад, малодисоційована сполука. |
Na2S + 2HCl→2NaCl + H2S↑, K2SiO3 + 2HNO3→2KNO3 + H2SiO3↓, KNO2 + HCl → KCl + HNO2 |
|
Реакція з лугами |
|
|
Взаємодія відбувається, якщо внаслідок реакції утворюється слабкий електроліт – осад, газ, малодисоційована сполука. Корисно знати, що при дії лугів на розчинні солі, що містять катіон Ag+ чи Hg2+, утворюється нова сіль і випадає осад нерозчинного оксиду. |
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl, NH4Cl + NaOH → NaCl + NH4OH, однак при нагріванні утворюється газ: NH4Cl + NaOH →t NaCl + NH3↑ + H2O, 2AgNO3 + 2KOH → 2KNO3 + Ag2O↓ + H2O, HgNO3 + 2KOH → 2KNO3 + HgO↓ + H2O |
|
Реакція з солями |
|
|
Взаємодія відбувається, якщо внаслідок реакції утворюється осад чи (рідше) малодисоційована сполука (приклад з утворенням Fe(CNS)3) |
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓, Fe(NO3)3 + KCNS → 3KNO3 + Fe(CNS)3 |
|
Якісні реакції – це такі реакції, при яких за допомогою так званого якісного реагенту можна однозначно довести, що до складу дослідженої солі входить певний аніон чи певний катіон. При цьому слід пам’ятати про взаємність дії якісних реагентів: якщо, приміром, на солі Барію якісним реагентом є сульфат-аніон SO42–, то справедлива й обернена залежність, тобто на солі сульфатної кислоти якісними реагентами будуть розчинні сполуки, що містять катіон Ва2+. |
|
|
Якісним реагентом на катіони Fe2+ є жовта кров’яна сіль K3[Fe(CN)6], при цьому утворюється синій осад берлінської лазурі Fe3[Fe(CN)6]2 |
3FeCl2 + 2K3[Fe(CN)6] →6KCl + Fe3[Fe(CN)6]2↓, 3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓ |
|
Якісним реагентом на катіони Fe3+ є червона кров’яна сіль K4[Fe(CN)6] або розчинна сполука, що містить роданід-аніон CNS–. У першому випадку утворюється синій осад турнбулєвої сині Fe4[Fe(CN)6]3, а у другому – малодисоційована сіль Ферум (ІІІ) роданід Fe(CNS)3 |
4FeCl3 + 3K4[Fe(CN)6] →12KCl + Fe4[Fe(CN)6]3↓, 4Fe3+ + 3[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓; FeCl3 + 3KCNS → 3KCl + Fe(CNS)3, Fe3+ + CNS– → Fe(CNS)3 |
|
Якісними реагентами на катіони Ba2+ є сульфат-аніон (SO42–) або хромат-аніон (CrO42–), при взаємодії з якими утворюються осади: білий BaSO4 і яскраво-жовтий BaCrO4 |
Ba(NO3)2 + Na2SO4 → 2NaNO3 + BaSO4↓, Ba2+ + SO42– → BaSO4↓; BaCl2 + K2CrO4 → 2KCl + BaCrO4↓, Ba2+ + CrO42– → BaCrO4↓ |
|
Якісним реагентом на катіони Ag+ є розчинні сполуки, що містять аніони хлоридної та йодидної кислот (Cl– і I– відповідно), які утворюють з осади білого (AgCl) і жовтого (AgI) кольору |
AgNO3 + NaCl → NaNO3 + AgCl↓, Ag+ + Cl– → AgCl↓; CH3COOAg + KI → CH3COONa + AgI↓, Ag+ + I– → AgI↓ |
|
Якісним реагентом на катіони Pb2+ є хромат-аніон (CrO42–), при взаємодії з яким утворюється блідо-жовтий осад BaCrO4 |
Pb(NO3)2 + K2CrO4 → 2KNO3 + PbCrO4↓, Pb2+ + CrO42– →BaCrO4↓ |
|
Відновні властивості виявлять солі, в яких атоми будь-якого елементу, що входять до складу аніона чи катіона, знаходяться у мінімальних чи достаньо низьких ступенях окиснення |
|
|
До сильних відновників за рахунок катіона належать солі з катіонами Fe2+, Cr2+, Mn2+і амоній-катіон NH4+ |
|
|
За рахунок кислотного залишка відновні властивості виявляють солі, що містять аніони гідрогенгалогенідних кислот (Cl–, Br–, I–, крім F–), сульфід (S2–), сульфіт (SO32–), нітрит (NO2–) тощо. У наведених прикладах вказані ступені окиснення відновників і окисників, щоб наочніше продемонструвати характер їх змінювання |
2NaBr–1 + Mn+4O2 + 2H2SO4 →Br20 + Mn+2SO4 + Na2SO4 +2H2O, Na2S–2 + H2O2–1 →S0 + 2NaO–2H, 2Na2S+4O3+ O2 → 2Na2S+6O4–2, 2KN+3O2 + Br02 + H2O → 2KN+5O3 + 2HBr–1 |
|
Окисні властивості виявлять солі, в яких атоми будь-якого елементу, що входять до складу аніона чи катіона, знаходяться у максимальних чи достаньо високих ступенях окиснення |
|
|
За рахунок катіона окисні властивості виявляють солі малоактивних металів (Au+3, Hg+2, Cu+2, Ag+1) (Cr+3, Fe+3) |
|
|
За рахунок аніона окисні властивості виявляють солі окиснювальних оксигеновмісних кислот (SO42–, NO3–, MnO4– , CrO42–, Cr2O72–) |
CaS+6O4 + 3CaS–2 → 4CaO + 4S0, KN+5O3 + C+2O →KN+3O2 + C+4O2, 2KMn+7O4+ 16HCl–1→ 2Mn+2Cl2+ 5Cl02+ 2KCl + +8H2O, K2Cr+62O7+ 14HBr–1 → 2Cr+3Br3+ 3Br02+ 2KBr + +7H2O |
11.3 Одержання і застосування солей
Практично солі можна одержати, виходячи з будь-якого класу неорганічних сполук. Більшість способів добування солей вже розглянуті при попередьому вивченні представників інших класів сполук – оксидів, основ і кислот. У табл. 11.3 дані приклади реакцій, внаслідок яких утворюються солі.
Таблиця 11.3 – Способи одержання солей
|
Реакція нейтралізації |
|
|
Такі реакції проходять у тому випадку, якщо хоч би одна з вихідних сполук є сильним електролітом або, якнайменше, добре розчинною речовиною |
KOH + HNO3 → KNO3 + H2O, Cu(OH)2 + 2CH3COOH → (CH3COO)2Cu + 2H2O, однак: Cu(OH)2 + H2SiO3→реакція не проходить |
|
Взаємодія кислот з основними і амфотерними оксидами |
|
|
Як правило, для цього способу беруть сильну кислоту або, щонайменше, оксид активного металлу, оскільки між слабкою кислотою і оксидом малоактивного металлу взаємодія майже ніколи не відбувається |
H2SO4 + CuO → CuSO4 + H2O, 3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O, однак: H2СO3 + PbO → реакція не проходить |
|
Взаємодія кислот із солями |
|
|
Взаємодія відбувається, якщо внаслідок реакції утворюється осад чи (рідше) малодисоційована сполука |
H2S + CuCl2 → CuS↓ + 2HCl, HCl + CH3COONa → NaCl + CH3COOH, H2SO4 + 2NaCl(крист.) →t Na2SO4 + 2HCl |
|
Взаємодія двох різних солей |
|
|
Взаємодія відбувається, якщо внаслідок реакції утворюється осад чи (рідше) малодисоційована сполука |
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl, Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4↓ |
|
Взаємодія лугів з кислотними і амфотерними оксидами |
|
|
Реакція між лугами і кислотними чи амфотерними оксидами проходить у розчині або при сплавленні вихідних речовин за високих температур. При цьому з кислотними оксидами луги утворюють середні солі, з амфотерним у розчині – комплексні, а при сплавленні – теж середні солі |
Ca(OH)2 + CO2 → CaCO3↓ + H2O, 2NaOH + 2NO2→ NaNO3 + NaNO2 + H2O, 2КОН + Al2O3 + 3Н2О → 2K[Al(OH)4], 2КОН + Al2O3 →t 2KAlO2 + H2O, 2NaОН + ZnO + 2Н2О →Na2[Zn(OH)4], 2NaОН + ZnO →t Na2ZnO2 + H2O |
|
Взаємодія лугів з солями |
|
|
Взаємодія відбувається, якщо внаслідок реакції утворюється осад чи (рідше) малодисоційована сполука |
3KOH + FeCl3 → 3KCl + Fe(OH)3 ↓, NH4Cl + KOH→ KCl + NH4OH, Ba(OH)2 + Na2CO2 → BaCO3↓ + 2NaOH |
|
Взаємодія солетворних оксидів між собою |
|
|
Солі утворюються внаслідок реакції (за звичайних умов чи при сплавленні) основних і кислотних оксиів, або амфотерних – з кислотними чи основними оксидами |
Na2O + SO3 → Na2SO4, CaO + SiO2 →t CaSiO3, P2O5 + Al2O3 →t 2AlPO4, Na2O + Al2O3 →t 2NaAlO2 |
|
Взаємодія металів з неметалами |
|
|
У такий спосіб можна одержати солі безоксигенових кислот. Слід пам’ятати, що метали зі змінними ступенями окиснення окиснюються галогенами до більш високих ступенів (приклад з Fe і Cl2) |
2K + Cl2 → 2KCl, 2Fe + 3Cl2 → 2FeCl3, Fe + S →t FeS |
|
Взаємодія металів з кислотами |
|
|
Одержання солей внаслідок реакції металів з кислотами розглядалося при вивченні теми 16.3 |
Fe + 2HCl → FeCl2 + H2↑, Cu + 8HNO3(розв.) → 3Cu(NO3)2 + 2NO↑ + 4H2O, Zn + 4H2SO4(конц.) → 3ZnSO4 + S↓ + 4H2O, 3Ag + 4HNO3(розв.) → 3AgNO3 + NO↑ + 2H2O, 4Mg + 5H2SO4(конц.) → 4MgSO4 + H2S↑ + 4H2O |
|
Взаємодія металів із солями |
|
|
Солі вступають у реакцію тільки з більш активними металлами, що стоять у ряді напруг ліворуч від того металу, що входить до складу солі |
Fe + CuSO4→ FeSO4 + Cu, однак FeSO4 + Cu → реакція не проходить |
|
Взаємодія амоніаку з кислотами |
|
|
Амонійні солі утворюються при взаємодії амоніаку з неокиснювальними кислотами |
NH3 + HCl → NH4Cl, 2NH3 + H2SO4(розв.) → (NH4)2SO4, 3NH3 + H3РO4 → (NH4)3РO4 |
|
Взаємодія лугів з простими речовинами |
|
|
З амфотерними металами луги при сплавленні дають середні солі, а внаслідок реакції у розчинах – комплексні |
2NaOH(тв.) + Zn →t Na2ZnO2 + H2↑, 2NaOH + Zn + 2Н2О→Na2[Zn(OH)4] + H2↑, 2NaOH + 2Al+ 6Н2О→2Na[Al(OH)4] + 3H2↑ |
|
Солі утворюються при взаємодії лугів з такими неметалами: кремнієм, фосфором, сіркою, галогенами Cl2 і Br2, рідше – з I2 (згідно зі схемами, показаними на прикладі Cl2), а взаємодія з фтором проходить за іншим механізмом порівняно з рештою галогенів |
2KOH + Si + H2O →t K2SiO3 + 2H2↑, 3NaOH + 3P →3NaH2PO2 + PH3↑, 6KOH + 3S →t K2SO3 + 2K2S + 3H2O, 2NaOH + Cl2 → NaCl + NaClO + H2O, 6NaOH + 3Cl2 →t NaCl + NaClO3 + 3H2O, однак: 4NaOH + 2F2 4NaF + O2 + 2H2O |
Солі широко застосовуються в різних галузях техніки і народного господарства. Наприклад, Натрій хлорид NaCI є сировиною для одержання хлору, хлоридної кислоти, Натрій гідроксиду, соди та інших речовин. Сода Na2СО3 – один із головних продуктів основної хімічної промисловості. Вона використовується у виробництві скла, мила, фарб. Кальцієві та амонійні солі фосфатної кислоти відомі як фосфорні добрива, а нітратні солі амонію та Калію – як азотні.



