- 14.1 Галогени. Хлор, та його сполуки
- 14.2 Оксиген та його сполуки
- 14.3 Сульфур та його сполуки
- 14.4 Нітроген та його сполуки
- 14.5 Карбон та його сполуки
- 14.6 Силіцій та його сполуки
- 14.7 Гідроген. Водень і вода
- 14.8 Вода.
Ключові терміни:
Амоніак, Галогени, Гідроген, Карбон, Кварц, Нітроген, Оксиген, Оксиди Сульфуру, Силікатна кислота, Сульфатна, або сірчана кислота, Сульфур, Сірка, Сірководень, Фосфор, вода, вуглекислий газ, кремнезем, озон, ортофосфатна (фосфорна) кислота, розчинне або рідке скл14.1 Галогени. Хлор, та його сполуки
Галогени - елементи, що складають головну підгрупу VII групи – це Флюор, Хлор, Бром, Йод, Астат (отриманий штучно в невеликих кількостях). Назва «галогени» в перекладі – солетворні. Галогени – це р – елементи, що мають 7 електронів на зовнішньому шарі. Загальна характеристика елементів – галогенів представлена в таблиці.
Таблиця. Загальна характеристика елементів 7 групи головної підгрупи.

На основі будови атомів елементів – галогенів можемо оцінити їх окисні та відновні властивості, реакційну здатність, особливості хімічного зв’язку в молекулі та ін..
1. Окисні властивості галогенів зменшуються від Флюору до Астату. Це пов’язано із збільшенням радіусу атома. Отже Як відомо, в межах головних підгруп із збільшенням заряду ядра атома збільшується радіус атома і як наслідок зменшується притягання валентних електронів до ядра. Це приводить до збільшення металевих властивостей, і до зменшення окисних. Флюор – є найсильнішим окисником серед неметалів. Цей елемент не здатний виявляти позитивний ступінь окиснення. Інші галогени в сполуках виявляють позитивні ступені окиснення +1, +3, +5, +7.
2. Реакційна здатність галогенів зменшується в ряду F→Cl→Br→I. Енергія зв’язку в молекулах має одне аномальне значення: У Флюору енергія зв’язку в молекулі нижче ніж у Хлору чи Брому. Таку аномалію можна пояснити відсутністю в атомі Флюору d – орбіталі, за рахунок якої у інших галогенів можливе утворення додаткових донорно-акцепторних взаємодій, що підвищує міцність зв’язку.
3. Перебування в природі. В природі галогени зустрічаються у вигляді сполук
Флюор: СаF2 - флюорит, плавіковий шпат; Na3[АІF6] – кріоліт; 3 Са3(РО4) 2 · СаF2 – фтор апатит
Хлор:NаСІ - кам’яна сіль, кухонна сіль; КСІ – Сильвин; КСІ · NаСІ – сильвініт;
Бром :КВr · МВr2 · 6 Н2О – бромкарналіт; КСІ · КВr – бромсильвініт.
Йод: міститься в нафтових і деяких мінеральних водах. Самостійних мінералів практично не утворює.
4. Методи одержання.
1. Електролізом розплавів або розчинів концентрованих розчинів галогенідів (одержання фтору, хлору, брому).
Розглянемо процес електролізу розплаву KCl
Іони, що утворюються в розплаві електроліту внаслідок електролітичної дисоціації під впливом електричного струму рухаються до електродів:
Катіони – до катоду (-) Аніони –до аноду (+ )
KCl ⇔ K+ + Cl-
Катод Анод
K+ + 1e → K0 2Cl- - 2e → Cl20
2. Заміщення хлором із солей, що містяться в морській воді, бурових водах, морських водоростях ( для брому і йоду).
2 КВr + СІ2 = 2 КСІ + Вr2 ↓
2 NаJ + СІ2 = 2 NаСІ + J2 ↓
Лабораторні методи.
3. Окислення концентрованої соляної кислоти різними окисниками (одержання хлору).
4 НСІ + МnО2 = СІ2 ↑ + МnСІ2 + 2 Н2О
16 НСІ + 2 КMnО4 = 5 СІ2 ↑ + 2 МnСІ2 + 2 КСІ + 8 Н2О
Фізичні властивості.
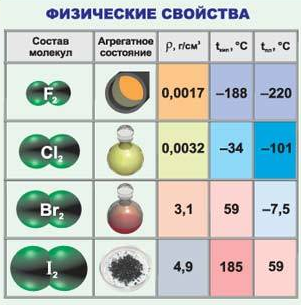
Всі галогени у вільному стані утворюють двоатомні молекули. Міцність зв’язку в молекулах галогенів зменшується від F2 до J2 .
Фтор – безбарвний газ з різким запахом, не розчиняється у воді, тому що з нею реагує. Хлор – газ жовто-зеленого кольору, досить легко зріджується. Розчинність хлору у воді середня, причому частина розчиненого хлору реагує з водою. Бром – важка темно-бура рідина з різким запахом, легко випаровується, при попаданні на шкіру викликає важкі опіки. Розчинність брому у воді середня. Йод – кристалічна речовина майже чорного кольору, мало розчинний у воді, але добре розчиняється в органічних розчинниках, наприклад, спирті. Йод легко переходить в
пароподібний стан з твердого стану, пари йоду мають фіолетове забарвлення.
|
|
|
В ряду F→Cl→Br→I
а) зростає радіус атома; б) зменшується електронегативність;
в) зменшуються неметалеві властивості; г) зменшуються окисні властивості.
Хлор- Сl2- використовується для одержання соляної кислоти, брому, хлорного вапна, хлоратів, для хлорування води, відбілювання тканин та ін.
Хімічні властивості галогенів.
1. Реакції з простими речовинами:
- з металами (утворюються солі): 3Cl2 + 2Fe→ 2FeCl3;
- з воднем (утворюються галогеноводні): Cl2 + H2→ 2HCl. Галогеноводні HF, HCl, HBr, HJ – це безбарвні гази, досить легко зріджуються, легко розчиняються у воді з утворенням галогеноводневих кислот. Сила цих кислот збільшується в ряду: НF< НСІ < НВr < НJ
- з неметалами 3Cl2+ 2P 2PCl3
З киснем, азотом, інертними газами хлор не реагує.
2. Реакції з складними сполуками:
- реакція з водою (J2 з водою не реагує): в реакції з водою хлор утворює хлорну воду - H2O + Cl2→ HCl + HClO; Флюор розкладає воду: 2 F2 + 2 Н2О = 4 НF + О2
- з лугами: 2NaOH + Cl2→ NaCl + NaClO + Н2О(на холоді)
6NaOH + 3Cl2→5NaCl + NaClO3 + 3Н2О(при нагріві);
- реакція заміщення галогенів в їх солях: 2NaBr+ Cl2 → 2NaCl + Br2
Сполука хлору з воднем – хлороводень (HCl) – безбарвний газ, добре розчинний у воді. Розчин хлороводню у воді – хлоридна (соляна) кислота (хлороводнева кислота). HCl- сильна кислота, її солі – хлориди, майже всі розчинні у воді (крім: хлоридів срібла, свинцю). Нерозчинність галогенидів срібла дозволяє використовувати катіони Ag+ як якісний реагент на іони галогенів. AgCl (білий осад), AgBr (жовтий осад), AgJ (темно-жовтий осад), Хлоридна кислота легко реагує з металами, що стоять в ряду напруг до водню, але не реагує з металами, що стоять після водню:
2HCl+ Zn→ZnCl2 + H2 ; HCl+ Сu →реакція не відбувається
Крім соляної кислоти, відомі кисневі кислоти хлору:
|
Приклади кисневих кислот хлору |
Характеристика властивостей |
|
HClO – хлорнуватиста кислота (солі гіпохлорити) HClO2 – хлориста кислота (солі хлорити) HClO3 – хлорнувата кислота (солі хлорати) HClO4 – хлорна кислота (солі перхлорати) |
В ряду: HClO HClO2 HClO3 HClO4 а) збільшуються кислотні властивості; б) зменшуються окисні властивості. |
Застосування галогенів.
Фтор застосовують для одержання цінних органічних фтор похідних термічно стійких мастил, Хімічно стійких пластмас (тефлон), хладоагентів (фреони).
Хлор використовується для виробництва органічних і неорганічних хлорпохідних. Для відбілювання, для обеззаражування води, в металургії. Широко використовуються хлорорганічні розчинники, пластмаси, штучна шкіра, отрутохімікати.
Бром знаходить застосування у виробництві барвників і медикаментів. Бромід аргентума АgВr у великих кількостях використовується у виробництві фотоплівки, фотопаперу. Дуже велике фізіологічне значення сполук Брому в нормальній життєдіяльності організмів людини і тварин. До їх додаткового введення особливо чуттєва центральна нервова система: броміди використовують в медицині як заспокійливі засоби. Надлишок накопичення сполук Брому призводить до появи шкіряних висипів.
Йод накопичується в щитовидній залозі, входить до складу білка треоглобуліна, що стимулює процеси асиміляції. Нестача Йоду в їжі і воді викликає базедову хворобу. Із звичайних продуктів споживання найбільш багаті Йодом цибуля і морська риба. Йод входить до складу ряду ліків. Спиртовий розчин йоду використовується як дезинфікуючий засіб в медицині.
14.2 Оксиген та його сполуки
Оксиген – елемент з порядковим номером 8 , знаходиться в головній підгрупі 6 групи (ІІ період).
Оксиген є найпоширенішим елементом земної кори. В атмосфері його перебуває близько 23 %, у складі води — близько 89 %, у людському організмі — близько 65 %, у піску - 53 %, у глині — 56 % і т.і. Якщо підрахувати його кількість у повітрі (атмосфері), воді (гідросфері) і доступній частини твердої земної кори (літосфері), то виявиться, що на частку Оксигену доводиться приблизно 50 % їхньої загальної маси. Вільний кисень міститься майже винятково в атмосфері, причому кількість його оцінюється в 1,2•1015 т.
|
|
|
Оксиген було відкрито в 1777 р. Шееле при розкладанні нітрату натрію і незалежно від нього в 1774 р. Прістлі при розкладі оксиду меркурію (ІІ) Назву цьому елементу надав Лавуазьє.
Вільний кисень складається із двохатомних молекул. Під звичайним тиском він зріджується при -1830С и твердіє при -219 0С. У газоподібному стані кисень безбарвний, а в рідкому і твердому має блідо-синє забарвлення.
.
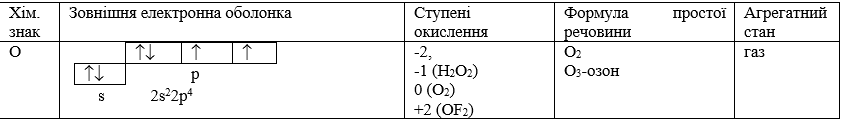
Таблиця. Характеристика елемента Оксигену.
14.2.1 Озон.
В 1840 році була отримана газоподібна речовина, що складається з молекул О3 і сильно відрізняється по властивостях від звичайного кисню (О2). Новий газ, що мав характерний запах, назвали озоном (по-грецькі - “пахучий”).
Подібно звичайному кисню, озон являє собою просту речовину. Він є алотропна модифікація Оксигену.
В газоподібному стані озон має голубий колір, в рідкому – темно-синій, в твердому – майже чорний. Навіть в малих дозах озон дуже токсичний. Температура кипіння -1120 С. У всіх агрегатних станах озон здатний вибухати від удару. Розчинність його у воді набагато більше, ніж кисню.
Перебування в природі.
В природі Оксиген зустрічається у вигляді простих і складних сполук.
Прості – кисень та озон. Кисень міститься майже винятково в атмосфері. Озон знаходиться на відстані 22 км від земної поверхні утворюючи озоновий шар Землі, який поглинає шкідливе для усього живого радіаційне випромінювання Сонця.
Складні речовини у великій кількості містять елемент Оксиген. Він входить до складу оксидів, кислот, солей основ, органічних і неорганічних речовин.
4. Методи одержання кисню.
1. Фракційна перегонка зрідженого повітря.
Основним джерелом промислового одержання кисню є рідке повітря. При цьому азот, температура кипіння якого нижча в порівнянні з киснем, випаровується раніше, ніж кисень. Такий кисень містить сліди азоту і аргон, але для більшості технічних цілей ці домішки не заважають. Для одержання особливо чистого кисню використовують іноді розкладанням води електричним струмом
2. Електроліз води, водних розчинів кислот і солей.
Електроліз Н2О→½ О2↑+ Н2↑
(-) Катод Анод (+)
2 Н2О + 2ē = Н2 ↑ + 2ОН¯ 2 Н2О – 2ē = ½ О2 ↑ + 2Н+
3. Лабораторні методи одержання кисню
2KMnO4→ K2MnO4 + MnO2 + O2
2KClO3→ 2KCl + 3O2 розкладання при нагріванні
2KNO3→ 2KNO2 +O2
2H2O2→ 2H2O + O2 (в присутності MnO2)
4. Одержання озону.
Одержують озон найчастіше дією на газоподібний кисень тихого розряду (електричного розряду без світіння й іскор). Застосовуваний для цього прилад — озонатор. Вихідний з озонатора кисень містить кілька відсотків озону. Його утворення супроводжується зменшенням об'єму, тому що по реакції:
3 О2 ⇔ 2 О3
із трьох об'ємів кисню виходить два об'єми озону.
4. Хімічні властивості.
На зовнішньому енергетичному рівні атому Оксигену знаходиться 6 електронів. До завершення стійкої електронної оболонки з 8 електронів атому Оксигену недостає 2 електронів. Тому Оксиген, приймаючи ці 2 електрони, виявляє окислювальну здатність і ступінь окислення –2. В звичайних сполуках Оксиген виявляє ступінь окислення –2. В пероксидах (пероксид водню - H2O2)ступінь окислення Оксигену становить –1. В сполуках зі фтором (OF2) Оксиген виявляє ступень окислення +2. Ступінь окислення Оксигену в кисні становить (O2)0. Таким чином, для Оксигену характерні ступені окислення: -2 , -1 , 0 , +1 , +2.
Однією з найбільш характерних особливостей кисню є його здатність з’єднуватись з більшістю елементів з виділенням тепла і світла (згоряння). Для виникнення цього процесу часто потрібно нагрівання до певної температури (температури запалення), тому що за звичайної температури кисень є досить інертною речовиною. Але в присутності вологі відбувається повільне окислення (повільне згоряння) вже за звичайних умов. Наприклад, процес дихання живих організмів, корозія металів, процеси гниття і розкладу.
Кисень безпосередньо реагує з всіма елементами (виключення – інертні гази, галогени, платинові метали).
1. Реакція з простими речовинами:
Загальний вигляд: Проста речовина (метал або неметал) + О2→ оксиди (в більшості при нагріванні)
В реакціях з лужними металами кисень утворює пероксиди:2Na + O2 → Na2O2 (пероксид натрію);
В реакціях з іншими металами кисень утворює оксиди Ca + O2→CaO (оксид кальцію);
З неметалами при нагріванні: S + O2→ SO2 (оксид Сульфуру IV)
2. Реакція з оксидами: 2SO2 + O2→ 2SO3 ; 2NO +O2→2NO2
3. Реакція з водневими сполуками відбувається по різному залежно від умов:
2H2S +3O2→2 SO2 + 2H2O (надлишок кисню);
2H2S + O2→ 2S +2H2O (недостача кисню)
4. Хімічні властивості озону.
Порівняно з киснем озон більш активний, завдяки протіканню процесу розпаду молекули з утворенням атомарного Оксигену: О3→О2 + О.
Озон є сильним окисником. Навіть на холоді він реагує з тими речовинами, які не окислюються молекулярним киснем
2К+1J-1 + О30 + Н2О = J20+ О20+ 2К+1О-2Н+1
|
|
Схема |
електрони |
коефіцієнти |
|
|
відновник |
2J-1 - 2 ē J02 |
2 |
1 |
процес окиснення |
|
окисник |
О30 + 2 ē → О20 + О-2 |
2 |
1 |
процес відновлення |
Біологічне значення кисню і озону та їх застосування.
Кисень.
Кисень використовується в суміші з воднем і ацетиленом для різки і автогенної зварки металів, при плавленні тугоплавких металів. В доменних і мартенівських печах використовується повітря, збагачене киснем – до 85% .
Рідкий кисень використовується для виготовлення вибухових речовин, для створення низьких температур, в дихальних апаратах.
Теплокровні тварини гинуть без кисню на протязі декількох хвилин. Аеробні мікроорганізми менш чутливі до нестачі кисню. І тільки анаеробні мікроорганізми, наприклад, дрижи, існують при відсутності кисню.
У вищих тварин кисень спочатку попадає в кров, де з гемоглобіном крові утворює легко дисоціюючу сполуку – оксигемоглобін. Далі оксигемоглобін проходить крізь капілярні судини органів тіла, дисоціює на гемоглобін і кисень, а останній через стінки судин попадає в тканини. Частина кисню затримується в тканях. Здорова людина в спокійному стані використовує близько 20 л кисню за годину і приблизно 1/5 частина його затримується в організмі. За добу потреба людини в кисні становить близько 500 л.
В тканях органів кисень приймає участь в процесах повільного окислення, внаслідок яких руйнуються непотрібні речовини в клітинах, виділяється тепло і інші форми життєвої енергії.
В природі відбувається постійна регенерація кисню за рахунок процесів асиміляції в рослинах, тобто відбувається кругообіг Оксигену в природі.
Озон.
Поглинання озоном ультрафіолетового випромінювання Сонця має велике біологічне значення. Якщо б ці «жорстокі» промені вільно досягали земної поверхні, вони б швидко знищили все живе на планеті.
Озон вбиває мікроорганізми, тому хлорування води при її очищенні все частіше заміняють озонуванням, тим більше, що така вода не має неприємного смаку хлору. Озон використовується також для очищення повітря і в препаративній хімії.
14.3 Сульфур та його сполуки
Сульфур – елемент з порядковим номером 16 , знаходиться в головній підгрупі 6 групи (ІІІ період).
Елемент цей був відомий ще древнім єгиптянам. У теоретичних поданнях алхіміків Сульфур відігравав значну роль, тому що вважався найбільш досконалим виразником одного з “основних початків” природи - горючості.
По вмісту в земній корі (0,03 %) цей елемент відноситься до досить розповсюджених елементів. Форми знаходження Сульфуру в природі різноманітні. Порівняно рідко зустрічаються його самородні родовища, основна ж маса Сульфуру пов'язана з металами в складі різних мінералів, які можуть бути поділені на дві великі групи: сульфідів і сульфатів. Із сульфідів особливе значення для технології має пірит FeS2. Із сульфатів найпоширенішим є гіпс CaSO4·2H2O. Сполуки Сульфуру звичайно присутні у вулканічних газах і воді деяких мінеральних джерел. Сульфур входить також до складу білкових речовин і тому міститься в організмах тварин і рослин.
|
|
|
|
Сірка – проста речовина, яку утворює елемент Сульфур.
Сірка – тверда кристалічна речовина жовтого кольору без запаху і смаку. Має дуже низьку тепло- і електропровідність. Не розчиняється у воді, але добре розчиняється в органічних розчинниках, наприклад, сірковуглеці.
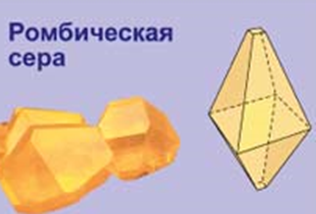
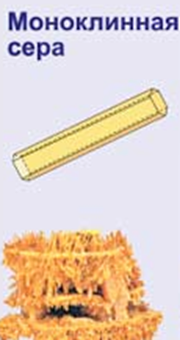
Сульфур утворює декілька алотропних модифікацій. Найбільш стійкою є природна сірка – ромбічна, температура плавлення її становить 112,8°С. При нагріванні вище 110°С і наступному охолодженні ромбічна сірка переходить в моноклінну з температурою плавлення 119,3°С. При температурі вище 160°С утворюється гумоподібна чорно-коричнева пластична сірка, якій можна надавати будь-яку форму і витягувати в нитки. Ця алотропна модифікація також нестійка.
|
|
|
|
|
В пароподібному стані Сульфур утворює молекули S8, S6 , S4 , S2 . При збільшенні температури зменшується кількість атомів Сульфуру в молекулі і при 2000С відбувається дисоціація молекул сірки на окремі атоми.
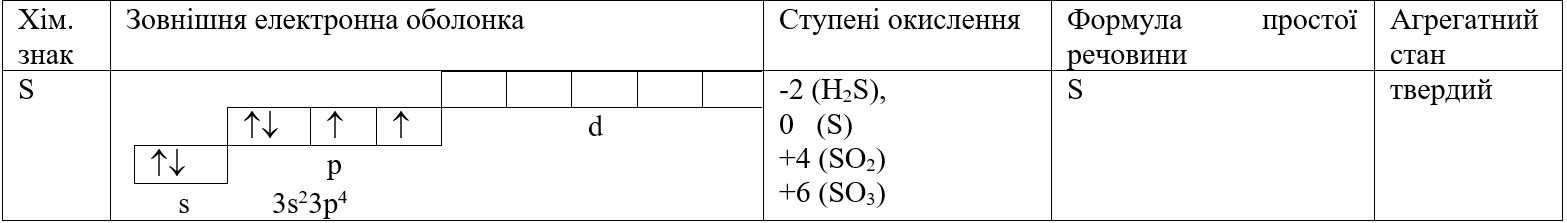
Таблиця. Характеристика елемента Сульфура.
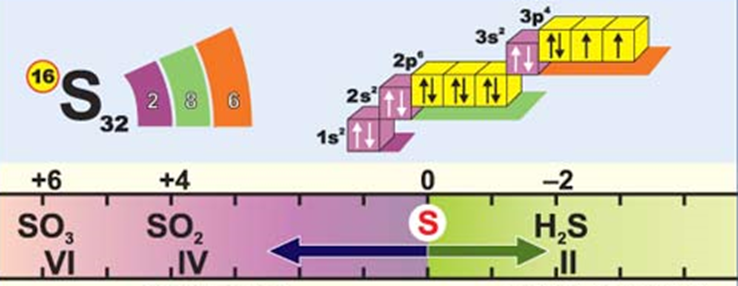
Хімічні властивості.
В хімічному відношенні Сульфур є активним елементом.
1. Взаємодія з неметалами При нагріванні сірка безпосередньо реагує з воднем, киснем, галогенами, вуглецем і фосфором. Не взаємодіє сірка з азотом і йодом.
Н2 + S → Н2S
2 S + С → СS2
3 S+ 2 Р → Р2S3
S + О2 → SО2
2. Взаємодія з металами.
При звичайній температурі сірка взаємодіє зі ртуттю, міддю і сріблом з утворенням сульфідів:
Сu + S → СuS
При нагріванні сірка взаємодіє з усіма іншими металами, крім золота, платини, іридію.
Ca + S → CaS (сульфід кальцію)
S + 2Na → Na2S (сульфід натрію
Таким чином, в реакція з металами сірка є окисником, а в реакціях з неметалами може виявляти і окислювальні і відновні властивості.
3. Взаємодії з складними речовинами (з водою, лугом, кислотами):
3H2O + 2S → 2H2S + H2SO3;
6NaOH + 3S → Na2S + 2Na2SO3
2H2SO4 + S → 3SO2 + H2O
Сполуки Сульфуру.
Сірководень H2S – З воднем сірка у звичайних умовах не з'єднується. Лише при нагріванні протікає оборотна реакція:
Н2 + S → H2S + 21 кДж
рівновага якої близько 350 С зміщена вправо, а при підвищенні температури зміщується вліво. Практично сірководень одержують звичайно дією розведених кислот на сульфід заліза:
FeS + 2 HСl → FeCl2 + H2S↑
Сірководень являє собою безбарвний і досить отрутний газ, уже 1 частина якого на 100 000 частин повітря виявляється по його характерному запахом (тухлих яєць).
Один об'єм води розчиняє у звичайних умовах близько 3 об'ємів сірководню. При нагріванні розчинність знижується. Підпалений на повітрі сірководень згоряє по одному з наступних рівнянь:
2 H2S + 3 O2 → 2 H2O + 2 SO2 (при надлишку кисню)
2 H2S + O2 → 2 H2O + 2 S (при недоліку кисню).
В реакціях окислення-відновлення виявляє відновні властивості. При дисоціації в водних розчинах утворює слабку сульфідну (сірководневу) кислоту:
H2S⇔ H++HS-; - перший ступінь дисоціації. HS- ⇔ H++S-2; - другий ступінь дисоціації практично не відбувається
Сульфіди – солі сірководневої кислоти. Сульфіди лужних металів та амонію – розчинні у воді (Na2S, K2S, (NH4)2S); сульфіди інших металів – нерозчинні.
Помітна взаємодія сірки з киснем наступає лише при підвищених температурах. Будучи підпалена на повітрі вона згоряє синім полум'ям з утворенням оксиду Сульфуру (IV) по реакції:
S + O2 → SO2 + 297 кДж
Оксид Сульфуру (IV) SO2 (сірчистий газ) являє собою безбарвний газ із характерним різким запахом. Розчинність його досить велика й становить при звичайних умовах близько 40 об'ємів на 1 об'єм води. Використовується для одержання сульфатної кислоти і як дезінфікуючий засіб для обробки підвалів, овочесховищ та ін..
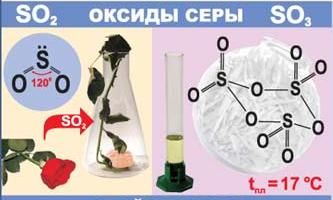
Сірчистий газ хімічно досить активний. Ступінь окислення Сульфуру в SO2 проміжна (+4), тому він виявляє і окисні і відновні властивості:
- відновні: 2SO2 + O2 → 2SO3;
- окисні: SО2 + 2 Н2S → 3 S + 2 Н2О
Насамперед цікава взаємодія SO2 c водою, що веде до утворення сульфітної (сірчистої) кислоти H2SO3. Тому SO2 називають ангідридом сульфітної кислоти. Остання будучи кислотою середньої сили, разом з тим нестійка, тому в її водяному розчині мають місце процеси:
H2O + SO2 ⇔ H2SO3 ⇔ H+ + HSO3− ⇔ 2 H+ + SO32−
При каталітичному окисленні оксид Сульфуру (IV) переходе в оксид Сульфуру (VI);
2SO2 + O2 2SO3
Оксид Сульфуру (VI) SO3 – рідина з температурою кипіння = + 44,5С. Дуже сильний окисник, при розчиненні в воді утворює сильну сульфатну кислоту:
SO3 + H2O → H2SO4.
SO3 називають ангідридом сульфатної кислоти.
Сульфатна, або сірчана кислота H2SO4– найбільш важлива сполука Сульфуру.
Безводна сульфатна кислота – безбарвна масляниста рідина, може розчиняти до 70% SО3 з утворенням олеуму.
Сульфатну кислоту одержують в промисловості в основному контактним способом:
1 етап. Випалювання піриту
4 FеS2 + 11О2 →2Fе2О3 + 8SО2
2 етап. Очищення, осушення, підігрів сірчистого газу SО2 в суміші з повітрям.
3 етап. Окислення сірчистого газу в контактному апараті на каталізаторі ( платина, або ванадій (V) оксид)
2 SО2 + О2 → 2 SО3
4 етап. Розчинення SО3 в концентрованій сульфатній кислоті (98%) до одержання олеуму – важка масляниста рідина:
n SО3 + Н2SО4 →Н2SО4 · n SО3
5 етап. Розведення олеуму до товарної концентрації сульфатної кислоти (98%).
Хімічні властивості сульфатної кислоти H2SO4
Сульфатна кислота – сильний електроліт, легко реагує з:
- основами 2NaOH +H2SO4→Na2SO4 + 2H2O;
- основними та амфотерними оксидами CaO + H2SO4 →CaSO4 + H2O;
ZnO + H2SO4 → ZnSO4 + H2O;
- солями , якщо внаслідок реакції утворюється слабкий електроліт
BaCl2 + H2SO4 → BaSO4↓ + 2HCl;
Розведена сульфатна кислота реагує з металами, що стоять в ряду напруг до Гідрогену, з виділенням водню та утворенням солі (сульфати) :
Zn + H2SO4 → ZnSO4 + H2
Концентрована сульфатна кислота пасивує деякі метали на холоді (Fe, Cr, Al), але при нагріванні реагує з ними з утворенням сульфату відповідного металу , а також продуктів відновлення Сульфуру: SO2 (або H2S, S) та води:
2Fe + 6H2SO4(к) Fe2(SO4)3 + 3 SO2 + 6H2O
Концентрована сульфатна кислота реагує також з металами, що стоять в ряду напруг після Гідрогену з утворенням солі, води та SO2 :
Cu + 2H2SO4(к) CuSO4 + SO2 + 2H2O
Як сильний окисник, сульфатна кислота здатна окислювати і неметали:
С + 2Н2SО4 (конц.) СО2 + 2SО2 + 2Н2О
Якісна реакція на іон SO42- є реакція з іоном барію Ba2+ : SO42- + Ba2+ → BaSO4 ↓ (осад білого кольору.)
Застосування сульфатної кислоти.
За різноманітністю застосування сульфатна кислота займає перше місце серед кислот. Найбільша її кількість витрачається для одержання фосфатних та азотних добрив. Оскільки сульфатна кислота не литка, її використовують для одержання інших кислот – хлоридної, фторидної, фосфатної, ацетатної та ін.. Багато сульфатної кислоти йде на очищення нафтопродуктів. Вона застосовується у виробництві вибухових речовин, штучного волокна, барвників, пластмас і багатьох інших речовин. Можна сказати, що сульфатна кислота використовується майже в усіх галузях виробництва. Щорічне виробництво сульфатної кислоти у світі перевищує 100млн т
14.4 Нітроген та його сполуки
Нітроген – елемент з порядковим номер 7, знаходиться в головній підгрупі 5 групи (ІІ період).
Загальний зміст Нітрогену в земній корі оцінюється в 0,03%. Найбільша його частина (близько 4·1015 т) зосереджена в атмосфері, основну масу якої (75,6 % по масі) і становить вільний азот (N2). Складні органічні похідні азоту входять до складу всіх живих організмів. У результаті відмирання цих організмів і тління їхніх останків утворяться більше прості азотні сполуки, які при сприятливих умовах (головним чином при відсутності вологи) можуть накопичуватися. Саме такого походження природні родовища NaNO3 у Чилі, що мають промислове значення як одне із джерел одержання зв'язаного Нітрогену.
Природний Нітроген складається із суміші двох ізотопів — 14N (99,63%) і 15N (0,37%).
У лабораторних умовах азот може бути отриманий по реакції:
NH4NO2 = 2 H2O + N2 + 334 кДж,
яка легко протікає при нагріванні концентрованого розчину нітриту амонію.
При звичайних умовах азот являє собою безбарвний газ, що не має запаху. Безбарвний він в рідкому, і у твердому стані. Температура плавлення азоту лежить при -210 0С, температура кипіння при -196 0С. Розчинність його у воді мала. Молекула азоту двохатомна й помітно не розпадається на атоми навіть при дуже високих температурах.
|
Хім..знак |
Зовнішня електронна оболонка |
Ступені окислення |
Формула простої речовини, |
Агрегатний стан |
||||||||
|
N |
s 2s22p3 |
-3, +1,0 +2,+3,+4, +5 |
N2 |
газ |
Хімічні властивості Нітрогену
Молекула азоту N2 з’єднана за допомогою дуже міцного, потрійного ковалентного зв’язку між атомами Нітрогену N≡N, що приводить до утворення малоактивної молекули. При звичайних умовах азот легко реагує лише з лужними металами. З іншими речовинами азот, якщо і вступає в реакцію , то при значному нагріванні, в присутності каталізатора та ін.
6Na + N2 2Na3N (нітрид натрію)
3H2+ N2 2NH3 (аміак) ; (при температурі 400-500 0С, в присутності каталізатора, під тиском)
2O2 + N2 2NO2 (при температурі 30000С)
Амоніак NH3-безбарвний газ з різким, задушливим запахом. Добре розчиняється у воді – в 1 об’ємі води за кімнатної температури розчиняється 700 об’ємів аміаку.
Процес одержання аміаку 3H2+ N2 =2NH3 складний технологічний процес, пов'язаний з оборотністю процесу. Враховуючі, що реакція одержання аміаку – екзотермічна, відбувається із зменшенням об’ємів газів, то по принципу Ле -Шательє необхідно дотримуватися певних умов:
Температура =400-500C;
Тиск = 200 атм;
Каталізатори: губчасте залізо, платина, з добавками оксидів К та Al.
Наявність неподіленої пари електронів на атомі Нітрогену в молекулі аміаку сприяє утворенню ковалентного зв’язку по донорно-акцепторному механізму донором електронів є Нітроген, а акцептором – вільна орбіталь , наприклад: Н+:
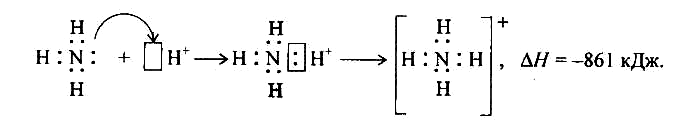
NH3 + H+ →NH4+ - іон амонію
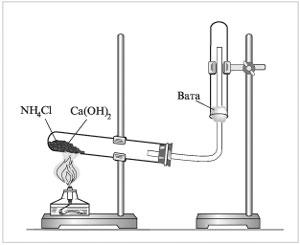
Лабораторний спосіб одержання амоніаку полягає у взаємодії амоній хлориду з кальцій гідроксидом при нагріванні:
2NH4Cl + Са(ОН)2 = СаCl2 + 2NH3 + H2O
Хімічні властивості аміаку: NH3 + H2O → NH4OH гідроксид амонію
Амонійні солі за розчинністю і іншими властивостями дуже схожі із солями лужних металів. вони відрізняються від останніх тим, що леткі при нагріванні і тим, що сильні основи витісняють з них аміак
NH3 + HCl → NH4Cl хлорид амонію
NН3 + НNО3 = NН4NО3 нітрат амонію.
4NH3 + 5O2→ 4NO + 6H2O (t, каталізатор)
NH4NO3→ N2O +2H2O (реакція відбувається при нагріванні)
NH4NO2→ N2 + 2H2O (реакція відбувається при нагріванні)
Якісна реакція на іон NH4+ реакція з іоном ОН- : NH4+ + ОН- = ↑NH3 +H2O
Сполуки Нітрогену з Оксигеном.
Оксиди : N2O (оксид Нітрогену І)- сміховий газ; несолетворний;
NO(оксид Нітрогену ІІ)- газ без запаху, безбарвний, несолетворний
N2O3(оксид Нітрогену ІІІ)- газ, нестійкий, утворює к-ту нітритну HNO2
NO2 (оксид Нітрогену ІV)- бурий газ з різким запахом, утворює дві кислоти HNO2 та HNO3
N2O5 (оксид Нітрогену V)- кристалічна речовина, безбарвна, утворює кислоту HNO3
HNO3- нітратна (азотна) кислота.
Безбарвна рідина, добре розчиняється у воді, при тривалому зберіганні розкладається :
4HNO3→ 4NO2 + H2O + O2 завдяки наявності NO2 розчин кислоти набуває світло-жовтого кольору.
HNO3- сильна кислота і сильний окисник. Окислює не тільки метали, що стоять в ряду напруг до Гідрогену, але й ті, що стоять після. Концентровану нітратну кислоту разом з хоридною кислотою у співвідношенні 1:3 – називають “царська горілка” – така суміш розчиняє навіть золото!
Як будь-яка сильна кислота, нітратна кислота легко реагує з основами, основними та амфотерними оксидами, солями.
Реакції HNO3 з металами:
В реакціях металів з нітратною кислотою не виділяється водень, а утворюються солі – нітрати , вода , та продукт відновлення Нітрогену (NO2,N2,NO та ін.).

Концентрована HNO3 на холоді пасивує деякі метали Fe, Al, Cr.
В загальному вигляді реакції між металами та азотною кислотою можна записати схемою: 2.
Особливо енергійно нітратна кислота реагує з металами, при цьому вона може послідовно відновлюватися до наступних ступіней окислення:
НN+5О3 N+4О2 НN+3О2 N+2О N2+1О N20N-3Н3
Взаємодію металів з нітратною кислотою можна зобразити схемою:
HNO3 + Me → Me(NO3)n + Х + H2O, де Х – один із продуктів відновлення Нітрогену, представлений в таблиці.
Таблиця. Продукти відновлення нітратної кислоти в реакціях з металами залежно від активності металу та концентрації кислоти.
|
НNО3 |
|||||
|
Концентрована |
Розведена |
||||
|
На холоді пасивує Fе, Сr, АІ Аu,Рt,Іr,Та |
З малоактивними металами (Cu, Ag, Pb, Sb, Sn) |
з лужними та лужноземельними металами |
Малоактивні метали (Cu, Ag, Pb, Sb, Sn) |
Активні метали Na, Mg, Zn, Al, Fe, Ni, Cr. |
|
|
Не реагує |
NО2 |
N2О (N2) |
NО |
NН3 , NН4NО3 |
|
Солі нітратної (азотної ) кислоти – нітрати- всі добре розчинні у воді. При нагріванні нітрати розкладаються. В залежності від активності металу, що входить до складу солі , розкладання відбувається по різному:
Активні метали 2KNO3→ 2KNO2 +O2
Метали середньої активності 2Pb(NO3)2→ 4NO2 + 2PbO + O2
Неактивні метали Hg(NO3)2→ 2NO2 + Hg+ O2
Благородні метали розчиняються лише в концентрованій суміші 3 об’ємів хлоридної і 1 об’єму нітратної кислот (“царська горілка”). При взаємодії золота з такою сумішшю послідовно відбуваються процеси:
Аu + 3 НСІ + НNО3→ АuСІ3 + NО + 2 Н2О
АuСІ3 + НСІ → Н[АuСІ4] - золотохлористоводнева кислота
Місце Нітрогену та його сполук в природі.
З розвитком органічної хімії солі азотної кислоти стали служити матеріалом для того, щоб рослини виробляли білкові речовини. Рослини частково є їжею для травоїдних тварин, а останні є для хижаків. Останки тварин і рослин вертають ґрунту зв’язаний Нітроген, що взяли з нього. Під впливом особливих бактерій ці останки піддаються гниттю і в кінці кінців їх Нітроген переходить в аміак і солі амонію.
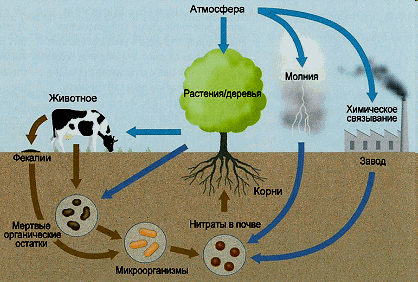
Кругообіг Нітрогену в природі
Частково продукти гниття знову засвоюються рослинами, частково в ґрунті піддаються подальшому перетворенню в солі нітратної кислоти. Цей перехід відбувається під впливом двох видів мікроорганізмів – нітрозобактерій і нітробактерій. Перші викликають окислення аміаку тільки до нітритної кислоти, другі – до нітратної. Нітратна кислота, що утворюється при цьому, переводить карбонати в нітрати, які потім знов засвоюються рослинами і т.д.
Але в цьому основному циклі є досить серйозні джерела втрат зв’язаного Нітрогену. Деяка частина його завжди виділяється у вільному стані як при гнитті, так і при перетворенні аміаку під дією бактерій. Друге джерело втрат Нітрогену пов’язано з життєдіяльністю “денітрифікуючих” бактерій, діяльність яких призводить до безпосереднього перетворення нітратів у вільний азот, який виходить з коло оберту.
Поряд із джерелами втрат, в природі існують й джерела поповнення Нітрогену. В цьому напрямку і в наш час продовжують діяти атмосферні електричні розряди. Приблизно підраховано, що щорічно таким шляхом в ґрунт вноситься до 15 кг зв’язаного Нітрогену на 1 га.
Іншим джерелом поповнення Нітрогену є життєдіяльність “азотобактерій”, які здатні в присутності органічних речовин переводити вільний азот в аміак. За сприятливих умов азотобактерії здатні накопичити за рік до 50 кг зв’язаного Нітрогену на 1 га.
14.4.1 Фосфор та його сполуки
Фосфор – елемент з порядковим номером 15 , знаходиться в головній підгрупі 5 групи (ІІІ період).
Елемент цей був відкритий у 1669 р. Фосфор являє собою “чистий“ елемент — складається тільки з атомів Р31.
По вмісту в земній корі (0,08 %) цей елемент відноситься до досить розповсюджених елементів. Форми знаходження Фосфору в природі різноманітні. В основному це фосфорити Са3(РО4)2та апатити Са3(РО4)2⋅CaF2вони є вихідними продуктами для одержання фосфорних мінеральних добрив. Фосфор входить також до складу кості та зубів в організмах тварин і людини.
Фосфор – проста речовина, яку утворює елемент Фосфор.
Елементарний Фосфор відомий у вигляді декількох алотропних модифікацій: білий, червоний, чорний.
Білий фосфор (густина 1,82 г/см3) прозорий, температура плавлення 44,1°С, не розчинний у воді, але добре розчиняється в сірковуглеці, аміаку і ефірі, дуже токсичний. На повітрі він дуже швидко окислюється і світиться в темноті. Загоряється при температурі 40 – 45°С. При зберіганні білий фосфор поступово переходить в червоний.
Червоний фосфор (густина 2,2 г/см3) повільно окислюється на повітрі, в темноті не світиться, не токсичний. Загоряється лише при температурі більше 400°С, має температуру плавлення 500°С.
Чорний фосфор (густина 2,69 г/см3) за зовнішнім виглядом і будовою схожий на графіт, не розчиняється в сірковуглеці і органічних розчинниках, не токсичний, добре проводить електричний струм.

Алотропні модифікації фосфору
Існування декількох алотропних модифікацій фосфору пов’язано із зміною складу його молекул: в розчині в пароподібному стані до 800°С молекула фосфору має склад Р4, вище 800°С дисоціює на Р2, вище 2000°С на атоми Р. Таким чином, різні алотропні модифікації фосфору існують лише в твердому стані.
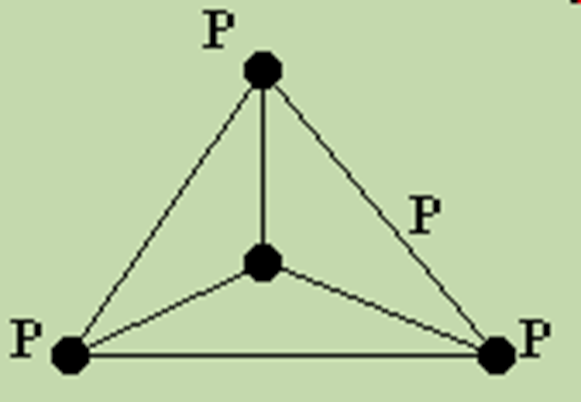
Рисунок . Молекула фосфору
Таблиця. Характеристика елемента Фосфору.
|
Хім. знак |
Зовнішня електронна оболонка |
Ступені окислення |
Формула простої речовини |
Агрегатний стан |
|||||||||||||||||||||||||||
|
Р |
s 3s23p3 |
-3 (РH3), 0 (Р) +3 (Р2O3) +5 (Р2O5) |
Р4 |
твердий |
Одержання.
Фосфор одержують з фосфоритів при термічному нагріванні з піском і вугіллям.
Са3(РО4)2 + 3 SiO2 + 5 C = 3 СаSiO3 + 5 CO + 2 P.
Пари фосфору відводять, зрошують водою і збирають під водою, де і накопчується розплавлений фосфор. Утворений фосфор – білий фосфор у воді не розчиняється і з водою не реагує.
Хімічні властивості.
Алотропні модифікації фосфору значно різняться за хімічною активністю. Так, білий фосфор – речовина що легко займається (його зберігають під водою), в той час як решта алотропних форм досить інертні по відношенню до кисню.
Фосфор хімічно більш активний, ніж Нітроген. Він вступає в багато реакцій, виявляючи при цьому властивості як окислювача, так і відновлювача..
1. Взаємодія з неметалами. При повільному окисленні киснем повітря спочатку утворюється оксид фосфору (ІІІ), а при нагріванні – оксид фосфору (V):
4 Р + 3 О2 = 2 Р2О3
4 Р + 5 О2 = 2 Р2О5
3 S+ 2 Р = Р2S3
2Р + 3 СІ2 = 2 РСІ3
2. Взаємодія з металами. При нагріванні фосфор реагує з металами. При цьому утворюються фосфіди
3 Мg + 2 Р = Мg3Р2 (фосфід магнію)
Фосфіди металів І – ІІІ груп нагадують нітриди, вони розкладаються водою і кислотами:
Мg3Р2 + 6 Н2О = 3 Мg(ОН) 2 + 2 РН3
Фосфін – (РН3)– безбарвний газ з характерним запахом («гнилої риби»), дуже токсичний. Безпосередньо фосфор не реагує з воднем і тому фосфін можна одержати тільки дією води чи кислот на фосфіди металів. Фосфін, як і аміак, здатний утворювати солі фосфонію з кислотами:
РН3 + НСІ = РН4СІ - хлорид фосфонію
В сполуках з металами і Гідрогеном Фосфор є окисником і має ступінь окиснення -3, а в сполуках з Оксигеном виявляє відновні властивості, і має ступені окиснення (+3, +5).
Сполуки Фосфору.
Оксиди Фосфору Р2О3 , Р2О5 – безбарвна , схожа на сніг речовина, без запаху, дуже гігроскопічна
При розчиненні у воді оксиди Фосфору утворюють кислоти:
Р2О3 + 3Н2О = 2Н3РО3 фосфориста кислота;
Р2О5 + 3Н2О = 2Н3РО4 ортофосфорна кислота

Н3РО3 – фосфітна (фосфориста) кислота – слабка двоосновна кислота. Кристалічна сполука, в якій Фосфор виявляє ступінь окиснення +3 і здатний виявляти як окисні так і відновні властивості. Структурна формула її має вигляд
|
O || H – Р – OH | OH |
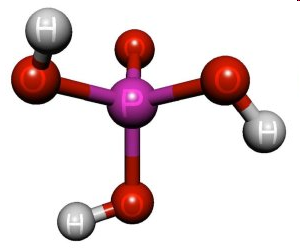
Н3РО4 - ортофосфатна (фосфорна) кислота – це триосновна кислота середньої сили, прозора кристалічна речовина, гігроскопічна. Тому “розпливається” на повітрі. Концентрована ортофосфатна кислота (83 –98%) сиропоподібна рідина, змішується із водою в будь-яких співвідношеннях. Її структурна формула:
|
O || HО – Р – OH | OH
|
При розчиненні у воді фосфорного ангідриду Р2О5 спочатку утворюється мета фосфатна кислота, яка поступово ( при нагріванні це відбувається швидше) переходить в ортофосфатну кислоту:
Р2О5 + 2 Н2О = 2 НРО3 (метафосфатна кислота)
НРО3 + Н2О = Н3РО4
В промисловості ортофосфатну кислоту одержують з фосфоритів:
Са3(РО4) 2 + 3 Н2SО4 = 3 СаSО4 + 2 Н3РО4
Н3РО4 – ортофосфорна кислота у водних розчинах дисоціює з утворенням катіонів Гідрогену та кислотних залишків:
Н3РО4 ↔ Н+ + Н2РО4- (дигідрофосфат – іон);
Н2РО4- ↔ Н+ + НРО42- (гідрофосфат– іон);
НРО42- ↔ Н+ + РО43- (фосфат– іон)
Як будь-яка кислота, ортофосфорна кислота легко реагує з основами, основними та амфотерними оксидами, солями, металами, що стоять в ряду напруг до Гдрогену.
3NaOH +H3РO4= Na3РO4 + 3H2O;
3Na2O +2H3РO4= 2Na3РO4 + 3H2O
Солі , що утворює ортофосфорна кислота мають назви, що відповідають назвам кислотних залишків :
Na3РО4 – фосфат натрію; Na2НРО4 – гідрофосфат натрію; NaН2РО4 – дигідрофосфат натрію.
Якісна реакція на фосфатну кислоту і її солі – фосфати – реакція з нітратом Аргентума AgNO3. Утворюється яскраво жовтий осад Ag3PO4:
3AgNO3 + Na3РО4= Ag3PO4+ 3NaNO3.
Фосфорні добрива.
Рослини не можуть нормально функціонувати і розвиватись при нестачі фосфору в ґрунті. З фосфорних добрив найбільше значення мають наступні:
Са3(РО4) 2 - фосфоритна мука, містить 16 – 35% Р2О5, є дешевим добривом, але мало розчинним у воді. Тому використовується на кислих ґрунтах. В яких фосфат переходить в розчинний дигідрогенфосфат.
Са5(РО4) 3 F ,СІ – апатитовий концентрат, може містити до 40% Р2О5.
Са(Н2РО4) 2 · 2 СаSО4 - простий суперфосфат. Містить від 14% до 20% Р2О5.
Простий суперфосфат одержують за схемою: Са3(РО4) 2 + 2 Н2SО4 = Са(Н2РО4) 2 + 2 СаSО4
Са(Н2РО4) 2 – подвійний суперфосфат, не містить сульфату кальцію, вміст Р2О5 становить від 40% до 50%. Одержують за схемою:
Са3(РО4) 2 + 4 Н3РО4 = 3 Са(Н2РО4) 2
СаНРО4 · 2 Н2О - преципітат, містить 30 – 35% Р2О5. Добре засвоюється рослинами на кислих грунтах. Одержують при нейтралізації ортофосфатної кислоти гашеним вапном:
Н3РО4 + Са(ОН) 2 = СаНРО4 · 2 Н2О
Біологічне значення Фосфору.
Білий фосфор і сполуки тривалентного фосфору оказують токсичну дію на живі організми. Навпаки, ортофосфатна кислота і її органічні похідні необхідні для життєдіяльності живих організмів, тому що вона входить до складу рослинних і тваринних клітин. При нестачі фосфору в рослин спостерігається пригнічений ріст, короткі, тонкі пагони, листя - дрібні, передчасно опадають. Забарвлення листя темно-зелене, з синім відтінком , тьмяні.

В тваринних організмах і в організмі людини Фосфор у вигляді фосфатів входить до складу кісток. Кров містить буферну систему, яка складається з NаН2РО4 і Nа2НРО4. Фосфор входить також до складу жирів, казеїну молока, яєчного жовтка, нуклеїнових кислот
14.5 Карбон та його сполуки
Карбон – елемент з порядковим номером 6 , знаходиться в головній підгрупі 4 групи (ІІ період).
В природі Карбон знаходиться у вигляді двох стабільних ізотопів 12С (98,89%) і 13С (1,11%). Вміст Карбону в літосфері складає 0,35% за масою, в атмосфері – 0,03% (СО2). Карбон не належить до самих розповсюджених елементів, але, не дивлячись на це, значення Карбону виключно велике, тому що його сполуки є основою всіх живих організмів – рослинних і тваринних.
Таблиця. Характеристика елемента Карбону.
|
Хім..знак |
Будова електронної оболонки атому Карбону в нормальному і збудженому стані |
Ступені окислення |
Формула простої речовини, |
Агрегатний стан |
|||||||||||||||||||||||||||||||||||||
|
Не збуджений стан |
Збуджений стан |
||||||||||||||||||||||||||||||||||||||||
|
С |
|
|
-4, 0 +2,+4 |
С |
твердий |
||||||||||||||||||||||||||||||||||||
Форми знаходження Карбону в природі різноманітні. Крім тканин живих організмів і продуктів їхнього руйнування (кам'яне вугілля, нафта й т.і.), він входить до складу багатьох мінералів, що мають загальну формулу МСО3, де М – двовалентний метал. Найпоширенішим з таких мінералів є кальцит (CaCO3), що утворює іноді величезні родовища. В атмосфері Карбон находиться у вигляді вуглекислого газу, що у розчиненому стані перебуває також у всіх природних водах.
У формі деревного вугілля Карбон був відомий людству з незапам'ятних часів. Сучасна назву він одержав в 1787 р.
Вільний Карбон зустрічається в природі у вигляді двох простих речовин — алотропних модифікацій – алмаза й графіту. Алмаз має густину 3,5 г/см3 і є самим твердим із всіх мінералів. Найбільш чисті алмази безбарвні й прозорі. Графіт являє собою сіру масу, що має металевий блиск і жирну на дотик поверхню із густиною 2,2 г/см3.
Утворення природних алмазів відбувалося шляхом кристалізації Карбону в глибинних шарах Землі (200-300 км від поверхні) при температурах порядку 3000 0С и тисках порядку 200 тис. атм. Промислові розробки містять у середньому тільки 0,5 г алмаза на тонну породи. Багаті родовища були відкриті в Якутії (1955 г).
|
Схема розташування атомів С у алмазі |
Схема розташування атомів С у графіті |
||
|
|
Структуру алмаза можна представити у вигляді тетраедрів з атомом Карбону в центрі, які повторюються в нескінченності в трьох вимірах. Алмаз має атомну кристалічну решітку. |
|
Кристалічна структура графіту має слоїсту структуру. Кожний шар утворений правильними шестикутниками, у вершинах яких розташовані атоми Карбону з відстанню 0,142 нм. Відстань між шарами становить 0,34 нм. Взаємодія між атомами сусідніх шарів значно слабша, чим і викликається слоїстість і м’якість графіту. |
Спроби штучного одержання алмазів увінчалися успіхом лише в 1953 р. Перекристалізація графіту в алмаз може бути здійснений тільки при дуже високих тисках, при високих температурах і при наявності каталізаторів.
Хімічні властивості
За звичайних умов Карбон досить інертний. При високих температурах він безпосередньо з’єднується з багатьма металами і неметалами
Реакція з металами (утворюються карбіди). Карбон в карбідах виявляє негативний ступінь окиснення:
Са+ С = CaC2 – карбід кальцію (t=2000 C)
4АІ + 3С = АІ4С3 – карбід алюмінію
Реакції з неметалами:
Взаємодія з воднем при нагріванні, в присутності каталізатора : 2H2 + C= CH4.
Взаємодія з киснем:
при недостачі кисню утворюється оксид Карбону (ІІ) – чадний газ: 2 С + О2 = 2 СО;
в надлишку кисню утворюється оксид Карбону (ІV) – вуглекислий газ: С + О2 = СО2
Взаємодія з сіркою при нагріванні С + 2S= СS2;
Реакції з складними речовинами:
Відновлення металів та неметалів: (при нагріванні)
С+ CuO = Cu + CO
ZnО + С = Zn + СО
SіО2 + 2 С = Sі + 2 СО
Взаємодія з водою – утворення «водяного газу».
C+ H2O = CO + H2
«Водяний газ» одержують при пропусканні перегрітої водяної пари над розжареним вугіллям у вигляді коксу або антрациту. Водяний газ використовується для синтезу вуглеводнів і в тому випадку, коли потрібно створити дуже гаряче полум’я.
СО2 – оксид карбону (ІV) – вуглекислий газ.
Одержання СО2 .
В промисловості СО2 одержують випалюванням вапняку:
СаСО3СаО + СО2 ;
В лабораторії вуглекислий газ одержують дією хлоридної кислоти на мармур:
СаСО3 + 2 НСІ = СаСІ2 + СО2 ↑+ Н2О
За звичайних умов вуглекислий газ уявляє собою газ без запаху і кольору, майже в 1,5 рази важчий за повітря. Мало поглинається водою – при 0°С в 1 об’ємі води розчиняється 1,7 об’ємів СО2, при 20°С – лише 0,38 об’єму.
Вуглекислий газ не підтримує дихання і горіння. При концентрації його в повітрі до 3% у людини спостерігається прискорене дихання, при 10% - настає витрата свідомості і швидка смерть. При підвищені тиску до 60 атм. вуглекислий газ перетворюється на рідину, яку зберігають в стальних балонах. При швидкому випаровуванні рідкий вуглекислий газ утворює снігоподібну масу твердого СО2. Тверда пресована вуглекислота називається “сухим льодом”.
Молекула СО2 побудована лінійна: О = С = О і, хоча зв’язки С = О ковалентні полярні, молекула в цілому неполярна.
Вуглекислий газ є типовим кислотним оксидом – при розчиненні у воді він утворює слабку карбонатну кислоту (вугільну), взаємодіє з лугами та основними оксидами:
СО2 + Н2О ↔ Н2СО3
2КОН + СО2 = К2СО3 + Н2О
Са(ОН) 2 + СО2 = СаСО3+ Н2О

Рисунок. Якісна реакція на вуглекислий газ з вапняною водою
Карбонатна кислота Н2СО3 – слабка, дисоціює ступінчасто:
Н2СО3 ↔Н+ + НСО3 ¯
НСО3 ¯↔Н+ + СО32-
Карбонатна кислота утворює два типи солей: середні – карбонати і кислі – гідроген карбонати.
Карбонати – середні солі карбонатної кислоти – можна одержати при взаємодії вуглекислого газу з оксидами і гідроксидами металів:
К2О + СО2 = К2СО3
2 КОН + СО2 = К2СО3 + Н2О
Всі карбонати, за виключенням карбонатів лужних металів, амонію, практично не розчинні у воді.
Карбонати двовалентних металів при нагріванні розкладаються з виділенням вуглекислого газу:
ВаСО3 = ВаО + СО2
Якісна реакція на карбонат – іон (СО32-)– реакція з сильними кислотами. Утворюється вуглекислий газ.
Гідрогенкарбонати (гідрокарбонати) – кислі солі карбонатної кислоти – утворюються в умовах надлишку карбонатної кислоти або вуглекислого газу, вони практично всі добре розчинні у воді.:
СаСО3 + СО2 + Н2О = Са(НСО3)2
Відомі гідрогенкарбонати лужних, лужноземельних і деяких інших металів. Всі вони добре розчиняються у воді. При нагріванні вони переходять в карбонати:
2NаНСО3 = Nа2СО3 + СО2 + Н2О
(гідрогенкарбонат натрію NаНСО3– питна або чайна сода)
Розчинні солі Ca, і Mg (гідрокарбонати: Са(НСО3)2 Mg(НСО3)2) що знаходяться в природній воді забезпечують їй твердість
|
Типи твердості води |
Тимчасова, або карбонатна |
Постійна, або некарбонатна |
|
Причини твердості |
Наявність у воді кальцій гідроген карбонату, і магній гідроген карбонату |
Наявність у воді інших солей кальцію і магнію. В основному сульфатів. |
|
Усунення твердості |
Видаляється при кип’ятінні. |
Не видаляється при кип’ятінні. Видаляється хімічними реагентами. |
СО – оксид карбону (ІІ) – чадний газ.
Одержання СО.
При пропусканні вуглекислого газу над розжареним вугіллям утворюється оксид карбону (ІІ) – чадний газ:
СО2 + С = 2СО
Ступінь окислення Карбону в оксиді СО дорівнює +2. СО утворюється при згорянні вугілля при недостатньому притоці повітрі. Це отруйний газ без запаху і кольору, не підтримує горіння, але сам горить. Погано розчиняється у воді. Токсичність його пояснюється тим, що він з’єднується з гемоглобіном крові, внаслідок чого останній втрачає здатність приєднувати кисень.
Оксид карбону (ІІ) відноситься до несолетворних оксидів, тобто не утворює солей з лугами і кислотами.
Оксиди багатьох металів відновлюються оксидом карбону (ІІ). В цьому випадку С виступає як окисник:
FеО + СО = Fе + СО2
Взаємодіє з киснем з утворенням вуглекислого газу: 2CO + O2= 2CO2.
Застосування.
Алмаз застосовується в техніці для обробки металів, різання скла. Вугілля, нафта є різними видами палива і ають величезне значення в житті людини. Кокс використовують як відновник і джерело енергії при одержанні заліза. Кам’яне вугілля, нафта є цінною сировиною для хімічної промисловості.
14.6 Силіцій та його сполуки
Силіцій – елемент з порядковим номером 14 , знаходиться в головній підгрупі 4 групи (ІІІ період).
Найближчий аналог Карбону – Силіцій є третім після Оксигену та Гідрогену по розповсюдженості елементом. Його вміст в земній корі становить 16,7%. Якщо Карбон можна розглядати як основний елемент для всього органічного життя, то Силіцій відіграє подібну роль по відношенню до неорганічної природи. Основна частина земної кори складається із силікатних порід, що зазвичай представляють різні сполуки Силіцію з Оксигеном та іншими елементами. Найбільш поширеним є диоксид Силіцію (SiO2) який перебуває в природі у вигляді звичайного піску.
Кремній – проста речовина, яку утворює елемент Силіцій, вперше був одержаний в 1811 р. Гей-Люссаком і Тенором, хоча природні сполуки Силіцію відомі дуже давно.
У вільному стані Силіцій в природі не зустрічається. Основними природними сполуками силіцію є
SіО2 – пісок, гірський кришталь (кристалічний кварц)
АІ2О3 · 2 SіО2 · 2 Н2О - каолин (глинисті мінерали)
К2О · АІ2О3 · 6 SіО2 - ортоклаз
Nа2О · АІ2О3 · 6 SіО2 - альбіт
3 МgО · 4 SіО2 · Н2О - тальк
Фізичні властивості кремнію.
Кремній – тверда речовина з характерним блиском.. Існує у вигляді двох алотропних модифікацій – кристалічний кремній і аморфний кремній.
Чистий кристалічний кремній утворює темно – сірі кристали, блискучі, непрозорі у вигляді октаедрів. Кристалічний кремній має електропровідність, яка за кімнатної температури в 1000 разів менша, ніж електропровідність ртуті. З підвищенням температури електропровідність кристалічного кремнію зростає. Кристалічний кремній має досить високу твердість (він шкрябає скло), але досить крихкий і його легко перетворити на порошок.
|
|
|
Аморфний кремній уявляє собою порошок бурого кольору. Він хімічно більш активний. Дослідження показують, що і кристалічний і аморфний кремній мають однакову структуру – структуру алмазу.
Таблиця. Характеристика елемента Силіцію.
|
Хім. знак |
Зовнішня електронна оболонка |
Ступені окислення |
Формула простої речовини |
Агрегатний стан |
|||||||||||||||||||||||||||
|
Si |
s 3s23p2 |
-4 (SіН4), 0 (Si) +4 (SiO2) |
Si |
твердий |
Атом Силіцію може віддавати або приєднувати 4 електрони і виявляти в сполуках ступені окислення –4 і +4. Але найбільш характерним ступенем окислення для Силіцію є +4.
За кімнатною температурою кремній досить інертний, але при нагріванні досить легко взаємодіє з багатьма елементами і речовинами
Одержання.
Для держання значної кількості кремнію використовують реакцію, що відбувається в електричних печах за рівнянням:
SiO2 + 2 C = 2 CO + Si
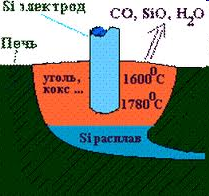
Рисунок. Одержання Силіцію
Хімічні властивості Силіцію.
1. Взаємодія з неметалами.
Сполуки з Гідрогеном.
Кремній безпосередньо з воднем не реагує, але його водневі сполуки відомі. Сполуки Силіцію з гідрогеном називають силанами. Силани можна одержати при взаємодії силіцидів (сполук Силіцію з металами) з кислотами. Наприклад:
Мg2Sі + 4 НСІ = 2 МgСІ2 + SіН4 ↑ силан
Силан – безбарвний газ, самозапалюється на повітрі:
SіН4 + 2 О2 = SіО2 + 2 Н2О
Луги розкладають силан:
SіН4 + 2 NаОН + Н2О = Nа2SО3 + 4 Н2
2. Взаємодія з металами.
Сполуки з металами – силіциди
Силіцидами називають бінарні сполуки Силіцію з металами.
Силіциди можна одержати при безпосередній взаємодії металів з кремнієм:
2Мg + Sі = Мg2Sі
а також при взаємодії металів з оксидом силіцію (ІV):
4 Мg + SіО2 = 2 МgО + Мg2Sі
3. Відношення до води, кислот і лугів.
Кремній не розчиняється у воді і кислотах, крім плавікової кислоти та суміші нітратної і плавікової кислот, але легко розчиняється в лугах:
Sі + 6 НF = Н2[SіF6] + 2 Н2
Sі + 4 НNО3 + 18 НF = 3 Н2 [SіF6] + 4 NО + 8 Н2О
Sі + 2 NаОН + Н2О = Nа2SіО3 + 2 Н2
Оксид Силіцію (ІV) SіО2 (кремнезем).
Диоксид Силіцію зустрічається в природі в трьох різних кристалічних формах – у вигляді кварцу, тридиміту і кристобаліту.
Кварц SіО2– кристалічна форма оксиду Силіцію (ІV). Часто він зустрічається у виглядів добре утворених кристалів, іноді значної величини. Кварц відноситься до досить розповсюджених мінералів (Гірський кришталь, Аметист та ін..)


Рисунок. Кристалічні модифікації кварцу
Тридиміт також є модифікацією кристалічного SіО2, зустрічається і в гірських породах, і в метеоритах.
Кристобаліт іноді зустрічається в природі у вигляді мілких кристалів, що включені в лаву.
Ці три різних модифікації кварцу стійки за різних температур.
Диоксид Силіцію існує також аморфному виді – у вигляді білого порошку. В природі він зустрічається у вигляді інфузорної землі, що складається із залишків кремнієвих панцирів інфузорій.
З хімічної точки зору диоксид Силіцію SіО2 є надзвичайно стійкою речовиною. З кислот його розчиняє лише плавікова кислота:
4 НF + SіО2 = SіF4 + 2 Н2О
SіF4 + 2 НF = Н2SіF6
У воді SіО2 практично не розчиняється. При сплавленні з лугами досить легко переходить в силікати:
SіО2 + 2 NаОН = Nа2SіО3 + Н2О
Аналогічно він взаємодії з карбонатами лужних металів при сплавленні:
SіО2 + Nа2СО3 = Nа2SіО3 + СО2
Силікати утворюються і при сплавленні диоксиду Силіцію з оксидами металів:
SіО2 + Nа2О = Nа2SіО3 силікат натрію
Силікатна кислота і її солі силікати.
Силікатна кислота Н2SіО3– студнеподібна нерозчинна у воді речовина. Добре розчиняється лише в лугах з утворенням солей.

Рисунок. Силікагель
Силікатна кислота відноситься до дуже слабких кислот (слабша за карбонатну) і малостійких кислот. При нагріванні вона відщеплює воду: Н2SіО3=SіО2 + Н2О
Частково обезводнена силікатна кислота (силікагель) використовується як адсорбент вологи та інших речовин.
Із солей силікатна кислота може бути витіснена вуглекислим газом або вугільною кислотою:
Nа2SіО3 + СО2 + Н2О = Nа2СО3 + Н2SіО3 ↓
Відомі солі метасилікатної Н2SіО3 і ортосилікатної Н4SіО4 кислот. Розчинними є лише солі лужних металів (розчинне або рідке скло).
Силікатна промисловість. Скло. Цемент.
Силікатна промисловість охоплює виробництво скла (кварцове, віконне, пляшкове, термостійке, оптичне і т. і.), керамічних виробів (порцеляна, фаянс, гончарні вироби), цегли і покрівельних матеріалів, а також цементу.
Кварцове скло виготовляють переплавкою диоксиду силіцію SіО2. Воно характеризується високою температурою розм’якшення і не тріскає при різкому охолодженні, тому що має дуже малий коефіцієнт теплового розширення. Кварцово скло, на відміну від інших сортів скла, пропускає ультрафіолетові промені.
Віконне і пляшкове скло виготовляють при нагріванні суміші (шихти) піску, вапна і соди:
Nа2СО3 + СаО + 6 SіО2 = Nа2О · СаО · 6 SіО2 + СО2
Варку скла проводять до тих пір, доки маса не стане рідкою і легко рухомою. Потім її поступово охолоджують, маса стає в’язкою і тоді з неї можна виготовляти вироби. Термостійке скло відрізняється від віконного або пляшкового тим, що містить близько 12% В2О3, тому воно має значно менший коефіцієнт теплового розширення. Оптичне скло буває свинцевим (містить близько 49% РbО) і баритовим (містить 42% ВаО і 3% РbО). Кришталь утворюється при сплавленні SіО2 з поташем К2СО3 і оксидом плюмбуму РbО. Він уявляє собою важке скло, що складається із силікатів калію, свинцю і SіО2. Кришталь має високий коефіцієнт заломлення світла, з нього виготовляють оптичне скло, художній і побутовий посуд.
Для виготовлення цегли і покрівельних матеріалів готують шихту з глини і піску, переводять в пластичний стан, формують, висушують і прожарюють при температурі 900 – 1050С. Цемент виробляють випіканням суміші глини, вапняку і піску при 1400 – 1500С. Шихту виготовляють таким способом, щоби в цементному клінкері (продукт після випікання) містилось 64 – 67% СаО, 21 – 24% SіО2, 4 – 7% АІ2О3 і 2 – 4% Fе2О3. Внаслідок випікання утворюються алюмінати і силікати кальцію. Цементний клінкер роздрібнюють в спеціальних млинах. При змішуванні цементу з водою відбувається утворення кристалогідратів і цемент стає твердим. Виготовляють цемент різних марок: 200, 250, 300, 400, 500 і 600. Марка цементу означає навантаження в кг/см, яку витримує без деформації твердий цемент через 28 днів після змішування його з водою. При змішуванні цементного розчину з гравієм, щебенем і дрібним шлаком утворюється тверда маса, яку називають бетон. Якщо цією масою заливають залізну арматуру, то утворюється залізобетон. Бетон і залізобетон використовують як будівельний матеріал.

Рисунок. Застосування сполук силіцію
14.7 Гідроген. Водень і вода
Гідроген– хімічний елемент Символ Н, порядковий номер в Періодичній системі: 1, відносна атомна маса: 1,00794. Утворює просту речовину –водень Н2.
Водень був уперше описаний в 1766 р. Кавендишем, що одержував його дією заліза і деяких інших металів на розведену сульфатну або хлоридну кислоту. Отриманий легкий газ Кавендиш прийняв спершу за флогістон, а потім (1781 р.) за сполуку флогістону з водою. Розкладання води розпеченим залізом було вперше (1783) проведене Лавуазьє. Сучасну назву дав цьому елементу Лавуазьє (1783 р.). Розкладання води електричним струмом було здійснено в 1789 р.
Водень є одним з найпоширеніших елементів - його частка становить 0,88% від маси всіх трьох оболонок земної кори (атмосфери, гідросфери й літосфери), що при перерахуванні на атомні відсотки дає цифру 15,5%.
Таблиця. Загальна характеристика Гідрогену.
|
Будова електронної оболонки 1s1 |
Фізичні властивості |
|||||
|
Н |
|
Водень (т. пл. -2590С, т.кип. -2530С ) - безбарвний газ, що не має запаху. У воді він розчиняється незначно - 2:100 по об'єму. Для нього характерна розчинність у деяких металах. Це самий легкий, самий рухливий і самий теплопровідний із всіх газів. |
Основна кількість цього елемента перебуває у зв'язаному стані. Так, вода містить його близько 11%, глина - близько 1,5% і т.д. У вигляді сполук з вуглецем водень входить до складу нафти, горючих природних газів і всіх організмів. Вільний водень складається з молекул Н2. Він часто міститься у вулканічних газах. Частково він утвориться також при розкладанні деяких органічних залишків. Гідроген є найпоширенішим елементом Всесвіту. На його частку доводиться близько 80% маси Юпітера й близько 60% маси Сатурна. У міжзоряному просторі атоми Гідрогену зустрічаються в кілька разів частіше, ніж атоми всіх інших елементів, разом узятих
Гідроген складається із суміші ізотопів з масовими числами 1, 2 і 3 (1Н - протій, 2Н - дейтерій, 3Н - тритій). Співвідношення між ними: 1Н – 99,98%, 2Н – 0,015%, У незначних кількостях — порядку одного атома на 1018 атомів 1Н — до них домішаний радіоактивний ізотоп водню 3Н .
Хімічні властивості водню.
Гідроген стоїть на початку періодичної системи й не може бути віднесений до якої-небудь певної її групи. Гідроген поєднує ознаки першої і передостанньої (VII) груп. Але при цьому існують і розходження в його відношенні до лужних металів і галогенів. Уже одна та обставина, що Гідроген як перший член у ряді елементів може втрачати тільки один електрон, доводить, що він по багатьом властивостям сильно відрізняється від галогенів. У випадку відщіплення від атома Гідрогену електрона залишається дуже маленьке ядро атома — протон. Це відрізняє Гідроген від всіх інших елементів періодичної системи.
1. Реакція з неметалами.
Реакція з киснем. Водень не підтримує горіння. Так, запалена свіча гасне в ньому Сам водень горить у чистому кисні, і на повітрі, причому продуктом згоряння є вода. При підпалюванні суміші обох газів (“гримучого газу”) взаємодія протікає з вибухом. Реакція утворення води з водню й кисню сильно екзотермічна:
2 Н2 + О2 = 2 Н2О + 573 кДж
Молекула водню Н2 є достатньо стійкою молекулою. Цим пояснюється той факт, що водень при звичайних умовах реагує тільки з фтором.
Н2 + F2 = 2НF
Реакції з іншими простими речовинами відбуваються при нагріванні або в присутності каталізатора::
Н2 + Cl2 = 2НCl
Н2 + S = Н2S
У всіх цих реакціях Гідроген виявляє відновні властивості, віддає один електрон і набуває ступеня окиснення +1. Сполуки Гідрогену з елементами 6-7 груп при розчиненні у воді дають кисле середовище – тобто є різними по силі кислотами.
2. Реакція з металами відбувається при нагріванні. В результаті реакції утворюються гідриди – безбарвні кристалічні сполуки, здатні реагувати з кислотами та водою
2Na + H2 = 2NaH
Ca + H2 = CaH2;
NaH + Н2О = NaOH + H2;
CaH2+ Н2О =Ca(OH)2 + H2;
3. Реакція з оксидами металів. В реакціях з оксидами металів водень виявляє відновні властивості. Такі реакції можливі при нагріванні:
СuO + H2 = H2O + Cu
Одержання водню
1. Розчинення цинку в розведеній соляній кислоті
Zn + 2 HCl = ZnCl2 + H2↑.
Цей спосіб найчастіше застосовують у лабораторіях.
2. Дія натрію на воду
2 Na + 2 H2O = 2 NaOH + H2↑.
3. Пропущення водяної пари над розпеченим до червоного заліза
4 Н2О + 3 Fe = Fe3O4 + 4 H2↑.
4. Пропущення водяної пари над коксом.
При температурі вище 10000 С реакція йде головним чином по рівнянню
Н2О + С = СО + Н2.
5. Електролітичне розкладання води.
Чиста вода практично не проводить токи, тому до неї додаються електроліти (звичайно КОН). При електролізі водень виділяється на катоді. На аноді виділяється еквівалентна кількість кисню.
2Н2О=2Н2 + О2
Практичне застосування водню різноманітне: їм заповнюють кулі-зонди, у хімічній промисловості він служить сировиною для одержання багатьох досить важливих продуктів (аміаку та ін.), у харчовий - для вироблення з рослинних масел твердих жирів і т.д. Висока температура (до 2600 С), що виходить при горінні водню в кисні, використається для плавлення тугоплавких металів, кварцу й т.п. Рідкий водень є одним з найбільш ефективних реактивних палив.
14.8 Вода.
Найпростіша формула води — Н2О. У рідкому стані вода асоційована, тобто поряд із простими молекулами містить і більше складні утворення, що відповідають загальній формулі (Н2О)n, де n = 2, 3, 4 і т.д. Подібні молекулярні агрегати увесь час виникають і знову розпадаються, що можна виразити схемою: nН2O ⇔ (H2O)n.
При нагріванні води ступінь її асоціації зменшується Загалом кажучи, причиною асоціації молекул може бути їхня висока полярність. Молекули води, що є постійними диполями, можуть за рахунок взаємного притягання протилежно заряджених полюсів комбінуватися по двох, трьох і т.д. Основне значення для асоціації молекул води має утворення так званих водневий зв'язків. Останні виникають за рахунок притягання водню однієї молекули води до кисню іншої за схемою:
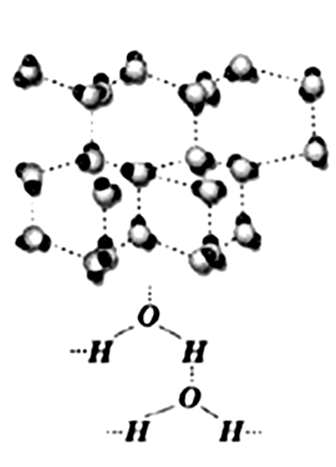
Рисунок . Утворення водневих звязків між молекулами води
Рідка вода в тонких шарах безбарвна, а в товсті має блакитнувато-зелені кольори. На противагу майже всім іншим речовинам, густина яких у міру охолодження увесь час зростає, вода має найбільшу густину при +4 0С. Густина води при 250С ρ = 1 г/мл
Причина аномалії води точно не встановлена. Припускають, що при 0 °С вода в значній частині складається з (Н2О)3, а при нагріванні її до +4 °С потроєні молекули переходять в (Н2О)2, що супроводжується збільшенням густини ρ >1 г/мл.
Чиста вода майже не проводить електричний струм. Вона характеризується найбільшої їх всіх рідких і твердих речовин питомою теплоємністю, тобто для нагрівання води потрібно затратити більше тепла, чим для нагрівання на теж число градусів рівного по масі кількості якої-небудь іншої рідини або твердого тіла.
При охолодженні води до 0 °C вона переходить у твердий стан — лід. Густина льоду дорівнює 0,92 г/см3, тобто він легше води. Ця обставина має величезне значення для збереження життя, тому що завдяки йому лід, що утвориться у водоймах, залишається на поверхні води й охороняє більш глибокі її шари від подальшого охолодження. Якби лід був важче води, всі водойми холодного й помірного поясів промерзали б до дна, і лише в літню пору відтавали з поверхні. Властивість води в цьому випадку аномальні, тому що у величезної більшості речовин густина у твердому стані більше, ніж у рідкому.
З хімічної точки зору вода є досить реакційно здатною речовиною, і часто виступає каталізатором багатьох процесів. Вона з'єднується з багатьма оксидами металів і неметалів, енергійно взаємодіє з найбільш активними металами й вступає в різні інші реакції найрізноманітнішого характеру:
Реакції з оксидами:
Na2O + H2O= 2NaOH
SO3 + H2O = H2SO4
Реакція з неметалами:
Cl2 + H2O = HCl + HClO
3H2O + 2S= 2H2S + H2SO3;
Реакція з активними металами:
2Na + 2H2O = 2NaOH + H2↑
2АІ +6Н2О 2АІ(ОН) 3 +3Н2 (за умов руйнування оксидної плівки)
3Fe + 4H2O Fe3O4+ 4H2 (при нагріванні)
Реакція із складними сполуками:
PCl5 + 4H2OH3PO4 + 5HCl
СаС2 + 2Н2О C2H2 + Ca(OH)2
Крім свого виняткового значення для життя природи, вода є найважливішим і найбільш різнобічним по характері об'єктом промислового використання. Вона застосовується як вихідна речовина, учасник реакції або розчинник при проведенні різних хімічних процесів, як теплоносій у теплотехніці, як механічна сила при розмиві ґрунтів і т.д. і т.п. Загальне споживання води для технічних цілей колосально так, одна лише металургія витрачає її більше, ніж витрачає на побутові потреби все населення промислово розвитий країни.
У зв'язку із цим для ряду країн зростаючого значення набуває проблема поповнення своїх природних водних ресурсів за рахунок опріснення морської води.