- ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ
- І.1 Особливості органічних сполук
- І.2 Стан атома Карбону і характер хімічних зв’язків в органічних сполуках
- І.3 Теорія будови органічних сполук
- І.4 Класифікація органічних сполук
- І.5 Номенклатура органічних сполук
- І.5.1 Замісникова номенклатура
- І.5.2 Утворення назв органічних сполук
- згідно із замісниковою номенклатурою IUPAC
- І.6 Загальна характеристика органічних реакцій
- І.6.1 Особливості органічних реакцій
- І.6.2 Класифікація органічних реакцій
ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ
Існує багато визначень органічної хімії. Найдавніше з них належить Берцеліусу, який ще в 1827р. видав підручник, де виділив всю відому на той час інформацію про сполуки Карбону в окрему главу, названу „Керування з органічної хімії”. Саме в цьому підручнику і зустрічається перше формулювання предмету органічної хімії як самостійної науки.
Органічна хімія – це частина хімічної науки про речовини рослинного та тваринного походження.
Берцеліус та його прихильники вважали, що органічні сполуки утворюються виключно внаслідок життєдіяльності організмів під впливом так званої «життєвої сили». Однак послідовники берцеліусівської «теорії віталізму» дуже швидко зазнали поразки, коли німецький хімік Велер (1828р.) вперше в історії науки синтезував органічну сполуку – сечовину – із неорганічної речовини – цианату амонію. Це дало поштовх до бурного розвитку органічного синтезу: Зінін одержав анілін (1842р.), Кольбе – оцтову кислоту (1845р.), Бертло – сполуки типу жирів (1854р.), Бутлеров – цукроподібні речовини (1861р.). Отже, на базі експериментів поступово доводилося, що невірно вважати органічну хімію наукою тільки про ті сполуки, які є продуктами життєдіяльності живих організмів. І хоч спочатку предметом вивчення органічної хімії були переважно саме природні сполуки, що виділялися із живих організмів, поступово збільшувалося значення органічного синтезу, за допомогою якого одержувалися якісно нові матеріали, що не мали природних аналогів. Кекуле (середина XIX ст.) запропонував таке визначення:
Органічна хімія – це наука про сполуки Карбону з іншими елеметами.
Пізніше Шорлеммер (1889р.) уточнив це формулювання:
Органічна хімія – це наука про вуглеводні та їх похідні.
С тих пір було зроблено багато найважливіших відкрить, винайдена велика кількість природних речовин (гормонів, вуглеводів, жирів, вітамінів, алкалоїдів тощо) і синтезована ще більша кількість штучних органічних сполук (пластмаси, синтетичні волокна, барвники, каучуки, антибіотики та інші лікарські препарати). Більш того, успіхі органічної хімії в останні десятиріччя сприяли виділенню окремих розділів у самостійні наукові дисципліни, наприклад: елементоорганічна хімія, хімія високомолекулярних сполук і полімерів, хімія нафти і газу, біохімія та біоорганічна хімія, стереохімія тощо.
Тому зрозуміло, що не можна обмежувати предмет органічної хімії вивченням лише продуктів життєдіяльності рослин і тварин. У зв’язку з цим найбільш узагальненим визначенням можна вважати таке:
Органічна хімія – це наука, що вивчає сполуки Карбону, їх будову, властивості, способи одержання і закони їх взаємних перетворень, а також шляхи практичного застосування.
До органічних речовин належать сполуки Карбону із Гідрогеном, Оксигеном, Нітрогеном, Фосфором, галогенами та іншими хімічними елементами, за виключенням оксидів карбону СО, СО2, вугільної кислоти Н2СО3 та її солей, які традиційно відносять до неорганічних сполук.
РОЗДІЛ І. ТЕОРЕТИЧНІ ОСНОВИ ОРГАНІЧНОЇ ХІМІЇ
-
Особливості органічних сполук
-
Стан атома Карбону і характер зв’язків в органічних сполуках
-
Теорія будови органічних сполук
-
Класифікація
-
Номенклатура
-
Загальна характеристика органічних реакцій
І.1 Особливості органічних сполук
Розвиток органічної хімії як самостійної науки зумовлений специфічними особливостями органічних сполук. Розглянемо найважливіші з них.
-
Величезна кількість органічних речовин, яка пояснюється здатністю атомів Карбону сполучатися один із одним, утворюючи ланцюги і кільця. За різними джерелами кількість органічних сполук оцінюється від 17 до 20 млн., у той час як неорганічних речовин достовірно відомо десь близько 500 тис.
-
Органічні сполуки поряд із водою є, з одного боку, головним будівельним матеріалом тваринних і рослинних організмів, а з іншого – основним харчовим компонентом, що забезпечує постійну підтримку їх життєдіяльності на відповідному рівні. Крім того, величезна кількість органічних сполук є основою для створення багатьох виробів із широким спектром властивостей, які набули застосування у всіх без виключення галузях промисловості, у будівництві, а також у повсякденному побуті.
-
Молекули органічних речовин, в яких атоми сполучені між собою переважно за рахунок неполярних чи малополярних ковалентних зв’язків, як правило, належать до неелектролітів. Йонний тип зв’язку зустрічається рідко, найчастіше в солях органічних кислот, наприклад, в ацетаті натрію.
-
Органічні сполуки, що містять тільки прості одинарні зв’зки С–С, С–Н, за звичайних умов взаємодіють між собою надзвичайно повільно або не взаємодіють зовсім.
-
При нагріванні до підвищених температур органічні речовини обвуглюються, а у присутності кисню – згоряють. Це пояснюється невисокою міцністю зв’язків між атомами Карбону.
-
Органічні сполуки всіх класів утворюють особливі ряди гомологів – речовин, що мають загальні ознаки у будові молекул та у властивостях.
Гомологічним рядом називається послідовність подібних за будовою та властивостями речовин, в якій кожний наступний член відрізняється від попереднього на постійну структурну одиницю – гомологічну різницю СН2.
Генетичною основою гомологічних рядів для більшості класів органічних сполук є гомологічний ряд насичених незамкнутих вуглеводнів – алканів (табл. І.1).
Таблиця І.1 – Гомологічний ряд алканів
|
Будова, склад (у дужках) |
Кількість атомів Карбону |
Назва |
|
СН4 (СН4) |
1 |
Метан |
|
СН3-СН3 (С2Н6) |
2 |
Етан |
|
СН3-СН2-СН3 (С3Н8) |
3 |
Пропан |
|
СН3-(СН2)2-СН3 (С4Н10) |
4 |
Бутан |
|
СН3-(СН2)3-СН3 (С5Н12) |
5 |
Пентан |
|
СН3-(СН2)4-СН3 (С6Н14) |
6 |
Гексан |
|
СН3-(СН2)5-СН3 (С7Н16) |
7 |
Гептан |
|
СН3-(СН2)6-СН3 (С8Н18) |
8 |
Октан |
|
СН3-(СН2)7-СН3 (С9Н20) |
9 |
Нонан |
|
СН3-(СН2)8-СН3 (С10Н22) |
10 |
Декан |
Загальна формула для алканів – CnH2n+2. Як видно із порявняння їх складу (табл. 1), два найближчі гомологи дійсно відрізняються один від одного на гомологічну різницю СН2. У загальному випадку гомологичний ряд будь-якого класу органічних сполук теж має загальну формулу. Наприклад, для насичених спиртів – CnH2n+1OH, для насичених карбонових кислот – CnH2n+1COOH.
-
Для органічних сполук характерно явище ізомерії та утворення ізомерів.
Ізомерія – це явище, при якому декілька сполук – ізомерів – мають однаковий склад і однакову молекулярну масу, але відрізняються один від одного будовою молекул, а отже, і своїми фізичними та хімічними властивостями.
Існує декілька типів ізомерії, серед яких найбільш поширеними є структурна і просторова.
І Структурна ізомерія зумовлюється різним порядком розміщення окремих атомів чи атомних груп у молекулі. Вона поділяється на певні види:
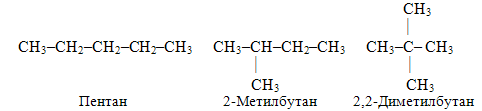
– ізомерія вуглецевого ланцюгу, наприклад, для алканів складу С5Н12 існують три ізомери різної будови:
– ізомерія положення кратного зв’язку, наприклад, для вуглеводнів складу С5Н8, які мають лінійну будову:
СН≡С–СН2–СН2–СН3 СН3–С≡С–СН2–СН3
Пентин-1 Пентин-2
– ізомерія положення замісника, наприклад, для С3Н7–ОН можливо існування двої ізомерів – пропанола-1 і пропанола-2;

– міжкласова ізомерія (так звана метамерія). Слід зазначити, що на відміну від інших структурних ізомерів, властивості яких відрізняються не дуже різко, метамери за своїми властивостями зовсім не походять один на одного. Так, для складу С5Н10, крім розглянутих видів структурної ізомерії, характерне ще й явище метамерії. Як приклад можна навести будову вуглеводнів, один з яких належить до алкенів, а інший – до циклоалканів:
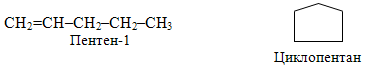
Сполуки складу С3Н6О теж представлені метамерами, що належать до різних класів – альдегідів, кетонів і ненасичених спиртів:
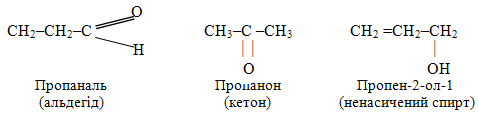
Ще один приклад метамерів – карбонова кислота і естер складу С3Н6О2:

ІІ Просторова ізомерія, при якій залишаються однаковими склад і послідовність сполучення атомів в молекулах ізомерів, але змінюється просторове розміщення однакових атомів чи атомних груп відносно карбонового ланцюгу. Просторова ізомерія представлена такими видами:
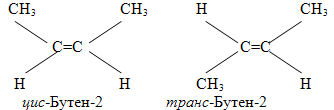
– геометрична, зумовлена різним положенням замісників відносно подвійного зв’язку чи малого цикла, наприклад, для бутена-2, в якому подвійний зв’язок розміщується після другого атома Карбону СН2–СН=СН2–СН3 є два геометричних ізомери:
І.2 Стан атома Карбону і характер хімічних зв’язків в органічних сполуках
Елемент Карбон, порядковий номер якого дорівнює 6, розміщується у другому періоді та в головній підгрупі IV групи періодичної системи Д.І.Менделєєва. З електронної конфігурації Карбону (1s22s22p2) випливає, що на двох енергетичних рівнях атома С перебуває шість електронів, з яких чотири знаходяться на зовнішньому, другому рівні:
|
… |
|
|
|
|
|
|
Зовнішні електрони атома зумовлюють спінвалентність, або ковалентність Карбону.
Ковалетність – це кількість ковалентних зв’язків, що утворює атом; вона визначається кількістю неспарених електронів у атомі в основному стані або кількістю неспарених електронів, що з’являються в атомі при його збудженні.
Оскільки атом Карбону в основному стані має два неспарених електрони, його ковалентність дорівнює двом, тобто він може утворювати два зв’язки. Однак практично в усіх органічних сполуках атом Карбону утворює чотири зв’язки, що стає можливим завдяки збудженню внаслідок поглинання певної кількості енергії (405,6кДж/моль). У збудженему стані, який позначають за допомогою зірочки С*, атом Карбону має вже чотири неспарених електрони:
6C 1s22s22p2 6C* 1s22s12p3
Зрозуміло, що збудження атома С при переході із стану 2s22p2 у стан 2s12p3 потребує затрати енергії, яка не тільки компенсується, а й дає енергетичний виграш при утворенні хімічних зв’яків. Наприклад, енергія, що виділяється при утворенні кожного зв’язку С–Н у вуглеводнях, становить 415,5кДж/моль. Отже при утворенні двох додаткових (порівняно з основним станом) ковалентних зв’язків виділяється енергії на 415,5⋅2 – 405,7 = 425,3кДж/моль більше, ніж її потрібно для збудження атома.
Кожна орбіталь збудженого атома С* характеризується певною формою та енергією (рис. І.1 і ІІ.2).
|
Рис. І.1 – Сферична форма s-орбіталі, яка характеризується найменшою енергією на енергетичному рівні та розташовується найближче від ядра порівняно з іншими орбіталями даного енергетичного рівня
|
Рис. ІІ.2 – Три р-орбіталі: чим вища енергія електрона, тим швидше він обертається навколо ядра, тим сильніше витягується область його існування, утворюючи гантелеподібну форму. При цьому електронні хмари займають у навколоядерному просторі три положення вздовж вісів координат x, y і z. Це пояснюється тим, що завдяки негативному заряду електронні хмари взаємно відштовхуються та намагаються зайняти положення якомога далі одна від одної. Усі разом px-, py- і px-електронні хмари утворюють симетричну геометричну фігуру, у центрі якої розміщується атомне ядро |
Різниця у формі та енергії атомних орбіталей повинна спричиняти утворення хімічних зв’язків С–Н, відмінних за своєю енергією. Однак дослідження доводять, що насправді зв’язки однакові завдяки явищу гібридизації.
Гібридизація – це процес змішування та вирівнювання орбіталей за формою і енергією, при якому відбувається перерозподіл електронних густин близьких за енергією орбіталей, внаслідок чого вони стають рівноцінними.
Для валентних орбіталей збудженого атома Карбону можливі три типи гібридизації.
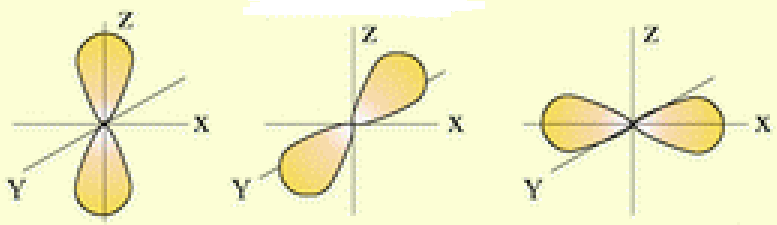
sp-Гібридизація. При комбінації однієї s- i однієї р-орбіталей виникають дві sp-гібридизовані орбіталі, розміщені симетрично під валентним кутом 1800 (рис. І.3а).
Валентним називається кут між вісями зв’язку – уявними лініями, які проходять через ядра хімічно сполучених атомів.
Зв’язки, які утворюються за участю електронів цих орбіталей, також розміщуються під кутом 1800, що зумовлює лінійну форму молекули. Такий тип гібридизації спостерігається в молекулах вуглеводнів з потрійними зв’язками (наприклад, в ацетилені НС≡СН). 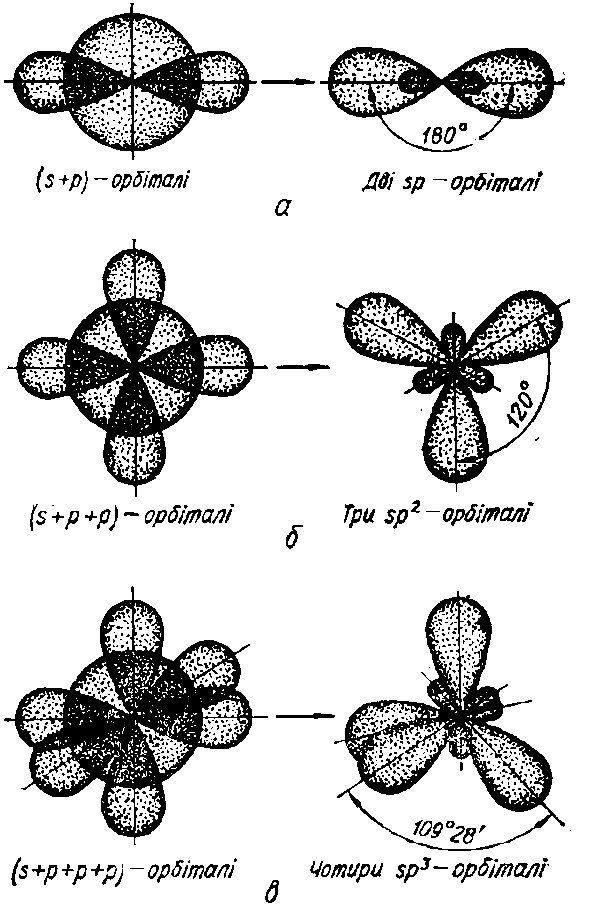
Рисунок І.3 – Гібридизація атомних орбіталей
sp2-Гібридизація. Комбінація однієї s- і двох р-орбіталей приводить до утворення sp2-гібридизованих зв'язків, розміщених під кутом 1200 (рис. І.3б). Тому фрагмент молекули, в якому зв’язки утворені за рахунок sp2-гібридизованих орбіталей, набуває форми правильного трикутника. Наприклад, збуджений атом Карбону С*(2s12p3) перебуває у стані sp2-гібридизації в молекулі етилену (Н2С=СН2). Три гібридизовані орбіталі кожного атому Карбону утворюють три зв’язки: два з атомами Гідрогену (С–Н) і один з сусіднім атомом Карбону (С–С), а негібридизовані р-орбіталі утворюють ще один додатковий зв’язок між атомами Карбону.
sp3-Гібридизація. Комбінація чотирьох орбіталей (однієї s- і трьох р-) приводить до sp3-гібридизації, при якій чотири гібридизовані орбіталі симетрично орієнтовані у просторі до чотирьох вершин тетраедра, тобто під кутом 109028` (рис. І.3в). Тетраедричне розміщення зв’язків зумовлює тетраедричну форму молекул, що характерно для насичених сполук чотиривалентного Карбону (СН4, СCl4, C2H6).
В органічних сполуках Карбону здійснюється ковалентний тип хімічного зв’язку.
Зв’язок атомів за допомогою спільних електронних пар називається ковалентним.
Для скорочення спільні пари електронів позначаються рискою між символами атомів відповідних елементів: С–Н, С–С, С–Cl.
Сутність ковалентного зв’язку пояснюється спеціальними теоріями, серед яких найбільш доступною є модель валентних зв’язків (так званий метод ВЗ). Основні положення методу ВЗ стисло можна викласти так: 1) кожна пара атомів у молекулі утримується разом за допомогою однієї або декількох спільних електронних пар, при цьому електронні орбіталі взаємодіючих атомів перекриваються; 2) міцність зв’язку залежить від ступеня перекривання електронних орбіталей; 3) умовою утворення ковалентного зв’язку є анти-напрямленість спінів електронів ( ); завдяки цьому виникає узагальнена електронна орбіталь з найбільшою електронною густиною у між’ядерному просторі, що забезпечує притягання позитивно заряджених ядер один до одного і супроводжується зменшенням загальної енергії системи.

 Для ковалентного зв’язку використовують такі характеристики: довжина і енергія зв’язку, напрямленість, насиченість, кратність, поляризація та поляризованісить тощо. Розглянемо деякі з них.
Для ковалентного зв’язку використовують такі характеристики: довжина і енергія зв’язку, напрямленість, насиченість, кратність, поляризація та поляризованісить тощо. Розглянемо деякі з них.
Довжина зв’язку – це між’ядерна відстань між хімічно сполученими атомами.
Енергія зв’язку – це міра міцності зв’язку, що показує кількість енергії, яку необхідно витратити для розриву зв’язку, або енергія, яка виділяється під час утворення зв’язку.
Довжину зв’язку вимірюють у нанометрах (1 нм = 10–9м). Зі збільшенням радіусів атомів, між якими виникає зв’язок, зростає його довжина. Одиницями вимірювання енергії зв’язку є кДж/моль або еВ. Енергія зв’язку характеризує його міцність: чим більше енергія зв’язку, тим він міцніший, зі збільшенням міцності зменшується довжина зв’язку.
Відповідно до методу ВЗ хімічний зв’язок між атомами зумовлюється перекриванням орбіталей, які, за винятком s-орбіталей, мають напрямленість у просторі.
Напрямленість ковалентного зв’язку – це таке розміщення електронної густини між атомами, яке забезпечує максимальне перекривання електронних орбіталей.
Оскільки електронні орбіталі мають різні форму і орієнтацію у просторі, то їхнє взаємне перекривання може реалізуватися різними способами. Залежно від цього розрізняють σ- і π- зв’язки (рис. І.4).
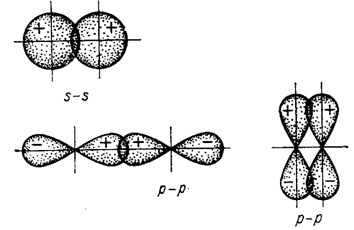
Рисунок І.4 – Схема перекривання електронних орбіталей при утворенні σ- і π-зв’язків
Сигма-зв’язок (σ-зв’язок) – це таке перекривання електронних орбіталей, при якому максимальна електронна густина концентрується вздовж вісі зв’язку – уявної лінії, що з’єднує два ядра.
Сигма-зв’язок може утворюватися за рахунок двох s-електронів, одного s- і одного р-електрона, двох р-електронів або за участю гібридних орбіталей. Ознакою сигма-зв’язку є наявність однієї області перекривання, зосередженої між ядрами атомів.
Пі-зв’язок (π-зв’язок) – це перекривання електронних орбіталей, при якому максимальна електронна густина концентрується з обох боків від вісі, що з’єднує ядра атомів.
Ще одна характеристика ковалентного зв’язку – кратність, яка визначається числом спільних електронних пар, що сполучають атоми. Ковалентний зв’язок за кратністю може бути одинарним (простим), подвійним і потрійним.
Зв’язок між двома атомами за допомогою однієї спільної електронної пари називається одинарним (простим), двох електронних пар – подвійним, трьох електронних пар – потрійним.
 Так, у молекулі етану С2Н6 між атомами Карбону існує одинарний зв’язок (С–С), в етилені С2Н4 – подвійний (С=С), в ацетилені С2Н2 – потрійний (С≡С).
Так, у молекулі етану С2Н6 між атомами Карбону існує одинарний зв’язок (С–С), в етилені С2Н4 – подвійний (С=С), в ацетилені С2Н2 – потрійний (С≡С).
Кратність зв’язку впливає на енергію: з підвищенням кратності зростає міцність зв’язку. Підвищення кратності приводить до зменшення між’ядерної відстані (довжини зв’язку) і збільшення енергії зв’язку.
Характеристика ковалентного зв’язку, яка описує різну локалізацію електронної густини у між’ядерному просторі, називається полярністю. Залежно від неї розрізняють полярний і неполярний ковалентні зв’язки.
Неполярним, або гомеополярним, називається такий зв’язок, при якому область перекривання електронних орбіталей розміщується симетрично відносно ядер сполучених атомів і однаковою мірою належить обом атомам.
Полярним, або гетерополярним, називається зв’язок, при якому область перекривання електронних орбіталей несиметрична і зміщена до одного з атомів.
Електронна густина зв’язку здатна зміщуватися під дією зовнішнього електричного поля, в тому числі й поля іншої молекули або йона.
Зміна полярності зв’язку молекули внаслідок зміщення електронної густини під дією зовнішнього електричного поля іншої молекули (або атома чи атомної групи) називається поляризованістю.
Поляризованість молекули залежить від напрямленості зовнішнього поля і від здатності електронних хмар деформуватися. З поляризованістю пов’язане виникнення в молекулі електронних ефектів – індуктивного і мезомерного, які впливають на реакційну здатність окремих ділянок молекули органічної сполуки і зумовлюють спеціфічні особливості взаємодії між органічними речовинами. Докладно електронні ефекти буде розглянуто пізніше.
І.3 Теорія будови органічних сполук
До середини XIXст. в органічній хімії був накопичений величезний фактичний матеріал, подальше вивчення якого гальмувалося відсутністю систематизуючої основи, спроможної пояснити і обґрунтувати особливості будови і властивостей органічних сполук. Тому почали з’являтися численні теорії, які зробили певний внесок у познання структури органічних сполук, однак не могли узагальнити всі відомості про їх властивості та реакційну здатність. Це вдалося здійснити О.М.Бутлерову (1861р.).
Сутність теорії будови органічних сполук Бутлерова можна стисло сформулювати за допомогою декількох основних положень.
-
Атоми в молекулах сполучені один із одним хімічними зв’язками відповідно до їх валентностей. Карбон практично в усіх органічних сполуках виявляє валентність IV, Гідроген – I, Оксиген – II.
-
Атоми розташовуються в молекулах не хаотично, а сполучені між собою в певній послідовності.
Порядок розміщення атомів у молекулі та характер хімічних зв’язків між ними називається хімічною будовою.
Склад органічних сполук виражають за допомогою структурних формул, в яких кожний ковалентний зв’язок позначається рисочкою. Наприклад, пропан, склад якого відповідає емпіричній брутто-формулі С3Н8, можна зобразити структурною формулою
Н Н Н
| | |
Н–С–С–С–Н
| | |
Н Н Н
Однак доцільніше і зручніше користуватися раціональними, тобто скороченими структурними формулами, в яких зазначають тільки зв’язки між атомами Карбону та між Карбоном і гетероатомом; зв’язки між атомами Карбону і Гідрогену не показують, а просто приписують символ Гідрогену поруч із символом Карбону, наприклад:
СН3–СН2–СН3, СН3–СН2–ОН.
Для тих органічних сполук, які мають розгалужену будову, інколи допускається така форма запису скороченої структурної формули, при якій бокові ланцюги записуються у дужках після сполученого з ними атома С, наприклад:
Раціональні структурні формули циклічних сполук зображують багатокутниками із відповідною кількістю кутів. Наприклад, структуру циклобутану С4Н8, замкнутий ланцюг якого містить чотири атома С, показують за допомогою квадрата:

Циклобутан
-
Властивості органічних сполук залежать не тільки від якісного і кількісного складу, але і від хімічної будови їх молекул.
Це положення найбільш наочно ілюструється при співставленні будови і властивостей ізомерів. Наприклад, відомі дві різні речовини складу С2Н6О з однаковою молекулярною масою (46а.о.м.), які відрізняються послідовністю сполучення атомів, фізичними і хімічними властивостями: етиловий спирт (рідина, Ткип=78оС) і диметиловий етер (газ, Ткип= –24оС), різна будова яких відображається структурними формулами:
СН3–СН2–ОН СН3–О–СН3
Етиловий спирт Диметиловий етер
-
В молекулах існує взаємний вплив атомів – як тих, що сполучені хімічними зв’язками безпосередньо один із одним, так і тих, що розділені проміжними атомами чи атомними групами.
Для прикладу розглянемо властивості атома Гідрогену в сполуках: метані СН4, воді Н2О, амоніаку NН3, Натрій гідроксиді NaОН. Умовно виділимо один атом Гідрогену в кожній сполуці: метан Н–СН3, вода Н–ОН, амоніак Н–NН2, Натрій гідроксид Н–ОNa. Якщо порівняти відношення виділених атомів Гідрогену до металів, кислот, лугів та представників інших класів, зрозуміло, що вони поводять себе в хімічних реакціях протилежним чином завдяки впливу сполучених з ними атомних груп.
-
Хімічна будова речовини встановлюється при вивченні її хімічних перетворень і, навпаки, на основі хімічної будови сполуки можна визначити її властивості.
Теорія будови органічних сполук Бутлерова стала логічно завершеною науковою основою органічної хімії. Вона не тільки пояснила вже відомі на той час факти, але і дозволила прогнозувати існування нових органічних речовин.
І.4 Класифікація органічних сполук
Надзвичайно велику кількість органічних сполук вдалося вивчити лише базуючись на їх класифікації, тобто на віднесенні кожної окремої речовини до певного класу чи типу за наявністю в її будові та властивостях характерних родових ознак, притаманних данній групі сполук.
При класифікації органічних сполук за основу беруть три найважливіші ознаки.
-
Будова карбонового скелету, за якою органічні сполуки поділяються на такі групи:
– ациклічні, або аліфатичні сполуки, ознакою яких є незамкнутий карбоновий ланцюг нормальної чи розгалуженої структури, наприклад, незамкнутий ланцюг із чотирьох атомів Карбону:
СН3–СН2–СН2–СН3 СН3–СН–СН3
Бутан ? Ізобутан
СН3
-
карбоциклічні сполуки, в яких карбоновий скелет утворює цикл (кільце), наприклад,
замкнутий ланцюг із шісти атомів Карбону:

Циклогексан Бензен
– гетероциклічні сполуки, які містять у циклі атоми не тільки Карбону, але й інших елементів (Нітрогену, Оксигену, Сульфуру), наприклад:

Пірол Фуран Тіофен
Ізохінолін Пурин
2. Характер зв’язків між атомами Карбону. Атоми Карбону здатні сполучатися між собою ковалентними зв’язками різної кратності, залежно від чого органічні сполуки поділяються на ряди:
– насичені, або граничні, в яких між атомами Карбону утворюються прості (одинарні) ковалентні σ-зв’язки С–С;
– ненасичені, у карбоноввих ланцюгах яких містяться подвійні (С=С) чи потрійні (С≡С) зв’язки, наприклад,
СН2=СН2 СН≡СН
Етилен Ацетилен
3. Наявність у молекулі певних функціональних груп.
Функціональна група – це атом чи група атомів, що має невуглеводневу природу і надає речовині певних властивостей, специфічних для даного класу органічних сполук.
Залежно від кількості та характеру функціональних груп органічні сполуки бувають такими:
– монофункціональні, до складу яких входить лише одна функціональна група, наприклад, метанол СН3–ОН;
– поліфукціональні, які містять декілька однакових функціональних груп, наприклад, гліцерин НО–СН2–СН(ОН) –СН2–ОН;
– гетерофукціональні, що мають у своєму складі дві чи більше різних функціональних груп, наприклад, амінокислота гліцин NН2–СН2–СООН.
У моно- і поліфункціональних сполуках природа функціональної групи в молекулі визначає належність речовини до конкретного класу. Наприклад, метанол, молекула якого містить одну гідроксильну групу ОН, належить до класу одноатомних спиртів, а поліфункціональний гліцерин, в якому таких груп три, – до багатоатомних спиртів.
У випадку гетерофункціональних сполук належність до певного класу визначається за природою характеристичної групи.
Характеристична група – це старша функціональна група, яка визначає належність даної гетерофункціональної сполуки до певного класу і відображається у назві речовини.
Наприклад, у молекулі гліцину міститься дві функціональні групи – карбоксильна СООН і аміно NH2, серед яких старшою є саме карбоксильна група, тому ця речовина належить до кислот. Зрозуміло, що в моно- чи поліфункціональних сполуках єдина функціональна група одночасно буде і характеристичною.
Перелік функціональних груп у порядку зменшення їх старшинства наведений у табл. І.4.
І.5 Номенклатура органічних сполук
Номенклатура – це сукупність термінів і система правил, відповідно до яких утворюються назви органічних сполук.
В органічній хімії найчастіше використовують дві номенклатури: систематичну і тривіальну.
Систематична номенклатура об’єднує назви органічних сполук, побудовані згідно із загальними правилами, застосування яких вимагає знайомства з певними поняттями: родопочаткова структура, замісник, вуглеводневий радикал тощо – їх буде розглянуто дещо піздніше.
Тривіальна номенклатура (від лат. trivialis – звичайний) – це історично складені назви, що вказують на джерела добування органічних речовин чи на яскраві риси їх властивостей, наприклад, сечовину вперше було виділено із сечі; у назвах глюкози, гліцину, гліцерину (від грецького корня glycys – солодкий), відображається спільна властивість цих сполук – солодкий смак. Тривіальна номенклатура особливо поширена серед природних речовин (амінокислот, вуглеводів, алкалоїдів, стероїдів, гормонів), однак користуватися нею доречно тільки при вивченні окремих сполук чи їх невеликих рядів.
А при розгляданні величезної сукупності різних класів органічних речовин необхідна об’єднувальна міжнародна система назв, якою стала номенклатура IUPAC (IUPAC – Міжнародний союз теоретичної та прикладної хімії). Слід відмітити, що назви для складних за структурою сполук відповідно до правил IUPAC іноді бувають надзвичайно громіздкими, тому для спрощення допускається використання тривіальної номенклатури.
Згідно із положеннями IUPAC для утворення назви розроблено вісім способів, але найвідомішими є чотири з них.
1. Замісниковий, в якому основою назви найчастіше є відповідний вуглеводень, а всі інші фрагменті у структурі молекули розглядаються як замісники атомів Гідрогену, наприклад:
С6Н5–Br СН3–NН2.
Бромбензен Амінометан
2. Сполучальний, згідно із яким назва складається з декількох рівноправних частин, наприклад:
С6Н5–С6Н5 СН2=СН–СН=СН2.
Дифеніл Дивініл
3. Радикально-функціональний, при якому до назви радикалу додається назва функціональної групи; цей варіант номенклатури IUPAC найчастіше вживають для спиртів, галогенопохідних і простих етерів; для деяких класів органічних сполук вона не годиться. Наприклад:
СН2=СН–Сl С2Н5–NН2.
Вінілхлорид Етиламін
4. Замінювальний – для сполук, що містять гетероатоми в аліфатичному чи циклічному ланцюгу. Перша частина назви вказує на гетероатом, який за цим способом IUPAC називають так: N – аза, O – окса, S – тіа, P – фосфа. А друга частина є назвою відповідного вуглеводню, якщо виходити з припущення, що сполука містить тільки атоми Карбону. Цифри перед назвою вказують на номери атомів Карбону, що були замінені гетероатомами, наприклад:
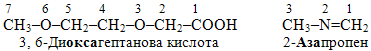 .
.
І.5.1 Замісникова номенклатура
Незважаючи на великий вибір способів IUPAC, найбільш зручною є замісникова номенклатура, для застосування якої необхідно знати назви родопочаткових структур і замісників.
Родопочаткова структура – це основа будови молекули, від корня назви якої утворюється назва сполуки.
Наприклад, етан СН3–СН3, що містить два атоми Карбону, є родопочатковою структурою для етанової кислоти СН3–СООН, ланцюг якої складається теж із двох атомів Карбону. Тобто етанову кислоту СН3–СООН можна розглядати як похідне етану
СН3–СН3, в якому два атоми Гідрогену в групі СН3 заміщені на атом О, а третій атом Гідрогену – на групу ОН. У свою чергу етанова кислота СН3–СООН є родопочатковою структурою для аміноетанової кислоти NH2–СН2–СООН, що утворюється шляхом заміщення атома Н в групі СН3 на функціональну аміногрупу NH2.
Родопочатковою структурою для аліфатичних (незамкнутих) вуглеводнів вважається головний карбоновий ланцюг, а для карбо- і гетероциклічних сполук – цикл. Назви більшості головних карбоноввих ланцюгів і циклів формуються на основі номенклатури алканів – насичених аліфатичних вуглеводнів (табл. І.2).
Таблиця І.2 – Назви алканів – насичених аліфатичних вуглеводнів нормальної (нерозгалуженої) будови відповідно до замісникової номенклатури UPAC
|
Склад |
Кількість атомів Карбону |
Назва |
|
СН4 |
1 |
Метан |
|
С2Н6 |
2 |
Етан |
|
С3Н8 |
3 |
Пропан |
|
С4Н10 |
4 |
Бутан |
|
С5Н12 |
5 |
Пентан |
|
С6Н14 |
6 |
Гексан |
|
С7Н16 |
7 |
Гептан |
|
С8Н18 |
8 |
Октан |
|
С9Н20 |
9 |
Нонан |
|
С4Н10 |
10 |
Декан |
|
С11Н24 |
11 |
Ундекан |
|
С12Н26 |
12 |
Додекан |
|
С20Н42 |
20 |
Ейкозан |
|
С30Н62 |
30 |
Триаконтан |
|
С40Н82 |
40 |
Тетраконтан |
|
С100Н202 |
100 |
Гектан |
При утворюванні назви ненасиченого вуглеводня, суфікс -ан замінюють на -ен (чи -єн) для сполук, що містять подвійний зв’язок, чи на -ин (-ін) для сполук з потрійним зв’язком: етан СН3–СН3, етен СН2=СН2, етин СН≡СН. У назвах сполук з більш довгим ланцюгом після суфікса (через дефіс) необхідно вказувати локант.
Локант – це номер атома Карбону, від якого починається кратний зв’язок, чи номер атома Карбону, сполученого із замісником.
Наприклад, положення подвійного зв’язку у вуглеводнях складу С4Н8 вказується цифрой, яка позначає номер атома Карбону, через дефіс до назви або після неї:
СН3–СН=СН–СН3,СН2=СН–СН2–СН3.
Бутен-2 Бутен-1
(2-Бутен) (1-Бутен)
При наявності двох чи декількох кратних зв’язків, застосовують множувальні частки.
Множувальними називаються частки (ди-, три-, тетра-, пента- та ін.), за допомогою яких позначають кількість кратних зв’язків чи замісників.
Використовуючи множувальні частки, необхідно приводити і відповідну кількість локантів:
СН2=СН–СН=СН2, СН2=СН–СН=СН–СН=СН–СН3.
Бутадієн-1,3 Гептатриєн-1,3,5
Обов’язково слід звернути увагу на те, що у родопочаткових назвах ненасичених вуглеводнів з декількома подвійними зв’язками остання буква зникає: не бутандієн, а батадієн.
У тому випадку, коли сполука містить одночасно зв’язки різної кратності, у назві спочатку зазначають подвійний, а потім – потрійний. При цьому, якщо обидва кратні зв’язки знаходяться на однакових відстанях від країв карбонового ланцюгу, атоми Карбону нумерують таким чином, щоб подвійний зв’язок одержав найменший номер. Якщо ж потріний зв’язок разташований ближче до краю, то нумерацію починають з найближчого до нього боку, але у назві все одно спочатку вказують подвійний зв’язок, наприклад:
![]()
Назви карбоциклічних вуглеводнів теж будуються на основі номенклатури аліфатичних вуглеводнів (з тією ж кількістю атомів Карбону в основному ланцюгу) при додаванні префікса цикло- та з урахуванням кратних зв’язків, наприклад:
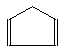

Циклобутан Циклопентадієн-1,3
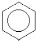
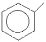
В ароматичних вуглеводнях, головним фрагментом молекул яких є бензенове кільце С6Н6, родопочатковою структурою вважається бензен (стара назва – бензол). Однак деякі представники ароматичних сполук мають настільки розповсюджені тривіальні назви, що вони вже офіційно закріплені правилами IUPAC, наприклад:
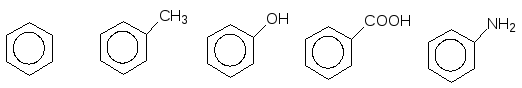
Бензен Толуен Фенол Бензойна Анілін
(бензол) кислота
(С6Н6) (С6Н5–СН3) (С6Н5–ОН) (С6Н5–СООН) (С6Н5–NН2)
Як видно із порівняння приведених структур та емпиричних формул, всі сполуки, крім самого бензену, мають бокові розгалуження, тобто містять замісники.
Замісник – це будь-який атом чи група атомів, які заміщують атом Гідрогену в родопочатковій структурі.
У якості замісника може виступати вуглеводневий радикал чи функціональна група.
Вуглеводневим радикалом називається залишок молекули вуглеводню, який містить на один чи декілька атомів Гідрогену менше, ніж у вихідній молекулі.
Залежно від кількості втрачених атомів Гідрогену, вуглеводневі радикали можуть бути одновалентними і двохвалентними.
Насичені одновалентні радикали мають загальну назву алкіли (позначаються Alk чи R). Назви одновалентних насичених радикалів утворюються шляхом заміни у назві вихідного алкана суфікса -ан на -ил (-іл), наприклад: радикали метил СН3–, єтил
СН3–СН2–, які походять відповідно від алканів метану СН4 і етану С2Н6.
Назви одновалентних радикалів, утворених із ненасичених аліфатичних вуглеводів, складаються із назви вихідного вуглеводню, до якого додається закічення -ил (-іл); при цьому вказують положення (локант) кратного звязку, а нумерацію починають від атома Карбону з вільною валентністю, наприклад:
![]()
Інколи для деяких з них використовують спеціальні назви: вініл, аліл (табл. І.3).
Загальна назва ароматичних радикалів – арили (позначаються символом Ar). Серед них найважливішими є феніл С6Н5–, бензил С6Н5–СН2– і три ізомери (залежно від положення метильної групи відносно атома Карбону з вільною валентністю: орто-, мета-, пара-) з назвою толіл, або толуїл СН3–С6Н4–:
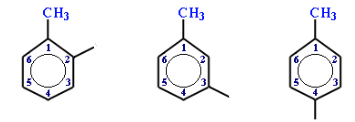
Орто-толіл Мета-толіл Пара-толіл
Для називання розгалужених радикалів вживаються додаткові префікси (ізо-, втор-, трет-), які визначаються особливостями будови атома Карбону з вільною валентністю: у випадку його сполучення лише з одним іншим атомом Карбону, він вважається первинним, з двома сусідніми атомами Карбону – вторинним, з трьома – третинним і з чотирма – четвертинним:
СН3–... ...–СН2–... ... –СН–... ... –С–...
Первинний Вторинний Третинний Четвертинний
У назвах двохвалентних вуглеводневих радикалів використовується додатковий суфікс -иліден (-іліден), якщо атоми Гідрогену відщеплені від одного і того ж атома Карбону (винятком є назва двохвалентного радикалу метилену СН=):
СН3–СН=, СН2=С=, С6Н5–СН=.
Етиліден Вініліден Бензиліден
Таблиця І.3 – Номенклатура одновалентних вуглеводневих радикалів
|
Вуглеводень |
Радикал |
Вуглеводень |
Радикал |
|
СН4 Метан |
СН3– Метил |
СН2=СН2 Етен |
СН2=СН–Етеніл (Вініл) |
|
С2Н6 Етан |
С2Н5– Етил (ацетилен) |
СН≡СН Етин (етилен) |
СН≡СН–Етиніл |
|
С3Н8 Пропан |
СН3–СН2–СН2– Пропіл СН3–СН–СН3 Ізопропил |
СН3–СН=СН2 Пропан |
СН3–СН=СН– Пропеніл СН2=СН–СН2– Аліл
|
|
С4Н10 Бутан |
СН3–(СН2)2–СН2– н-Бутил СН3–СН2–СН–СН3 Вторбутил СН3–СН–СН2– СН3 Ізобутил СН3 СН3–С– СН3 Третбутил |
С6Н6 Бензен |
С6Н5– Феніл |
Як вже згадувалося, до іншого типу замісників належать функціональні групи (табл. І.4), старша з яких є характеристичною і визначає клас органічної сполуки. Наявність функціональної групи відображається у назві за допомогою префіксів чи суфіксів. Деякі групи позначаються тільки префіксами (галогени, нітро, алкокси), але для більшості існують як префікси, так і суфікси. У гетерофункціональних сполуках лише одна група – старша – позначається суфіксом, а всі інші виносяться на початок назви у вигляді префіксів і перелічуються в алфавитному порядку.
Таблиця І.4 – Функціональні групи (у порядку зменшення старшості)
|
Група |
Назва групи |
Префікс |
Суфікс |
Клас сполук |
|
– (С)ООН* –СООН |
Карбоксильна |
- Карбокси- |
-ова кислота, -карбонова кислота |
Карбонові кислоти |
|
–SO3H |
Сульфогрупа |
Сульфо- |
-сульфонова кислота |
Сульфонові кислоти |
|
– (С)ООМ* –– (С)ООR*
|
Карбоксильна Естерна
|
|
-оат катіона М+ -оат** |
Солі карбонових кислот Естери (складні ефіри) |
|
– (С)Н=О* |
Карбонільна |
Оксо- |
-аль |
Альдегіди |
|
–СН=О |
Карбонільна |
Формил- |
-карбальдегід |
Альдегіди |
|
=(C)=O* =С=О |
Карбонільна |
Оксо- Оксо- |
-он - |
Кетони |
|
–OH |
Гідроксильна |
Гідрокси-*** |
-ол, -фенол |
Спирти, феноли |
|
–NH2 |
Аміногрупа |
Аміно- |
-амін |
Аміносполуки |
|
–NO2 |
Нітрогрупа |
Нітро- |
- |
Нітросполуки |
|
–OR |
Алкоксильна |
Алкокси- |
- |
Прості етери |
|
–F, –Cl, –Br, –I (–Hal) |
Галогени |
Фтор-, хлор-, Бром-, йод- |
- |
Галогенопохідні |
*Атом Карбону в дужках входить до складу головного ланцюгу, саме з нього розпочинається нумерація.
І.5.2 Утворення назв органічних сполук
згідно із замісниковою номенклатурою IUPAC
Отже, із основних положень замісникового способу номенклатури IUPAC випливає такий алгоритм у послідовності при складанні назв органічних сполук:
1. Встановлюють старшу характеристичну групу, оскільки саме вона зумовлює подальший вибір родопочаткової структури та її нумерацію. Наприклад, у сполуці, будова якої виражається структурною формулою
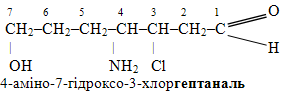
міститься чотири функціональні групи (–CH=O, –Cl, –NH2, –OH). Але старшою з них є карбонільна група –СН=О, тому нумерація ланцюгу починається з неї і саме вона буде вважатися основою назви родопочаткової структури: гептаналь.
2. Визначають родопочаткову структуру – головний аліфатичний ланцюг чи циклічну систему. Для обрання родопочаткової структури керуються такими критеріями (у порядку зменшення їх питомої ваги):
– найбільша кількість функціональних груп;
– найбільша кількість кратних зв’язків;
– найбільша довжина карбонового ланцюгу – саме кількість атомів Карбону є основою назви родопочаткової структури;
– найбільша кількість вуглеводневих радикалів.
Для карбоциклічних, гетероциклічних і ароматичних сполук родопочатковою структурою є цикл. Якщо сполука містить одночасно і відкритий ланцюг, і цикл, за родопочаткову структуру вважається та частина, в якій міститься старша характеристична група. Для прикладу порівняємо структуру двох сполук, до складу яких входить бензенове кільце:
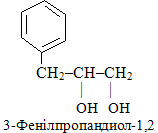
Однак у першому випадку родопочатковою структурою є боковий ланцюг, оскільки він містить три замісники (один фенільний радикал –С6Н5 і дві гідроксогрупи –ОН), а другому – цикл (бензенове кільце) з двома замісниками.
- 3. Нумерують атоми Карбону у складі родопочаткової структури, починаючи від старшої характеристичної групи. Якщо це правило не дозволяє однозначно вибрати напрямок нумерації, то ланцюг нумерують таким чином, щоб замісники чи кратні зв’язки одержали найменші номери.
- 4. В алфавитному порядку називають ті замісники, що позначаються префіксами, із попереднім вказанням їх локантів. При наявності декількох однакових замісників користуються множувальними префіксами (множувальні префікси не входять в алфавитну послідовність), а цифри-локанти повторюється стільки разів, скільки є замісників. Цифри записують перед префіксами і після суфіксів. При цьому цифри одна від одної розділяються комою, а цифра від букви – дефісом, наприклад: 2,2,3-триметил..., 3,4-дибром-1,1,1-трихлор....
- 5. Називають родопочаткову структуру, з урахуванням відповідних суфіксів (для позначення характеру і кратності зв’язків, а також природи старшої характеристичної групи) з множувальними частками; після суфіксів через дефіс записують цифри-локанти, кількість яких повинна відповідати множувальним часткам, наприклад: ...триєн-1,3,5-ін-8, ...триол-1,2,3.
Приклад 1. Перевірити правильність нумерації головного ланцюгу і назвати вуглеводень:
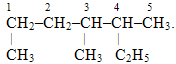
Розв’язок. Нумерація приведена невірно, оскільки порушені критерії, згідно із якими головним вважається найдовший карбоноввий ланцюг. Тому метильну групу СН3–, сполучену з першим атомом С, і етильну групу С2Н5–, сполучену із другим від краю атомом Карбону, необхідно розглядати не як радикал, а як продовження основного ланцюгу. Отже, наочніше переписати запропоновану структурну формулу, розвернувши її таким чином, щоб було видно самий довгий ланцюг, який містить сім атомів С (що відповідає гептану) і два метильні радикали. Тоді нумерація починається з того боку, до якого найближчим є один із радикалів:
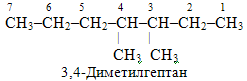
Приклад 2. Назвати сполуку, будова якої виражається структурною формулою
![]()
Розв’язок. Із структурної формули видно, що сполука належить до аліфатичних (оскільки має незамкнутий ланцюг), ненасичених (оскільки містить кратні зв’язки – подвійний і потрійний), розгалужених вуглеводнів. Головний ланцюг складається із пяти атомів Карбону, що відповідає алкану з назвою пентан. Однак наявність кратних звязків вимагає змінення суфікса -ан на -ен і додавання ще одного суфікса -ін для позначення відповідно подвійного і потрійного зв’язків: пентенін. Далі, щоб визначити локанти, необхідно пронумерувати головний ланцюг, починаючи від потрійного зв’язку (оскільки саме він знаходиться у крайньому положенні), і перед назвою головного ланцюгу поставити як префікс назву бокового радикалу:
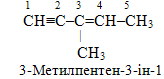
Приклад 3. Назвати сполуку, будова якої виражається структурною формулою
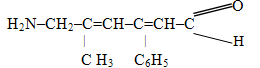
Розв’язок. Ця сполука містить чотири замісники, два з яких є вуглеводневими радикалами (алкільний метил –CH3 і арильний феніл –C6H5), а два інші (–NH2, –CH=O) – функціональними групами. Згідно із порядком старшинства характеристичною буде карбонільна група –СН=О, тому вона визначає належність сполуки до альдегідів і відображається у назві за допомогою суфікса -аль; з неї необхідно починати нумерацію атомів Карбону. Назву другої функціональної групи – аміногрупи NH2 – разом із назвами радикалів у алфавітному порядку слід віднести у префікс, зазначивши перед ними локантні номери атомів Карбону. Загальна кількість атомів Карбону в ланцюгу – 6 – відповідає насиченому аліфатичному вуглеводню з нерозгалуженою структурою – гексану, але наявність подвійних зв’язків вимагає заміни суфікса -ан на -єн. Однак, у випадку двох, трьох чи більше подвійних зв’язків формування назв має невеликий нюанс, який полягає в тому, що заміняють не весь суфікс -ан, а тільки останню букву (-н) у назві алкана з додаванням множувальної частки (для даної сполуки – -ди), за кількістю подвійних зв’язків. Отже, узагальнюючи всі міркування, одержимо кінцевий варіант назви запропонованої структури:
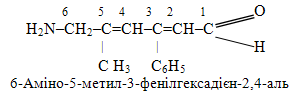
Приклад 4. Дати систематичні назви таким кислотам: а) сорбінова; б) щавлева; в) α-аланін; г) саліцилова; д) олеїнова; е) лимонна. Привести необхідні пояснення.
Розв’язок. а) Сорбінова кислота має нерозгалужений карбоноввий ланцюг із шісти атомів Карбону, карбосильну групу –СООН і два подвійні звязки: між атомами С-2 і С-3 та між С-4 і С-5. Кількість атомів С зумовлює корінь назви – гексан, карбоксильна група дає закінчення родопочаткової структури -ова кислота, наявність подвійних зв’язків зазначається суфіксом -єн, а їх кількість – множувальною часткою ди. Отже, систематична назва сорбінової кислоти буде такою:
6 5 4 3 2 1
СН3–СН=СН–СН=СН–СООН
Гексадієн-2,4-ова кислота
б) До складу щавлевої кислоти входять два атоми Карбону, але на відміну від оцтової (етанової) кислоти СН3СООН вона належить до двохосновних (дикарбонових) кислот. Отже, кожний атом С одночасно є і основою ланцюгу і центром характеристичної групи. Тому перед відповідним префіксом неохідно поставити множувальну частку ди:
НООС–СООН
Етандиова кислота
в) α-Аланін – це одноосновна аліфатична насичена амінокислота, молекула якої містить три атоми Карбону (один з них входить до складу старшої характеристичної групи СООН) і функціональну аміногрупу, сполучену з С-2:
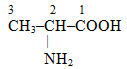
2-Амінопропанова кислота
г) В основі будови саліцилової кислоти лежить структура бензену, в якому один із атомів Гідрогену заміщений карбоксильною групою –СООН, а сусідній – гідроксильною групою –ОН. Оскільки старшою є карбоксильна група, то родопочатковою назвою буде бензойна кислота, а назва гідроксильної групи разом із локантом повинна виноситися у префікс:
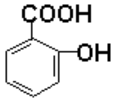
2-Гідроксибензойна кислота
д) Молекула олеїнової кислоти має нерозгалужений аліфатичний ланцюг із 18 атомів Карбону, що дає корінь родопочаткової назви – октадекан. Перший атом Карбону входить до складу старшої характеристичної групи –СООН, тому до родопочаткової назви додається закінчення -ова кислота. Карбоновий ланцюг містить один подвійний зв’язок між атомами С-9 і С-10, що визначає зміну суфіксу -ан у родопочатковій назві на -ен. Однак латинська граматика вимагає одночасну заміну звука к на ц: октадецен-9-ова кислота.
Олеїнова кислота належить до просторових цис-ізомерів. (Нагадаємо, що особливості структури просторових геометричних ізомерів зумовлюються типом sp2-гібридизації атомів С при подвійному зв’язку і виявляються в існуванні цис-ізомерів, в яких продовження ланцюгу від подвійного зв’язку розміщується по один бік відносно нього, і транс-ізомерів, в яких ланцюг розміщується по обидва боки відносно подвійного зв’язку). Для наголошення того, що атоми С-9 і С-10 не просто сполучені кратним зв’язком, але і визначають вид ізомерії, цифра-локант переноситься на початок назви. Підсумовуючи всі моменти, одержуємо систематичну назву олеїнової кислоти:
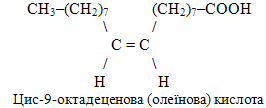
Для порівняння доречно привести структуру геометричного ізомеру олеїнової кислоти – формулу елаїдинової кислоти:
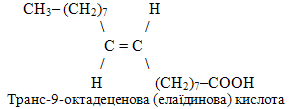
е) Лимонна кислота є прикладом триосновної (трикарбонової) органічної кислоти, молекула якої складається із шісти атомів С. Оскільки три атоми Карбону трьох карбоксильних груп не можуть входити до складу головного ланцюгу, одна група –СООН розглядається як замісник атома Н при С-3, тому її назва відображається за допомогою префіксу карбокси-. Крім того, лимонна кислота містить ще гідроксильну групу –ОН, назва якої теж виноситься у префікс:
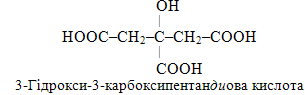
Поряд із розглянутим способом утворення назв багатоосновних (полікарбонових) кислот у рамках методів IUPAC користуються й іншим підходом. Із цих позицій атоми С всіх трьох карбоксильних груп до нумерації родопочаткової структури не включаються, а вважаються замісниками атомів Н у відповідному вуглеводні – у випадку лимонної кислоти таким вуглеводнем є пропан. Для кращого розуміння структурну формулу лимонної кислоти зручніше зобразити іншим чином. Тоді з урахуванням замісників повна назва лимонної кислоти буде такою:
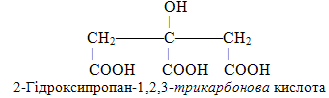
Приклад 5. Скласти структурні формули і дати назви таким похідним карбонових кислот: а) натрієва сіль оцтової кислоти; б) етиловий естер стеаринової кислоти; в) ангідрид пальмітинової кислоти; г) хлорангідрид мурашиної кислоти; д) амід масляної кислоти;
е) α-дихлорзаміщена пропіонова кислота.
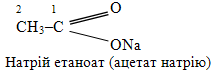
Розв’язок. а) Оцтова – це тривіальна назва насиченої одноосновної (монокарбонової) кислоти, молекула якої складається із двох атомів Карбону; при цьому один із атомів С входить до складу характеристичної карбоксильної групи –СООН. Загальна кількість атомів С визначає корінь (етан), а характеристична група – суфікс систематичної назви:

Натрієва сіль оцтової кислоти має тривіальну назву Натрій ацетат. За систематичною міжнародною номенклатурою IUPAC до кореня назви родопочаткової структури – етан – додають закінчення -оат, а метал називають першим:
б) Оскільки стеаринова кислота С17Н35СООН має нерозгалужений насичений ланцюг із 18 атомів Карбону і систематичну назву октадеканова, то родопочатковою назвою для солей та естерів (складних ефірів) буде октадеканоат, перед якою необхідно назвати відповідний радикал – етил:
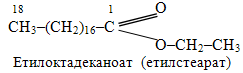
в) Ангідрид можно разглядати як сполучення ацильного і карбоксилатного залишків карбонової кислоти:
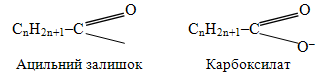
Для зображення структури ангідриду пальмітинової (гексадеканової) кислоти звичайно використовують дві типові форми, а називають як за систематичною, так і за тривіальною номенклатурою. При цьому назви походять від назв відповідних кислот при замінюванні слова кислота на ангідрид:
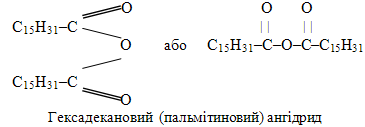
г) Систематичні назви галогенангідрідів утворюються від назв родопочаткової структури, яким вважається карбоноввий ланцюг відповідної кислоти, при додаванні до її кореня суфікса -оіл та назви галогеніду. Мурашина кислота за номенклатурою IUPAC називається метановою, а будь-який її галогенангідрид – метаноілгалогенідом. З іншого боку, виходячи із тривіальної назви ацилу мурашиної кислоти – форміл (від лат. formica - мурах), утворюються і тривіальні назви галогенангідрідів:
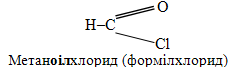
д) Масляна – це тривіальна назва бутанової кислоти СН3–СН2–СН2–СООН, а систематична назва її аміда склається із кореня родопочаткової назви бутан, до якого додають суфікс -оіламід. Ураховуючи, що тривіальні назви ацильного і карбоксилатного залишків масляної килоти – бутироіл і бутират, можна привести одночасно не тільки систематичну, але і тривіальну назву аміда масляної кислоти:
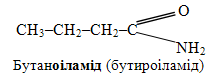
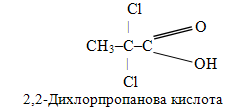
е) α-Дихлорзаміщена пропіонова кислота – це пропанова кислота, в якій два атоми Гідрогену при С-2 заміщені атомами Хлору:
Приклад 6. Навести структурні формули таких речовин: а) 4,4-диметилгексин-5-ол-1 і 2-гідрокси-4,4-диметилгексин-5-аль; б) гексадієн-3,5-нітрил і 2-цианогексадієн-3,5-ова кислота; в) 4-гідроксибензальдегід і 4-гідроксиметилфенол. Дати необхідні пояснення.
Розв’язок. а) Як видно із родопочаткових назв 4,4-диметилгексин-5-ол-1 і 2-гідрокси-4,4-диметилгексин-5-аль (корінь гекс), карбоноввий ланцюг обох сполук складається із шісти атомів Карбону і має потрійний зв’язок (суфікс -ин) між атомами С-5 і С-6:
![]()
Обидві сполуки містять замісники – метильні радикали (–СН3) поруч з атомом С-4:
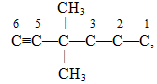
Але виходячи із додаткових суфіксів, які вказують на старші функціональні групи, перша сполука належить до спиртів (на що вказує суфікс -ол), а друга, незважаючи на наявність гідроксильної групи біля С-2, – до альдегідів (суфікс -аль). Тому в структурній формулі першой сполуки гідроксильну групу (–ОН) необхідно приписати до С-1, а в другій – до С-2. Крім того, з урахуванням чотиривалентого стану атомів Карбону слід дописати певну кількість атомів Гідрогену. Після цього одержимо:
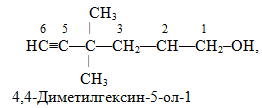
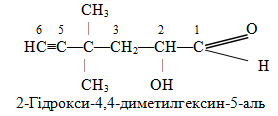
б) У сполуках гексадієн-3,5-нітрил і 2-цианогексадієн-3,5-ова кислота головні ланцюги теж складаються із шісти атомів С, але на відміну від попередніх вони мають по два подвійних зв’язки (-дієн):
![]()
Обидві сполуки містять цианогрупу (C≡N), однак у гексадієн-3,5-нітрилі вона є старшою, з якої починається нумерація ланцюгу і відображається у закінченні назви. А в 2-цианогексадієн-3,5-овій кислоті старшою є карбоксильна група –СООН, тому назва цианогрупи виноситься у префікс. Отже, структурні формули заданих сполук будуть такими:
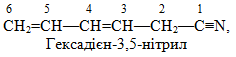
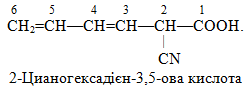
в) В основі наступних сполук (4-гідроксибензальдегід і 4-гідроксиметилфенол) лежить бензенове кільце, але як випливає із їх назв, родопочатковою структурою першої є бензальдегід, а другої – фенол:
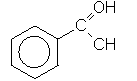
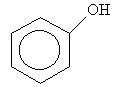
Бензальдегід Фенол
Нумерація атомів С бензенового кільця починається від старшої характеристичної групи, а в положенні С-4 містяться відповідні замісники (гідроксильна група –ОН і гідроксиметильна група НО–СН2–):
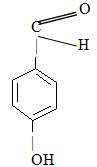
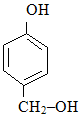
4-Гідроксибензальдегід 4-Гідроксиметилфенол
І.6 Загальна характеристика органічних реакцій
І.6.1 Особливості органічних реакцій
Реакції між органічними сполуками підкоряються практично тим же самим законам, що і реакції неорганічних речовин, однак у той же час мають деякі свої специфічні особливості.
-
В неорганічних реакціях, особливо тих, що протікають у розчинах чи розплавах, найчастіше беруть участь йони, а у взаємодії органічних сполук – переважно молекули; при цьому відбувається розрив старих ковалентних зв’язків і утворення нових.
-
Неорганічні реакції звичайно протікають швидко, інколи миттєво, а взаємодія між органічними сполуками відбувається повільно, іноді десятки годин; для їх успішного завершення практично завжди необхідно застосовувати жорсткі умови: підвищені температури, тиск, випромінювання, каталізатори.
-
Неорганічні реакції протікають до повного витрачання вихідних реагентів (необоротні процеси) чи до досягнення стану рівноваги (оборотні процеси), а органічні реакції рідко закінчуються високим виходом продуктів: у більшості випадків він не перебільшує 40-50%.
Вихід реакції – це частка реально одержаного продукту від теоретично розрахованого; виражається у частках одиниці чи у відсотках
mпракт νпракт Vпракт
η = --------- = --------; для газів η = ------.
mтеор νтеор Vтеор
-
В органічних реакціях як правило спостерігається паралельний перебіг декількох процесів, внаслідок чого одержують суміш ізомерів чи певну кількість побічних продуктів. З цієї причини не завжди доцільно користуватися стехіометричними рівняннями реакції, які виражають кількісні співвідношення між вихідними речовинами і продуктами. В органічній хімії частіше звертаються до схем, де зазначають вихідні речовини і основний продукт, без урахування коефіцієнтів, наприклад, схема нітрування толуолу:
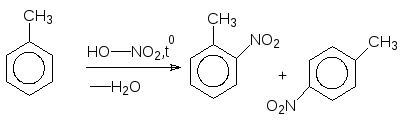
Толуол о-Нітротолуол n-Нітротолуол
Рівняння реакції для цього випадку можна записати так: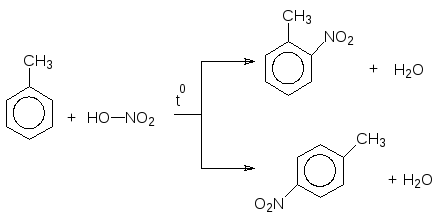
Необхідно уточнити, що в органічній хімії поряд із терміном „вихідні речовини” розповсюджені й інші: субстрат (основна речовина, реакційна здатність якої вивчається в даній реакції) і реагент – сполука, якою діють на субстрат для дослідження його властивостей. Однак при взаємодії рівноправних партнерів поняття субстрату і реагенту втрачають зміст.
І.6.2 Класифікація органічних реакцій
Класифікація органічних реакцій полягає у віднесенні кожної реакції за певною ознакою до якоїсь групи. Оскільки будь-яку реакцію можна охарактеризувати з різних позицій, то і класифікацій існує достатньо багато.
I. За типом розриву хімічних зв’язків у вихідних частинках органічні реакції поділяються на радикальні, йонні та узгоджені.
1. Радикальні – це процеси, що супроводжуються гомолізом (гомолітичним розривом зв’язків), при якому внаслідок руйнування спільної електронної пари кожна одержана частинка набуває по одному неспареному електрону, при цьому утворюються вільні радикали, формулу яких записують з крапкою:
A ׃ В → A∙ + ∙B
Вільним радикалом називається нейтральний атом чи частинка з неспареним електроном.
Гомоліз, як правило, викликається внаслідок опромінювання (hν,УФ) чи високої температури в газовій фазі. Прикладом радикальних реакцій є взаємодія алканів із хлором при опромінювання розсіяним світлом, пероксидне окиснення ліпідів, гідробромування алкенів у присутності Н2О2 (ефект Харраша), а прикладами радикальних реагентів – вільні радикали Cl∙, HO∙, H3C∙. Не слід плутати поняття вуглеводевий радикал, яке застосовується лише у номенклатурному контексті при утворенні назв органічних сполук, з поняттям вільний радикал, яке характеризує реально існуючий фізичний об’єкт.
2. Йонні реакціі – це процеси, що супроводжуються гетеролізом, або гетеролітичним розривом ковалентних зв’язків, при якому спільна електронна пара залишається на одній із частинок. Внаслідок гетероліза утворюються заряджені частинки: нуклеофіл і електрофіл.
Нуклеофіл – це частинка, що має вільну електронну пару на зовнішньому рівні, яку може надавати для утворення нового ковалентного зв’язку при взаємодії з тією ділянкою іншої молекули, де зосереджений ефективний позитивний заряд.
Нуклеофілом можуть виступати:
– негативно заряджені аніони (H–, OH–, CN–, RS–, HOO–, RO–, C5H5O–);
– електронейтральні молекули з неподіленими p- чи π-електронами (H2O׃, ׃NH3, ׃NH2R, ׃NHR2, CH2=CH2, CH≡CH, C6H6)
– карбаніони, тобто частинки, в яких неподілена електронна пара перебуває на атомі Карбону, наприклад, (CH3)2CH–. Карбаніони утворюються при гетеролітичному розриві полярних зв’язків за схемою:
![]()
Електрофіл – це частинка із дефіцитом електронної густини (за рахунок неповністю забудованих електронами валентних енергетичних рівнів), яка може надавати на утворення ковалентного зв’язку вільну орбіталь чи центр із зниженою електронною густиною.
Електрофілом можуть бути:
– позитивно заряджені катіони (Н+, Br+, NO2+);
– електронейтральні молекули з вільними валентними орбіталями (SO3, AlCl3, FeBr3);
-
карбкатіони – частинки з позитивним зарядом на атомі Карбону, наприклад, R3C+. Карбкатіони подібно до карбаніонам теж утворюються внаслідок гетеролізу:
![]() .
.
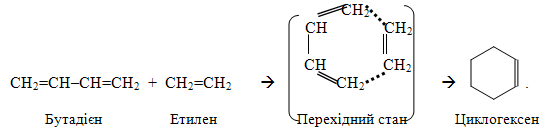
3. Узгоджені реакції (інколи їх називають ще молекулярними чи синхронними) – це процеси, при яких руйнування старих зв’язків і утворення нових відбувається одночасно без участі радикальних чи йонних частинок, тобто спостерігається узгоджений розрив зв’язків. Наприклад, дієновий синтез Дільса-Альдера, що протікає при нагріванні чи опромінюванні вихідних речовин:
II. За структурною ознакою, або за кінцевим результатом, органічні реакціі поділяються на такі типи.
1. Реакціі сполучення, які позначаються символом А (від англ. addition – додавання) і додатково поділяються на певні групи залежно від механізму реакції. Так, якщо реагентом є електрофільна частинка, то реакція проходить за механізмом нуклеофільного сполучення і позначається АЕ, тобто поруч із символом А записують індекс Е. У випадку нуклеофільної реагуючої частинки або вільного радикалу реакції відповідно проходять за механізмами нуклеофільно (АN) чи радикального (АR) сполучення. Реакції сполучення характерні для ненасичених вуглеводнів (AE, рідше – AR), альдегідів (AN) та інших класів органічних сполук. Наприклад:
![]()
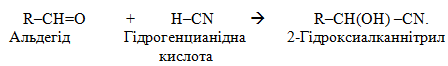
2. Реакції заміщення (символ S від англ. substitution – заміщення), які в свою чергу залежно від природи реагенту і механізму поділяються на такі види:
– радикальне заміщення SR
– електрофільне заміщення SE
– нуклеофільне заміщення SN
![]()
3. Реакції елімінування, або відщеплення (символ Е), при яких від молекули вихідної сполуки внаслідок розриву зв’язків відривається частинка, здатна до самостійного існування, наприклад:
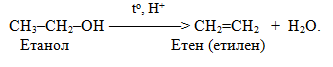
4. Реакції перегрупування, в ході яких відбувається перехід (міграція) окремих атомів чи атомних груп від одних ділянок молекули до інших, наприклад, кето-єнольне перегрупування Ельтекова:
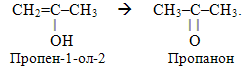
5. Реакції полімеризації, які можна вважати крайнім випадком реакцій сполучення, наприклад, полімеризація етилену:
![]()
III. За зміною валентного стану атомів Карбону розглядають такі процеси:
– реакції невалентних перетворень, при яких ступінь окиснення атомів Карбону не змінюється;
– окисно-відновні реакції, внаслідок яких відбувається змінення ступеня окиснення атомів Карбону. Ці реакції мають свої особливості порівняно з неорганічними ОВР. По-перше, розглядають атом Карбону тільки в тому фрагменті молекули, який піддається перетворенню, не звертаючи уваги на інші; по-друге, вважається, що сума ступенів окиснення всіх атомів у даному фрагменті дорівнює нулю; по-третє, атомам інших елементів приписують такі ступені окиснення: H+1, O–2, N–3, S–2, P–3. Складання рівнянь електронного балансу проводиться таким же чином, що і в неорганічних реакціях. Наприклад, окиснення стирену Калій перманганатом у сульфатнокислому середовищі:
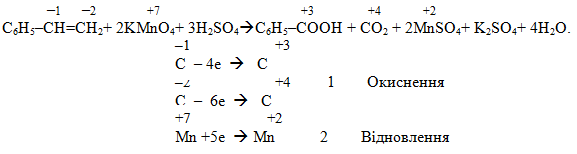
IV. За природою частинок, що приєднуються до органічної сполуки, чи відщеплюються від неї, бувають такі реакції:
– гідрування, тобото прєднання водню (+Н2), і зворотній процес – дегідрування, відщеплення водню (–Н2). Гідруванню, яке протікає у жорстких умовах у присутності каталізаторів, піддають ненасичені та циклічні вуглеводні, оксигенвмісні органічні речовини і нітросполукі – відносно них частіше вживають термін відновлення замість гідрування; наприклад:
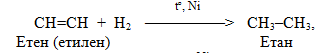
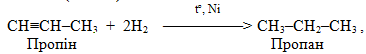
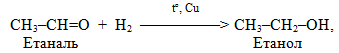
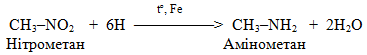
Для дегідрування використовуються тіх ж самі каталізатори:
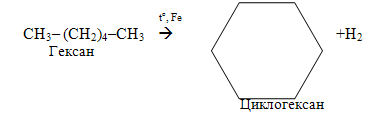
– галогенування (введеня в молекулу галогенів при взаємодії сполуки з Hal2, найчастіше, це взаємодія з Cl2 і Br2) і дегалогенування, тобто відщеплення галогенів (–Hal2);
– гідрогалогенування (+HHal, HCl, HBr,) і дегідрогалогенування (–HHal, HCl, HBr);
– гідратація (+H2O) і дегідратація (–H2O);
– сульфування (+SO3H);
– нітрування (+NO2);
– алкілування (+-CnH2n+1, у тому числі метилювання, тобто введення в молекулу метильної групи -СН3);
– ацилювання (введення R–CO– – ацильного залишку карбонової кислоти, який утворюється при відщепленні від неї гідроксильної групи , в тому числі, формілювання – введення залишку HCO– мурашиної (метанової) кислоти, ацетилювання – введення залишку CH3CO– оцтової (етанової) кислоти);
– карбонілювання – це найчастіше взаємодія алкенів із сумішшю СО+Н2, внаслідок чого утворюється альдегід чи кетон, і декарбонілювання – відщеплення оксогрупи СН=О від альдегідів;
– карбоксилювання – введення карбоксильної групи –СООН при взаємодії алкенів з сумішшю СО+Н2О чи СО2+Н2, і декарбоксилювання – відщеплення від карбонових кислот та їх похідних карбоксильної групи -СООН чи просто –СОО-.
Необхідно відмітити, що в органічній хімії зустрічаються складні реакції, які неможливо віднести до будь-якого з перелічених типів, наприклад, піроліз, крекінг, поліконденсація, електроліз карбоксилатів тощо. Однак більшість процесів піддається класифікації, що значно полегшує їх вивчення.