- 12.1 Eлектроліти і неелектроліти
- 12.2 Теорія електролітичної дисоціації
- 12.3 Теорія сильних електролітів
- 12.4 Приклади розв'язання типових задач
Ключові терміни:
cлабкі електроліти, eлектроліти середньої сили, активність, амфоліти, амфотерні гідроксиди, аніон, асоціація, гідроксокатіон, електроліти, електролітична дисоціація, закон розведення Оствальда, катіон, кислоти, кислотність основ, кислі солі, коефіцієнт активності, комплексні солі, константа дисоціації, константа нестійкості, луги, неелектроліти, основи, основні солі, основність кислот, позірний ступінь дисоціації, потенційні електроліти, провідники другого роду, провідники першого роду, реакція нейтралізації, рекомбінація, рівняння Дебая-Хюккеля, середні солі, сильні електроліти, солі, ступінь дисоціації, іон гідроксонію, іонна атмосфера, іонна сила розчину, іонізація, істинні електроліти12.1 Eлектроліти і неелектроліти
За електропровідністю та особливостями передачі електричного струму речовини поділяються на провідники першого роду (метали та їх сплави), в яких електрика переноситься за рахунок переміщення електронів, і провідники другого роду, де електрика передається за допомогою іонів (рис. 6.1).
Речовини, які не проводять електричний струм ні в розплавленому, ні в розчиненому стані, називаються неелектроліти.

Рисунок 6.1 – Неелектроліти, в яких відсутні переносники електричного струму (як приклад – дистильована Н2О і кристалічний NaCl) і провідники другого роду – електроліти, в яких переносниками електричних зарядів є іони (водний розчин натрій хлориду – за рахунок іонів Na+ і Cl–)
До неелектролітів належать речовини з ковалентними неполярними чи малополярними зв'язками, наприклад: сахароза, бензен, етанол.
Провідники другого роду – це електроліти.
Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Електроліти при розчиненні або розплавленні утворюють іони, рух яких і зумовлює їх електропровідність.
Електроліти та неелектроліти
Електропровідність розплавів
Залежно від механізму виникнення іонів електроліти умовно поділяються на дві групи: істинні та потенційні.
1. Істинні електроліти – це речовини з іонним зв'язком, які в розчинах і розплавах проводять електричний струм, а в твердому стані утворюють іонну кристалічну решітку і не мають електропровідності (рис. 6.1).
Істинні електроліти (або власне електроліти) – це речовини з іонною кристалічною решіткою, які розпадаються на іони при розплавленні або при розчиненні.
Виникнення іонів пояснюється послабленням, а потім і розривом хімічних зв'язків (що спричиняє руйнування кристалічної решітки) під дією полярних молекул розчинника чи нагрівання. У процесі розчинення у воді (або в інших полярних розчинниках) молекули розчинника витягують з кристалу у першу чергу менші за розмірами позитивно заряджені іони, що призводить до випадіння з решітки й негативно заряджених іонів. У розчині обидва види іонів піддаються гідратації (рис. 6.2).
Процес розпаду істинного електроліту на іони при розплавленні або під дією полярних молекул розчинника називається електролітична дисоціація.
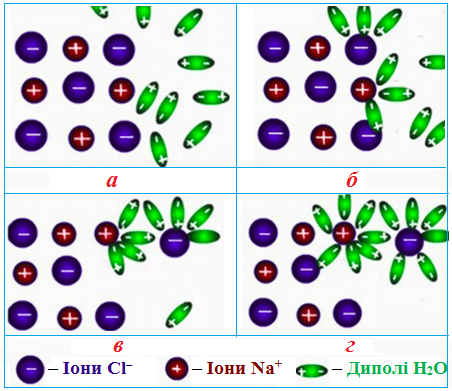
Рисунок 6.2 – Механізм утворення іонів при розчиненні у воді істинного електроліту (NaCl → Na+ + Cl–)
2. Потенційні електроліти, представниками яких є речовини з полярним ковалентним зв’язком: більшість кислот, деякі основи (водні розчини амоніаку NH3, гідразину N2H4, органічних амінів тощо).
Потенційні електроліти – це речовини з молекулярною кристалічною решіткою, які в твердому і розплавленому стані не проводять електричного струму, але здатні утворювати іони при взаємодії їх молекул з полярними розчинниками.
Механізм виникнення іонів у потенціальних електролітах має свої особливості (рис. 6.3). Внаслідок диполь-дипольної взаємодії між полярною молекулою електроліту і диполями розчинника, полярні ковалентні зв'язки спочатку поляризуються ще сильніше, а потім і розриваються, утворюючи іони, які поступово сольватуються.
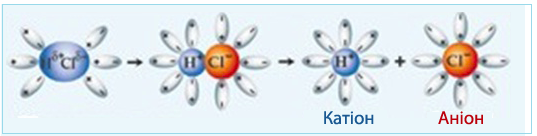
Рисунок 6.3 – Механізм утворення іонів внаслідок іонізації полярної молекули потенційного електроліту (НCl ↔ Н+ + Cl–) під впливом полярних молеул води і утворення гідратованих позитивно і негативно заряджених іонів (Н+ . nH2O і Cl– . nH2O)
Отже, відносно процесу утворення іонів потенційними електролітами термін «дисоціація» використовується умовно. По суті відбувається процес іонізації.
Іонізація – утворення іонів з полярної молекули потенційного електроліту під дією диполів розчинника.
Однак надалі для спрощення ми будемо вживати термін «дисоціація» відносно обох випадків.
12.2 Теорія електролітичної дисоціації
Сучасна теорія електролітичної дисоціації складалася на основі гіпотези Арреніуса про розщеплення молекул на іони, гідратної теорії Менделєєва, яка стверджувала, що розчинена речовина обов'язково вступає у хімічну взаємодію з молекулами розчинника, і робіт Каблукова, присвячених сольватації іонів.
Теорія електролітичної дисоціації містить декілька положень.
-
Розчинення електроліту супроводжується його розкладом на позитивно і негативно заряджені іони, які піддаються сольватації (або гідратації, якщо розчинником є вода). Для запису в загальному вигляді рівняння електролітичної дисоціації, яка відбуваєтьсяу водному розчині, символами Kty+і Anx– позначають відповідно позитивно заряджений іон (катіон) і негативно заряджений іон (аніон), а нижніми індексами x і y – кількості іонів кожного знака. З урахуванням процесу гідратації, внаслідок якої утворюється гідрат катіона з n молекулами води і гідрат аніона с m молекулами води, повне рівняння електролітичної дисоціації записують так:
KtxAny + (xn + ym)H2O [TEX]\leftrightarrow [/TEX] x[Kt(H2O)n]y+ + y[An(H2O)m]x–,
але частіше користуються спрощеним рівнянням дисоціації, не враховуючи процесу гідратації:
KtxAny [TEX]\leftrightarrow [/TEX] xKty+ + yAnx–.
При цьому сумарний заряд аніонів за абсолютною величиною дорівнює сумарному заряду катіонів, тому електроліт в цілому електронейтральний. Наприклад, при дисоціації алюміній сульфату сумарний заряд аніонів дорівнює –6n, а сумарний заряд катіонів – +6n:
[TEX]\rm \color{red}{n}Al_{\color{red}{2}}(SO_4)_{\color{blue}{3}}\rightarrow \color{red}{2n}Al^{\color{red}{3+}}+\color{blue}{3n}{SO_{4}}^{\color{blue}{2-}}[/TEX].
Властивості іонів відрізняються від властивостей атомів, з яких вони утворилися. Наприклад, металічний Na взаємодіє з водою із виділенням водню, а іони Na+ на воду не діють. Атоми Cl утворюють двохатомні молекули Cl2, які мають різкий запах та отруйні властивості, а іони Cl– зовсім нешкідливі і позбавлені запаху. У загальному випадку іони найчастіше мають повністю заповнений електронами зовнішній енергетичний рівень і тому перебувають у більш стійкому енергетичному стані, ніж нейтральні атоми. Вони можуть бути однозарядними і багатозарядними, складатися з одного атома (Na+, K+, Cl–, Br–) чи з декількох (SO42–, NO3–). Багато іонів мають забарвлення, наприклад, MnO4– рожево-фіолетового кольору, MnO42– – зеленого, CrO42– – жовтого, Cr2O72– – оранжевого.
Сольватовані іони перебувають у стані невпорядкованого теплового руху і переміщуються у розчині за різними напрямками.
-
При пропусканні електричного струму через розчин чи розплав електроліту іони набувають напрямленого руху: позитивно заряджені іони переміщуються до катода (саме тому вони одержали назву катіон), а негативно заряджені – до анода, тому вони називаються аніон (рис. 6.4).
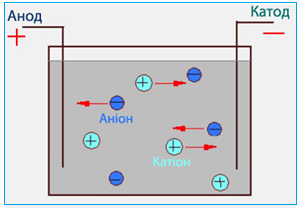
Рисунок 6.4 – Напрямок руху позитивно і негативно заряджених іонів в електричному полі
-
Електролітична іонізація є оборотним процесом, тобто одночасно з розпадом молекул на іони відбувається зворотний процес – сполучення іонів у молекули – так звана асоціація, або рекомбінація.
-
Електрична провідність і деякі інші загальні властивості розчинів електролітів пропорційні сумарній концентрації молекул та іонів.
-
Кількісними характеристиками процесу дисоціації є ступінь і константа дисоціації.
12.2.1 Ступінь дисоціації
Різні речовини дисоціюють неоднаково, але і одна і та сама сполука теж може піддаватися дисоціації по-різному залежно від умов. Для оцінювання та порівняння міри розкладу речовин на іони користуються величиною ступеня дисоціації.
Ступінь дисоціації [TEX]\alpha [/TEX] – це відношення концентрації електроліту, що розпався на іони, до його загальної концентрації в розчині:
де Сдис і Сзаг – відповідно молярна концентрація тієї частини електроліту, що розпався на іони, і його загальна концентрація, моль/л. Зважаючи на те, що молярна концентрація визначається відношенням кількості речовини [TEX]\nu[/TEX] до об’єму розчину [TEX](C=\nu/V)[/TEX], то за умов постійного об’єму рівняння (6.1) набуває вигляду:
Ступінь дисоціації виражається у частках одиниці або у відсотках.
Оскільки здатність речовин до дисоціації залежить від багатьох умов, то і ступінь дисоціації є функцією багатьох змінних, тому на величину α впливають різні чинники.
Чинники, що впливають на величину ступеня дисоціації [TEX]\alpha[/TEX].
1. Природа речовин. Залежно від здатності електроліту до дисоціації і, як наслідок, від величини ступеню дисоціації в розведених розчинах, всі електроліти поділяють на окремі групи: сильні, середньої сили і слабкі (рис. 6.5).

Рисунок 6.5 – Залежність сили електроліту від природи речовин
-
Сильні електроліти – це ті, для яких ступінь дисоціації у розведених розчинах має достатньо високі значення: [TEX]\alpha >0,3\;(\alpha >30\%)[/TEX], що пояснюється майже повною дисоціацією. З цієї причини в рівняннях дисоціації сильних електролітів замість знака оборотності [TEX](\leftrightarrow )[/TEX] ставлять стрілку [TEX](\rightarrow )[/TEX], наприклад: HI → Н+ + І–. До сильних електролітів належать: практично всі розчинні солі; сильні кислоти (H2SO4, HClО4, HNO3, HMnО4, HCl, HBr тощо); гідроксиди лужних (LiОН, NaОН, KОН, RbОН, CsОН) і лужноземельних металів (Ca(ОН)2, Sr(ОН)2, Ba(ОН)2); деякі комплексні основи, наприклад, [Cu(NH3)4](OH)2. Крім того, сильними електролітами є також розчини над осадами малорозчинних солей з іонною кристалічною решіткою. Незважаючи на погану розчинність таких солей, їх кристалічні решітки під дією диполів води піддаються частковому руйнуванню, внаслідок чого у розчині виникає невелика кількість іонів, які зумовлюють електричну провідність розчинів і, отже, належність цих солей до групи сильних електролітів. Однак при оцінюванні сили конкретного електроліту завжди слід пам'ятати, що його здатність розпадатися на іони реалізується виключно в розчинах чи розплавах, а у твердому стані електрична провідність відсутня і процес дисоціації не відбувається.
-
Електроліти середньої сили, для яких у розведених розчинах величина ступеня дисоціації коливається у межах 0,02<[TEX]\alpha[/TEX]<0,3 (або 2%<[TEX]\alpha[/TEX]<30%). Представниками цієї групи електролітів є: сульфітна H2SO3, ортофосфатна H3PO4, арсенатна H3AsO4, мурашина HCOOH кислоти, деякі солі та деякі основи, наприклад, гідроксид Ca(ОН)2, який в дуже розведених розчинах поводить себе як сильний електроліт, а при збільшенні концентрації – як електроліт середньої сили.
-
Слабкі електроліти, які навіть у розведених розчинах дисоціюють дуже незначною мірою та мають невисокі значення ступеня дисоціації ([TEX]\alpha[/TEX]< 0,02 або [TEX]\alpha[/TEX]< 2%). До них належать більшість органічних кислот і основ, слабкі неорганічні кислоти (Н2СО3, H2S, H2SiO3, H3AsO3, HCN, HF, HClO); основа NH3•H2O (або NH4ОН); деякі солі, особливо галогеніди, наприклад, Hg2Cl2, HgCl2, а також значна кількість комплексних іонів ([Fe(CN)6]4–, [Fe(CN)6]3–, [HgI4]2– та інші).
Іноді поділ електролітів залежно від їх здатності до дисоціації (у розчинах концентрації 0,01–0,1 н) обмежують тільки двома групами: сильні і слабкі електроліти (рис. 6.6).
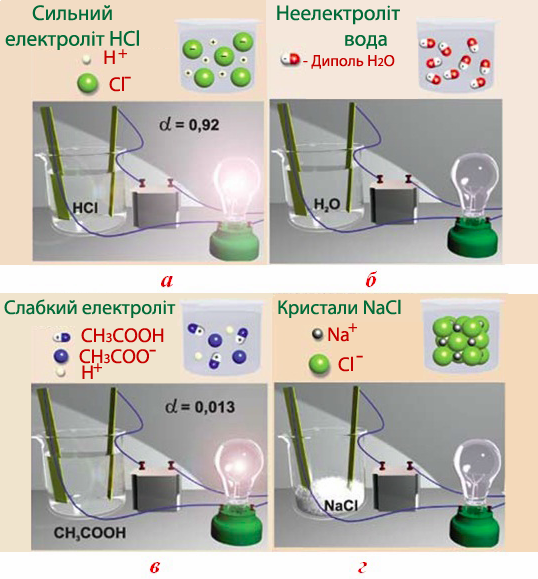
Рисунок 6.6 – Сильні та слабкі електроліти
2. Будова молекул речовин. Вплив молекулярної структури на силу електроліту наочно видно на прикладі однотипних молекул галогенідних кислот HF, HCl, HBr, HI. За умов однакових концентрацій і температур [TEX]\alpha[/TEX] зростає майже вдвічі при збільшенні довжини і зниженні енергії зв'язку, тобто при переході від HF до HI.
Для молекул більш складної будови процес протікає у декілька стадій, кожна з якої описується власним ступенем дисоціації. Наприклад, для сульфітної кислоти:
H2SO3 [TEX]\leftrightarrow [/TEX] H+ + HSO3– [TEX]\alpha_1[/TEX],
HSO3– [TEX]\leftrightarrow [/TEX] Н+ + SO32– [TEX]\alpha_2[/TEX],
причому [TEX]\alpha_1>>\alpha_2[/TEX], тому що відірвати іон Н+ від нейтральної молекули H2SO3 набагато легше, ніж від негативно зарядженого гідросульфіт-аніона HSO3–. Однак поведінка будь-якої кислоти характеризується концентрацією іонів Н+, тому якщо віднести загальну кількість іонів Н+ до кількості молекул Н2SO3 (яка була до початку дисоціації кислоти), можна одержати середнє значення [TEX]\alpha[/TEX].
3. Природа розчинника. Чим вища діелектрична стала [TEX]\varepsilon[/TEX] розчинника, тим сильніше розчинена в ньому речовина піддається дисоціації і тим більше значення [TEX]\alpha[/TEX]. Необхідно зауважити, що природа розчинника впливає і на утворення сольватів іонів: більш полярні молекули розчинника легше утворюють сольвати. Деякі іони навіть спроможні утворювати як би постійні сполуки з розчинником. Так, іон Гідрогену у воді ізольовано існувати не може і приєднується до молекули води, перетворюючись на іон гідроксонію Н3О+ (рис. 6.7):
Н+ + Н2О [TEX]\rightarrow [/TEX] H3O+.
Але в рівняннях реакції для спрощення записують звичайно тільки формулу Н+, маючи на увазі саме іон гідроксонію Н3О+.
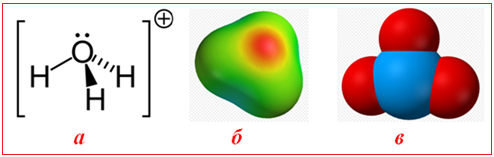
Рисунок 6.7 – Іон гідроксонію H3O+: а) просторова формула, в якій пунктиром показаний донорно-акцепторний зв'язок між іоном Н+ і атомом кисню молекули Н2О; б) модель, що зображує локалізацію підвищеної електронної густини (в центрі іона H3O+) і дефіциту негативного заряду (на периферії); в) кулькова модель
4. Температура. Ця залежність завжди однозначна: згідно з принципом Ле-Шательє ступінь дисоціації підвищується при нагріванні, оскільки розклад молекул на іони відбувається з поглинанням енергії.
Залежність дисоціації від температури
5. Концентрація розчину. У міру розведення розчину ступінь дисоціації зростає. Більш докладніше цю залежність ми розглянемо пізніше.
Залежність електропровідності розчинів від концентрації
12.2.2 Константа дисоціації
Оскільки електролітична дисоціація слабких електролітів є оборотним процесом, то вона підлягає закону діючих мас. Тому для слабкого електроліту KtxAny, електролітична дисоціація якого проходить за загальною схемою
Ktx Any [TEX]\leftrightarrow [/TEX] xKty++ yAnx–,
константа рівноваги матиме вигляд:
[TEX]k=\dfrac{[Kt^{y+}]^x\cdot [An^{x-}]^y}{[Kt_xAn_y]}[/TEX],
де [Kty+] і [Anx–] – молярні концентрації відповідно катіонів і аніонів, а [KtxAny] – молярна концентрація недисоційованих молекул. Нагадаємо, що за допомогою квадратних дужок позначають молярну концентрацію речовини у рівноважному стані.
Константа рівноваги К процесу дисоціації слабкого електроліту називається константа дисоціації Кдис і характеризує здатність речовини розпадатися у розчині на іони. Чим менше значення Кдис, тим слабкішим є електроліт, і навпаки, велике значення Кдис свідчить про його високу здатність до дисоціації.
Важливішою ознакою константи дисоціації є те, що вона не залежить від концентрації розчину, а залежить лише від природи розчиненої речовини і розчинника та від температури. Значення констант дисоціації наводяться у спеціальних довідниках.
Для електролітів, що дисоціюють у декілька стадій, кожному ступеню дисоціації відповідає своє значення константи дисоціації. Наприклад, для ортофосфорної кислоти:
[TEX]\rm H_3PO_4\leftrightarrow H^++H_2{PO_4}^-[/TEX] [TEX]\rm K_1=\frac{[H^+]\cdot[H_2{PO_4}^-]}{[H_3PO_4]}=7,1\cdot 10^{-3}[/TEX]
[TEX]\rm H_2{PO_4}^-\leftrightarrow H^++H{PO_4}^{2-}[/TEX] [TEX]\rm K_2=\frac{[H^+]\cdot[H{PO_4}^{2-}]}{[H_2{PO_4}^{-}]}=6,2\cdot 10^{-8}[/TEX]
[TEX]\rm H{PO_4}^{2-}\leftrightarrow H^++{PO_4}^{3-}[/TEX] [TEX]\rm K_3=\frac{[H^+]\cdot[{PO_4}^{3-}]}{[H{PO_4}^{2-}]}=5,0\cdot 10^{-13}[/TEX]
Для загального процесу:
Н3РО4 [TEX]\leftrightarrow [/TEX] 3Н+ + РО43–
сумарна константа дисоціації
[TEX]\rm K_{заг}=\dfrac{[H^+]^3\cdot [PO_4^{3-}]}{[H_3PO_4]}=2,2 \cdot 10^{-22}[/TEX]
дорівнює добутку ступінчастих констант дисоціації:
Кзаг = К1 · К2 · К3 = 7,1 · 10–3 · 6,2 · 10–8 · 5,0 · 10–13 = 2,2 · 10–22.
При цьому К1 > К2 > К3, оскільки відщеплення іона Н+ від нейтральної молекули відбувається значно легше, ніж від однозарядного негативного аніона Н2РО4–, тим більше, від двохзарядного негативного аніона НРО42–. З цього випливає, що Н3РО4 є значно сильнішою кислотою, ніж Н2РО4–, а Н2РО4–, у свою чергу, – ніж НРО42–.
Багатокислотні гідроксиди теж дисоціюють по стадіях, наприклад:
[TEX]\rm Pb(OH)_2\leftrightarrow PbOH^++{OH}^-[/TEX] [TEX]\rm K_1=\frac{[PbOH^+]\cdot[{OH}^-]}{[Pb(OH)_2]}=9,6\cdot 10^{-4}[/TEX]
[TEX]\rm PbOH^+\leftrightarrow Pb^{2+}+{OH}^-[/TEX] [TEX]\rm K_2=\frac{[Pb^{2+}]\cdot[{OH}^-]}{[PbOH^+]}=3,0\cdot 10^{-8}[/TEX]
Комплексні іони також піддаються ступінчастій дисоціації, однак частіше розглядають не постадійний, а сумарний процес і тому користуються загальним рівнянням дисоціації. Константа дисоціації комплексного іона називається константа нестійкості Кнест. Так, для комплексного іона [Fe(CN)6]3–, який є дуже слабким електролітом, сумарне рівняння дисоціації і загальна константа дисоціації мають вигляд:
[Fe(CN)6]3– [TEX]\leftrightarrow [/TEX] Fe3+ + 6CN–,
[TEX]\rm K_{нест}=\dfrac{[Fe^{3+}]\cdot [CN^-]^6}{[[Fe(CN)_6]^{3-}]}[/TEX].
12.2.3 Закон розведення Оствальда
Зв'язок між ступенем дисоціації, концентрацією розчину і константою електролітичної дисоціації встановлює закон розведення Оствальда. Для його виведення запишемо рівняння електролітичної дисоціації слабкого бінарного електроліту KtAn:
KtAn [TEX]\leftrightarrow [/TEX] Kt+ + An–.
Позначимо вихідну молярну концентрацію електроліту через С (моль/л), тоді концентрація тієї частини електроліту, яка піддалася дисоціації, з урахуванням ступеня дисоціації дорівнює [TEX]\alpha[/TEX] · C. Як видно з рівняння дисоціації, утворюються однакові кількості іонів обох знаків, причому, їх концентрації дорівнюють концентрації тієї частини електроліту, що розпався на іони:
[Kt+] = [An–] = [TEX]\alpha \cdot C[/TEX],
а концентрація недисоційованих молекул:
[KtAn] = [TEX]C-\alpha\cdot C=C(1-\alpha)[/TEX].
Підставляючи значення концентрацій у вираз константи дисоціації, одержимо:
- (3) [TEX]K_{дис}=\dfrac{[Kt^+][An^-]}{[KtAn]}=\dfrac{\alpha C\cdot \alpha C}{C(1-\alpha)}=\dfrac{\alpha^2C}{1-\alpha}[/TEX]
Рівнянням (6.3) математично виражений закон розведення Оствальда.
У тому випадку, коли електроліт дуже слабкий, ступінь дисоціації має невелике значення ([TEX]\alpha[/TEX] → 0), яким можна знехтувати, тоді знаменник у рівнянні (6.3) прирівнюється до одиниці (1 – [TEX]\alpha[/TEX]) ~ 1, а закон розведення набирає вигляду:
звідки ступінь дисоціації
Рівняння (6.5) дає можливість сформулювати закон розведення Оствальда: у міру розведення розчину (тобто при зменшенні концентрації електроліту) ступінь його електролітичної дисоціації підвищується.
12.2.4 Властивості кислот, основ і солей з позицій теорії електролітичної дисоціації
Кожний клас сполук має власні загальні властивості, зумовлені наявністю деякої спільної ознаки. Для кислот цією ознакою є іони Гідрогену, які входять до їх складу.
Кислоти – це електроліти, що при дисоціації в якості позитивно зарядженого іона утворюють виключно катіони Гідрогену Н+ (або, точніше, іони гідроксонію Н3О+).
Кількість іонів Гідрогену, що утворюються при дисоціації однієї молекули, визначає основність кислот. Так, HCl, HNO3, CH3COOH – одноосновні кислоти, Н2S, H2SO4, H2CO3 – двохосновні, Н3РО4, Н3AsO4 – триосновні. Кислоти з більшою основністю зустрічаються рідко.
Багатоосновні кислоти дисоціюють ступінчасто, наприклад, арсенатна кислота:
I ступінь: H3AsO4 [TEX]\leftrightarrow [/TEX] H+ + H2AsO4–,
II ступінь: Н2AsO4– [TEX]\leftrightarrow [/TEX] H+ + HАsO42–,
IІІ ступінь: HAsO42– [TEX]\leftrightarrow [/TEX] H+ + AsO43–.
В розглянутому прикладі не тільки молекула Н3AsО4 є кислотою, але й утворені внаслідок її дисоціації аніони Н2AsО4– і НAsO42– теж належать до кислот, оскільки при їх дисоціації теж вивільняються іони Н+, що є головною ознакою класу кислот.
З позицій теорії електролітичної дисоціації кислоти – це не тільки нейтральні молекули кислоти, але й негативно заряджені аніони, які спроможні дисоціювати з утворенням катіона Н+ (або Н3О+).
У сильних кислот, які піддаються повній дисоціації, кислотні властивості виявляються більшою мірою, у слабких – меншою. Силу кислоти можна визначити за її константою дисоціації: якщо Кдис > 10–2, кислоту відносять до сильних, якщо Кдис < 10–4 – до слабких. Ті кислоти, константи дисоціації яких лежать у межах 10–2 – 10–4, називають кислотами середньої сили.
Завдяки наявності іонів Н+ (точніше, гідратованих іонів у вигляді катіона гідроксонію Н3О+), у водних розчинах усі кислоти тою чи іншою мірою виявляють спільні властивості:
-
здатність реагувати з основами, тобто вступати в реакція нейтралізації, сутність якої виражається скороченою схемою: Н+ + ОН– → H2O;
-
взаємодія з металами, розташованими в електрохімічному ряді напруг до водню, внаслідок чого внаслідок реакції виділяється водень Н2;

-
кислий смак;
-
змінення забарвлення індикатору (рис. 6.8), наприклад, забарвлення нейтрального лакмусу в червоний колір.
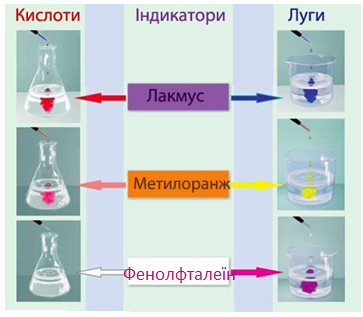
Рисунок 6.8 – Змінення забарвлення деяких індикаторів у розчинах кислот і лугів
Дія кислот на індикатори
Основи – це електроліти, що при дисоціації в якості негативно заряджених іонів утворюють виключно гідроксильні іони OH– (або гідроксид-аніони OH–).
Сила основ характеризується величиною константи дисоціації: чим вище значення Кдис, тим основа сильніша.
Розчинні у воді основи називаються луги. До них належать гідроксиди лужних (Li, Na, K, Rb, Cs) і лужноземельних металів (Са, Sr, Ва), а також хоч і слабка, але розчинна основа NH4OH.
Кількість гідроксильних груп, що входять до складу основи, визначає кислотність основ. Так, КОН – однокислотна основа, Fe(OH)2 – двохкислотна.
Багатокислотні основи дисоціюють ступінчасто:
І ступінь: Fe(OH)3 [TEX]\leftrightarrow [/TEX] Fe(OH)2+ + OH–,
ІІ ступінь: Fe(OH)2+ [TEX]\leftrightarrow [/TEX] FeOH2+ + OH–,
ІІІ ступінь: FeOH2+ [TEX]\leftrightarrow [/TEX] Fe3+ + OH–.
Гідроксильні групи надають основам певних спільних властивостей:
-
здатність взаємодіяти з кислотами (реакція нейтралізації);
-
відчуття милкості під час дотику;
-
змінення забарвлення індикатору (рис. 6.8), наприклад, нейтрального лакмусу – у синій колір, фенолфталеїну – в малиновий.
Дія лугів на індикатори
Особливе місце посідають амфотерні гідроксиди (або амфоліти) (рис. 6.9).
Амфотерні гідроксиди (амфоліти) – це слабкі електроліти, здатні залежно від умов виявляти властивості кислот або основ, тобто дисоціювати з утворенням катіонів Н+ чи аніонов ОН–:
хН+ + МеОхх– [TEX]\leftrightarrow [/TEX] Ме(ОН)х [TEX]\leftrightarrow [/TEX] Мех+ + хОН–.
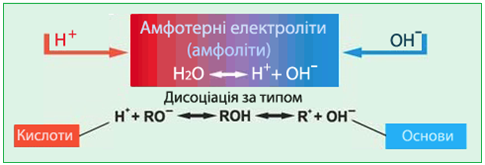
Рисунок 6.9 – Амфотерні основи
Наприклад, у випадку амфотерного цинк гідроксиду дисоціація у водних розчинах може відбуватися за типом кислоти з утворенням гідроксокомплексів чи за типом основи з утворенням аквакомплексів:
2Н+ + [Zn(ОH)4]2– [TEX]\leftrightarrow [/TEX] Zn(ОН)2 + 2H2O [TEX]\leftrightarrow [/TEX] [Zn(H2O)2]2+ + 2ОН–,
або у спрощеному вигляді:
2Н+ + ZnО22– [TEX]\leftrightarrow [/TEX] Zn(ОН)2 [TEX]\leftrightarrow [/TEX] Zn2+ + 2ОН–.
У розчині амфотерного електроліту встановлюється складна рівновага, в якій беруть участь продукти дисоціації як за типом кислоти, так і за типом основи. Як приклад амфотерних гідроксидів можна навести такі основи: Bе(ОН)2, Al(ОН)3, Cr(ОН)3, Pb(ОН)2, Pb(ОН)4 тощо.
Солі – це електроліти, при дисоціації яких утворюються катіони металів (або катіони NH4+ у випадку амонійних солей) і аніони кислотних залишків.
Треба мати на увазі, що це визначення стосується тільки однієї групи солей, які називаються середні солі, наприклад:
Na3PO4 [TEX]\rightarrow [/TEX] 3Na+ + PO43–.
Слід пам'ятати, що в рівняннях електролітичної дисоціації середніх солей, більшість яких належить до сильних електролітів і піддається повній дисоціації, замість знака оборотності ([TEX]\leftrightarrow [/TEX]) записують стрілку ([TEX]\rightarrow [/TEX]).
Середні солі можна розглядати як продукти повного заміщення атомів Н в кислоті HxAn атомами металу чи продукти повного заміщення гідроксильних груп в основі Me(OH)x (або NH4OH) аніонами – кислотними залишками (An).
Однак таке заміщення може відбуватися неповною мірою – тоді утворюються кислі солі або основні солі.
Кислі солі – це продукти неповного заміщення іонів Н+ в багатоосновній кислоті атомами металу. Так, якщо в триосновній фосфатній кислоті [TEX]\rm \color{blue} {H_3}PO_4[/TEX] замістити атомами металу тільки один чи два атоми Н, то можна отримати кислі солі: [TEX]\rm Na\color{blue}{H_2}PO_4[/TEX] – натрій дигідрогенфосфат і [TEX]\rm Na_2\color{blue} {H}PO_4[/TEX] – натрій гідрогенфосфат.
Кислі солі піддаються ступінчастій дисоціації. При цьому, відщеплення катіонів металу на початковій стадії найчастіше відбувається необоротно, а дисоціація кислого аніону проходить частково. Наприклад, схема дисоціації натрій гідрогенфосфату:
І ступінь: NaН2PO4 [TEX]\color{red} {\rightarrow }[/TEX] Na+ + Н2PO4–,
ІІ ступінь: Н2PO4– [TEX]\leftrightarrow [/TEX] H+ + HРO42–;
ІІІ ступінь: HРO42– [TEX]\leftrightarrow [/TEX] H+ + РO43–.
Інший приклад – дисоціація натрій дигідрогенфосфату:
І ступінь: Na2НPO4 [TEX]\color{red} {\rightarrow }[/TEX] 2Na+ + НPO42–,
ІІ ступінь: HРO42– [TEX]\leftrightarrow [/TEX] H+ + РO43–.
Основні солі – це продукти неповного заміщення груп ОН– в багатокислотних основах на кислотні залишки. Наприклад, заміщення аніоном (кислотним залишком) хлоридної кислоти HCl однієї чи двох гідроксильних груп у трикислотній основі [TEX]\rm Fe\color{blue} {(OH)_3}[/TEX] дає дві основні солі: [TEX]\rm Fe\color{blue} {(OH)_2}Cl[/TEX] – дигідроксиферум (ІІІ) хлорид і [TEX]\rm Fe\color{blue} {(OH)}Cl_2[/TEX] – гідроксиферум (ІІІ) хлорид.
Основні солі теж дисоціюють у декілька стадій. Причому перша стадія проходить, як правило, необоротно, внаслідок чого утворюється аніон кислотного залишку і гідроксокатіон – позитивно заряджений іон, до складу якого входять атом металу і одна чи декілька гідроксильних груп. На наступних стадіях гідроксокатіон теж піддається дисоціації, але вже частковій, наприклад, основна сіль дигідроксоферум (ІІІ) хлорид Fe(OH)2Cl дисоціює відповідно до схеми:
I ступінь: Fe(OH)2Cl [TEX]\color{red} {\rightarrow }[/TEX] Fe(OH)2+ + Cl–,
ІI ступінь: Fe(OH)2+ [TEX]\leftrightarrow [/TEX] Fe(OH)2+ + ОН–.
ІIІ ступінь: Fe(OH)2+ [TEX]\leftrightarrow [/TEX] Fe3+ + ОН–.
Комплексні солі при дисоціації дають комплексний іон (первинна дисоціація), який в свою чергу теж здатний дуже незначною мірою розкладатися на простіші частинки (вторинна дисоціація):
первинна дисоціація: К3[Fe(CN)6] [TEX]\color{red} {\rightarrow }[/TEX] 3K+ + [Fe(CN)6]3–,
вторинна дисоціація: [Fe(CN)6]3– [TEX]\leftrightarrow [/TEX] Fe3+ + 6CN–.
12.3 Теорія сильних електролітів
Принципова відмінність сильних електролітів від слабких полягає в тому, що рівновага дисоціації сильних електролітів повністю зміщена вправо:
[TEX]\rm H_2SO_4\rightarrow H^++HSO_4^-[/TEX],
тому константа рівноваги (дисоціації) є величиною невизначеною.
Сучасна теорія сильних електролітів, найбільший внесок в розробку якої вніс П.Дебай, враховує електростатичну взаємодію між іонами.
Головні ідеї теорії сильних електролітів можна звести до декількох основних положень.
1. Сильні електроліти у розведених розчинах (C < 0,01 моль/л) піддаються повному необоротному процесу дисоціації, тому не підлягають закону діючих мас і закону розведення Оствальда. Оскільки дисоціація відбувається повністю, то можна б було очікувати, що ступінь дисоціації дорівнюватиме одиниці: [TEX]\alpha=1[/TEX]. Проте при вивченні властивостей розчинів сильних електролітів значення [TEX]\alpha[/TEX] виявляється меншим.
Величина ступеня дисоціації сильних електролітів, встановлена експериментально, називається позірний ступінь дисоціації.
2. Відхилення в значенні ступеня дисоціації від одиниці [TEX](\alpha<1)[/TEX] описується моделлю іонних атмосфер. Суть її полягає в тому, що незважаючи на наявність навколо кожного іона сольватної (гідратної) оболонки, утвореної молекулами розчинника, сили електростатичній взаємодії між іонами примушують їх координуватися певним чином. Внаслідок цього навколо кожного іона виникає своєрідний шар – так звана іонна атмосфера, що складається з молекул розчинника та іонів протилежного знака. Заряд іонної атмосфери за абсолютною величиною протилежний за знаком заряду центрального іона. Будь-який іон, що входить до складу іонної атмосфери даного центрального іона, в свою чергу можна розглядати как інший центральний іон, що теж має власну іонну атмосферу. Тому можна навести таке спрощене визначення:
Іонна атмосфера – це шар однаково заряджених іонів, які оточують певний центральний іон, що має заряд протилежного знаку, і прагнуть наблизитися до нього внаслідок електростатичного притягання.
3. Електростатична взаємодія іонів протилежного знаку відбувається з урахуванням впливу іонної атмосфери. Внаслідок дії сил між’іонної взаємодії електроліт поводить себе так, начебто його концентрація менша за реальну. Тому поняття концентрація замінюється поняттям активної концентрації, або активності.
Активність [TEX]a[/TEX] – це ефективна концентрація, відповідно до якої електроліт виявляє себе в дії. Під терміном активність розуміють величину, при підстановці якої у термодинамічні рівняння обчислені значення збігаються з експериментально визначеними.
Активність, як і молярна концентрація, має розмірність [моль/л] і пов'язана з нею залежністю:
[TEX]a=f C[/TEX],
де f – коефіцієнт активності, безрозмірна величина, на яку необхідно помножити концентрацію, щоб дістати значення активності. Коефіцієнт активності формально ураховує всі види взаємодії між частинками, які призводять до відхилення від властивостей ідеального розчину. Тому коефіцієнт активності визначається експериментально.
Якщо f < 1, іони в розчині перебувають під взаємним впливом і тоді активна концентрація менше реальної ([TEX]a[/TEX]< C), а якщо f ~ 1, то взаємодія між іонами практично відсутня, а активність зрівнюється з концентрацією: [TEX]a[/TEX]~ C.
У дослідженнях і розрахунках, які не вимагають високої точності, можна застосовувати для обчислень замість коефіцієнта активності f позірний ступінь дисоціації [TEX]\alpha[/TEX]: [TEX]a=f\cdot C\sim \alpha \cdot C[/TEX]. Коефіцієнт активності зростає з підвищенням температури та зі зниженням концентрації розчину. Крім того, значення коефіцієнту активності залежить від природи електроліту та іонної сили розчину.
Іонна сила розчину [TEX]\mu[/TEX] – це величина, що визначається напівсумою добутку концентрацій всіх іонів у розчині на квадрат заряду кожного іона (Сі·zі2):
[TEX]\mu=\frac{1}{2}\left(C_1\cdot z_1^2+C_2\cdot z_2^2 +...+C_n\cdot z_n^2 \right)[/TEX].
Зокрема, для розведених водних розчинів сильних електролітів при С < 0,01 моль/л коефіцієнт активності пов'язаний з іонною силою залежністю
[TEX]\text{lg}f=-0,5117 \cdot z_1 \cdot z_2 \cdot \sqrt{\mu}[/TEX].
При більш високій концентрації зв'язок між коефіцієнтом активності f та іонною силою розчину μ визначається за допомогою рівняння Дебая-Хюккеля:
[TEX]\text{lg}f=-\frac{0,5117 \cdot z_1 \cdot z_2 \sqrt{\mu}}{1+\sqrt{\mu}}[/TEX].
Теорія сильних електролітів задовільно пояснює поведінку розведених розчинів, однак не може описати концентровані розчини. Іншою її вадою є те, що вона не враховує хімічні процеси, що відбуваються у розчинах сильних електролітів: явище сольватації і можливе змінення при цьому активності розчинника, який є компонентом розчину.
12.4 Приклади розв'язання типових задач
Приклад 6.1. Написати рівняння дисоціації основ: калій гідроксиду і ферум (ІІ) гідроксиду, скласти вираз константи дисоціації.
Розв'язок. Калій гідроксид – луг, належить до сильних електролітів і піддається у розчинах повній дисоціації:
KOH → K+ + OH–.
Оскільки КОН є сильним електролітом, він не підлягає закону діючих мас і константа дисоціації для нього не записується.
Ферум (ІІ) гідроксид, навпаки, належить до слабких електролітів, тому дисоціює по двом ступеням, кожному з яких відповідає свій вираз константи дисоціації:
[TEX]\rm Fe(OH)_2\leftrightarrow FeOH^++{OH}^-[/TEX] [TEX]\rm K_1=\frac{[FeOH^+]\cdot[{OH}^-]}{[Fe(OH)_2]}[/TEX]
[TEX]\rm FeOH^+\leftrightarrow Fe^{2+}+{OH}^-[/TEX] [TEX]\rm K_2=\frac{[Fe^{2+}]\cdot[{OH}^-]}{[FeOH^+]}[/TEX]
Приклад 6.2. Скласти рівняння електролітичної дисоціації для таких речовин: а) хлоридна кислота; б) ортоарсенатна кислота; в) купрум (ІІ) гідроксид; г) ферум (ІІІ) сульфат; д) кальцій дигідрогенортофосфат; е) гідроксокупрум (ІІ) хлорид.
Розв'язок. а) Хлоридна (соляна) кислота – сильний електроліт, тому в водних розчинах дисоціює повністю:
[TEX]\rm HCl\rightarrow H^{+}+Cl^-[/TEX].
б) Ортоарсенатна кислота – слабкий електроліт, триосновна кислота, тому дисоціація відбувається частково, у три стадії, причому ступені дисоціації для окремих стадій перебувають в залежності [TEX]\alpha_1>\alpha_2>\alpha_3[/TEX]. Рівняння дисоціації:
I ступінь: [TEX]\rm H_3AsO_4\leftrightarrow H^++H_2AsO^{^-}_4[/TEX],
II ступінь: [TEX]\rm H_2AsO^{^-}_4\leftrightarrow H^++H_2AsO^{2-}_4[/TEX],
III ступінь: [TEX]\rm HAsO^{2-}_4\leftrightarrow H^++AsO^{3-}_4[/TEX].
в) Купрум (ІІ) гідроксид – слабкий електроліт, піддається частковій дисоціації по двом ступеням:
I ступінь: [TEX]\rm Cu(OH)_2\leftrightarrow CuOH^++OH^{^-}[/TEX],
II ступінь: [TEX]\rm CuOH^{+}\leftrightarrow Cu^{2+}+OH^{^-}[/TEX].
г) Ферум (ІІІ) сульфат – сильний електроліт, добре розчинна сіль, тому дисоціює повністю, в одну стадію:
[TEX]\rm{Fe_2(SO_4)_3\rightarrow 2Fe^{3+}+3SO^{2-}_4}[/TEX].
д) Кальцій дигідрогенортофосфат – кисла сіль, яка по першому ступеню дисоціює повністю як сильний електроліт, а по другому і третьому – тільки частково, як слабкий електроліт:
I ступінь: [TEX]\rm{Ca(H_2PO_4)_2\rightarrow Ca^{2+}+2H_2PO^{^-}_4}[/TEX],
II ступінь: [TEX]\rm{H_2PO^{^-}_4\leftrightarrow H^++HPO^{^{2-}}_4}[/TEX],
III ступінь: [TEX]\rm{HPO^{^{2-}}_4\leftrightarrow H^++PO^{^{3-}}_4}[/TEX].
е) Гідроксокупрум (ІІ) хлорид – основна сіль, по першому ступеню дисоціює повністю, а по другому – частково:
I ступінь: [TEX]\rm{CuOHCl\rightarrow CuOH^++Cl^{^-}}[/TEX],
II ступінь: [TEX]\rm{CuOH^+\leftrightarrow Cu^{2+}+OH^{^-}}[/TEX].
Приклад 6.3. Обчислити ступінь дисоціації і концентрацію іонів Гідрогену в розчині оцтової кислоти концентрації 0,1М, якщо Кдис = 1,8 · 10–5.
Розв'язок. Оцтова кислота належить до слабких електролітів, дисоціює частково:
СН3СООН [TEX]\leftrightarrow [/TEX] СН3СОО– + Н+,
тому для неї концентрація іонів Гідрогену визначається добутком ступеня дисоціації на загальну концентрацію кислоти
[TEX]\rm{[H^+]=\alpha \cdot C_{CH_3COOH}}[/TEX],
а ступінь дисоціації обчислюється згідно із законом розведення Оствальда:
[TEX]\rm{\alpha =\sqrt{\dfrac{K}{C}}=\sqrt{\dfrac{1,8 \cdot 10^{-5}}{0,1}}=1,34\cdot 10^{-2}}[/TEX].
Тоді концентрація іонів Гідрогену:
[H+] = 1,34 · 10–2 · 0,1 = 1,34 · 10–3 моль/л.
Приклад 6.4. Скільки грамів KNO3 розпалося на іони в 500 мл розчину концентрації 0,8М, якщо [TEX]\alpha[/TEX] = 70 %?
Розв'язок. Калій нітрат належить до сильних електролітів, тому практично повністю розкладається на іони:
KNO3 → K+ + NO3–.
Як видно із завдання, об’єм розчину і концентрація дорівнюють:
Vрозч = 500 мл = 0,5 л, СМ = 0,8М = 0,8 моль/л.
Знайдемо загальну кількість речовини калій нітрату
[TEX]\nu[/TEX](KNO3)заг = СМ · Vрозч = 0,8 · 0,5 = 0,4 моль.
Ступінь дисоціації ([TEX]\alpha[/TEX] = 70%) показує, скільки відсотків загальної кількості піддається дисоціації, або в частках одиниці: [TEX]\alpha[/TEX] = 0,7.
Обчислимо кількість речовини і масу солі KNO3, що розпалася на іони, які позначимо відповідно [TEX]\nu[/TEX](KNO3)дис і m(KNO3)дис:
[TEX]\nu[/TEX](KNO3)дис = [TEX]\alpha[/TEX] · [TEX]\nu[/TEX](KNO3)заг = 0,7 · 0,4 = 0,28 моль.
m(KNO3)дис. = [TEX]\nu[/TEX](KNO3)дис · М(KNO3) = 0,28 · 101 = 28,3 г.
Приклад 6.5. У скільки разів збільшиться ступінь дисоціації амоній гідроксиду, якщо до 200 мл 0,1М розчину NH4OH додати 800 мл води?
Розв'язок. Амоній гідроксид – слабка основа, тому піддається лише частковій дисоціації:
NH4OH [TEX]\leftrightarrow [/TEX] NH4+ + OH–.
Об’єм і концентрація вихідного розчину дорівнюють:
Vвих.розч = 200 мл = 0,2 л, СМ = 0,1М = 0,1 моль/л.
Тоді кількість речовини у вихідному розчині:
[TEX]\nu[/TEX](NH4OH)вих = СМ · Vрозч = 0,2 · 0,1 = 0,02 моль.
Величину константи дисоціації основи NH4OH візьмемо з довідника:
K = 1,8 · 10–5.
Ступінь дисоціації обчислимо за законом розведення Оствальда:
[TEX]\alpha=\sqrt{\dfrac{K}{C}}=\sqrt{\dfrac{1,8\cdot 10^{-5}}{0,1}}=0,013[/TEX] (або 1,3%).
Після додавання до вихідного розчину 800 мл води, об’єм одержаного розчину складає:
Vрозч1 = Vвих.розч + V(Н2О) = 200 + 800 = 1000 мл =1 л,
а концентрація основи в одержаному розчині:
СМ(1) =[TEX]\nu[/TEX](NH4OH)вих / Vрозч = 0,02 / 1 = 0,02 моль/л.
Після розведення розчину ступінь дисоціації становить:
[TEX]\alpha_1=\sqrt{\dfrac{K}{C}}=\sqrt{\dfrac{1,8\cdot 10^{-5}}{0,02}}=0,09[/TEX] (або 9,0%).
Внаслідок додавання до вихідного розчину води ступінь дисоціації збільшився у
[TEX]\alpha_1/\alpha=9,0/1,3\approx 7[/TEX] разів.



