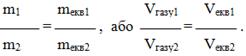1.1. Основні положення атомно-молекулярної теорії
Основні положення атомно-молекулярної теорії зводяться до наступних тез:
- Частинки речовин безперервно рухаються.
- Між частинками речовини діють сили взаємного притягання і відштовхування.
- Між складовими частинками речовини є відстані, розмір яких залежить від агрегатного стану.
- Молекули складаються із атомів.
- Молекули зберігаються при фізичних явищах і руйнуються під час хімічних реакцій.
- Атоми під час хімічних процесів залишаються неподільними, але перегруповуються, внаслідок чого утворюються нові сполуки.
- Різноманітність речовин у природі зумовлена різними сполученнями атомів, завдяки чому можуть виникати речовини з молекулярною або немолекулярною будовою.
1.2. Найважливіші поняття атомно-молекулярного вчення
1.2.1. Атом
Атом – це найменша, хімічно неподільна, електронейтральна частинка елемента, яка складається з позитивно зарядженого ядра і негативно зарядженої електронної оболонки.
Атом – це система, що складається з ядра і електронної оболонки. До складу атомного ядра, радіус якого у 10000 разів менший за радіус атома, входять ядерні частинки нуклони. Нуклони – це позитивно заряджені протони й електронейтральні нейтрони. Електронна оболонка, розмір якої визначає радіус усього атома, – це сукупність електронів. Позитивний заряд ядра визначається кількістю протонів і дорівнює за абсолютною величиною негативному заряду електронної оболонки, який відповідає кількості електронів. Завдяки рівності за абсолютною величиною зарядів протонів і електронів атом є електронейтральним.
Кількісними характеристиками атома є заряд ядра і відносна атомна маса Аr. Ці величини зазначаються у періодичній системі елементів. Заряд ядра атома дорівнює порядковому номеру елемента (закон Мозлі).
В хімії впроваджена позасистемна одиниця вимірювання, яка називається атомною одиницею маси (а.о.м.) і дорівнює одній дванадцятій маси атома ізотопу Карбону–12 (m(атома12С) = 19,92·10–27кг):
![]()
![]()
Відносна атомна маса Аr – це фізична величина, що дорівнює відношенню середньої маси атома елемента до однієї дванадцятої маси атома ізотопу Карбону-12.
![]()
У системі вимірювань СI Аr – безрозмірна величина. Позасистемна одиниця вимірювання відносної атомної маси – а.о.м.
Абсолютна маса атома дорівнює добутку його відносної атомної маси на 1/12 маси атома Карбону –12.
Атом є носієм хімічних властивостей елемента. Разом з цим у атомів одного елемента можуть бути різні маси внаслідок явища ізотопії, при якому атоми одного елемента містять однакову кількість протонів у ядрі, але різну кількість нейтронів, що позначається на їх масі.
1.2.2. Молекула
Молекула – це найменша частинка речовини, яка здатна самостійно існувати і має всі хімічні властивості речовини.
Як матеріальні частинки молекули мають розміри і маси. Молекула зберігає хімічні властивості речовини. Молекули складаються з атомів, які сполучені між собою хімічними зв’язками у певній послідовності і певним чином орієнтовані у просторі. Усі молекули однієї речовини мають однакові склад, масу, розміри, властивості. Молекули різних речовин відрізняються одна від одної за усіма переліченими параметрами. Між молекулами є відстані, що зумовлені агрегатним станом речовини. Молекули безперервно рухаються. При фізичних явищах молекули зберігаються, а при хімічних перетвореннях – руйнуються.
Кількісною характеристикою молекули є відносна молекулярна маса Мr.
Відносна молекулярна маса Мr – це відношення середньої маси молекули речовини до 1/12 маси атома Карбону –12.
У системі СІ відносна молекулярна маса Mr – безрозмірна величина, а позасистемною одиницею її вимірювання є а.о.м.
Відносна молекулярна маса Мr дорівнює сумі відносних атомних мас Аr елементів, що входять до складу молекули, з урахуванням кількості атомів кожного елемента.
1.2.3. Хімічний елемент
Нині відомо 118 хімічних елементів: з них 89 виявлені у природі, а інші отримані штучно під час ядерних реакцій.
Хімічний елемент – це вид атомів з однаковим зарядом ядра.
Кожний елемент має свою назву і символ. Хімічний символ означає, по-перше, назву елементу, по-друге, – один атом цього елементу при записах формул хімічних реакцій. Українські назви хімічних елементів вживаються як похідні від латинських назв.
Носієм властивостей хімічних елементів є атом. Основною кількісною характеристикою елемента є заряд ядра його атомів Z, що збігається з порядковим номером елемента.
Існують атоми різних елементів з однаковими Аr – так звані ізобари, наприклад, ![]() і
і ![]() . З іншого боку, як вже згадувалося, існують атоми одного й того самого елемента з різними Аr – ізотопи, наприклад
. З іншого боку, як вже згадувалося, існують атоми одного й того самого елемента з різними Аr – ізотопи, наприклад ![]() і
і ![]() .
.
1.2.4. Прості та складні сполуки
Простими називаються речовини, які складаються з атомів одного елемента, тобто прості речовини – це форма існування хімічного елемента у вільному стані.
Алотропія – це здатність елемента утворювати декілька простих, відмінних за властивостями речовин, які називаються алотропними модифікаціями, або алотропами.
Складними називаються речовини, що містять атоми різних елементів, тобто це форма існування елементів у зв’язаному стані. Складні речовини можуть мати як молекулярну будову, так і немолекулярну: іонну чи металічну.
1.2.5. Хімічні реакції, їх класифікація
Хімічні реакції – це явища, при яких відбуваються перетворення одних речовин в інші без змінювання складу атомних ядер.
Для умовного запису хімічних реакцій застосовують рівняння хімічних реакцій, де в лівій частині вказують формули вихідних речовин, а в правій – кінцевих продуктів, що утворилися у результаті реакції. Перед формулами всіх речовин проставляють необхідні стехіометричні коефіцієнти – числа, за допомогою яких зрівнюють кількості атомів кожного елемента зліва і справа. Отже, рівняння хімічної реакції – умовний запис, в якому за допомогою хімічних формул сполук і стехіометричних коефіцієнтів зазначають, склад і кількість вихідних речовин і продуктів реакції.
1.3. Основні закони хімії
1.3.1. Закон збереження маси і енергії
Закон збереження маси сформулюється так: Загальна маса речовин, що вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються внаслідок реакції.
Наслідок закону збереження маси: кількість атомів кожного елемента до і після реакції залишається постійною.
Закон збереження енергії: Енергія не виникає і не зникає безслідно, а лише перетворюється з однієї форми в іншу в еквівалентних кількостях.
Закони збереження маси і енергії відображають принцип незнищуваності матерії та руху: В ізольованій системі сума мас і енергій є постійною, тобто сумарні маса і енергії речовин, що вступають у реакцію, дорівнює сумарним масам і енергіям продуктів реакції.
1.3.2. Закон сталості складу
Сутність закону сталості складу полягає в тому, що кожна хімічна сполука незалежно від способу й умов її добування має певний масовий склад: Співвідношення між масами елементів, що входять до складу певної сполуки, є сталими і не залежать від способу одержання цієї сполуки.
Сполуки, які мають сталий склад і цілочисельне атомне співвідношення компонентів, називаються дальтонідами. Сполуки змінного складу, в яких стехіометричні співвідношення компонентів не відповідають цілим числам, називаються бертолідами.
Сучасне формулювання закону сталості складу: Якщо хімічна сполука має молекулярну структуру, то незалежно від умов добування склад її залишається сталим. Склад хімічної сполуки, що не має молекулярної структури, може змінюватися в певних межах залежно від умов добування.
1.3.3. Закон об’ємних співвідношень Гей-Люссака
Закон об'ємних співвідношень Гей-Люссака (1808р.): Співвідношення об’ємів газів, що вступають у реакцію та утворюються внаслідок неї, є співвідношенням простих цілих чисел, які є кратними стехіометричним коефіцієнтам, що стоять у рівнянні реакції перед формулами відповідних газів.
Цей закон справедливий тільки у тому випадку, коли об’єми газів виміряні за однакових умов.
1.3.4. Закон Авогадро
Закон Авогадро: У рівних об’ємах різних газів за однакових умов міститься однакова кількість молекул: N = const, якщо Р,V,T = const, де N – кількість молекул, Р – тиск, V – об’єм, T – температура.
Кількість речовини[TEX]\nu[/TEX](або n) – це фізична величина, що визначається числом частинок – структурних елементів речовини: молекул, атомів, йонів, іонних асоціатів тощо. Одиницею її вимірювання є [моль] – одна з основних одиниць системи CI. Моль – це кількість речовини, що містить стільки ж структурних елементів речовини, скільки атомів міститься в ізотопі Карбону-12 масою 12·10–3кг.
Число, що дорівнює 6,02·1023 мол–1, називається сталою Авогадро NA. Стала Авогадро вказує на число частинок – структурних елементів речовині, кількість якої становить 1моль і тому має розмірність моль–1. Отже, моль будь-яких структурних елементів – це така кількість речовини, що містить 6,02·1023 частинок.
Кількість речовини пов’язана з числом частинок N і сталою Авогадро NA залежністю:[TEX]\nu = N/N_A[/TEX]. Маса одного моля речовини називається молярною масою цієї речовини, вона позначається через М.
Молярна маса – це фізична величина, що визначається відношенням маси речовини до кількості речовини, яка їй відповідає:[TEX]M=m/{\nu}[/TEX] . Одиницею вимірювання молярної маси в системі СІ є [кг/моль], але в хімії частіше користуються позасистемною величиною [г/моль], або [г×моль–1].
Молярна маса М пов’язана з відносною молекулярною масою Mr і сталою Авогадро NA залежністю М = Мr×NA×1а.о.м.
Молярна маса чисельно дорівнює відносній молекулярній масі, але має зовсім інший фізичний зміст: Мr характеризує масу однієї молекули, а М – масу одного моля, тобто 6,02·1023 молекул.
I Наслідок закона Авогадро: Один моль будь-якого газа за нормальних умов (н.у.) займає об’єм приблизно 22,4 л (0,0224 м3). Ця величина називається молярним об’ємом, позначається VM і вимірюється у [л/моль] або [м3/моль].
Нормальними умовами вважаються:
Р = 101325Па (~105Па) = 1атм = 760мм рт.ст.,
Т = 273,15К, або t = 00С.
Молярний об’єм – це емпірично встановлена величина на основі співвідношень:

де[TEX]\rho[/TEX]– густина газу, [г/л], або [кг/м3].
II Наслідок закону Авогадро: Відношення густини одного газу до густини іншого газу за однакових умов дорівнює відношенню їх молярних мас М або відносних молекулярних мас Мr. Ця величина називається відносною густиною першого газу за другим і позначається буквою d або D:
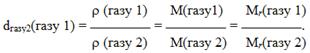
Звідки[TEX]\rho_1=\rho_2\cdot{d_2}[/TEX](газу1);[TEX]\rho_2= \rho_1/d_2[/TEX](газу1).
Відносна густина d – це величина безрозмірна, вона показує, наскільки один газ важче за другий.
1.3.5. Основні газові закони
Стан газу характеризується його об’ємом, тиском і температурою. Між цими величинами експериментально були встановлені такі закони:
-
Закон Бойля-Маріотта (ізотермічний) скорочено записується так:
- при Т = const
- Р1·V1 = Р2·V2, або Р·V = const;
-
Закон Гей-Люссака (ізобаричний)
- при Р = const
- V1/T1 = V2/T2, або V/T = const.
-
Закон Шарля (ізохоричний)
- при V = const
- Р1/T1 = Р2/T2, або Р/T = const.
Усі три закони можна поєднати в один універсальний газовий закон, що описується рівнянням Клапейрона:
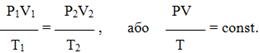
Залежність для одного моля газу була виведена Менделєєвим, тому називається рівнянням Менделєєва-Клапейрона. Воно містить постійну величину – універсальну газову сталу R:
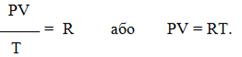
Для довільної кількості газу рівняння Менделєєва-Клапейрона має вигляд:
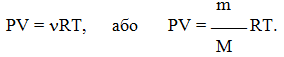
У системі вимірювання СІ універсальна газова стала дорівнює:
R = 8,314 кДж/моль·К.
1.3.6. Закон еквівалентів
Із закону сталості складу випливає, що елементи сполучаються один із одним у певних кількісних співвідношеннях, для характеристики яких було введено поняття еквівалента і еквівалентної маси.
Еквівалентом називається умовна чи реальна частинка речовини, яка може приєднувати, заміщати, віддавати або взаємодіяти іншим чином з одним йоном Гідрогену Н+ чи гідроксилу ОН– у кислотно-основних (або іоннообмінних) реакціях чи одному електрону в окисно-відновних реакціях. Еквівалент – це фактично одна частка молекули, яка відповідає одному атому Н чи йону Н+.
Число, що показує, яка частина молекули чи іншої частинки речовини відповідає еквіваленту, називається фактором еквівалентності fЕ.
Еквіваленти елемента і еквіваленти складної сполуки можуть бути різними, тому як наслідок, і фактор еквівалентності теж буде мати різні значення, для обчислення якого існують прості формули (табл. 1.3).
Таблиця 1.3 – Розрахунки фактора еквівалентності
| Частинка | Фактор еквівалентності | Приклади |
|---|---|---|
|
Елемент |
fЕ = 1/В, де В – валентність елемента |
fЕ(Р в P2O5) = 1/5; fЕ(С в СН4) = 1/4 |
|
Проста сполука |
fЕ = 1/ ч·В, де В – валентність елемента, ч – число атомів елемента (індекс у хімічній формулі) |
fЕ(H2) = 1/(2·1) = 1/2; fЕ(O2) = 1/(2·2) = 1/4; fЕ(Cl2) = 1/(2·1) = 1/2; fЕ(O3) = 1/(3·2) = 1/6 |
|
Оксид |
fЕ = 1/ч·В, де В – валентність елемента, ч – число атомів елемента (індекс у хімічній формулі) |
fЕ(Cr2O3) = 1/(2·3) = 1/6; fЕ(CrO) = 1/(1·2) = 1/2; fЕ(H2O) = 1/(2·1) = 1/2; fЕ(P2O5) = 1/(2·5) = 1/10 |
|
Кислота |
fЕ = 1/ч(H+), де ч(H+) – число атомів H, заміщених у ході реакції (основність кислоти) |
fЕ(H2SO4) = 1/1 = 1 (якщо основність у реакції дорівнює 1) або fЕ(H2SO4) = 1/2 (якщо основність дорівнює 2) |
|
Основа |
fЕ = 1/ч(ОН–), де ч(ОН–) – число гідроксильних груп ОН–, заміщених у ході реакції (кислотність основи) |
fЕ(Cu(OH)2) = 1/1 = 1 (якщо кислотність у реакції дорівнює 1) або fЕ(Cu(OH)2) = 1/2 (якщо кислотність у реакції дорівнює 2) |
|
Сіль |
fЕ = 1/ч(Me)·B(Me) = 1/ч(An)·В(An), де ч(Ме) – число атомів металу, заміщених у ході реакції, B(Me) – валентність металу, ч(An) – кількість заміщених кислотних залишків,·В(An) – валентність кислотного залишку (або його заряд за абсолютною величиною) |
FЕ(Cr2(SO4)3) = 1/(2·3) = 1/6 (розрахунок по металу) або fЕ(Cr2(SO4)3) = 1/(3·2) = 1/6 (розрахунок по кислотному залишку) |
|
Йон |
fЕ = 1/|z|, де |z| – заряд йона за абсолютною величиною |
fE(SO42–) = 1/2; fE(TiO22+) = 1/2 |
|
Частинка в окисно-відновній реакції |
fЕ = 1/ч(ē), де ч(ē) – число електронів, що беруть участь у процесі відновлення чи окиснення частинки |
Відновлення: Fe2+ + 2ē[TEX]\rightarrow[/TEX]Fe0 fE(Fe2+) =1/2; Окиснення: CrO42– + 8H+ + 3ē[TEX]\rightarrow[/TEX]Cr3+ + 4H2O fE(CrO42–) = 1/3 |
Як частинка еквівалент характеризується кількістю речовини еквіваленту nекв і молярною масою еквівалента mекв, яку частіше для скорочення називають просто еквівалентною масою. Еквівалентна маса елемента – це маса одного моль еквівалентів, яка дорівнює відношенню молярної маси елемента до його валентності в сполуці (або добутку фактора еквівалентності на молярну масу елемента).
Або: mекв.елемента = fE·Мелемента.
Якщо хоч одна речовина перебуває у газуватому стані, то зручніше використовувати поняття молярний об’єм еквівалента (чи просто – еквівалентний об’єм), який за розраховують за формулою
Vекв.газу = VМ /ч·В,
де VМ – молярний об’єм газу (VМ =22,4л/моль (н.у.), ч – кількість атомів елемента, В – валентність. Кількість еквівалентів nекв – це число еквівалентів, що визначається відношенням маси речовини до молярної маси еквівалента або відношенням об’єму газу до його еквівалентного об’єму:
nекв = mречовини/ mекв, nекв = Vгазу/ Vекв.газу.
Молярна маса еквівалента mекв (еквівалента маса) має розмірність [г/моль], молярний об’єм еквівалента Vекв.газу – [л/моль], а кількість еквівалентів – [моль], (інколи [моль-екв]).
Моль еквівалентів сполуки – це така її кількість, яка взаємодіє без залишку з 1 моль еквівалентів атомів водню або в загальному випадку – з 1 моль еквівалентів будь якої речовини.
Для визначення еквівалентної маси складної сполуки використовуються найпростіші правила.
- Еквівалентна маса оксиду дорівнює відношенню його молярної маси М до добутку валентності елемента В на число атомів елемента ч;
- Еквівалентна маса кислоти дорівнює відношенню її молярної маси М до основності – кількості атомів Н, здатних заміщуватися атомами металу;
- Еквівалентна маса основи дорівнює відношенню її молярної маси М до кислотності – кількості гідроксильних груп ОН, що заміщуються на кислотний залишок;
- Еквівалентна маса солі дорівнює відношенню її молярної маси М до добутку валентності В металу на кількість його атомів ч;
- Еквівалентна маса йона дорівнює відношенню його молярної маси М до абсолютної величини заряду z;
- Еквівалентна маса бінарної сполуки будь-якого елемента з гідрогеном дорівнює відношенню молярної маси цієї сполуки до валентності елемента;
- Еквівалентна маса складної речовини дорівнює сумі еквівалентних мас її складових частин.
Закон еквівалентів: Хімічні сполуки реагують між собою в еквівалентних співвідношеннях.
З цього випливає, що для двох будь-яких речовин однієї хімічної реакції (вихідних реагентів чи продуктів реакції) закон еквівалентів можна виразити так:
nекв1 = nекв2.
Ще один вираз закону еквівалентів:
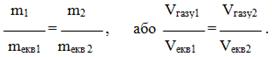
Однак при практичних розрахунках іноді зручніше користуватися іншим формулюванням закону еквівалентів: маси речовин (об’єми газів), що взаємодіють між собою, пропорційні їх еквівалентним масам (об’ємам газів):