- 2.1 Передумови створення сучасної моделі атома
- 2.2 Квантова теорія будови атома
- 2.3 Атомні орбіталі
- 2.4 Послідовність заповнення електронами енергетичних рівнів
- 2.5 Приклади розв’язання типових задач
Ключові терміни:
s-, p-, d-, f-електронами, Головне квантове число n, Друге правило Клечковського, Другий наслідок принципу Паулі, Другий постулат Бора, Електрон, Магнітне квантове число, Орбіталь, Орбітальне (азимутальне, побічне) квантове число, Орбітальне квантове число, Перше правило Клечковського, Перший наслідок принципу Паулі, Перший постулат Бора, Принцип Паулі, Радіоактивність, Спінове квантове число, Третій наслідок принципу Паулі, виродженими, граничні умови, електронну хмару, енергетичним рівнем, закон Мозлі, корпускулярно-хвильовим дуалізмом, орбіталлю, планетарна модель будови атома Резерфорда, правилом Гунда, принцип невизначеності Гейзенберга, принципом мінімуму енергії, рівнянням Де Бройля, хвильового рівняння Шредінгера2.1 Передумови створення сучасної моделі атома
Слово атом в буквальному перекладі означає «неподільний». Вперше цим терміном скористався давньогрецький вчений Демокрит (300 р. до н.е.), який вважав атоми найдрібнішими матеріальними частинками, що не піддаються зовнішній дії та ніколи не змінюються. Такі метафізичні уявлення щодо структури атома панували в хімії до кінця ХIXст., коли завдяки великої кількості видатних відкриттів стало зрозуміло, що атом – це надзвичайно складна система. Серед важливіших досліджень необхідно згадати досліди Фарадея (XIXст.) по вивченню процесів, які відбуваються при пропусканні електричного струму через рідини, відкриття Круксом невидимого катодного випромінювання у вакуумі, що викликає флюоресценцію (світіння) скла навколо анода, а також вивчення фотоефекту – явища, яке виникає при випромінюванні електронів у результаті прожарювання чи ультрафіолетового опромінювання металів. На базі цих досліджень Крукс (1880 р.) висловив гіпотезу про негативно заряджені частинки, які Томсона запропонував назвати електронами (1897 р.).
Електрон – це елементарна частинка, що має найменший з існуючих у природі негативних електричних зарядів (величиною 1,60×1–19Кл) і масу 9,1095·10–28г, яка приблизно у 1840 разів менша за масу атома Гідрогену.
Пізніше Рентген (1895 р.), вивчаючи катодне випромінювання, знайшов новий вид випромінювання – Х-промені (або рентгенівські промені), які мають велику проникну здатність і спричиняють флюоресценцію різних речовин. Ще однією важливою подією стало відкриття Беккерелем явища радіоактивності та досліди Кюрі і Склодовскої-Кюрі, які встановили, що солі урану і торію випромінюють особливі проміні, що викликають почорніння фотопластинок. Наслідком їх роботи було відкриття двох нових елементів – полонію та радію.
Радіоактивність – це здатність атомів деяких елементів самочинно випромінювати невидиме для ока проміння, що спричиняє почорніння фотопластинок, проходить через речовини та іонізує повітря.
Експериментальні докази складності природи атома поставили вчених перед необхідністю створити нову теорію – так звану модель атома. Найбільш відомими стали перші моделі будови атома, розроблені У.Томсоном-Кельвіном (1902р.), Х.Нагаока (1904р.), Дж.Томсоном (1904р.), Ленардом (1904р.). Однак запропоновані моделі атома були, головним чином, гіпотетичними і якісними, тобто не підтверджувалися суровими математичними викладками. І тільки Резерфорд спирався на точні експериментальні дані та розрахунки (рис.2.1).
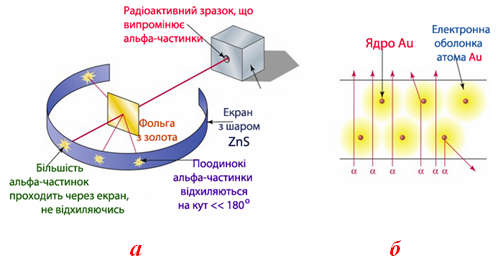
Рисунок 2.1 – Досліди Резерфорда: а) схема пристрою: у камері, закріпленій на поворотному диску, знаходиться радіоактивний зразок (препарат) Радію, який випромінює α-частинки (тобто ядра атомів Гелію), що бомбардують тонку золоту фольгу. Альфа-частинки, які пролітають через фольгу зі швидкістю 10000 км/с, відхиляються атомами Ауруму на різні кути і потрапляють на екран, вкритий шаром ZnS, викликаючи сцинтиляції (спалахи). Кількість спалахів реєструється за допомогою мікроскопу. Протягом досліду зафіксовано більше 100 тис. сцинтиляцій і встановлено, на кут 180о (в протилежному напрямку відносно α-випромінювання) відхиляється тільки одна частинка з 8 тис. Експеримент підтвердив, що α-частинки відштовхуються ядром Au відповідно до закону Кулона; б) модель руху α-частинок поблизу атомів Au
Результатом багаточислених експериментів стала планетарна модель будови атома Резерфорда (1911р.), яка базується на таких ствердженнях:
- атом – електронейтральна система, що складається з ядра і електронної оболонки;
- у центрі атома міститься позитивно заряджене ядро, радіус якого (~10–15 м) становить мізерну частину радіуса атома (~10–10м);
- увесь позитивний заряд і майже вся маса атома зосереджені в його ядрі;
- навколо ядра обертаються електрони, кількість яких дорівнює позитивному заряду ядра.
Досліди Резерфорда дали змогу встановити фундаментальну залежність, нині відому як закон Мозлі:
Заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі Д.И.Менделєєва.
Ядерна модель Резерфорда підтверджувалася великою кількістю експериментальних даних і була значним кроком вперед у процесі пізнання будови атома. Проте вона неспроможна була пояснити деякі відомі факти і мала певні недоліки. Головним з них була неможливість аргументувати стійкість атомів. Другий істотний недолік теорії Резерфорда – неможливість на її основі пояснити походження лінійчатих спектрів, оскільки при безперервному випромінюванні енергії електроном, як випливало з моделі Резерфорда, атомні спектри мали бути суцільними, але у дійсності вони лінійчаті.
На основі моделі Резерфорда, квантової теорії світла, лінійчатої природи спектрів, відкриття дискретних властивостей електрона в атомі Бор запропонував нову теорію (1913р.), згідно з якою електрон трактувався як матеріальна частинка, що має певні масу та заряд і рухається виключно по колових стаціонарних траєкторіях – так званих «дозволених орбітах» (рис.2.2а). Таке припущення випливає у першу чергу з аналізу атомних спектрів – їх лінійчатий характер свідчить про дискретність (переривчастість) значень внутрішньої енергії атома. Атом не спроможний безперервно змінювати свій енергетичний стан, монотонно поглинаючи чи випромінюючи енергію (інакше атомні спектри були б суцільними). Атом, який знаходиться у певному (основному) стані з певний запасом енергії Е1, при поглинанні нової порції енергії переходить в інший (збуджений) стан Е2, але через деякий час для повернення свого основного стану він мусить випромінити поглинену раніше енергію.
Основні положення теорії будови атома Бор сформулював у вигляді двох постулатів.
Електрон, не випромінюючи і не поглинаючи енергії, обертається навколо ядра тільки на певних колових орбітах, які називаються стаціонарними, або квантовими.
Радіус стаціонарної орбіти r і швидкість електрона на ній υ пов’язані квантовим співвідношенням Бора
- [TEX]m\upsilon = \frac{nh}{2\pi}[/TEX],(2.1)
- де m – маса електрона; n – номер орбіти; h – стала Планка (h = 6,626·10–34Дж·с).
Бор встановив, що радіуси орбіт співвідносяться як квадрати невеликих цілих чисел, що дорівнюють номерам орбіт (рис.2.2б):
r1 : r2 : r3 :...: rn = 12: 22 : 32 : ... : n2,
а швидкості електронів на квантових орбітах – обернено пропорційні номерам орбіт:
υ1 : υ2 : υ3 : ... υn ~ 1/1 :1/2 : 1/3 : ... : 1/n...
Електрон може переходити з однієї стаціонарної орбіти на іншу, при цьому поглинається або випромінюється квант електромагнітного випромінювання, енергія якого дорівнює різниці енергії атома в кінцевому і вихідному станах.
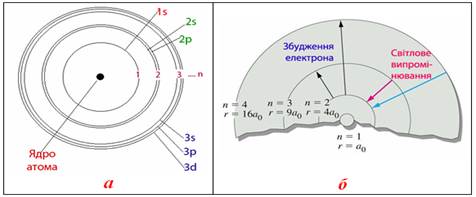
Рисунок 2.2 – Ілюстрація до постулатів Бора: а) «дозволені» борівські орбіти, що показують дискретність станів (рівнів енергії) електрона в атомі; б) перехід електрона на більш віддалені орбіти при збудженні – внаслідок поглинання кванта електромагнітного випромінювання; на схемі також показане співвідношення між розрахованими Бором радіусами орбіт: якщо радіус першої позначити через а0, то радіус другої дорівнюватиме 4а0, третьої – 9а0 і т.д.
З постулатів Бора випливає, що атоми існують, не змінюючи своєї енергії, тільки в певних стаціонарних станах, які утворюють дискретний ряд енергій Е1, Е2, ..., Еn, причому при поглинанні чи випромінюванні енергії атом стрибкоподібно переходить з одного стану в інший.
Енергія електрона, що обертається навколо ядра, залежить від радіуса орбіти. Найменшу енергію електрон має на найближчій до ядра орбіті. Стан, що відповідає найменшому запасу енергії атома, називається основним. Щоб перевести електрон на більш віддалену від ядра орбіту, необхідно подолати його притягання до позитивно зарядженого ядра, що потребує затрати енергії. Цей процес здійснюється завдяки поглинанню кванта енергії. Енергія атома при такому переході збільшується, і він переходить у збуджений стан. Повернення електрона у вихідний стан зумовлює зменшення енергії атома, оскільки вона виділяється у вигляді кванта електромагнітного випромінювання.
Енергія кванта, що випромінюється електроном при переході, дорівнює
- [TEX]E=E_2-E_1[/TEX],(2.2)
- де [TEX]E_1 i E_2[/TEX] - відповідно енергія електрона в основному стані і на більш віддаленій від ядра орбіті.
Бор встановив залежність, що дає змогу обчислити можливі частоти [TEX]\nu[/TEX] випромінювання, яке поглинає або випромінює атом, тобто обчислити спектри атомів:
- [TEX]\nu=\frac{E_2-E_1}{h}[/TEX].(2.3)
Теорія Бора про будову атома водню була досить наочною і зручною. Вона показала складність будови атома, наявність стаціонарних станів, при яких не відбувається випромінювання енергії, пояснила дискретну природу атомних спектрів як наслідок переходу електронів з однієї орбіти на іншу і обґрунтувала можливість існування невідомих на той час спектральних серій атома водню в ультрафіолетовій та інфрачервоній областях спектра. І саме головне – теорія Бора наочно доказала неможливість застосування законів класичної фізики до вивчення будови атома і тим самим дала потужний поштовх до розвитку квантової хімії.
Але поряд із успіхами теорія Бора мала і внутрішні суперечності. Так, з одного боку, за Бором електрон в атомі не підлягає законам класичної фізики, а з іншого – ці закони використовувалися для розрахунку сил, що діють на електрон в атомі.
Теорія Бора обмежувалася поясненням будови атома водню – одноелектронної системи, у якій діють лише кулонівські сили. Проте вона не могла бути використана для розрахунку багатоелектронних систем, у яких, крім кулонівських сил притягання, діють і електростатичні сили відштовхування між електронами.
Теорія Бора не змогла також висвітлити мультиплетність спектральних ліній та їх різну інтенсивність. Були нез’ясовані й деякі питання, пов’язані з постулатами. Наприклад, перехід електрона з однієї стаціонарної орбіти на іншу відбувається протягом певного часу. При цьому електрон перебуває у проміжному стані між кінцевою і вихідною орбітами, але такий стан забороняється самою теорією Бора.
Однак незважаючи на певні недоліки, теорія Бора стала поворотним етапом у розвитку сучасних уявлень про будову атома.
2.2 Квантова теорія будови атома
Перші моделі показали, що не можна автоматично поширювати закони природи, справедливі для великих тіл – об’єктів макросвіту, на малі об’єкти мікросвіту. Тому й виникла необхідність у розробленні нової фізичної теорії для описання властивостей і поведінки об’єктів мікросвіту. Цією теорією стала квантова, або хвильова механіка, яка ґрунтується на таких принципах:
- квантування енергії Планка;
- подвійності властивостей, або корпускулярно-хвильового дуалізму електрона (рівняння Де Бройля);
- невизначеності Гейзенберга;
- хвильового характеру руху електрона (рівняння Шредінгера).
При вивченні особливостей спектрів Планк (1900 р.) ввів деякі припущення. По-перше, фотон є неподільним і існує у вигляді дискретного утворення. По-друге, променева енергія випромінюється і поглинається не безперервно, а дискретно, тобто невеликими порціями (квантами), енергія яких залежить від частоти [TEX]\rm{\nu}[/TEX] згідно з рівнянням Планка:
- [TEX]E=h\cdot\nu[/TEX](2.4)
Припущення Планка блискуче підтвердилися після відкриття фотоефекту, який доводить, що фотон є носієм корпускулярних властивостей (корпускула – частинка), а його хвильова природа виявляється в явищах дифракції та інтерференції світла. Отже, фотон є одночасно і частинкою, і хвилею, тобто має двоїсті властивості (така ознака мікрооб’єктів називається корпускулярно-хвильовим дуалізмом). Але від звичайної частинки електрон відрізняється неможливістю точно визначити його положення, оскільки неможливо точно визначити положення хвилі, а від хвилі – неможливістю поділятися на частки.
Хвильові властивості фотона виражаються через зв’язок довжини хвилі [TEX]\lambda[/TEX] його електромагнітного коливання з частотою [TEX]\nu[/TEX] і швидкістю розповсюдження [TEX]c[/TEX]:
- [TEX]\lambda\cdot\nu=c[/TEX](2.5)
З рівнянь (2.4) і (2.5) випливає співвідношення, що пов’язує корпускулярну характеристику фотона Е з хвильовою [TEX]\lambda[/TEX]:
- [TEX]E=hc/\lambda[/TEX].(2.6)
Однак фотон з енергією Е має й деяку масу m згідно з рівнянням Ейнштейна (1905р.):
- [TEX]E=mc^2[/TEX].(2.7)
Із порівняння (2.6) і (2.7) випливає [TEX]mc^2=hc/\lambda[/TEX], звідки
- [TEX]\lambda=\frac{h}{mc}[/TEX].(2.8)
Добуток маси на швидкість називається кількістю руху, або імпульсом і позначається р = m·c. Тому
- [TEX]\lambda=\frac{h}{p}[/TEX].(2.9)
Рівняння (2.8) і (2.9) поєднують як хвильові, так і корпускулярні властивості фотона.
Розвиваючи це положення, Де Бройль (1924 р.) вперше висловив гіпотезу, що корпускулярно-хвильовий дуалізм виявляють не лише фотони, а й електрони, тому для них повинні виконуватися аналогічні співвідношення, які показують, що для електрона з масою m і швидкістю υ довжина хвилі, яку прийнято називати хвилею Де Бройля, дорівнює:
- [TEX]\lambda=\frac{h}{m\upsilon}[/TEX].(2.10)
Залежність (2.10) називається рівнянням Де Бройля і характеризує двоїсту, корпускулярно-хвильову природу електрона в атомі.
Згідно з гіпотезою Де Бройля корпускулярно-хвильовий дуалізм (двоїста природа) електрона доводиться наявністю одночасно як властивостей частинки (корпускули), що має деяку масу m і швидкість υ, так і властивостями хвилі з певною довжиною хвилі [TEX]\lambda[/TEX] та частотою коливань [TEX]\nu[/TEX]. Хвильові властивості електрона експериментально підтвердилися у дослідах по їх розсіюванні та дифракції (1927 р.), а в теперішній час вони широко застосовуються у наукових методах при дослідженні будови речовини, наприклад, в електронографії.
Порівняння хвильових ([TEX]\lambda[/TEX]) і корпускулярних (m) властивостей електрона
- [TEX]\lambda:m[/TEX]=0,332·10–9·9,1095·10–31 ~ 3,7·1020
свідчить про значну (~ 20 порядків) перевагу хвильових властивостей електрона над корпускулярними. На цьому базується принцип невизначеності Гейзенберга (1927 р.):
неможливо однозначно і точно встановити швидкість електрона і його координати.
Математичний вираз принципу невизначеності має вигляд
- [TEX]\Delta{x}\Delta{p}\geq \frac{h}{2\pi}[/TEX] або [TEX]\Delta{x}\Delta{\upsilon}\geq \frac{h}{2\pi{m}}[/TEX],(2.11)
- де [TEX]\Delta{x}, \Delta{p}, \Delta{\upsilon}[/TEX] - відповідно невизначеності в координаті, імпульсі та швидкості електрона.
Із (2.11) випливає: чим точніше визначена координата електрона (тобто чим менша похибка у визначенні координати [TEX]\Delta{x}[/TEX]), тим менш визначеною стає величина імпульсу (тобто похибка у визначенні імпульсу прямує до нескінченності) і навпаки: чим точніше визначений імпульс (швидкість), тим більш невизначене місцезнаходження електрона. Так, якщо при радіусі атома приблизно 10–10 м положення електрона визначено з точністю усього до 10–12 м, то невизначеність у швидкості складатиме 58000000 м/с (при швидкості електрона 2,187·106м/с).
Отже, квантова механіка відмовилася від уточнення місцезнаходження електрона, а замінила класичне поняття точних координат поняттям статистичної імовірності його знаходження у даному елементі об’єму dV навколо ядра.
Оскільки положення електрона в атомі невизначене, можна говорити лише про імовірність його перебування у тій чи іншій точці атомного простору, яку визначають за допомогою хвильового рівняння Шредінгера (1925 р.), що пов’язує потенціальну U і повну Е енергії електрона з хвильовою функцією «псі» [TEX]\psi[/TEX], яка деякою мірою аналогічна амплітуді тримірного хвильового процесу. Для одноелектронного атома водню рівняння Шредінгера має вигляд
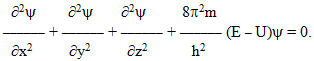
Допустимими розв’язками рівняння Шредінгера є функції [TEX]\psi_1, \psi_2, \psi_3,...,\psi_n[/TEX], кожній з яких відповідає своє значення енергії Е1, Е2, Е3,...Еn. Хвильова функція не має строгого фізичного змісту, вона лише сподобляється тримірній амплітуді коливання, але не ідентична їй. Однак фізичний зміст має добуток [TEX]\psi^2dV[/TEX], який характеризує імовірність локалізації електрона в елементарному об’ємі навколоядерного простору dV = dxdydz.
На хвильову функцію накладаються граничні умови, або вимоги регулярності – обмеження, що окреслюють область існування функції. Відповідно до граничних умов [TEX]\psi[/TEX] повинна бути:
- безперервною, оскільки стан квантової системи змінюється безперервно;
- кінцевою, тобто вона не повинна перетворюватися у ∞ ні при яких значеннях аргументу;
- однозначною, оскільки функція [TEX]\psi[/TEX], що є аналогією амплітуди імовірністи, повинна мати єдине значення у будь якій точці простору;
- граничною, тобто перетворюватися у нуль при нескінченно великому віддаленні від ядра;
- нормованою – це означає, що сумарна імовірність находження електрона в навколоядерному просторі повинна дорівнювати одиниці; математично умову нормування записують так: [TEX]\int\psi^2dV=1[/TEX].
Подібно до амплітуди будь-якого іншого процесу хвильова функція може набувати як додатних, так і від’ємних значень. Однак величина [TEX]\psi^2[/TEX] завжди додатна. При цьому вона має надзвичайну властивість: чим більше значення [TEX]\psi^2[/TEX] в якійсь точці простору, тим вища імовірність того, що електрон виявить там свою дію, тобто його існування може бути відкритим у фізичному процесі.
Хвильова функція [TEX]\psi[/TEX], що є розв'язком рівняння Шредінгера, називається орбіталлю.
Отже, орбіталь – це математичне поняття, але часто користуються й спрощеним тлумаченням:
Орбіталь – це простір навколо ядра, в якому найімовірніше перебування електрона.
Поряд з поняттям орбіталь в квантовій механіці застосовується уявлення про електронну хмару – модель стану електрона в атомі, густина відповідних ділянок якої пропорційна імовірності перебування там електрона. Тобто максимальна густина електронної хмари пропорційна квадрату хвильової функції [TEX]\psi^2[/TEX]. Одна з можливих форм електронної хмари показана на рис.2.3. Очевидно, чим міцніший зв’язок електрона з ядром, тим електронна хмара менша за розміром і компактніша за розподіленням енергії.
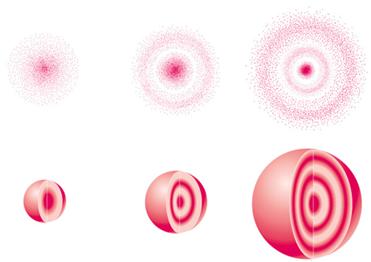
Рисунок 2.3 – Моделі електронних хмар для n = 1, 2 і 3
2.3 Атомні орбіталі
Згідно з квантово-механічною теорією атомну орбіталь і стан електрона в атомі можна однозначно описати за допомогою набору чотирьох квантових чисел – енергетичних характеристик стану електрона в атомі. Три з них (n – головне, l – орбітальне, m – магнітне) безпосередньо випливають з рівняння Шредінгера, яке описує електрон як хвилю у трьох координатах. Тому для повної характеристики енергетичного стану електрона в атомі потрібні три цілих числа. А четверте квантове число (s – спінове) характеризує деякі особливі магнітні властивості електрона.
Головне квантове число n. Згідно з умовами квантування електрон в атомі може перебувати лише у визначених квантових станах, які відповідають певним значенням його енергії зв’язку з ядром. Перехід електрона з одного квантового стану в інший пов’язаний з стрибкоподібною зміною енергії. Отже, основною характеристикою електрона, який обертається навколо ядра, є його енергія.
Головне квантове n визначає загальну енергію електрона в певному квантовому стані і характеризує радіус квантового рівня, тобто середню відстань від ядра до ділянки підвищеної електронної густини.
Для атома в нормальному (основному) стані головне квантове число n набуває усіх цілочислових значень від 1 до 7. Для атома у збудженому стані n може набувати значення від 1 до нескінченності.
Стан електрона, який характеризується певним значенням головного квантового числа, називається енергетичним рівнем електрона в атомі. Для позначення енергетичних рівнів, що відповідають різним значенням n, інколи використовують латинські літери (табл. 2.1). Зрозуміло, що значення головного квантового числа n=1 відповідає першому, найближчому до ядра, енергетичному рівню, n=2 – другому, значення n=∞ вказує на повне видалення електрона з атома.
Таблиця 2.1 – Позначення енергетичних рівнів у атомі
| Головне квантове число n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Позначення енергетичного рівня | K | L | M | N | O | P | Q |
Найменшу енергію електрон має при n=1; із зростанням n енергія електрона збільшується. При n=∞ припускають, що електрону надано енергію, достатню для його повного відділення від ядра (іонізація атома).
Головне квантове число визначає й розміри електронної хмари. Квантові переходи електрона в атомі відповідають стрибкоподібній зміні середнього розміру електронної хмари: зменшення енергії зв’язку електрона з ядром викликає збільшення об’єму хмари і навпаки.
Орбітальне квантове число l. Електрони, які перебувають на одному й тому самому енергетичному рівні, можуть відрізнятися один від одного за енергією зв’язку з ядром, тому що вони екрануються від ядра тими електронами, які розміщуються найближче від ядра. Отже, основні енергетичні рівні складаються з деякого числа енергетичних підрівнів.
Орбітальне (азимутальне, побічне) квантове число l характеризує енергію електрона на енергетичному підрівні і визначає форму електронної хмари.
Орбітальне квантове число може набувати n цілочислових значень від 0 до (n–1). Кожному значенню l відповідає певний підрівень, який позначається латинською буквою s, p, d, f тощо (табл 2.2).
Таблиця 2.2 – Позначення енергетичних підрівнів
| Орбітальне (побічне) квантове число l | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Позначення енергетичного підрівня | s | p | d | f | g | h |
Для певного значення головного квантового числа n орбітальне квантове число l може мати n значень, тобто кількість підрівнів на будь-якому енергетичному рівні дорівнює номеру цього рівня. Наприклад, на п’ятому енергетичному рівні (n=5) орбітальне квантове число може набувати п’ять значень від 0 до (5–1=4), тобто до (n–1). Отже, на п’ятому енергетичному рівні міститься п’ять підрівнів, кожний з яких має своє позначення: 5s (l=0), 5p (l=1), 5d (l=2), 5f (l=3) і 5g (l=4). Значення головного n і орбітального l квантових чисел для перших чотирьох енергетичних рівнів наведені в табл. 2.3.
Таблиця 2.3 – Значення головного і орбітального квантових чисел для чотирьох енергетичних рівнів
|
Головне квантове число n (і номер енергетичного рівня) |
Орбітальне квантове число l |
Позначення енергетичних підрівнів |
|---|---|---|
|
1 |
0 |
1s |
|
2 |
0, 1 |
2s 2p |
|
3 |
0, 1, 2 |
3s 3p 3d |
|
4 |
0, 1, 2, 3 |
4s 4p 4d 4f |
Відповідно до буквених позначень енергетичних підрівнів електрони, які перебувають на них, називаються s-, p-, d-, f-електронами, причому для кожного енергетичного рівня n найменшу енергію мають s-електрони, потім р-, d- i f-електрони.
Квантово-механічні розрахунки визначають форму орбіталей: s-орбіталі мають форму кулі (сферична симетрія), р-орбіталі – гантелі, d-орбіталі – пелюсткову форму, а f-орбіталі – більш складнішу форму (рис.2.4 – 2.6).
Стан електрона в атомі, що відповідає певним значенням n i l, записують так: спочатку цифрою позначають головне квантове число, а потім буквою – орбітальне. Наприклад, запис 3р позначає електрон, який характеризується головним квантовим числом n=3 (перебуває на третьому енергетичному рівні) і орбітальним квантовим числом l=1 (орбіталь має форму гантелі).
Магнітне квантове число m. З рівняння Шредінгера випливає, що орієнтація орбіталі в атомі не може бути довільною, оскільки рух електрона навколо ядра викликає появу магнітного поля. Тому стан електрона залежить від його орбітального магнітного моменту.
Магнітне квантове число m характеризує енергію електрона на орбіталі і визначає просторове розміщення орбіталі відносно магнітного поля, тобто величину проекції орбітального моменту кількості руху на напрямок магнітного поля.
Магнітне квантове число може набувати таких значень: 0, ±1, ±2,...±l. Число значень залежить від орбітального квантового числа l і дорівнює (2l+1) (табл. 2.4).
Таблиця 2.4 – Кількість орбіталей на енергетичному підрівні залежно від значень орбітального і магнітного квантових чисел
| Орбітальне квантове число l і позначення підрівня | Магнітне квантове число m | Кількість орбіталей на енергетичному підрівні при данному значенні l |
|---|---|---|
|
l = 0 (s-підрівень) |
0 |
1 |
|
l = 1 (p-підрівень) |
–1, 0, +1 |
3 |
|
l = 2 (d-підрівень) |
–2, –1, 0, +1, +2 |
5 |
|
l = 3 (f-підрівень) |
–3, –2, –1, 0, +1, +2, +3 |
7 |
Орбіталі з однаковою енергією називаються виродженими. Тому можна сказати, що р-стан вироджено три рази, d-стан – п’ять, а f-стан –сім разів.
На відміну від кулястої s-орбіталі, р-, d-, f-орбіталі мають певну орієнтацію у просторі (рис.2.4 – 2.6), за характером якої р-орбіталі позначають рх, ру, рz (витягнуті вздовж осей х,у,z). Напрям d-орбіталей не тільки збігається з осями координат, а й лежить між ними: d-орбіталі, орієнтовані вздовж осей координат, позначають dx2–dy2 (витягнуті вздовж осей х і у) і dz2 (витягнуті вздовж осі z); d-орбіталі, орієнтовані між осями координат, позначають dxy, dyz, dxz (розташовані на бісектрисах між осями координат).
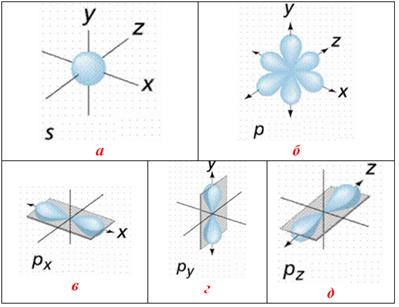
Рисунок 2.4 – Форми орбіталей: а) сферична s-орбіталь, яка має найменшу енергію і розміщується ближче до ядра порівняно з іншими орбіталями даного енергетичного рівня; б) три р-орбіталі: чим вище енергія р-електрона, тим скоріше він обертається навколо ядра і тим сильніше витягується область його існування, утворюючи гантелеподібну форму; в)px-орбіталь; г)py-орбіталь; д)px-орбіталь
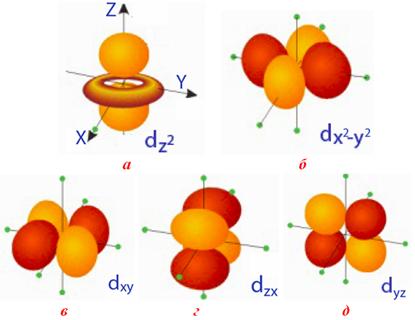
Рисунок 2.5 – П’ять d-орбіталей з однаковою енергією, але різної форми: чотири з них мають пелюсткову форму, а остання – форму гантелі, пропущеної крізь кільце. Напрямленість d-орбіталей може не тільки співпадати з осями координат, а й розміщуватися між ними: а) d-орбіталь, розташовану уздовж вісі z, позначають dz2; б) d-орбіталь, ориєнтовану уздовж осей x і y, позначають dx2–dy2; в, г, д) три d-орбітали, витягнуті між осями координат, позначають dxy, dyz і dxz
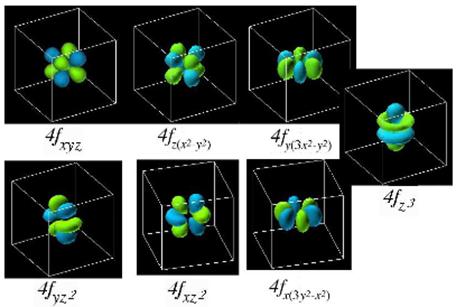
Рисунок 2.6 – Загальний вид і позначення f-орбіталей
Орбітали умовно зображають як енергетичні (або квантові) комірки у вигляді квадратів (табл. 2.5). Кількість енергетичних комірок дорівнює кількості орбіталей на даному енергетичному підрівні (або числу значень магнітного квантового числа m).
Таблиця 2.5 – Графічне зображення орбіталей у вигляді квантових комірок, над якими записані відповідні значення магнітного квантового числа m
|
Енергетичний підрівень |
Графічне позначення орбіталей |
|---|---|
|
Орбіталі s-підрівня |
|
|
Орбіталі р-підрівня |
|
|
Орбіталі d-підрівня |
|
|
Орбіталі f-підрівня |
|
Спінове квантове число, або просто спін ms (однак на практиці частіше користуються скороченим позначенням спінового квантового числа, залишаючи тільки один символ – s). Його назва походить від англ. spin – крутіння, обертання. На основі вивчення тонкої структури атомних спектрів встановлено, що стан електронів у атомі, крім обертання навколо ядра, яке визначається квантовими числами n, l, m, залежить також від власного руху – спіну. Спочатку для наочності вважали, що це явище аналогічне обертанню Землі навколо своєї осі під час руху навколо Сонця. На теперішній час думки щодо фізичного змісту спінового квантового числа діаметрально протилежні у багатьох науковців, що займаються квантовою хімією. Одні доводять, що спін – це суто квантово-механічна ознака електрона, яка не має класичних аналогів, а тільки відображає наявність у електрона власного моменту кількості руху. Інші впевнені, що ms характеризує обертання електрона навколо власної вісі за годинниковою стрілкою чи проти неї (рис.2.7), залежно від чого спіновому квантовому числу приписують знак «+» чи «–».
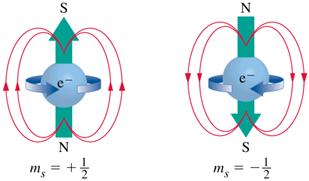
Рисунок 2.7 – Гіпотетична модель спінового квантового числа, яка достовірно не доведена, але і доказово не спростована
Спінове квантове число (ms або s)– це власний момент імпульсу електрона, який не пов’язаний з його рухом у просторі.
Спінове квантове число може мати тільки два значення: +½ і –½. Спін зображують протилежно напрямленими стрілками:
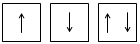
Спіни електронів, напрямлені в один бік, називаються паралельними, а у протилежні боки – антипаралельними.
2.4 Послідовність заповнення електронами енергетичних рівнів
Стан електронів у атомі можна однозначно описати за допомогою чотирьох квантових чисел n, l, m, s. Однак для вичерпного пояснення будови електронних оболонок необхідно знати три фундаментальних положення.
2.4.1 Принцип Паулі
Принцип Паулі (1925 р.) дає змогу визначити такі комбінації квантових чисел, що відповідають реальному розподілу електронів у атомі. Принцип Паулі, який іноді називають забороною Паулі, формулюється так:
В атомі не може бути двох або більше електронів з однаковими значеннями усіх чотирьох квантових чисел.
Інакше кажучи, кожний електрон має власний набір чотирьох квантових чисел. Із цього випливає кілька наслідків.
Перший наслідок принципу Паулі:
одну орбіталь, що характеризується певними значеннями квантових чисел n, l, m, можуть займати не більше, ніж два електрони з антипаралельними спінами.
Наприклад, на першому енергетичному рівні (n=1) і орбітальне квантове число і магнітне квантове число можуть мати тільки одне значення: l=0 (що вказує на s-підрівень) і m=0 (що вказує на сферичну форму орбіталі). На цій єдиній орбіталі 1s-підрівня розміщуються тільки два електрони, для яких збігаються квантові числа n, l, m, але відрізняються значення спінового квантового числа s, а саме:
1 електрон: n=1, l=0, m=0, s = +1/2 ;
2 електрон: n=1, l=0, m=0, s = –1/2.
Другий наслідок принципу Паулі:
максимальна кількість електронів на енергетичному підрівні, що характеризується квантовими числами n i l, дорівнює 2(2l+1).
Отже, на s-підрівні (l=0) може максимально перебувати 2(2·0+1)=2 електрони, на р-підрівні (l=1) –2(2·1+1)=6, на d- підрівні (l=2) – 2(2·2+1)=10, на f- підрівні (l=3) – 2(2·3+1)=14 електронів.
Третій наслідок принципу Паулі:
максимальна кількість електронів на будь-якому енергетичному рівні, що характеризується головним квантовим числом n, дорівнює 2n2.
Виходячи з цього, легко розрахувати можливу кількість електронів на будь-якому енергетичному рівні: на першому (n=1) може знаходитися 2·12=2 електрони, на другому (n=2) – 2·22=8, на третьому (n=3) – 2·32=18, на четвертому (n=4) – 2·42=32 електрони.
Таким чином, принцип Паулі визначає максимальну ємність рівнів, підрівнів і орбіталей.
2.4.2 Принцип мінімуму енергії
Найстійкішим є такий стан атома, в якому електрони перебувають в найнижчих енергетичних рівнях. Згідно з принципом мінімуму енергії
в атомі електрони заповнюють вільні орбіталі з мінімальними енергіями, що відповідає їх найміцнішому зв’язку з ядром.
Оскільки енергія електрона визначається квантовими числами n i l, то послідовність заповнення атомних орбіталей залежить від значень цих квантових чисел, що встановив В.М.Клечковський (1961 р.).
При збільшенні заряду ядра атома послідовне заповнення електронних орбіталей відбувається від орбіталей з меншим значенням суми головного і орбітального квантових чисел (n+l) до орбіталей з більшим значенням цієї суми.
При однакових значеннях суми (n+l) заповнення орбіталей відбувається послідовно у напрямку зростання головного квантового числа n.
Для прикладу визначимо послідовність заповнення підрівнів 2s, 2p i 3s. Для них суми головного і орбітального квантових чисел дорівнюють:
2s: n+l = 2+0 = 2;
2p: n+l = 2+1 = 3;
3s: n+l = 3+0 = 3.
Згідно з першим правилом Клечковського спочатку заповнюється 2s-підрівень, для якого сума n+l менша, за ним 2р-підрівень, а потім 3s, який хоча й має таку саму суму n+l, що і 2р, але характеризується більшим значенням головного квантового числа.
У міру зростання енергії орбіталей відповідні підрівні утворюють послідовність – так звану шкалу енергії:
[TEX]\rm{1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s\approx 4f\approx 5d<6p<7s\approx 5f \approx 6d<7p}[/TEX]
Якщо енергії близьких підрівнів (таких, як 4f i 5d, 4s i 3d) дуже мало відрізняються між собою, то порядок заповнення підрівнів ускладнюється, і електрони можуть перебувати то на одному із них, то на іншому.
Відповідно до наведеної схеми змінюється і енергія електронів. На кожному наступному рівні енергія електронів більша, ніж на попередньому, а зв’язок із ядром відповідно менший. У межах певного енергетичного рівня енергія електронів збільшується при переході з s-підрівня на р- і з р- на d-підрівень (рис.2.8).
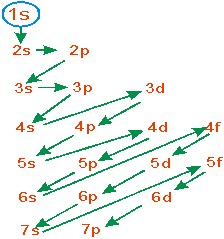
Рисунок 2.8 – Послідовність заповнення електронами енергетичних підрівнів
2.4.3 Правило Гунда
У межах одного підрівня послідовність заповнення орбіталей теж не є довільною. Вона визначається правилом Гунда:
Стійкому стану атома відповідає такий розподіл електронів на енергетичному підрівні, при якому абсолютне значення сумарного спінового числа є максимальним.
Іншими словами, електрони певного підрівня займають максимально можливу кількість вироджених орбіталей, тобто на суміжних орбіталях одного підрівня спочатку розміщуються електрони з паралельними спінами, а після цього ті самі орбіталі заповнюються електронами з антипаралельними спінами. При іншому розміщенні електронів абсолютне значення сумарного спіну не буде максимальним. Так, якщо атом має на d-підрівні п’ять електронів, то вони розміщуються за схемою
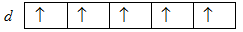
Правило Гунда не забороняє іншого розподілу електронів у межах підрівня. Воно лише стверджує, що максимальне значення сумарного спіну відповідає стійкому (незбудженому) стану, в якому атом має найменшу можливу енергію. При будь-якому іншому розподілі електронів енергія атома буде більшою, отже, атом буде перебувати у збудженому нестійкому стані.
2.5 Приклади розв’язання типових задач
Приклад 2.1. Визначте
хімічні елементи, позначені символами Х: ![]() .
Скільки всього хімічних елементів наведено в цьому рядку? Відповідь поясніть.
.
Скільки всього хімічних елементів наведено в цьому рядку? Відповідь поясніть.
Розв'язок. Враховуючи, що
протонне число дорівнює порядковому номеру хімічного елемента і користуючись
періодичною таблицею, визначаємо, що ![]() – ізотоп хімічного
елемента Карбону
– ізотоп хімічного
елемента Карбону ![]() ,
, ![]() –
хімічного елемента Алюмінію
–
хімічного елемента Алюмінію ![]() , а
, а ![]() та
та ![]() –
ізотопи хімічного елемента Оксигену
–
ізотопи хімічного елемента Оксигену ![]() та
та ![]() відповідно. Отже, всього наведено три
хімічних елементи.
відповідно. Отже, всього наведено три
хімічних елементи.
Приклад 2.2. Розмістіть три електрони на орбіталях р-підрівня.
Розв'язок. Для р-підрівня орбітальне квантове число l=1 (табл.2.2), йому відповідає три значення магнітного квантового числа m (–1, 0, +1), що свідчить про наявність трьох орбіталей на енергетичному підрівні.
Введемо графічне позначення для спінового квантового числа за допомогою стрілки, напрямленій уверх ↑ (при s=+1/2) чи униз ↓ (при s= –1/2). Тоді згідно з правилом Гунда максимальне значення сумарного спіну за абсолютною величиною |Σ(s)| можливо при такому розподілі електронів у межах підрівня, коли на кожній орбіталі буде знаходитися по одному електрону з однаковими значеннями спінового квантового числа (s= +1/2 чи s = –1/2):
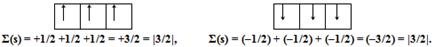
У протилежному випадку, при іншому розміщенні електронів на орбіталях, сума спінових чисел не може бути максимальною, наприклад:

Приклад 2.3. Розмістіть електрони по квантових комірках для атома деякого елемента з такою конфігурацією зовнішнього електронного шару: 3s23p4.
Розв'язок. Відповідно до правила Гунда на 3s-підрівні розміщуються два спарені електрони, а три орбіталі 3р-підрівня заповнюються спочатку по одному електрону і тільки після цього четвертий електрон займає першу з напівзабудованих р-орбіталей:
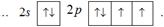
Приклад 2.4. Визначте кількість підрівнів на п’ятому енергетичному рівні та наведіть їх позначення. Скільки орбіталей містить кожний підрівень? Яка максимальна кількість електронів може знаходитися на п’ятому рівні?
Розв'язок. Кількість підрівнів на енергетичному рівні визначається кількістю значень орбітального квантового l числа, яких може бути усього n, тобто кількість підрівнів пов'язана зі значенням головного квантового числа n. Для п'ятого енергетичного рівня головне квантове число n=5, тому орбітальне квантове число може набувати п'ять значень, кожному з яких відповідає своє позначення підрівня:
l=0 (s-підрівень), l=1 (p-підрівень), l=2 (d-підрівень), l=3 (f-підрівень), l=4 (g-підрівень).
Кількість орбіталей обчислимо згідно з одним з наслідків принципу Паулі:
s-підрівень: 2l+1 = 2·0+1=1;
р-підрівень: 2l+1 = 2·1+1=3;
d-підрівень: 2l+1 = 2·2+1=5;
f-підрівень: 2l+1 = 2·3+1=7;
g-підрівень: 2l+1 = 2·4+1=9.
А згідно з іншим наслідком принципу Паулі розрахуємо максимальну кількість електронів, що можуть знаходитися на п’ятому енергетичному рівні:
N = 2·n2 = 2·52 = 50.
Приклад 2.5. Значення яких квантових чисел відрізняються для електронів: а) 4f14 і 5f14; б) 6s1 і 6s2; в) 3p1 і 3p3; г) 2s1 і 2p2?
Розв'язок. Для відповіді на питання побудуємо таблицю і заповнимо її:
|
Завдання |
Електрон |
Квантові числа |
Відмінне квантове число |
|||
|
n |
l |
m |
s |
|||
|
а |
4f14 |
4 |
3 |
+3 |
–1/2 |
Головне квантове число n |
|
5f14 |
5 |
3 |
+3 |
–1/2 |
||
|
б |
6s1 |
6 |
0 |
0 |
+1/2 |
Спінове квантове число s |
|
6s2 |
6 |
0 |
0 |
–1/2 |
||
|
в |
3p1 |
3 |
1 |
–1 |
+1/2 |
Магнітне квантове число m |
|
3p3 |
3 |
1 |
+1 |
+1/2 |
||
|
г |
2s1 |
2 |
0 |
0 |
+1/2 |
Орбітальне квантове число l |
|
2p2 |
2 |
1 |
0 |
+1/2 |
||
Приклад 2.6. Якою є послідовність заповнення електронами в атомі 7s-, 5d-, 6p- і 4f-підрівнів?
Розв'язок. Заповнення підрівнів в атомі відбувається відповідно до принципу мінімуму енергії, з якого випливають правила Клечковського. За першим правилом для встановлення заданої послідовності необхідно обчислити суму головного n і побічного l квантових чисел для кожного підрівня:
7s: n+l = 7+0 = 7;
5d: n+l = 5+2 = 7;
6p: n+l = 6+1 = 7;
4f: n+l = 4+3 = 7.
Всі підрівні мають однакові суми (n+l), тому скористаємося другим правилом Клечковського і розмістимо підрівні у порядку зростання енергії підрівня, що відповідає збільшенню значення головного квантового числа. Отже, заповнення підрівнів проходить у такій послідовності: 4f, 5d, 6p і 7s.
Приклад 2.7. За допомогою квантових чисел зазначте такий стан електрона в атомі:
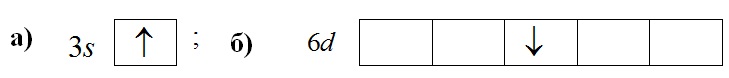
Розв'язок. а) Позначення 3s ↑ вказує на розміщення електрона на s-підрівні третього енергетичного рівня, отже, головне і орбітальне квантові числа дорівнюють: n=3, l=0. Однак значенню орбітального квантового числа l=0 відповідає магнітне квантове число m=0 (табл.2.3–2.4), а графічному зображенню неспареного електрона у вигляді напрямленої уверх стрілки – значення спінового квантового числа s=+1/2.
б) Символ 6d свідчить, що електрон розміщується на d-підрівні шостого енергетичного рівня, тому головне і орбітальне квантові числа дорівнюють: n=6, l=2. Щоб визначити решту квантових чисел, для зручності та наочності заповнимо квантові комірки електронами, що передують заданому електрону (його відмітимо зеленим кольором), і напишемо над кожною коміркою значення магнітного квантового числа (m), а під коміркою – значення спінових чисел (s):
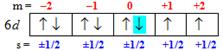
Із схеми знаходимо значення магнітного і спінового квантових чисел. Отже, одержимо повний набір квантових чисел для 6d8-електрона: n=6, l=2, m=0, s= –1/2.
Приклад 2.8.
Формуючий електрон атома деякого елемента характеризується набором таких
квантових чисел: ![]() ,
, ![]() ,
, ![]() ,
, 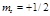 .
Складіть електронну формулу цього атома.
.
Складіть електронну формулу цього атома.
Розв'язок. Формуючим називають останній електрон, який завершує формування електронної оболонки атома.
Для формуючого електрона значення головного квантового числа (n=3) вказує на третій рівень, а орбітального (l=2) – на d-підрівень (табл. 2.2 і 2.3). Для знаходження магнітного квантового числа зручно звернутися до електронно-графічної схеми, з якої видно, що m= –1, тобто електрон перебуває на другій з п’яти d-орбіталей:
![]()
За значенням спінового квантового числа (s = +1/2)
встановлюємо, що цей електрон є неспареним. З урахуванням енергетичної шкали
складаємо електронну формулу атома заданого елемента: 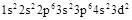 .
.
Приклад 2.9. Запишіть набори квантових чисел для кожного електрона, що міститься в атомі елемента з порядковим номером 7.
Розв'язок. Атом елемента №7 містить сім електронів, розподіл яких по енергетичних рівнях і підрівнях відображається електронною формулою 1s22s22p3. Згідно з принципом Паулі кожний електрон в атомі характеризується власним набором чотирьох квантових чисел. Наприклад, квантові числа для формуючого (сьомого) електрона 2p3, що розміщується на р-підрівні другого енергетичного рівня, є таким: n=2, l=1, m=+1, s=+1/2. Значення квантових чисел для всіх електронів зручно зводити в таблицю:
|
Квантові числа |
Номер електрона |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
n |
1 |
1 |
2 |
2 |
2 |
2 |
2 |
|
l |
0 |
0 |
0 |
0 |
1 |
1 |
1 |
|
m |
0 |
0 |
0 |
0 |
–1 |
0 |
+1 |
|
s |
+1/2 |
–1/2 |
+1/2 |
–1/2 |
+1/2 |
+1/2 |
+1/2 |



