2.1. Передумови створення сучасної моделі атома
Метафізичні уявлення щодо структури атома як неподільної частинки панували в хімії до кінця ХIXст., коли завдяки великої кількості видатних відкриттів стало зрозуміло, що атом – це надзвичайно складна система. Експериментальні докази складності природи атома поставили вчених перед необхідністю створити нову теорію – так звану модель атома. Найбільш важливою стала планетарна модель будови атома Резерфорда (1911р.), яка базується на таких ствердженнях:
- атом – електронейтральна система, що складається з ядра і електронної оболонки;
- у центрі атома міститься позитивно заряджене ядро, радіус якого (~10–15 м) становить мізерну частину радіуса атома (~ 10–10 м)
- увесь позитивний заряд і майже вся маса атома зосереджені в його ядрі;
- навколо ядра обертаються електрони, кількість яких дорівнює позитивному заряду ядра.
Досліди Резерфорда дали змогу встановити фундаментальну залежність, нині відому як закон Мозлі: Заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі Д.I.Менделєєва.
Ядерна модель Резерфорда була значним кроком вперед у процесі пізнання будови атома. Проте вона неспроможна була пояснити деякі відомі факти і мала певні недоліки. З урахуванням цього Бор запропонував нову теорію, яка містила два основні постулати.
Перший постулат Бора: Електрон, не випромінюючи і не поглинаючи енергії, обертається навколо ядра тільки на певних колових орбітах, які називаються стаціонарними, або квантовими.
Другий постулат Бора: Електрон може переходити з однієї стаціонарної орбіти на іншу, при цьому поглинається або випромінюється квант електромагнітного випромінювання, енергія якого дорівнює різниці енергії атома в кінцевому і вихідному станах.
Теорія Бора про будову атома гідрогену була досить наочною і зручною, але поряд із успіхами мала і певні недоліки. Однак саме головне – теорія Бора наочно доказала неможливість застосування законів класичної фізики до вивчення будови атома і тим самим дала потужний поштовх до розвитку квантової хімії.
2.2. Квантова теорія будови атома
Квантова, або хвильова механіка – це фізична теорія для описання властивостей і поведінки об’єктів мікросвіту, яка ґрунтується на певних законах, або принципах:
- принцип квантування енергії Планка, що виходила з деяких припущень. По-перше, фотон є неподільним і існує у вигляді дискретного утворення. По-друге, променева енергія випромінюється і поглинається не безперервно, а дискретно, тобто невеликими порціями – квантами, енергія яких залежить від частоти [TEX]\nu[/TEX] згідно з рівнянням Планка [TEX]E=h\nu[/TEX], де h – стала Планка;
- принцип корпускулярно-хвильового дуалізму, або подвійності властивостей, електрона, що відображається рівнянням Де Бройля [TEX]\lambda=\frac{h}{m\upsilon}[/TEX], де [TEX]\lambda, m, \upsilon[/TEX] – довжина хвилі, маса і швидкість електрона відповідно. Згідно з гіпотезою Де Бройля корпускулярно-хвильовий дуалізм електрона доводиться наявністю одночасно як властивостей частинки (корпускули), що має масу m і швидкість υ, так і властивостями хвилі з певною довжиною хвилі [TEX]\lambda[/TEX] та частотою коливань [TEX]\nu[/TEX]
- принцип невизначеності Гейзенберга, який формулюється так: неможливо однозначно і точно встановити швидкість електрона і його координати. Математичний вираз принципу невизначеності має вигляд [TEX]\Delta{x}\Delta{p}\geq \frac{h}{2\pi}[/TEX] або [TEX]\Delta{x}\Delta{\upsilon}\geq \frac{h}{2\pi{m}}[/TEX], де [TEX]\Delta{x}, \Delta{p}, \Delta{\upsilon}[/TEX] – відповідно невизначеності в координаті, імпульсі та швидкості електрона. Із цих рівнянь випливає: чим точніше визначена координата електрона (тобто чим менша похибка у визначенні координати [TEX]\Delta{x}[/TEX]), тим менш визначеною стає величина імпульсу (тобто похибка у визначенні імпульсу прямує до нескінченності) і навпаки: чим точніше визначений імпульс (швидкість), тим більш невизначене місцезнаходження електрона.
- принцип хвильового характеру руху електрона в атомі, який описується хвильовим рівнянням Шредінгера, що пов’язує потенціальну U і повну Е енергії електрона з хвильовою функцією «псі» [TEX]\psi[/TEX]:
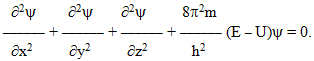
Отже, квантова механіка відмовилася від уточнення місцезнаходження електрона, а замінила класичне поняття точних координат поняттям статистичної імовірності його знаходження у даному елементі об’єму dV навколо ядра. Оскільки положення електрона в атомі невизначене, можна говорити лише про імовірність його перебування у тій чи іншій точці атомного простору.
На хвильову функцію [TEX]\psi[/TEX] накладаються граничні умови, або вимоги регулярності – обмеження, що окреслюють область існування функції. Хвильова функція може набувати як додатних, так і від’ємних значень. Однак величина [TEX]\psi^2[/TEX] завжди додатна. При цьому вона має надзвичайну властивість: чим більше значення [TEX]\psi^2[/TEX] в якійсь точці простору, тим вища імовірність того, що електрон виявить там свою дію, тобто його існування може бути відкритим у фізичному процесі. Хвильова функція [TEX]\psi[/TEX], що є розв'язком рівняння Шредінгера, називається орбіталлю. Отже, орбіталь – це математичне поняття, але часто користуються й спрощеним тлумаченням: Орбіталь – це простір навколо ядра, в якому найімовірніше перебування електрона.
Поряд з поняттям орбіталь в квантовій механіці застосовується уявлення про електронну хмару – модель стану електрона в атомі, густина відповідних ділянок якої пропорційна імовірності перебування там електрона. Тобто максимальна густина електронної хмари пропорційна квадрату хвильової функції [TEX]\psi^2[/TEX].
2.3. Атомні орбіталі
Згідно з квантово-механічною теорією атомну орбіталь і стан електрона в атомі можна однозначно описати за допомогою набору чотирьох квантових чисел – енергетичних характеристик стану електрона в атомі. Три з них (n – головне, l – орбітальне, m – магнітне) безпосередньо випливають з рівняння Шредінгера, яке описує електрон як хвилю у трьох координатах. Тому для повної характеристики енергетичного стану електрона в атомі потрібні три цілих числа. А четверте квантове число (s – спінове) характеризує деякі особливі магнітні властивості електрона.
Головне квантове число n визначає загальну енергію електрона в певному квантовому стані і характеризує радіус квантового рівня, тобто середню відстань від ядра до ділянки підвищеної електронної густини.
Для атома в нормальному (основному) стані головне квантове число n набуває усіх цілочислових значень від 1 до 7. Для атома у збудженому стані n може набувати значення від 1 до нескінченності. Стан електрона, який характеризується певним значенням головного квантового числа, називається енергетичним рівнем електрона в атомі. Для позначення енергетичних рівнів, що відповідають різним значенням n, інколи використовують латинські літери.
Найменшу енергію електрон має при n=1; із зростанням n енергія електрона збільшується. При n=∞ припускають, що електрону надано енергію, достатню для його повного відділення від ядра (іонізація атома).
Головне квантове число визначає й розміри електронної хмари. Квантові переходи електрона в атомі відповідають стрибкоподібній зміні середнього розміру електронної хмари: зменшення енергії зв’язку електрона з ядром викликає збільшення об’єму хмари і навпаки.
Орбітальне квантове число l характеризує енергію електрона на енергетичному підрівні і визначає форму електронної хмари. Орбітальне квантове число може набувати n цілочислових значень від 0 до (n–1). Кожному значенню l відповідає певний підрівень, який позначається латинською буквою s, p, d, f тощо (табл 2.1).
Таблиця 2.1 – Позначення енергетичних підрівнів
| Орбітальне (побічне) квантове число l | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Позначення енергетичного підрівня | s | p | d | f | g | h |
Для певного значення головного квантового числа n орбітальне квантове число l може мати n значень, тобто кількість підрівнів на будь-якому енергетичному рівні дорівнює номеру цього рівня. Значення головного n і орбітального l квантових чисел для перших чотирьох енергетичних рівнів наведені в табл. 2.2.
Таблиця 2.2 – Значення головного і орбітального квантових чисел для чотирьох енергетичних рівнів
|
Головне квантове число n (і номер енергетичного рівня) |
Орбітальне квантове число l |
Позначення енергетичних підрівнів |
|---|---|---|
|
1 |
0 |
1s |
|
2 |
0, 1 |
2s 2p |
|
3 |
0, 1, 2 |
3s 3p 3d |
|
4 |
0, 1, 2, 3 |
4s 4p 4d 4f |
Відповідно до буквених позначень енергетичних підрівнів електрони, які перебувають на них, називаються s-, p-, d-, f-електронами, причому для кожного енергетичного рівня n найменшу енергію мають s-електрони, потім р-, d- i f-електрони.
Квантово-механічні розрахунки визначають форму орбіталей: s-орбіталі мають форму кулі (сферична симетрія), р-орбіталі – гантелі, d-орбіталі – пелюсткову форму, а f-орбіталі – більш складнішу форму.
Магнітне квантове число m характеризує енергію електрона на орбіталі і визначає просторове розміщення орбіталі відносно магнітного поля, тобто величину проекції орбітального моменту кількості руху на напрямок магнітного поля. Магнітне квантове число може набувати таких значень: 0, ±1, ±2,...±l. Число значень залежить від орбітального квантового числа l і дорівнює (2l+1) (табл. 2.3).
Таблиця 2.3 – Кількість орбіталей на енергетичному підрівні залежно від значень орбітального і магнітного квантових чисел
| Орбітальне квантове число l і позначення підрівня | Магнітне квантове число m | Кількість орбіталей на енергетичному підрівні при данному значенні l |
|---|---|---|
|
l = 0 (s-підрівень) |
0 |
1 |
|
l = 1 (p-підрівень) |
–1, 0, +1 |
3 |
|
l = 2 (d-підрівень) |
–2, –1, 0, +1, +2 |
5 |
|
l = 3 (f-підрівень) |
–3, –2, –1, 0, +1, +2, +3 |
7 |
Орбіталі з однаковою енергією називаються виродженими. Тому можна сказати, що р-стан вироджено три рази, d-стан – п’ять, а f-стан – сім разів.
На відміну від кулястої s-орбіталі, р-, d-, f-орбіталі мають певну орієнтацію у просторі, за характером якої р-орбіталі позначають рх, ру, рz (витягнуті вздовж осей х,у,z). Напрям d-орбіталей не тільки збігається з осями координат, а й лежить між ними: d-орбіталі, орієнтовані вздовж осей координат, позначають dx2–dy2 (витягнуті вздовж осей х і у) і dz2 (витягнуті вздовж осі z); d-орбіталі, орієнтовані між осями координат, позначають dxy, dyz, dxz (розташовані на бісектрисах між осями координат).
Орбітали умовно зображають як енергетичні (або квантові) комірки у вигляді квадратів (табл. 2.4). Кількість енергетичних комірок дорівнює кількості орбіталей на даному енергетичному підрівні (або числу значень магнітного квантового числа m).
Таблиця 2.4 – Графічне зображення орбіталей у вигляді квантових комірок, над якими записані відповідні значення магнітного квантового числа m
|
Енергетичний підрівень |
Графічне позначення орбіталей |
|---|---|
|
Орбіталі s-підрівня |
|
|
Орбіталі р-підрівня |
|
|
Орбіталі d-підрівня |
|
|
Орбіталі f-підрівня |
|
Спінове квантове число, або просто спін ms (однак на практиці частіше користуються скороченим позначенням спінового квантового числа, залишаючи тільки один символ – s). Спінове квантове число (ms або s) – це власний момент імпульсу електрона, який не пов’язаний з його рухом у просторі. Спінове квантове число може мати тільки два значення: +½ і –½. Спін зображують протилежно напрямленими стрілками:
![]()
Спіни електронів, напрямлені в один бік, називаються паралельними, а у протилежні боки – антипаралельними.
2.4. Послідовність заповнення електронами енергетичних рівнів
Для вичерпного пояснення будови електронних оболонок необхідно знати три фундаментальних положення.
Принцип Паулі, який іноді називають забороною Паулі, формулюється так: В атомі не може бути двох або більше електронів з однаковими значеннями усіх чотирьох квантових чисел.
Перший наслідок принципу Паулі: одну орбіталь, що характеризується певними значеннями квантових чисел n, l, m, можуть займати не більше, ніж два електрони з антипаралельними спінами.
Другий наслідок принципу Паулі: максимальна кількість електронів на енергетичному підрівні, що характеризується квантовими числами n i l, дорівнює 2(2l+1).
Третій наслідок принципу Паулі: максимальна кількість електронів на будь-якому енергетичному рівні, що характеризується головним квантовим числом n, дорівнює 2n2.
Згідно з принципом мінімуму енергії В атомі електрони заповнюють вільні орбіталі з мінімальними енергіями, що відповідає їх найміцнішому зв’язку з ядром.
Перше правило Клечковського: При збільшенні заряду ядра атома послідовне заповнення електронних орбіталей відбувається від орбіталей з меншим значенням суми головного і орбітального квантових чисел (n+l) до орбіталей з більшим значенням цієї суми.
Друге правило Клечковського: При однакових значеннях суми (n+l) заповнення орбіталей відбувається послідовно у напрямку зростання головного квантового числа n.
У міру зростання енергії орбіталей відповідні підрівні утворюють послідовність – так звану шкалу енергії:
[TEX]\rm{1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s\approx 4f\approx 5d<6p<7s\approx 5f \approx 6d<7p}[/TEX]
У межах одного підрівня послідовність заповнення орбіталей визначається правилом Гунда: Стійкому стану атома відповідає такий розподіл електронів на енергетичному підрівні, при якому абсолютне значення сумарного спінового числа є максимальним. Іншими словами, електрони певного підрівня займають максимально можливу кількість вироджених орбіталей, тобто на суміжних орбіталях одного підрівня спочатку розміщуються електрони з паралельними спінами, а після цього ті самі орбіталі заповнюються електронами з антипаралельними спінами. При іншому розміщенні електронів абсолютне значення сумарного спіну не буде максимальним. Так, якщо атом має на d-підрівні п’ять електронів, то вони розміщуються за схемою
![]()
Правило Гунда не забороняє іншого розподілу електронів у межах підрівня. Воно лише стверджує, що максимальне значення сумарного спіну відповідає стійкому (незбудженому) стану, в якому атом має найменшу можливу енергію. При будь-якому іншому розподілі електронів енергія атома буде більшою, отже, атом буде перебувати у збудженому нестійкому стані.



