Основними характеристиками атома, які визначають його поведінку в хімічних реакціях і при утворенні простих речовин, є будова зовнішнього електронного шару і енергія електронів відносно позитивно зарядженого ядра. Обидві характеристики підлягають періодичній залежності від порядкового номера елемента, який завжди вказується в періодичній таблиці елементів (табл.3.1).
Згідно з сучасними квантово-механічними уявленнями конфігурація електронної оболонки визначається зарядом ядра атома і положенням елемента в періодичній системі. Електрони з однаковим значенням головного квантового числа утворюють квантові рівні, ємність яких збільшується у міру видалення від ядра. Квантові рівні, в свою чергу, побудовані з підрівнів, що об’єднують електрони з однаковим значенням орбітального квантового числа. А підрівні складаються з орбіталей, на кожній з яких може знаходитися не більше двох електронів.
Розподіл електронів в атомі виражають за допомогою електронних формул і електронно-графічних схем. При складанні електронної формули атома будь-якого елемента корисно пам’ятати декілька очевидних закономірностей:
· Загальна кількість енергетичних рівнів визначається значенням головного квантового числа n і відповідає номеру періоду, в якому розміщується елемент;
· Кількість енергетичних підрівнів на даному рівні співпадає з номером цього рівня і визначається значенням головного квантового числа n;
· Кількість орбіталей на енергетичному підрівні визначається кількістю значень магнітного квантового числа m, яке дорівнює (2l+1).
Графічно орбіталі зображуються у вигляді квантових комірок:
Одна орбіталь s-підрівня: ![]() ,
,
Три орбіталі p-підрівня: ![]() ,
,
П’ять орбіталей d-підрівня ![]() ,
,
Сім орбіталей f-підрівня: ![]() .
.
Таблиця 3.1 – Періодична система хімічних елементів Д.І.Менделєєва
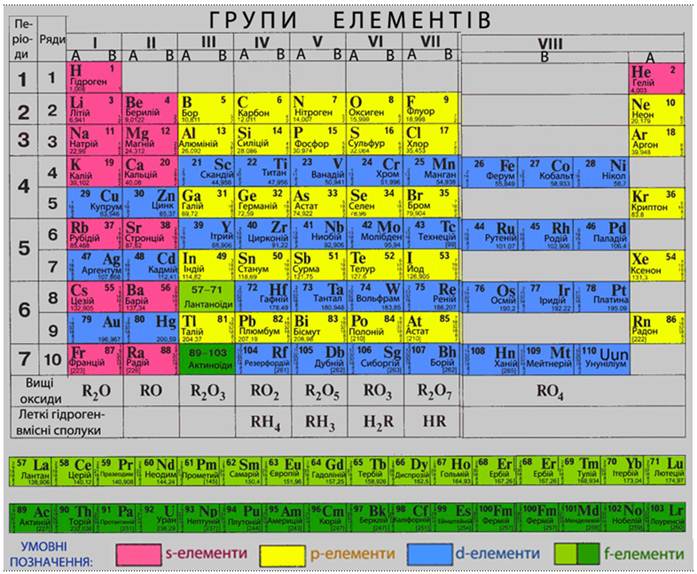
У перших трьох періодах, які називаються малими (або типовими), із збільшенням заряду ядра відбувається заповнення електронами зовнішнього енергетичного рівня, номер якого збігається з номером періоду в періодичній системі.
Перший період складається з двох елементів:
![]()
![]()
Елементи, в атомах яких забудовується електронами s-орбіталі зовнішнього енергетичного рівня, називаються s-елементами. Всі s-елементи об’єднуються в s-електронну родину, яка в періодичній системі елементів розміщується у двох перших групах, за винятком s-елемента гелію Не, який традиційно приміщують у VIII групу завдяки його належності до інертних елементів.
У елементів другого періоду відбувається заповнення другого енергетичного рівня (L-рівень, n=2):
![]()
![]()
![]()
Елементи Li та Be належать до s-електронної родини, оскільки в їх атомах саме на s-підрівень поступає останній електрон – так званий формоутворюючий електрон (або просто формуючий). У наступних шести елементів від 6С до 10Ne, формуючі електрони заповнюють р-підрівень (l=1) другого енергетичного L-рівня (n=2). Елементи, в атомах яких заповнюються електронами р-орбіталі зовнішнього енергетичного рівня, називаються р-елементами. Cукупність усіх р-елементів складає р-електронну родину. р-Елементи розміщуються в III-VIII групах періодичної системи Д.І.Менделєєва.
Для s- і р-елементів притаманна особливість: кількість зовнішніх (валентних) електронів дорівнює номеру групи. Справедливе й зворотнє твердження: за кількістю валентних електронів в атомах можно встановити, в якій групі знаходиться даний елемент.
Третій період, в якому проходить забудова М-рівня (n=3) містить вісім елементів: два s-елементи (Na, Mg) і шість р-елементів (Al, Si, P, Cl, Ar), причому конфігурація зовнішнього енергетичного рівня відповідних елементів другого і третього періодів аналогічна. Елементи з однаковою електронною конфігурацією зовнішнього енергетичного рівня називаються елементами-аналогами.
Четвертий і п’ятий періоди містять по вісімнадцять елементів. У атомів елементів четвертого періоду відбувається забудова N-рівня (n=4), починаючи с 4s-орбіталі. Поява електрона в 4s-стані при наявності вільних 3d-орбіталей зумовлюється екрануванням ядра щільним і симетричним шаром 3s23p6. У зв’язку з відштовхуванням від цього шару для формуючого дев'ятнадцятого електрона атома калію (№19) і формуючого двадцятого електрона атома кальцію (№20) найбільш вигідним є 4s-стан:
19К 1s22s22p63s23p64s1 ; 20Ca 1s22s22p63s23p64s2.
Забудова електронами у атомів К і Са зовнішнього 4s-підрівня при наявності вільного 3d-підрівня узгоджується с першим правилом Клечковського. А згідно з другим правилом Клечковського після 4s-підрівня, незважаючи на однакову суму (n+l=5), буде заповнюватися електронами 3d, а не 4р, оскільки саме 3d має менше значення головного квантового числа.
У десяти елементів – від скандію (21Sc) до цинку (30Zn) відбувається заповнення електронами 3d-підрівня. Елементи, в атомах яких заповнюються d-орбіталі другого ззовні енергетичного рівня, називається d-елементами. Електронна родина d-елементів, в атомах яких проходить заповнення електронами другого ззовні d-підрівня, розміщуються у побічних підгрупах періодичної системи Д.І.Менделєєва.
В атомах деяких d-елементів (24Cr, 29Сu) спостерігається самочинне переміщення електронів з ns-підрівня на (n–1)d-підрівень. Таке явище називається проскоком електронів (промотуванням).
У п’ятому періоді заповнення енергетичних рівнів і підрівнів відбувається аналогічно четвертому періоду. Треба відзначити, що у п’яти d-елементів п’ятого періоду (41Nb, 42Mo, 44Ru, 45Rh, 47Ag) теж спостерігається проскок одного, а у 46Pd – навіть двох електронів із зовнішнього 5s-підрівня на попередній 4d-підрівень.
Шостий період, що містить 32 елементи, починається двома s-елементами (55Cs, 56Ba), в атомах яких заповнюється 6s-орбіталь. У наступного елемента, Лантану, формуючий, п’ятдесят сьомий, електрон надходить на 5d-орбіталь всупереч другому правилу Клечковського, замість того, щоб заповнювати 4f-підрівень. Це явище зумовлене більш різким зменшенням енергії 4f-електронів із зростанням заряду ядра порівняно з енергією 5d-елекронів. Тому в 57La енергія 5d-електронів нижча, а у 58Се вища, ніж енергія 4f-електронів. Але у наступних чотирнадцяти елементів від 58Се до 71Lu стан 4f енергетично більш вигідний, ніж стан 5d, тому в їх атомах відбувається забудова 4f-орбіталей. Елементи, в атомах яких заповнюються електронами f-орбіталі третього ззовні рівня, називаються f-елементами.
Далі, починаючи з 72Hf, продовжується заповнення 5d-орбіталей у десяти елементів до Меркурію 80Hg включно. Період закінчується р-елементами (81Tl – 86Rn), в атомах яких забудовується 6р-підрівень. Проскоки електронів із зовнішнього 6s-підрівня на попередній 5d-підрівень спостерігаються у двох елементів: Платини 78Pt i Ауруму 79Au. Таким чином, шостий період складається з двох s-елементів, шести р-, десяти d- і чотирнадцяти f-елементів.
Сьомий період ще не завершений. Заповнення енергетичних рівнів і підрівнів відбувається в ньому аналогічно, як і у атомів елементів шостого періоду. Період починається двома s-елементами (87Fr, 88Ra). За ними йдуть d-елементи (89Ас, 90Th), а потім тринадцять f-елементів (91Ра – 103Lr). Завершують періодичну систему d-елементи.
Д.І.Менделєєв вивів стисле формулювання періодичного закону (1869р.): властивості елементів, а також властивості утворених ними простих і складних тіл перебувають у періодичній залежності від величин атомних ваг елементів.
Глибоке розуміння суті періодичної залежності дало Менделєєву змогу зробити кілька важливих висновків і передбачень. Подальші відкриття будови атома та явища ізотопії показали, що головною кількісною характеристикою елемента є не атомна маса, а заряд ядра (Z).
Тому сучасне визначення періодичного закону формулюється таким чином:
Властивості простих речовин, а також форми і властивості сполук елементів перебувають у періодичній залежності від значення заряду їх атомних ядер (або від порядкового номера елемента в періодичній системі).
Закономірності в електронних структурах атомів елементів відбиваються у періодичній системі елементів, для якої найчастіше використовують дві форми таблиць – скорочену (табл. 3.1) та розгорнуту. Кожний елемент посідає в періодичній таблиці певну клітинку, в якій подається основна інформація про елементи.
Період – це горизонтальний послідовний ряд елементів, в атомах яких електрони заповнюють однакову кількість енергетичних рівнів. Номер періоду збігається з номером зовнішнього квантового рівня. Різниця у послідовності заповнення як зовнішніх, так і більш близьких до ядра електронних шарів пояснює причину різної довжини періодів. У атомів s- і р-елементів йде забудова зовнішнього рівня, у d-елементів – другого ззовні, а у f-елементів – аж третього ззовні енергетичного рівня. Тому відмінність у властивостях найбільш чітко виявляється у сусідніх s- чи р-елементів. У d- і особливо f-елементів одного й того самого періоду відмінність у властивостях менш значна.
Перші три періоди називаються малими, а елементи другого і третього періодів – ще й типовими, оскільки їхні властивості є основою для розподілу всіх інших елементів на вісім груп. Усі інші періоди, включаючи і сьомий, незавершений, називаються великими.
Закономірність забудови електронних оболонок атомів дає можливість дійти до висновку: Періодичне повторення однакових електронних конфігурацій зовнішнього електронного шару є причиною подібності фізичних і хімічних властивостей у елементів-аналогів, тому що саме зовнішні електрони атомів переважно визначають їх властивості.
У малих типових періодах із збільшенням порядкового номера спостерігається поступове зменшення металічних і зростання неметалічних властивостей, оскільки збільшується кількість валентних електронів на зовнішньому енергетичному рівні. У межах одного періоду властивості елементів змінюються поступово, а при переході від попереднього періоду до наступного спостерігається різке змінювання властивостей, оскільки починається забудова нового енергетичного рівня.
У великих періодах металічні властивості послаблюються більш повільно. Це пов’язано з тим, що, починаючи з четвертого періоду, з’являються десять перехідних d-елементів, у яких забудовується не зовнішній, а другий ззовні d-підрівень, а на зовнішньому шарі d-елементів перебувають один або два s-електрони, які й визначають певною мірою властивості цих елементів. Періодична зміна властивостей елементів усередині великих періодів дає змогу розділити їх на два ряди, у яких друга частина періоду повторює першу.
Вертикальні стовпчики елементів у періодичній таблиці – групи складаються із підгруп: головної і побічної, які іноді позначаються літерами А і Б відповідно. До складу головних підгруп входять s- і р-елементи, а до складу побічних – d- i f-елементи великих періодів.
Головна підгрупа – це сукупність елементів, що розміщується в періодичній таблиці вертикально і має однакову конфігурацію зовнішнього електронного шару в атомах. Положення елемента в головній підгрупі визначається загальною кількістю електронів (s- і р-) зовнішнього енергетичного рівня, яка дорівнює номеру групи. Елементи однієї підгрупи характеризуються подібністю хімічних властивостей. Але у межах однієї підгрупи поряд із подібністю властивостей спостерігається їх деяке змінювання.
Побічна підгрупа Б – це сукупність елементів, що розміщуються в періодичній таблиці вертикально і мають однакову кількість валентних електронів за рахунок забудови зовнішнього s- і другому ззовні d-енергетичних підрівнів. Усі елементи побічних підгруп належать до d-родин. Ці елементи іноді називають перехідними металами. В побічних підгрупах властивості змінюються більш повільно, оскільки в атомах d-елементів електрони забудовують другий ззовні енергетичний рівень, а на зовнішньому рівні перебувають лише два електрони або один.
Положення перших п’яти d-елементів (підгрупи ІІІБ-VIIБ) кожного періоду можна визначити за допомогою суми зовнішніх s-електронів і d-електронів другого ззовні рівня. Положення останніх двох елементів кожного періоду (підгрупи ІБ і ІІБ) можна визначити за кількістю електронів на зовнішньому рівні, оскільки в атомах цих елементів передзовнішній рівень є повністю завершеним.
Тріади Fe-Co-Ni, Ru-Rh-Pd та Os-Ir-Pt розміщені в побічній підгрупі восьмої групи. Ці тріади утворюють дві родини: заліза і платиноїдів. Крім зазначених родин окремо виділяють родину лантаноїдів (чотирнадцять 4f-елементів) і родину актиноїдів (чотирнадцять 5f-елементів). Ці родини належать до побічної підгрупи третьої групи.
Зростання металічних властивостей елементів у підгрупах згори вниз, а також зменшення цих властивостей у межах одного періоду зліва направо зумовлюють появлення в періодичній системі діагональної закономірності.
Усі властивості елементів, які визначаються електронною оболонкою атома, закономірно змінюються у періодах і групах періодичної системи. Хімічна природа елемента зумовлюється здатністю його атома віддавати або приєднувати електрони, що кількісно характеризується енергією іонізації, спорідненістю до електрона і електронегативністю та залежить від радіуса атома.
Внаслідок хвильового характеру руху електрона атом не має чітко окреслених границь, тому виміряти абсолютне значення розміру атома неможливо, тому розглядають орбітальний радіус – відстань від ядра до найбільш віддаленого від нього максимуму розподілу електронної густини. Практично мають справу з радіусами атомів, які сполучені один із одним тим чи іншим типом хімічного зв’язку. Такі радіуси розглядають як ефективні, тобто ті, що виявляють себе у дії. Ефективні радіуси визначають при вивченні будови молекул і кристалів.
У межах одного періоду із підвищенням Z спостерігається тенденція до зменшення розмірів атомів. У межах головних підгруп розміри атомів збільшуються із зростанням зарядів ядер. У побічних підгрупах розміри атомів змінюються меншою мірою, особливо для перехідних d-металів п’ятого і шостого періодів, для яких радіуси атомів приблизно однакові.
Видалення електрона із незбудженого атома при перетворенні його в позитивно заряджений йон – це процес завжди ендоенергетичний (тобто такий, що проходить при поглинанні енергії), тому для його здійснення необхідно докласти певну енергію. Мінімальна енергія, що потрібна для відриву електрона від незбудженого атома, називається енергією іонізації І: Ео + І [TEX]\rightarrow[/TEX]E+ + ē, де символами Е і E+ позначені відповідно нейтральний атом і позитивно заряджений йон (катіон) деякого елемента, I – енергия йонізації, ē – електрон.
У елементів одного й того самого періоду при переході від лужного металу до благородного газу заряд ядра зростає, а радіус атома зменшується. Тому енергія іонізації поступово збільшується, а металічні властивості послаблюються. Енергія іонізації в рядах d-елементів змінюється мало. У межах підгруп періодичної системи збільшення порядкового номера елемента супроводжується збільшенням розміру атома. Збільшення заряду ядра в підгрупах менше впливає на зв’язок зовнішнього електрона з ядром, ніж збільшення розміру атома і числа екранувальних електронів. Тому в межах підгруп s- і р-елементів зв’язок зовнішнього електрона з ядром зменшується, що приводить до зменшення енергії іонізації і посилення металічних властивостей. Виняток становлять підгрупи d-елементів, у межах яких при переході від 3d- до 5d-елементів енергія іонізації збільшується. Величина енергії іонізації може характеризувати металічні властивості елемента: вони тим вищі, чим менше значення І.
Деякі нейтральні атоми можуть приєднувати електрони – така властивість називається спорідненістю до електрона. Якщо при цьому виділяється енергія, то утворюються стійкі негативно заряджені йони, а якщо енергія поглинається, то утворюються нестійкі негативно заряджені йони. Кількісною мірою спорідненості до електрона є енергія спорідненості. Енергією спорідненості до електрона F називається енергетичний ефект процесу приєднання електрона до нейтрального атома з перетворенням його в негативно заряджений йон: Е + е [TEX]\rightarrow[/TEX]E– ± F, де символами Е і E– позначені відповідно нейтральний атом і негативно заряджений йон (аніон) деякого елемента, F – спорідненість до електрону, ē – електрон.
Величина енергії спорідненості до електрона F для атомів елементів має періодичну залежність від заряду ядра атома. Спорідненість до електрона залежить від електронної конфігурації атома та його хімічних властивостей.
Один і той самий атом залежно від умов може приєднувати електрони, виявляючи спорідненість до них, або віддавати електрони атому іншого елемента, у якого спорідненість до електрона більша.
Електронегативність (ЕН або c) – це узагальнена функція, що характеризує здатність атома даного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів тієї самої сполуки.
Поняття електронегативності є умовним, воно дозволяє оцінити відносну активність елемента і здатність його атомів набувати негативного заряду. Очевидно, ця здатність залежить від енергії іонізації та спорідненості до електрона: c = ½ (I1 + F).
Електронегативність певного елемента не є постійною. На неї впливають різні фактори: валентний стан елемента, тип сполук, до вмісту якої він входить тощо. У межах одного періоду із зростанням порядкового номера елемента спостерігається тенденція підвищення електронегативності, а в підгрупах – її зниження. Найменшими значеннями електронегативності характеризуються s-елементи першої групи, а найбільшими – р-елементи сьомої групи.



