6.1 ЗАГАЛЬНІ ПОНЯТТЯ ХІМІЧНОЇ КІНЕТИКИ
Хімічна кінетика – це розділ хімії, який вивчає швидкість і механізм перебігу хімічних реакцій. Хімічна кінетика вирішує дві конкретні задачі.
1) Визначення механізм реакції, тобто сукупності і послідовності елементарних стадій, через які проходить хімічна реакція від вихідних речовин до кінцевих продуктів.
Елементарні стадії – це проміжні одиничні процеси протягом хімічної реакції, які не можуть бути розділені на простіші акти хімічної взаємодії і які включають зіткнення реагуючих частинок, розрив зв'язків у вихідних сполуках, утворення проміжних продуктів і взаємодію між ними, виникнення нових зв'язків і одержання продуктів реакції.
Встановлення механізму пов'язано з класифікацією реакцій за молекулярність – характеристикою, яка визначається кількістю молекул, що беруть участь в елементарній стадії при взаємодії чи перетворенні частинок.
За молекулярністю розрізнюють такі реакції: мономолекулярні, бімолекулярні, тримолекулярні
2) Кількісний опис хімічної реакції за допомогою кінетичного рівняння – математичного виразу, який описує залежність швидкості реакції від концентрації речовин і дає можливість визначати змінення кількостей вихідних реагентів і продуктів реакції протягом її перебігу.
6.2 ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ
Швидкість хімічної реакції характеризує інтенсивність хімічного процесу, тобто кількість елементарних актів взаємодії або розкладу частинок протягом певного часу. Але взаємодія між частинками може відбуватися тільки при їх безпосередньому контакті, який певним чином визначається особливостями реакційного середовища, або реакційного простору. За фазовим складом реакційного простору розрізнюють такі реакції: гомогенні, які перебігають в одній фазі одночасно по всьому реакційному простору; гетерогенні, у яких між речовинами в реакційній системі існує поверхня поділу фаз.
Швидкість реакції J називається фізична величина, яка визначається кількістю речовини, що вступає в реакцію чи утворюється внаслідок реакції за одиницю часу в одиниці реакційного простору, тобто в одиниці об’єму для гомогенних реакцій чи на одиниці площі реакційної поверхні – для гетерогенних.
Середня швидкість реакції Jсер визначається різницею концентрацій DС речовини протягом певного часу Dt: Jср = (C2 – C1)/(t2 – t1) = ± DC/ Dt, де С2 і С1 – концентрації речовини у кінцевий t2 і початковий t1 моменти часу.
Однак концентрації речовин у хімічному процесі змінюються безперервно, тому правильніше говорити не про середню, а про істинна швидкість реакції, яка є похідною від концентрації за часом: Jіст = dC / dτ. Як істинну, так і середню швидкості реакції можна визначити графічно – через тангенс кута нахилу дотичної (Jіст = tg a) до кривої залежності концентрацій від часу чи через тангенс кута нахилу до січної (Jсер = tgβ).
6.2.1 ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ
ВІД КОНЦЕНТРАЦІЇ РЕАГЕНТІВ
Залежнність швидкості реакції від концентрації була встановлена Гульдбергом і Вааге і одержала назву закону діючих мас, або закон Гульдберга-Вааге: швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у ступенях, які дорівнюють стехіометричним коефіцієнтам, що стоять перед формулами відповідних речовин у рівнянні реакції.
Для реакції між умовними речовинами A і B з утворенням продуктів L і M, (буквами a, b, l и m позначені коефіцієнти) аА + bВ à lL + mM математичний вираз закону діючих мас має вигляд: J = k CА × CВ, де CА і CВ – концентрації вихідних реагентів А і В, k – константа швидкості, яка не залежить від концентрації реагентів, але залежить від їх природи і температури; k має такий фізичний зміст константи швидкості: при концентраціях вихідних реагентів СА=СВ=1 моль/л константа швидкості чисельно дорівнює швидкості реакції. Отже при T=const константа швидкості реакції між певними сполуками має сталу величину і характеризує природу реагуючих речовин.
Однак закон Гульдберга-Вааге виявився справедливим тільки для обмеженого кола реакцій з невеликими коефіцієнтами, тому було введено поняття про порядок реакції – експериментально визначену величину, що дорівнює показнику ступеня, до якого необхідно піднести концентрацію даного реагенту, щоб теоретично розрахована швидкість реакції дорівнювала встановленій практично. При цьому закон діючих мас набуває математичного вигляду, який має назву кінетичне рівняння:
![]()
де nA i nB – порядки реакції за відповідними реагентами, вони визначаються на практиці для кожної окремої реакції, а їх сума nА+nВ = n є загальним порядком реакції, який і характеризує механізм процесу. З урахуванням поняття порядок реакції можна уточнити сучасне формулювання закон діючих мас: швидкість реакції пропорційна добутку концентрацій реагентів у ступенях, що дорівнюють порядкам реакцій за відповідними реагентами. Реакції можуть мати різні порядки (1, 2, 3, а інколи – і дробові).
6.2.2 ЕНЕРГІЯ АКТИВАЦІЇ
Під час хімічної реакції руйнуються одні молекули та утворюються інші. Внаслідок перерозподілу енергії у системі виникають активні молекули, які внаслідок невпорядкованих зіткнень і перерозподілу енергії в системі набувають певного надлишку енергії та стають здатними до хімічної взаємодії.
Хімічна взаємодія відбувається за умови ефективні зіткнення між частинками, тобто таких, при яких енергія молекул є не тільки достатньою для розриву старих зв’язків у молекулах вихідних реагентів, але і перевищує енергію відштовхування (тобто енергетичний бар’єр) між електронними оболонками реагуючих частинок.
Під час ефективних зіткнень реакційна система проходить через проміжний стан, який називають активований комплекс – це перехідний стан системи у хімічній реакції, коли старі зв’язки в молекулах вихідних реагентів ще не розірвані, але вже послаблені, а нові намітилися, але ще не утворилися. Час існування активованого комплексу дуже невеликий (приблизно 10–13с). При його руйнуванні утворюються або продукти реакції, або знов вихідні речовини.
Енергія переходу речовини у стан активованого комплексу, яка дорівнює різниці між середньою енергією молекул системи і енергією, необхідною для перебігу хімічної реакції, називається енергія активації.
Під час хімічного процесу перехід системи від вихідних речовин з енергетичним станом Евих до продуктів реакції з енергетичним станом Епрод здійснюється через енергетичний бар’єр, який визначається енергією активації реакції Еакт. При цьому різниця енергій у вихідному і кінцевому станах дорівнює тепловому ефекту реакції:
DН = Епрод – Евих.
Графічно хід реакції зображується за допомогою енергетичної діаграми, в якій вісь ординат відображує енергію реакційної системи, а вісь абсцис – координату реакції, якою може бути будь-який контрольований параметр, що змінюється протягом реакції, наприклад: концентрація вихідної речовини чи продукту реакції, густина, об’єм газу, маса осаду тощо.
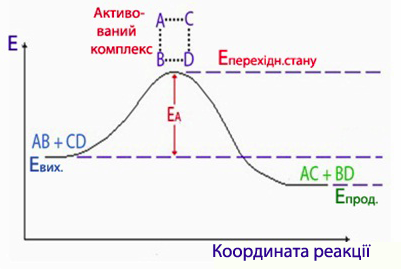
Рисунок – Енергетична діаграма реакції АВ+СDàАС+ВD, де ЕА – енергія активація, Евих. і Епрод. – середня енергія вихідних реагентів і продуктів реакції відповідно
6.2.3 ВПЛИВ ТЕМПЕРАТУРИ НА ШВИДКІСТЬ РЕАКЦІЇ
Вплив температури на швидкість реакції оцінюється за допомогою емпіричного правило Вант-Гоффа: підвищення температури на кожні 10 градусів збільшує швидкість реакції приблизно у 2-4 рази: J2 = J1× g(T2-T1)/10, де (Т2–Т1) = DТ – змінення температури, J1 і J2 – початкова і кінцева швидкість реакції, g – температурний коефіцієнт швидкості, який показує, у скільки разів зростає швидкість реакції при підвищенні температури на десять градусів. Якщо перетворити рівняння Вант-Гоффа, поділивши ліву і праву його частини на J1, одержимо рівняння вигляду
![]()
за допомогою якого легко обчислювати, у скільки разів швидкість реакції J2 при температурі Т2 більше (чи менше) швидкості J1 при температурі Т1.
Рівняння Вант-Гоффа зручно використовувати лише для приблизних розрахунків. Точніше вплив температури на швидкість реакції відображає рівняння Арреніуса :
![]()
де k – константа швидкості реакції, ЕА – енергія активації (для хімічних реакцій ЕА=40-400кДж/моль), k0 – передекспоненційний множник Арреніуса, пропорційний кількості зіткнень між молекулами.
6.3 КАТАЛІЗ
Каталізатор – це речовина, що збільшує швидкість реакції, кількісно і якісно при цьому не змінюючись. Явище змінювання швидкості реакції під впливом каталізатора називається каталіз. Речовина, яка уповільнює швидкість хімічних процесів, а сама при цьому не змінюється, називається інгібітор.
За своїм агрегатним станом каталізатори бувають твердими, рідкими і газоподібними, тому каталітичні процеси поділяються на гомогенні і гетерогенні.
Важливою властивістю каталізаторів є їх селективність (вибірність) – здатність спрямовувати взаємодію одних і тих же самих речовин у різних напрямках для одержання бажаних продуктів.
Каталітична активність багатьох каталізаторів зростає при додаванні невеликих кількостей промотор – каталітично неактивних речовин, присутність яких посилює дію каталізаторів. Наприклад, швидкість окиснення SO2 на каталізаторі V2O5 зростає у сотні разів при додаванні промоторів – сульфатів лужних металів.
У той же час існують речовини, які погіршують каталітичну активність каталізаторів – каталітична отрута.
7.4 ШВИДКІСТЬ ГЕТЕРОГЕННИХ РЕАКЦІЙ
Гетерогенні реакції відбуваються на поверхні поділу фаз, яка і вважається реакційним простором. Швидкість гетерогенної реакції називається зміна кількості речовини, що вступає в реакцію чи утворюється внаслідок неї за одиницю часу на одиниці площини поверхні фаз.
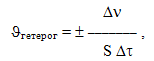
де Dn – різниця між кількістю речовини (Dn=n2–n1) в кінцевий t2 і початковий t1 моменти часу, S – площа поверхні. Необхідно зазначити, що площу поверхні твердого тіла не завжди легко виміряти, тому іноді швидкість гетерогенної реакції відносять не до одиниці поверхні, а до одиниці маси чи до одиниці об’єму більш конденсованої фази.
Особливістю кінетики гетерогенних реакцій є вплив площі реакційної поверхні на швидкість реакції, а також її залежність від швидкості подачі реагенту в реакційну зону і відведення продукту реакції звідти..
Більшість гетерогенних реакцій складається з трьох основних стадій: підведення однієї реагуючої речовини до поверхні іншої; хімічна взаємодія на поверхні; відведення продукту від поверхні. Найповільніша стадія, яка визначає швидкість реакції в цілому, називається лімітуючи стадія.
6.5 ХІМІЧНА РІВНОВАГА
6.5.1 НЕОБОРОТНІ ТА ОБОРОТНІ ХІМІЧНІ РЕАКЦІЇ
Необоротні реакції – це хімічні реакції, які перебігають лише у прямому напрямі і тривають до повного витрачання реагентів. Оборотні реакції – це хімічні реакції, які можуть відбуватися як у прямому, так і в зворотному напрямах.
6.5.2 УМОВА ХІМІЧНОЇ РІВНОВАГИ
Хімічна рівновага – такий стан системи, при якому концентрації всіх речовин залишаються незмінними, а швидкості прямої та зворотної реакцій є однаковими. Хімічна рівновага має динамічний характер. Це означає, що незмінність концентрації кожної речовини, що входить до складу реакційної системи, забезпечується не припиненням взаємодії, а тим, що швидкість прямої реакції дорівнює швидкості зворотної. З цієї причини кількість будь-якої речовини у системі, що витрачається внаслідок перебігу однієї реакції, компенсується за рахунок утворення такої ж кількості цієї речовини у результаті реакції в зворотному напрямку
6.5.3 КОНСТАНТА ХІМІЧНОЇ РІВНОВАГИ
У стані хімічної рівноваги концентрації вихідних речовин і продуктів реакції називаються рівноважні концентрації. Для реакції загального вигляду
aА + bВ « lL + mM
швидкості прямої (J1) і зворотної (J2) реакцій згідно з законом діючих мас дорівнюють:
J1 = k1 [A]a·[B]b, J2 = k2 [L]l·[M]m,
де за допомогою квадратних дужок позначені рівноважні концентрації речовин A, B, L і M, а буквами a, b, l і m – коефіцієнти перед формулами речовин. Але у стані хімічної рівноваги швидкості прямої та зворотної реакцій однакові (J1 = J2), тому можна прирівняти і праві частини виразів швидкостей:
k1 [A]a·[B]b = k2 [L]l·[M]m.
Якщо поділити ліву і праву частини одержаної рівності спочатку на k2, а потім – на добуток концентрацій вихідних речовин [A]a·[B]b, то після необхідних скорочень одержимо вираз
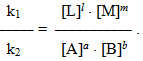
При даній температурі константи швидкості прямої k1 і зворотної k2 реакцій є величинами сталими, тому їх відношення k1/k2 теж стала величина, яка позначається великою літерою К і називається константою рівноваги:
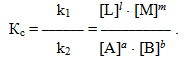
Останні рівняння є варіантами математичного виразу закон діючих мас для стану рівноваги: При постійній температурі відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у ступенях, що дорівнюють стехіометричним коефіцієнтам (або точніше, порядкам реакції за відповідними реагентами), являє собою сталу величину і називається константа рівноваги.
6.5.4 ВПЛИВ ЗОВНІШНІХ ЧИННИКІВ НА ХІМІЧНУ РІВНОВАГУ
Стан хімічної рівноваги за постійних умов може зберігатися будь-який час. Проте при змінюванні умов стан рівноваги порушується. Процес змінювання концентрацій речовин, викликаний порушенням стану рівноваги, називається зміщення, або зсув хімічної рівноваги.
Характер зміщення рівноваги залежно від дії зовнішніх чинників визначається за принцип Ле-Шательє: Якщо на систему, що перебуває у стані хімічної рівноваги, подіяти зовнішнім чинником, то рівновага зміщується у напрямі процесу, який послаблює цю дію.
З принципу Ле Шательє випливає ряд загальних наслідків:
· при збільшенні концентрації деякої речовини, що бере участь у рівновазі, рівновага зміщується у бік витрачання цієї речовини; при зменшенні концентрації – у бік її утворення;
· при підвищенні температури рівновага системи, що перебуває у стані рівноваги, зміщується у напрямку ендотермічної реакції, а при зниженні – у бік екзотермічної;
· підвищення тиску приводить до зміщення рівноваги у бік утворення меншої кількості молекул газу (тобто речовин, які займають менший об¢єм), а при зниженні тиску – у бік утворення більшої кількості молекул газу;
· якщо об¢єм системи під час реакції не змінюється, то змінювання тиску не впливає на стан рівноваги;
· каталізатор, однаково прискорюючи і пряму і зворотну реакції, не зміщує рівновагу, але сприяє її скорішому встановленню.



