- 7.1 Загальні уявлення про дисперсні системи
- 7.2 Істинні розчини. Основні поняття
- 7.3 Утворення розчинів
- 7.4 ΔН = ΔНруйн + ΔНсольв + ΔНдиф
- 7.5 Концентрація розчинів
- 7.6 Розчинність
- 7.7 Загальні властивості розчинів
- 7.8 Приклади розв'язання типових задач
Ключові терміни:
1. Грубодисперсні системи, 2. Тонкодисперсні (або мікрогетерогенні) системи, 3. Колоїдно-дисперсні (або ультрамікрогетерогенні) системи, Ідеальний розчин, Газоподібні розчини, Дисперсна система, Дисперсна фаза, Дисперсійне середовище, Емульсія, Коефіцієнт розчинності γ, Концентрація розчинів, Масова частка, Мольна частка, Моляльна концентрація, Молярна концентрація еквівалента, Молярна концентрація, або молярність СМ, Осмотичний тиск, Піна, Розчин, Рідкі розчини, Суспензія, Тверді розчини, Тверді розчини вкорінення, Тверді розчини заміщення, Титр Т, азеотроп, азеотропний розчин, гідратація, гідрати, децимолярний розчин, другий закон Рауля, ебуліоскопія, закон Вант-Гоффа, закон Генрі, закон еквівалентів щодо обмінних реакцій, закон розподілення Нернста-Шилова, зворотний осмос, колігативні властивості, кристалогідрати, кристалосольвати, критична температура розчинення, кріоскопія, моляльність, насичений розчин, ненасичений розчин, нормальна концентрація, нормальність СN, осмос, пересичений розчин, перший (тонометричний) закон Рауля, розчинність, розчинність s:, сантимолярний розчин, сольватація, сольвати, істинний розчин7.1 Загальні уявлення про дисперсні системи
Хімічна взаємодія під час гомогенних реакцій відбувається при зіткненні частинок по всьому об'єму реакційного середовища, а під час гетерогенних – на поверхні поділу фаз при контакті реагуючих речовин, причому швидкість реакції є тим більшою, чим сильніше розвинена поверхня. З цих позицій особливо важливими є дисперсні системи, які характеризуються великою питомою поверхнею.
Дисперсна система – це суміш, що складається як мінімум з двох речовин, які хімічно не взаємодіють одна з одною і відрізняються практично повною взаємною нерозчинністю. Отже, дисперсна система містить щонайменше два компоненти, тому розрізняють два поняття: дисперсна фаза і дисперсійне середовище (рис. 7.1).
Дисперсна система – суміш, в якій дуже подрібнені частинки однієї речовини рівномірно розподілені в об’ємі іншої.
Дисперсна фаза – це диспергована речовина, тобто та частина дисперсної системи, яка рівномірно розподілена в об’ємі іншої речовини.
Дисперсійне середовище – це середовище, в якому рівномірно розподілені частинки дисперсної фази. Ознакою дисперсійного середовища є його безперервність.
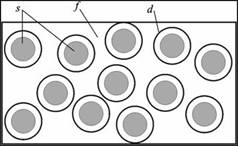
Рисунок 7.1 – Дисперсна система: s – частинки дисперсної фази (у вигляді дрібних твердих кристаликів, крапель рідини, бульбашок газу, асоціатів молекул чи йонів), d – адсорбційний шар, f – однорідне дисперсійне середовищі
Дисперсну фазу можна відділити від дисперсійного середовища фізичним способом (центрифугуванням, сепаруванням, відстоюванням тощо).
Класифікація за ступенем дисперсності. Залежно від розмірів частинок дисперсної фази дисперсні системи умовно поділяються на три групи.
1. Грубодисперсні системи, в яких розмір частинок перебільшує 10–4-10–5 м. Ця група дисперсних систем характеризується певними ознаками: частинки дисперсної фази осідають (або спливають) у полі гравітаційних сил, не проходять крізь паперові фільтри; їх можна роздивитися у звичайному мікроскопі. До них належать суспензії, емульсії, пил, піна тощо.
Суспензія – це дисперсна система, в якій дисперсною фазою є тверда речовина, а дисперсійним середовищем – рідина.
Прикладом суспензії може бути система, що утворюється при збовтуванні глини чи крейди у воді, барви, пасти.
Емульсія – це дисперсна система, в якій рідка дисперсна фаза рівномірно розподілена в об’ємі рідкого дисперсійного середовища, тобто емульсія складається з двох взаємно нерозчинних рідин.
До емульсій належить, приміром, молоко (в ньому дисперсною фазою виступають краплини жиру, а дисперсійним середовищем – вода), маргарин, морозиво, майонез, вершки (рис. 7.2).
При відстоюванні суспензії та емульсії розділяються (розшаровуються) на складові частини: дисперсну фазу і дисперсійне середовище. Так, якщо збовтати бензен з водою, то утворюється емульсія, яка через деякий час розділяється на два шари: верхній бензеновий і нижній водний (рис. 7.3). Для запобігання розшаровуванню емульсій в них додають емульгатори – речовини, що надають емульсіям агрегатну стабільність.
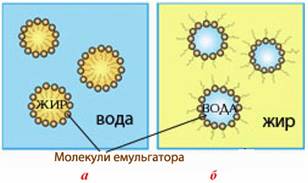
Рисунок 7.2 – Структура емульсій: а) дисперсна система, що містить рідку дисперсну фазу (жир) і рідке дисперсійне середовище (вода); б) дисперсна система, в якій дисперсною фазою є вода, а дисперсійним середовищем – рідкий жир (олія)

Рисунок 7.3 – Емульсії: а) дисперсна система, що складається з рідкої дисперсної фази (олія) і рідкого дисперсійного середовища (води); б) розшаровування емульсії на складові частини
Піна – комірчаста грубодисперсна система, в якій дисперсною фазою є сукупність бульбашок газу (чи пари), а дисперсійним середовищем – рідина.
У пінах загальний об'єм газу, що міститься у бульбашках, може у сотні разів перебільшувати об’єм рідкого дисперсійного середовища, який знаходиться у прошарках між бульбашками газу.
2. Тонкодисперсні (або мікрогетерогенні) системи з розміром частинок 10–5–10–7 м. До них належать тонкі зависі, дими, поруваті тверді тіла.
3. Колоїдно-дисперсні (або ультрамікрогетерогенні) системи, в яких частинки розміром 1–100 нм (10–9–10–7 м) складаються з 103_109 атомів і між ними та розчинником виникає поверхня поділу. Колоїдні розчини характеризуються гранично-високодисперсним станом, їх звичайно називають золями, або часто ліозолями, щоб підкреслити, що дисперсійним середовищем є рідина (ліос – рідкий). Якщо дисперсійним середовищем є вода, такі золі називають гідрозолями, а якщо органічна рідина — органозолями.
Для більшості колоїдних розчинів притаманні такі ознаки:
- невелика швидкість дифузії та відсутність здатності проходити через напівпроникні мембрани;
- частинки дисперсної фази (колоїдні частинки) можна роздивитися лише за допомогою ультрамікроскопа чи електронного мікроскопа;
- розсіювання променів світла колоїдними частинками, внаслідок чого в ультрамікроскопі вони мають вигляд світних цяток, що перебувають у безперервному хаотичному русі – ефект Тиндаля (рис.7.4);
- присутність стабілізаторів (йонів електролітів), які утворюють на поверхні поділу фаз іонний шар або сольватну оболонку, що забезпечує існування частинок у суспендованому стані;
- дисперсна фаза має малу розчинність у дисперсійному середовищі.
В якості прикладів колоїдних систем можна навести крохмаль, білки, полімери, каучук, мила, гідроксиди алюмінію та феруму.
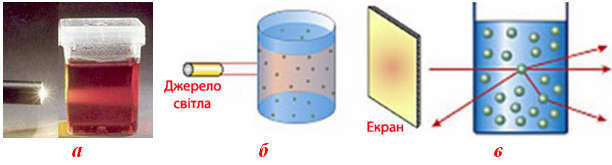
Рисунок 7.4 – Ультрамікрогетерогенна (тонкодисперсна) система: а) колоїдний розчин; б) розсіювання світла колоїдним розчином (ефект Тиндаля); б) схема відхилення тонкого променю світла при проходженні через колоїдний розчин
7.2 Істинні розчини. Основні поняття
Якщо дисперсна фаза подрібнена до розмірів молекул та йонів (менш 10–9 м), між частинками дисперсної фази і дисперсійного середовища зникає поверхня поділу, система стає гомогенною, – утворюється істинний розчин, або просто розчин.
Розчин – це гомогенна термодинамічно стійка система змінного складу, яка містить декілька компонентів: розчинник, розчинену речовину (одну чи декілька) та продукти їх взаємодії.
Розчини належать до рівноважних однорідних систем, які досягли мінімуму енергії Гіббса за рахунок взаємодії частинок внаслідок усіх можливих типів взаємодії між ними. Відмінними ознаками істинних розчинів є відсутність поверхні поділу між компонентами, що зумовлює прозорість і високу стійкість розчинів, тому вони самочинно не розділяються на складові частини протягом тривалого часу (рис. 7.5).
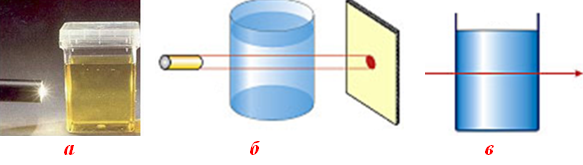
Рисунок 7.5 – Істинний розчин: а) прозорий водний розчин; б) точкова пляма світла на екрані після проходження тонкого променя світла через істинний розчин; в) схема проходження променя світла через істинний розчин без відхилення
Розчини мають як спільні риси з механічними сумішами і хімічними сполуками, так і відмінності від них. Подібно до механічних сумішей розчини мають змінний склад, але, на відміну від них, розчин неможливо розділити на компоненти простими фізичними методами (фільтруванням, відстоюванням тощо). Останнє цілком справедливо і для хімічних сполук, які здебільшого характеризуються сталим складом.
Залежно від агрегатного стану розчини поділяються на три групи, кожна з яких має свої особливості.

Рисунок 7.6 – Агрегатний стан розчинів: а) газоподібний; б) рідкий
- Газоподібні розчини – це суміш газів, що не взаємодіють між собою (рис. 7.6а), наприклад, повітря (суміш N2, O2, CO2 та ін.), природний газ.
- Рідкі розчини – це однофазні гомогенні системи (рис. 7.6б), що утворюються при розчиненні газоподібних, рідких або твердих речовин у рідкому розчиннику, роль яких можуть відігравати неорганічні речовини (найчастіше – це вода, рідкий амоніак, безводна сульфатна чи оцтова кислоти) або органічні сполуки (метанол спирти, ацетон, бензен, тетрахлорометан тощо).
- Тверді розчини, які можуть утворюватися солями, металами чи оксидами. Тверді розчини поділяються на два типи:
- Тверді розчини заміщення (рис. 7.7а), компоненти яких мають однотипну кристалічну решітку і близькі розміри частинок;
- Тверді розчини вкорінення(рис. 7.7б) утворюються внаслідок закріплення молекул, атомів чи йонів однієї речовини у пустотах кристалічної решітки іншої речовини.
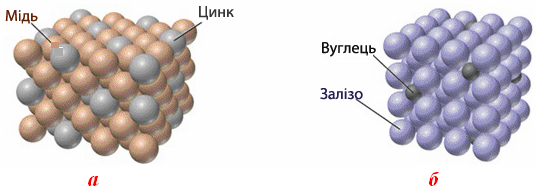
Рисунок 7.7 – Тверді розчини: а) заміщення; б) вкорінення
7.3 Утворення розчинів
Фізична теорія розчинів (Вант-Гофф, Арреніус) розглядає процес розчинення як просте розподілення (диспергування) однієї речовини в усьому об’ємі іншої. Згідно з цією теорією властивості розчинів повинні залежати лише від концентрації розчиненої речовини. Відповідно до фізичної теорії, розчинник – це індиферентне середовище, в якому хаотично розподілені частинки розчиненої речовини.
Хімічна теорія розчинів (Д.І.Менделєєв) розглядає розчин як динамічну систему, між рівноцінними компонентами якої – розчинником і розчиненою речовиною – відбувається хімічна взаємодія.
Сучасна теорія розчинів (Каблуков, Кістяковський) є поєднанням фізичної і хімічної теорій. Відповідно до неї процес розчинення є складною сукупністю фізико-хімічних явищ, серед яких виділяють три основні етапи.
- Руйнування структури речовини, що розчиняється. На руйнування хімічних і міжмолекулярних зв’язків необхідно витратити певну енергію, тому цей етап супроводжується поглинанням теплоти і зростанням ентальпії: ΔНруйн>0.
-
Хімічна взаємодія (рис. 7.8а) розчинника з частинками речовини – так звана сольватація (або гідратація, якщо розчинником є вода). При цьому утворюються сольвати (або гідрати) – нестійкі хімічні сполуки частинок розчиненої речовини з молекулами розчинника (або води) (рис. 7.8б).
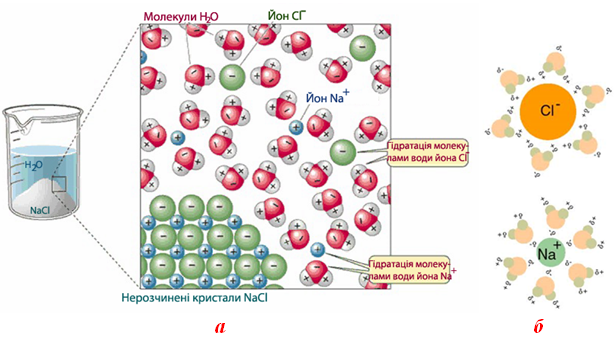
Рисунок 7.8 – Утворення розчину солі: а) схема розчинення кристалів NaCl; б) гідратовані йони Na+ і Cl–
Завдяки виникненню нових зв’язків у процесі сольватації, енергія вивільняється і спостерігається виділення теплоти. Ентальпія системи при цьому зменшується: ΔНсольв<0. Слід зазначити, що зменшення ентальпії системи залежить від розмірів йонів, які піддаються сольватації: чим меншим є радіус йона, тим сильніше він сольватується.
Утворення сольватів супроводжується зовнішніми ознаками, наприклад, зміненням об’єму при змішуванні етанолу С2Н5ОН з водою, виділенням теплоти внаслідок розчинення Н2SO4 у воді, зміненням забарвлення (білий CuSO4 утворює синій розчин, сині кристали CoCl2 – рожевий). Навіть забарвлення різних розчинів однієї сполуки відрізняються залежно від природи розчинника. Наприклад, при гідратації солі кобальту (II) водний розчин набуває рожевого кольору, а при сольватації цієї ж солі в ацетоні – блакитного. Цікаво, що при випаровуванні води-розчинника із розчину залишається рожевий осад складу CoCl2.6Н2О, а при випаровуванні ацетону-розчинника – блакитний осад складу CoCl2.6(CH3)2CO. Це – кристалосольвати.
Отже, існування сольватів (гідратів) у розчинах підтверджується можливістю виділення з них твердих сполук – їх називають кристалосольвати (кристалогідрати – у випадку, коли розчинником є вода), у кристалічній гратці яких міститься деяка кількість молекул розчинника. Так, якщо білі кристали CuSO4 розчинити у воді, розчин набуває синього забарвлення внаслідок утворення гідратів. При тривалому обережному нагріванні такого розчину в осад випадають кристали синього кольору складу CuSO4•5H2O (п’ятиводний кристалогідрат купрум (ІІ) сульфату). Якщо нагріти цей кристалогідрат до більш високої температури, кристалізаційна вода випаровується, а у твердій фазі залишається безводний білий порошок CuSO4 (відеоролік 1) . Подібним чином поводять себе більшість солей і деякі представники інших класів неорганічних сполук. З неводних розчинів теж вдається добувати тверді кристалосольвати. Наприклад, з метиловим спиртом утворюються кристалосольвати складу CaCl2•6CH3OH, Mg(ClO4)2•6CH3OH.
Відеоролік 1 – Руйнування та утворення кристалогідрату CuSO4•5H2O
-
Самочинний процес рівномірного розподілення сольватів (гідратів) у розчиннику, що пов’язаний з дифузією і вимагає витрати енергії. Ентальпія системи при цьому зростає: ΔНдиф>0. Сумарний тепловий ефект процесу розчинення
7.4 ΔН = ΔНруйн + ΔНсольв + ΔНдиф
може бути додатним (ендотермічне розчинення) чи від’ємним (екзотермічне розчинення - відеоролик 2).
Відеоролік 2 – Екзотермічний процес розчинення натрій гідроксиду
Якщо у воді розчиняються гази чи рідини, то енергія ΔНруйн для розриву зв’язків невелика і розчинення супроводжується виділенням теплоти (ΔНрозч-ня<0). При розчиненні кристалічних речовин, руйнування решітки потребує значної витрати енергії. Тому розчинення твердих речовин у воді частіше протікає з поглинанням теплоти (ΔНрозч-ня>0) і належить до ендотермічних процесів.
Процес розчинення відбувається самочинно (ΔG<0) до досягнення розчином стану насичення. Однак тепловий ефект (ΔН) і змінення ентропії (ΔS) можуть бути як від’ємними, так і додатними. Розчинення газів супроводжується виділенням теплоти (ΔН<0) і зменшенням ентропії (ΔS<0). Відповідно до рівняння ΔG=ΔH–TΔS самочинному розчиненню газів сприяють низькі температури. Чим вища температура, тим більша імовірність, що величина ТΔS досягне значення ΔН, а рівність ТΔS=ΔН відповідає стану рівноваги при розчиненні (ΔG=0), тобто насиченню розчину.
Розчинення кристалічних речовин часто відбувається з поглинанням теплоти (ΔН<О) і зростанням ентропії (ΔS>0). Згідно з рівнянням ΔG=ΔH–TΔS самочинному розчиненню кристалічних речовин у воді сприяють високі температури. При низьких температурах можливо, що добуток ТΔS не досягатиме значення ΔН і енергія Гіббса процесу буде додатною (ΔG>0), тобто розчинення самочинно не відбуватиметься.
7.5 Концентрація розчинів
Важливою кількісною характеристикою розчинів вважається їх концентрація.
Концентрація розчинів – це величина, що характеризує кількість розчиненої речовини, яка міститься у певній кількості розчину або припадає на певну кількість розчинника.
Для якісної оцінки концентрації розчину використовують терміни: розведений і концентрований, однак межі між ними досить умовні. Для точного вираження концентрації розчину застосовують декілька способів.
-
Масова частка ω – це величина, яка визначається відношенням маси розчиненої речовини (mреч) до маси усього розчину (mрозч) і вимірюється у частках одиниці:
-
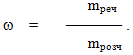 (7.1)
(7.1) -
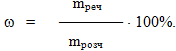 (7.2)
(7.2)
Однак іноді масову частку виражають у відсотках – у цьому випадку її можуть називати відсотковою концентрацією, або масовою часткою у відсотках:
З рівняння (7.2) зрозуміло, що відсоткова концентрація показує, скільки грамів розчиненої речовини mреч міститься у 100г розчину.
-
-
Молярна концентрація, або молярність СМ– це величина, що дорівнює відношенню кількості розчиненої речовини (νреч) до об’єму розчину (Vрозч), виміряному в літрах:
-
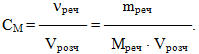 (7.3)
(7.3)
Молярність розчину виражається у [моль/л], але замість цієї розмірності дозволено позначати її великою літерою М, наприклад, записи 2 моль/л H2SO4 і 2М H2SO4 є рівноцінними. Вони вказують на розчин сульфатної кислоти, в одному літрі якого міститься 2 моль H2SO4. Розчини, в 1 л яких міститься 0, 1моль і 0,01 моль розчиненої речовини називаються відповідно децимолярний розчин і сантимолярний розчин.
-
-
Молярна концентрація еквівалента, або нормальна концентрація, або нормальність СN – це величина, що визначається відношенням кількості еквівалентів (nекв) розчиненої речовини до об’єму розчину (Vрозч), виміряному в літрах:
-
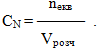 (7.4)
(7.4) -
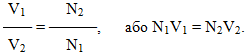 (7.5)
(7.5)
Молярна концентрація еквівалента, або нормальна концентрація, виражається у [моль-екв/л], чи просто [моль/л]. По аналогії з молярною концентрацією нормальність позначають буквою N (рідше – н), наприклад, запис 0,25N (0,25н) тотожний запису 0,25моль-екв/л. Розчини називають деци- і сантинормальними, якщо вони містять відповідно 0,1 моль і 0,01 моль еквівалентів розчиненої речовини в одному літрі.
Нагадаємо, що еквівалентом називається така реальна або умовна частка речовини, яка в обмінних реакціях може заміщувати, приєднувати або вивільняти 1 атом чи 1 йон гідрогену.
За допомогою нормальної концентрації можна виразити окремий випадок закон еквівалентів щодо обмінних реакцій у розчинах: взаємодія між розчинами відбувається в об’ємних співвідношеннях, обернено пропорційних їх нормальностям (молярним концентраціям еквівалентів):
Цей вираз дозволяє робити певні обчислення і за відомими даними однієї сполуки знаходити невідому величину (N чи V) іншої, з якою перша сполука пов’язана стехіометричним співвідношенням, наприклад:
-
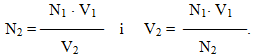 (7.6)
(7.6)
-
-
Моляльна концентрація, або моляльність Сm – це величина, яка визначається відношенням кількості розчиненої речовини (νреч) до маси розчинника (mрозч-ка), виміряної у кілограмах:
-
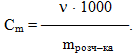 (7.7)
(7.7)
Отже, моляльність показує число молів розчиненої речовини, що приходиться на 1 кг (1000 г) розчинника, тому вона виражається у [моль/кг]. Як правило, у більшості стехіометричних розрахунків кількість речовини (ν) звичайно вимірюють у моль, а масу розчинника (mрозч–ка) – у грамах, тому для приведення моляльної концентрації до відповідної розмірності у числівнику рівняння (7.7) необхідно ставити число 1000. Якщо ж маса розчинника буде виміряною у кг, тоді перемножувати числівник на 1000 не потрібно.
-
-
Мольна частка χ – це величина, що визначається відношенням кількості розчиненої речовини n1 до загальної кількості всіх речовин у розчині (тобто суми числа молів розчиненої речовини ν1 і числа молів розчинника ν2). Раніше мольна частка позначалася великою літерою N, але в останній час уведене нове позначення – грецькою буквою χ (хі), тому необхідно брати до уваги обидва варіанти:
-
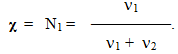 (7.8)
(7.8)
-
-
Титр Т – це величина, що визначається відношенням маси розчиненої речовини до об’єму розчину, виміряному у літрах.
-
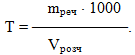 (7.9)
(7.9)
-
Інакше кажучи, титр показує, скільки грамів розчиненої речовини міститься в 1 мл розчину, тому вимірюється в [г/мл]. Відносно формули (7.9) знов необхідно привести деякі пояснення. Число 1000 у числівнику ставиться у тому випадку, коли об’єм розчину виміряний у літрах. Якщо об’єм виражається у мл, то числівник на 1000 перемножувати не слід.
7.6 Розчинність
Здатність речовини рівномірно розподілятися по всьому об’єму розчинника називається розчинність.
За розчинністю у воді усі речовини поділяються на три групи.
- Добре розчинні речовини, наприклад, цукор, натрій хлорид, натрій гідроксид (тверді); етиловий спирт, ацетон (рідкі); хлороводень, амоніак (гази).
- Малорозчинні: кальцій сульфат, свинець (тверді речовини); діетиловий етер, бензен (рідини); кисень, азот, метан (гази).
- Нерозчинні: скло, срібло, золото (тверді речовини); гас, рослинні масла (рідини); гелій, неон, аргон (гази).
Кількісною характеристикою розчинності можуть виступати дві величини: коефіцієнт розчинності γ, яким найчастіше користуються в інженерних розрахунках, і розчинність s, до якої зазвичай звертаються у розрахунках з аналітичної хімії.
Коефіцієнт розчинності γ – це величина, що показує, скільки грамів речовини може максимально розчинитися у 100 г розчинника при даній температурі.
Наприклад, запис γ18Pb(NO3)2=51,7 означає, що при 180С у 100 г води може максимально розчинитися 51,7 г солі Pb(NO3)2. Якщо у такий розчин внести ще декілька кристаликів Pb(NO3)2, то вони за даною температури розчинятися не будуть, а залишаються в осаді. Але між осадом і розчиненою речовиною у розчині встановлюється динамічна рівновага: одночасно здійснюється часткове розчинення осаду і кристалізація речовини із розчину, причому обидва процеси відбуваються з однаковими швидкостями (рис. 7.9б).
Розчин, у якому за даної температури речовина більш не розчиняється і встановлюється динамічна рівновага між розчиненою речовиною у розчині та її осадом, називається насичений розчин, а молярна концентрація насиченого розчину – розчинність s:
s = CM(насич).
Отже, розчинність s – це молярна концентрація речовини в насиченому розчині, тому s виражається у [моль/л], її використовують для розрахунків поряд із коефіцієнтом розчинності γ.
Розчин, що містить менше розчиненої речовини, ніж необхідно для його насичення, називається ненасичений розчин.
У ненасиченому розчині відбувається самочинний процес розчинення твердої фази, внаслідок якого вся речовина опиняється у розчині (рис. 7.9а).
Поняття «насичені» й «ненасичені» розчини не слід ототожнювати з поняттями «концентровані» та «розведені» розчини. Існує багато малорозчинних речовин (СаСО3, СаSO4), насичені розчини яких мають низьку концентрацію.
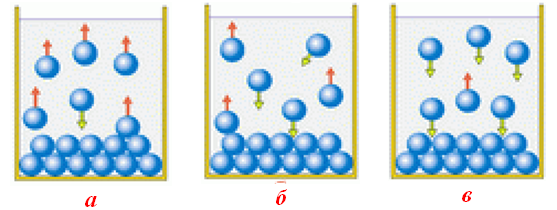
Рисунок 7.9 – Співвідношення між кількістю частинок, що випадають в осад і розчиняються у розчині: а)ненасиченому; б)насиченому; в)пересиченому
Деякі речовини можуть утворювати так звані пересичені розчини (рис. 7.9 в), в яких концентрація розчиненої речовини перебільшує величину розчинності s.
Розчин, в якому при певній температурі міститься більше розчиненої речовини, ніж це зумовлено межею розчинності, називається пересичений розчин.
Проте на відміну від термодинамічно стійких ненасичених і насичених розчинів, пересичений розчин є метастабільною (нестійкою) системою. Тому надлишкова кількість речовини (відносно значення розчинності) миттєво випадає в осад навіть при незначному зовнішньому втручанні (відеоролик 3), а розчин при цьому перетворюється на насичений. Пересичені розчини одержують за допомогою спеціальних методів, наприклад, при дуже повільному і обережному охолодженні насичених розчинів. (рис. 7.10).

Рисунок 7.10 – Утворення пересиченого розчину Na2S2O3: а) нагрівання твердого кристалогідрату натрій тіосульфату Na2S2O3·5H2O; б) за рахунок води, що містилася у кристалогідраті та вивільнилася при його нагріванні, відбувається розчинення безводної твердої фази (Na2S2O3) і утворення метастабільного пересиченого розчину; в) при незначному зовнішньому втручанні (постукування по колбі скляною паличкою) надлишок розчиненого Na2S2O3 миттєво випадає в осад, утворюючи кристали натрій тіосульфату у всьому об’ємі
Відеоролік 3 – Миттєве осадження надлишкової кількості розчиненої речовини з метастабільного пересиченого розчину
На розчинність речовин впливають як зовнішні умови, так і співвідношення між хімічною природою речовини і розчинника. Тут діє відома закономірність, на яку звертав увагу ще Д.І.Менделєєв: подібне розчиняється в подібному. Це означає, що речовини з неполярним ковалентним зв’язком краще розчиняються в неполярних розчинниках і, навпаки, речовини з полярним ковалентним або іонним зв’язком краще розчиняються в полярних розчинниках. Так, кисень, у молекулах якого здійснюється неполярний ковалентний зв’язок, добре розчиняється у неполярному бензені і погано – у полярному розчиннику – воді.
7.6.1 Розчинність газів
Для газів характерна залежність розчинності від тиску і температури. Крім того, необхідно враховувати хімічну природу газу і можливість його взаємодії з розчинником. Так, за однакових зовнішніх умов розчинності N2 i NH3 у воді неоднакові, оскільки амоніак утворює гідрат (NH3 + H2O⇔NH3 • H2O), у той час як молекулярний азот з водою не реагує.
Розчинність газів виражається кількістю літрів (а інколи кількістю грамів) розчиненого газу в 1 л розчинника. Наприклад, при кімнатній температурі в 1 л Н2О розчиняється близько 700 л NH3 і лише 0,02 л N2.
Залежність розчинності газів від тиску виражає закон Генрі:
розчинність газів у рідині за умов сталої температури прямо пропорційна його парціальному тиску
- m = k • Р,(7.10)
де m – маса газу, що розчиняється в 1 л розчинника, Р – тиск газу (або парціальний тиск, коли має місце суміш газів), k – коефіцієнт, що характеризує природу розчину.
А при сталому тиску розчинність газів зменшується з підвищенням температури. Тому кип’ятіння розчину дає змогу практично повністю позбутися розчинених у воді газів. Проте є випадки, коли цього досягти неможливо. Так, при нагріванні 37-38%-ного розчину HCl спочатку виділяється газоподібний хлороводень, а при концентрації 20,2% і температурі 1100С починає кипіти нероздільна суміш HCl i H2O.
Розчин, що не розділяється на компоненти при температурі кипіння, називається азеотропний розчин, або азеотроп.
Азеотропні суміші дуже часто утворюються і в системі рідина-рідина. Наприклад, вода і етанол утворюють азеотропну суміш, що містить 95,6% С2Н5ОН в 4,4% Н2О і має температуру кипіння 78,150С.
7.6.2 Розчинність рідин
При змішуванні двох рідин може спостерігатися декілька випадків:
- Рідини розчиняються одна в одній у будь яких масових чи об’ємних співвідношеннях. Прикладом таких бінарних систем можуть бути системи: вода-етанол, вода-гліцерин, бензол-гексан, ацетон-етанол та ін.
- Рідини, здатні до обмеженої взаємної розчинності за певної температури. При нагріванні взаємна розчинність рідин збільшується і при деякій температурі настає необмежена взаємна розчинність компонентів системи. Температура, при якій обмежена розчинність компонентів переходить у необмежену, називається критична температура розчинення. Наприклад, якщо змішувати анілін з водою, то після відстоювання утворюються дві рідкі фази: верхня – водна, насичена аніліном, і нижня – анілінова, насичена водою. При нагріванні цієї суміші до критичної температури (1680 С) двохфазна система перетворюється на гомогенну однофазну систему внаслідок досягнення взаємної необмеженої розчинності компонентів. Іноді необмежена взаємна розчинність настає не при підвищенні, а навпаки, при зниженні температури. До систем, які мають нижні критичні температури розчинення, належить суміш триметиламіну і води (Ткр=12,50С), триметилпіридину і води (Ткр=570С).
- Рідини практично не розчиняються одна в одній. До таких систем належать системи: вода-бензен, вода-ртуть, вода-циклогексан та ін. Для цього випадку спостерігається цікаве явище: одночасна розчинність третього компоненту в двох рідинах, які перебувають у контакті, але не змішуються між собою. Це явище описує закон розподілення Нернста-Шилова: при сталій температурі незалежно від кількості внесеної речовини відношення рівноважних концентрацій цієї речовини між двома рідинами, що не змішуються, є сталою величиною:
- Крозп = СА / СВ,(7.11)
- де Крозп – коефіцієнт розподілення;
- СА і СВ – молярні концентрації третього компоненту у рідинах (фазах) А і В.
- Наприклад, коефіцієнт розподілення І2 між С2Н5ОН і СS2 при 180С дорівнює 2,8, між CCl4 i H2O – 85, а між CS2 i H2O – 413. Отже, коефіцієнт розподілення показує, у скільки разів розчинність третього компонента більша у фазі А, ніж у фазі В. Закон розподілення лежить в основі концентрування і очищення рідин методом екстракції, який використовується для розділення продуктів радіоактивного розпаду елементів АЕС, добування металів із руд, виділення органічних сполук з рослинної сировини, очищення лікарських препаратів, а також у розподілювальній хроматографії.
7.6.3 Розчинність твердих речовин
Розчинність різних твердих речовин в одному і тому ж розчиннику може змінюватися у широких межах. При підвищенні температури здебільшого розчинність твердих тіл зростає, проте для деяких сполук вона може зменшуватися. Зменшення розчинності з підвищенням температури характерне для речовин, розчинення яких супроводжується виділенням теплоти. Це, наприклад, вапно Са(ОН)2, гіпс СаSO4•2H2O.
У деяких випадках змінення розчинності при підвищенні температури зумовлене зміною складу твердої фази, що насичує розчин. Наприклад, розчинність кристалогідрату Na2SO4•10H2O збільшується при нагріванні до 32,40С, але при цій температурі Na2SO4•10H2O зневоднюється, а розчинність Na2SO4 вже зменшується з підвищенням температури.
Дані щодо розчинності індивідуальних солей при різних температурах наводяться у спеціальних довідниках. Залежність розчинності твердих речовин від температури покладено в основу метода очищення сполук перекристалізацією.
7.7 Загальні властивості розчинів
Загальні, або колігативні властивості розчинів – це такі, що залежать лише від їх концентрації та природи розчинника і не залежать від складу розчинених речовин.
Колігативні властивості можуть повною мірою виявлятися тільки в ідеальних розчинах.
Ідеальний розчин – це розчин, в якому не відбувається хімічної реакції між компонентами, а сили міжмолекулярної взаємодії між усіма молекулами однакові.
Утворення ідеальних розчинів не супроводжується тепловим ефектом (ΔН=0) і кожний компонент поводить себе незалежно від інших компонентів. До ідеальних розчинів за своїми властивостями наближаються лише дуже розведені розчини неелектролітів.
До колігативних властивостей належать зниження тиску насиченої пари розчинника над розчином, зниження температури замерзання і підвищення температури кипіння розчинів, а також осмотичний тиск.
Для опису стану речовини та її фазових перетворень звичайно користуються змінними – тиском Р і температурою Т, за допомогою яких зображують криві рівноваги при фазових переходах сполуки. Діаграма, побудована у згаданих змінних, називається діаграмою стану (рис. 7.11), вона дозволяє визначити, які фазові переходи відбуваються під час тих чи інших процесів. Кожній точці на діаграмі відповідає певний рівноважний стан.
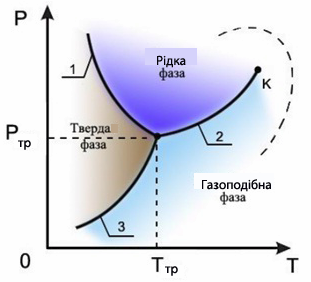
Рисунок 7.11 – Діаграма стану речовини, що характеризує залежність тиску насиченої пари від температури: 1 – крива плавлення, 2 – крива випаровування, 3 – крива возгонки (або сублімації); К – критична точка, в якій зникають відмінності між рідкою та газоподібною фазами речовини; Ртр і Ттр – координати потрійної точки, в якій речовина одночасно може перебувати у трьох агрегатних станах
7.7.1 Закони Рауля
Будь-яка рідина, що знаходиться у відкритій посудині, поступово зменшує свій об'єм завдяки випаровуванню: молекули рідини переходять у газову фазу і віддаляються від поверхні. Однак, якщо рідина перебуває в закритій посудині (рис.7.12а), то внаслідок випаровування молекули накопичуються над поверхнею, а частина з них – піддається зворотному процесу – конденсації і повертається в рідину (рис. 7.12б). У деякий момент встановлюється динамічна рівновага між процесами випаровування і конденсації – отже, пара стає насиченою (рис. 7.12в).
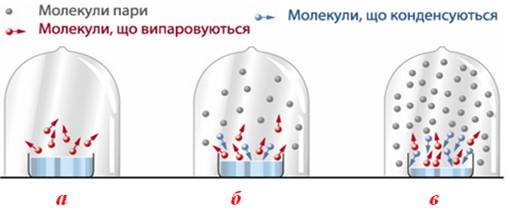
Рисунок 7.12 – Утворення насиченої пари
При сталій температурі тиск насиченої пари чистої рідини (розчинника) – величина постійна. Але досвід свідчить, що при розчиненні у цій рідині якоїсь іншої речовини тиск насиченої пари завжди знижується. Це пояснюється тим, що молекули розчиненої нелеткої речовини перешкоджають випаровуванню з розчину молекул розчинника (рис. 7.13), оскільки, по-перше, зв’язують певну кількість молекул розчинника на утворення сольватів і, по-друге, займають частину поверхні, зменшуючи площу випаровування.
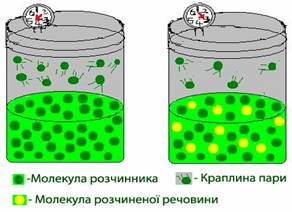
Рисунок 7.13 – Кількість молекул розчинника, що випаровуються з розчину, менше у порівнянні з чистим розчинником, тому тиск насиченої пари у посудині з розчином нижчий, ніж у посудині з чистим розчинником
На діаграмі фазового стану тиск насиченої пари над чистим розчинником А у широкому інтервалі температур дає певну криву (рис. 7.14). Однак при вимірюванні тиску насиченої пари розчинів А1 і А2, концентрації розчинених речовин в яких складають відповідно С1 і С2, криві на діаграмі тиск-температура будуть розташовуватися нижче кривої, що відносилася до чистого розчинника А (рис. 7.14).
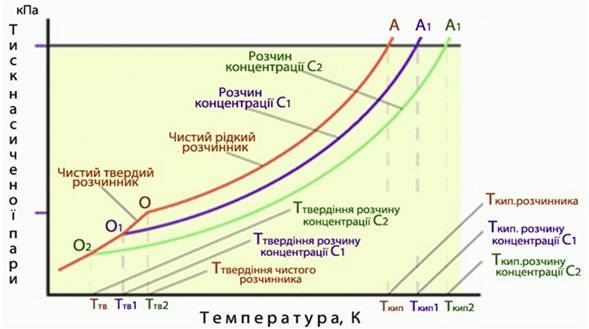
Рисунок 7.14 – Залежність тиску насиченої пари над чистим розчинником А і над розчинами А1 і А2, концентрації розчинених речовин в яких складають відповідно С1 і С2
Отже, за умов сталої температури тиск насиченої пари розчинника над розчином менший, ніж над чистим розчинником. При цьому зниження тиску насиченої пари розчинника над розчином тим помітніше, чим вища концентрація розчину. Цю залежність виражає перший (тонометричний) закон Рауля:
зниження тиску насиченої пари розчинника над розчином пропорційне мольній частці нелеткої розчиненої речовини
- Р0А – РА = ΔРА = Р0А χВ,(7.12)
- де Р0А і РА тиск насиченої пари розчинника А відповідно над чистим розчинником і над розчином,
- ΔРА – зниження (або депресія) тиску насиченої пари;
- χВ – мольна частка розчиненої речовини В.
Враховуючи, що мольна частка розчиненої речовини дорівнює χB = νB/(νA + νB), рівняння (7.12) можна переписати у вигляді:
-
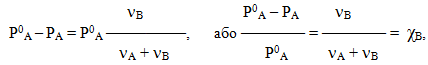 (7.13)
(7.13)
звідки видно, що відносне зниження тиску, яке позначається виразом {(Р0А–РА)/Р0А}, дорівнює мольній частці розчиненої речовини.
Для дуже розведених розчинів, коли νВ << νА, рівняння (7.13) спрощується:
-
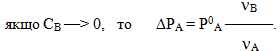 (7.14)
(7.14)
З розглянутих рівнянь випливає, що зниження тиску насиченої пари розчинника над розчином не залежить від природи розчиненої речовини, а зумовлюється лише її концентрацією.
Зважаючи на те, що кількість розчиненої речовини дорівнює відношенню її маси до молярної маси (νВ = mB/MB), можна перетворити рівняння (7.14)
-
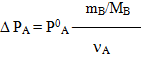 (7.15)
(7.15)
і знайти молярну масу розчиненої речовини:
-
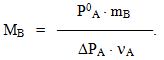 (7.16)
(7.16)
Тиск насиченої пари розчинника над розчином впливає на температури кипіння і замерзання (кристалізації) розчинів (рис.7.15). Зменшення цього тиску спричиняє підвищення температури кипіння або зниження температури кристалізації розчину порівняно з відповідними температурами для чистого розчинника.
Підвищення температури кипіння розчину зумовлюється тим, що кипіння відбувається за умови, коли тиск насиченої пари розчинника над розчином стає рівним атмосферному тиску. А це трапляється при температурі, вищій, ніж температура кипіння чистого розчинника.
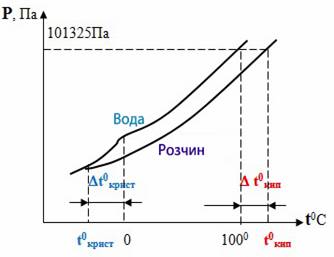
Рисунок 7.15 – Криві залежності тиску насиченої пари на чистою водою і над водним розчином
Аналогічно і зниження температури замерзання (кристалізації, твердіння) зумовлюється нижчим тиском насиченої пари розчинника над розчином, ніж над чистим розчинником. Цю залежність встановлює другий закон Рауля:
підвищення температури кипіння або зниження температури замерзання розчину прямо пропорційне моляльній концентрації розчиненої речовини:
- Δ Ткип = КЕ • Сm,(7.16)
- Δ Тзам = КК • Сm(7.17)
- де Сm – моляльна концентрація, що показує кількість речовини ν, розчиненої у 1кг розчинника;
- КЕ і КК – відповідно ебуліоскопічна і кріоскопічна константи, які визначаються природою розчинника і не залежать від складу та концентрації розчиненої речовини
Фізичний зміст цих сталих випливає з рівнянь (7.16) і (7.17) при розгляданні випадку, коли Сm=1моль/1кг. Тоді КЕ і КК чисельно дорівнюють відповідно підвищенню температури кипіння і зниженню температури замерзання одномоляльних розчинів порівняно з температурою кипіння і температурою замерзання чистого розчинника. Ебуліоскопічну КЕ і кріоскопічну КК константи вимірюють у градусах, їх значення для різних розчинників наводяться у довідниках.
Якщо в рівняння (7.16) і (7.17) підставити вираз моляльної концентрації, то другий закон Рауля можна виразити інакше:
-
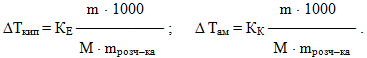 (7.18)
(7.18)
Користуючись рівняннями (7.18), визначають молярну масу розчиненої речовини за даними щодо підвищення температури кипіння чи зниження температури замерзання:
-
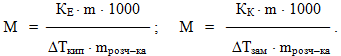 (7.19)
(7.19)
Визначення молярних мас речовин за величиною підвищення температури кипіння або зниження температури замерзання розчинів називається відповідно ебуліоскопія і кріоскопія. Ці методи використовуються для встановлення складу сполук, визначення ступеня дисоціації електролітів, вивчення процесів полімеризації у розчинах. Здатність розчинів замерзати при нижчій температурі, ніж чистий розчинник, застосовується для приготування різних охолоджувальних сумішей і розчинів з низькою температурою замерзання – антифризів для циліндрів двигунів при їх експлуатації у зимовий період. Наприклад, 66,7% водний розчин етиленгліколю замерзає лише при температурі –750С.
7.7.2 Закон осмотичного тиску
Самочинний перехід розчинника через напівпроникну мембрану, що розділяє розчин і розчинник або два розчина різної концентрації, називається осмос.
Осмос зумовлюється різницею тиску насиченої пари розчинника над розчином і над чистим розчинником (чи більш розведеним розчином). Якщо між такими розчинами поставити напівпроникну мембрану або перегородку, яка пропускає тільки молекули розчинника і затримує молекули розчиненої речовини, то молекули розчинника дифундують крізь неї із розчинника у розчин або з більш розведеного розчину у більш концентрований (рис. 7.16).
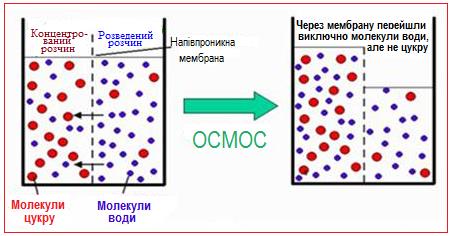
Рисунок 7.16 – Осмос: схема переходу молекул розчинника через напівпроникну мембрану з більш розведеного розчин у більш концентрований
Осмотичний тиск вимірюють за допомогою простих приладів – осмометрів, в яких внаслідок переходу молекул розчинника з розведеного розчину в концентрований збільшується висота стовпа h, а отже, і гідростатичний тиск (рис. 7.17).
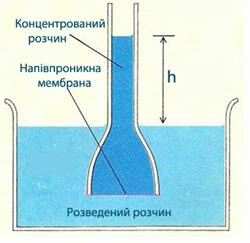
Рисунок 7.17 – Осмометр – прилад для визначення осмотичного тиску
Кількісно осмос характеризується величиною осмотичного тиску.
Осмотичний тиск – це такий тиск що дорівнює силі, яка припадає на одиницю площини поверхні і примушує молекули розчинника проходити через напівпроникну мембрану.
Інакше кажучи, осмотичний тиск дорівнює тиску стовпа розчину висотою h. Він характеризує надлишковий гідростатичний тиск на розчин, відділений від чистого розчинника напівпроникною
мембраною, при якому припиняється дифузія молекул розчинника у більш концентрований розчин. Цей тиск прагне зрівняти концентрації обох розчинів внаслідок зустрічної дифузії молекул розчиненої речовини і розчинника.
Осмос – процес динамічний, оскільки проникнення молекул розчинника через мембрану відбувається в обох напрямках. Динамічна рівновага встановлюється лише тоді, коли осмотичний тиск π урівноважується зовнішнім тиском Р; при цьому осмос припиняється.
Для обчислення осмотичного тиску використовують закон Вант-Гоффа:
Осмотичний тиск розчину чисельно дорівнює тиску, який чинила б розчинена речовина, якби вона при тій самій температурі перебувала б у газоподібному стані і займала об'єм, що дорівнює об'єму розчину.
Вант-Гофф припустив, що для осмотичного тиску можна застосувати універсальне рівняння стану ідеального газу Менделєєва-Клапейрона:
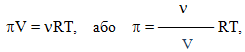
звідки
- π = СМRT,(7.20)
- де π – осмотичний тиск {[Па] = [Дж]/[м]3},
- СМ – молярна концентрація розчину (СМ=ν/V=m/M•V).
За відомим значенням осмотичного тиску легко обчислити молярну масу речовини:
-
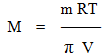 (7.21)
(7.21)
Якщо до більш концентрованого розчину докласти зовнішній тиск, вищий за осмотичний, тобто Рзовн>π, то швидкість переходу молекул розчинника із концентрованого розчину почне переважати і розчинник буде переходити у розведений розчин (або у чистий розчинник). Цей процес називається зворотний осмос (рис. 7.18), він використовується для очищення природних і стічних вод, для одержання питної води з морської води.
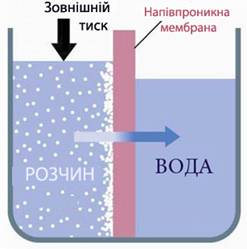
Рисунок 7.18 – Зворотний осмос
Осмос відіграє важливу роль у життєдіяльності тварин і рослин, оскільки кліткова плазматична мембрана є напівпроникною. Осмос зумовлює піднімання води по стеблині рослин, зріст клітин та багато інших явищ, забезпечуючи надходження води у біологічні структури. Осмотичний тиск буває досить значним. Так, під дією осмотичного тиску рослинний сік дерева секвої доставляється на висоту аж до 100 м. Не меншу роль відіграє осмотичний тиск і у клітинах живих організмів, які містять розчини солей та інших речовин (цукру, сечовини тощо). Наприклад, середній осмотичний тиск крові при 360С дорівнює 780 кПа.
Осмотичний тиск рідини, що контактує з клітиною, може різним чином співвідноситися з внутрішньоклітинним тиском. Якщо осмотичний тиск вищий, ніж внутрішньоклітинний, то він називається гіпертонічним (рис. 7.19а). Клітини, занурені у такий розчин, починають втрачати воду, протоплазма клітки стискається і відшаровується від оболонки – це явище так званого плазмолізу. Розчин навколо клітини, що має менший тиск, ніж внутрішньоклітинний, називається гіпотонічним (рис. 7.19в). Вода завдяки осмотичному тиску поступає у клітину, протопласт при цьому збільшується в об'ємі і натискає на жорстку клітинну стінку – це явище тургора. Розчини з однаковим осмотичним тиском всередині клітини та ззовні називаються ізотонічними (рис. 7.19 б), вони не впливають на водний режим клітини.
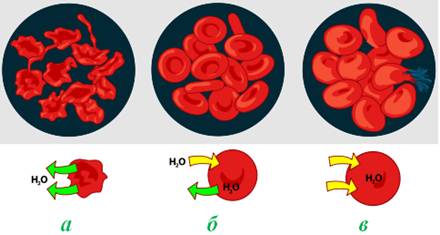
Рисунок 7.19 – Роль осмосу при взаємодії червоних кров’яних тілець з зовнішньоклітинними розчинами: а) в гіпертонічному розчині відбувається дифузія води з клітини, що зумовлює її стискання (плазмоліз); б) ізотонічний розчин врівноважує осмотичний тиск, створений клітинною рідиною; в) у гіпотонічному розчині за рахунок осмотичного тиску вода проходить всередину клітини і забезпечує тургор, але здатна привести і до розриву кліткової стінки
7.8 Приклади розв'язання типових задач
Приклад 7.1. Розрахувати маси солі і води, що потрібні для приготування 70 г розчину, в якому ω(NaCl) = 0,10.
Розв'язок. Перетворимо вихідну формулу (ω=mреч/ mрозч) і обчислимо масу речовини у розчині:
mреч = ω•mрозч,
m(NaCl) = 0,10•70 = 7г.
Тоді маса води буде дорівнювати:
m(H2O) = mрозч – mреч = 70 – 7 = 63г.
Приклад 7.2. У 100 г води розчинили 20 г солі. Визначити масову частку одержаного розчину.
Розв’язок. Спочатку знайдемо загальну масу розчину, яка складається з мас солі та води:
mр-ну = mсолі + mводи = 20г + 100г = 120г.
Масова частка складатиме:
ω = mpеч.·100% / mр-ну = 20г·100% / 120г = 16,66 %.
Приклад 7.3. Натрій гідроксид кількістю речовини 1,5 моль розчинили у 140 г води. Визначити масову частку NaOH у розчині.
Розв’язок. Обчислимо масу NaOH з урахуванням співвідношення між кількістю речовини, масою та молярною масою
(ν = m / M):
m(NaOH) = ν · M = 1,5моль · 40г/моль = 60г.
Маса усього розчину складається з маси NaOH і маси води:
m(р-ну) = 140г + 60г = 200г.
Знайдемо масову частку натрій гідроксиду в розчині:
ω = mpеч.·100% / mр-ну = 60г·100% / 200г = 30 %.
Приклад 7.4. Чому дорівнює молярна концентрація розчину сульфатної кислоти з масовою часткою речовини 98% і густиною розчину 1,84 г/мл?
Розв'язок: Розрахуємо масу 1 л (або 1000 мл) розчину:
mрозч = ρ • V = 1,84 г/мл • 1000 мл = 1840 г.
Перетворимо вихідну формулу
![]()
і знайдемо масу розчиненої речовини
m(H2SO4) = ω • mрозч / 100 %= 98% • 1840 г / 100 % = 1803,2 г.
Тоді молярна концентрація:
СМ = m(H2SO4)/ М(H2SO4)• V = 1803,2 г / 98г/моль • 1 л = 18,4 моль/л.
Приклад 7.5. У трьох склянках міститься по 100 мл 0,1М розчину Na2SO4 з густиною 1,012 г/мл. До однієї з них додали 60 мл води, до іншої – 10 г сухого Na2SO4, а з третьої випарили 20 г води. Як змінилася масова частка у кожному випадку?
Розв'язок. Для визначення масової частки вихідного розчину ωвих спочатку необхідно обчислити масу розчину
mрозч = ρ•V = 1,012 г/мл × 100 мл = 101,2 г
і масу речовини Na2SO4, вважаючи об'єм 100 мл = 0,1 л і молярну масу солі M(Na2SO4) = 142 г/моль:
m(Na2SO4) = CM • M (Na2SO4) • V = 0,1 моль/л • 142 г/моль • 0,1 л = 1,42 г.
Тоді масова частка вихідного розчину:
ωвих = m(Na2SO4)/ mрозч = 1,42г / 101,2г = 0,014 (або 1,4 %).
Після того, як у першу склянку долили воду, масса одержаного розчину збільшилися на масу води
m(H2O) = ρ • V = 1г/мл • 60мл = 60г,
тобто маса першого розчину:
mрозч1 = mрозч + m(H2O) = 101,2г + 60г = 161,2г,
а масова частку ω1 у ньому:
ω1 = m(Na2SO4)/ mрозч1= 1,42г / 161,2г = 0,0088 (або 0,88%).
Отже, у першій склянці масова частка зменшилась у
ωвих / ω1 = 0,014/ 0,0088= 1,6 рази.
У другій склянці після додавання 10г Na2SO4 маса розчину складає:
mрозч2 = 101,2г + 10г = 111,2г,
а маса речовини в ньому:
m(Na2SO4)2 = 1,42г + 10г = 11,42г.
Масова частка у другому розчині:
ω2 = m(Na2SO4)2/ mрозч2= 11,42г / 111,2г = 0,1027 (або 10,27 %).
Масова частка у другому розчині зросла у
ω2/ωвих = 0,1027/ 0,014 = 7,3 рази.
Маса розчину у третій склянці після випаровування 20г води дорівнює:
mрозч3 = 101,2г – 20г = 81,2г.
Беручи до уваги, що маса речовини не змінилася, обчислимо масову частку у третьому розчині:
ω3 = m(Na2SO4)/ mрозч3 = 1,42г / 81,2г = 0,0175 (або 1,75%).
Отже, у третьому розчині масова частка теж зросла у
ω3/ωвих = 0,0175/ 0,014= 1,2 рази.
Приклад 7.6. Внаслідок змішування 20% розчину (ρ1=1,12г/мл) нітратної кислоти з 30% розчином (ρ2=1,20г/мл) цієї ж кислоти одержали 200мл 24% розчину HNO3, густина якого ρ3=1,15г/мл. Розрахувати такі параметри: a) об'єми вихідних розчинів V1 i V2; б) молярну концентрацію СМ одержаного розчину.
Розв'язок. Всі величини, що стосуються одержаного розчину, будемо позначати індексом 3.
а) Спочатку знайдемо масу одержаного розчину mр–ну3 і масу речовини m(HNO3)3 в ньому:
mр–ну3 = ρ3 • V3 = 1,15г/мл • 200мл = 230г;
m(HNO3)3 = ω3 • mр–ну3 = 0,24 • 230 = 55,2г.
Для подальших розрахунків позначимо: Vр–ну1 = х і Vр–ну2 = у. Тоді маси вихідних розчинів складатимуть:
mр–ну1 = ρ1 • V1 = 1,12x,
mр–ну2 = ρ2 • V2 = 1,20y.
Маси речовини HNO3 в цих розчинах дорівнюватимуть:
m(HNO3)1 = ω1 • mр–ну1 = 0,20 • 1,12 х = 0,224х,
m(HNO3)2 = ω2 • mр–ну2 = 0,30 • 1,20 у = 0,360у.
Приймаючи до уваги, що маса HNO3 у кінцевому розчині складається з мас HNO3 вихідних розчинів (тобто 55,2=0,224х+0,360у), а маса самого одержаного розчину – із мас вихідних розчинів (230=1,12х+1,20у), маємо систему рівнянь:
![]()
Розв'язуючи систему, одержуємо невідомі величини: х = 123, у = 77.
Тобто шукані об'єми розчинів:
Vр–ну1 = 123мл; Vр–ну2 = 77мл.
б) Молярна концентрація визначається відношенням кількості розчиненої речовини до об’єму розчину (виміряного у літрах: Vр–ну3 = 200мл = 0,2л):
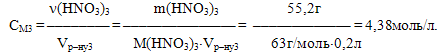
Отже, СМ = 4,38М.
Приклад 7.7. Коефіцієнт розчинності CuSO4 при 250С дорівнює 25г. Скільки грамів солі міститься у 200г насиченого розчину?
Розв'язок. Маса насиченого розчину складається з маси солі і маси води. Коефіцієнт розчинності CuSO4 показує, що 25г солі розчиняється у 100г води, тобто в такому випадку усього насиченого розчину утворюється 125г. А далі складемо пропорцію:
![]()
Звідки маса CuSO4 у 200г насиченого розчину:
х = 200 • 25/ 125= 40г.
Приклад 7.8. Визначити тиск насиченої пари розчинника над розчином, одержаним при розчиненні 12г карбаміду СО(NH2)2 у 180г води, при 1000С.
Розв'язок. Молярні маси речовин у розчині:
М(СО(NH2)2) = 60г/моль, М(Н2О) =18г/моль.
Кількість речовини карбаміду і води:
ν(СО(NH2)2) = m /М = 12/60 = 0,2моль;
ν(Н2О) = m /М = 180/18 = 10моль.
Згідно з тонометричним законом Рауля зниження тиску (Р10 – Р1) насиченої пари розчинника над розчином пропорційне мольній частці розчиненої речовини:
Р10 – Р1 = Р10 χ2,
а мольна частка розчиненої речовини визначається з формули χ2 = ν1 /(ν1+ ν2),
звідки маємо вираз для обчислення тиску насиченої пари
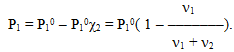
Підставимо в одержаний вираз відповідні дані:
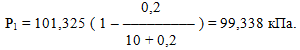
Приклад 7.9. Обчислити молярну масу неелектроліту, якщо тиск насиченої пари розчинника над його 8%-ним розчином в етиловому спирті при 200С становить 7,02кПа, а тиск пари над чистим розчинником при тій самій температурі – 7,22кПа.
Розв'язок. В кожних 100г 8%-ного розчину міститься 8г неелектроліту і 92г етилового спирту. Молярна маса етилового спирту М(С2Н5ОН) = 46г/моль, а молярну масу неелектроліту позначимо Мнеел. Тоді мольна частка неелектроліту
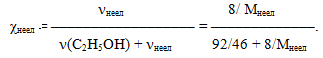
Скористуємось виразом тонометричного закона Рауля (7.13):
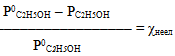
Підставивши у вираз (7.13) відповідні значення:
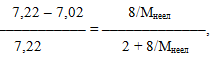
одержимо молярну масу неелектроліту: Мнеел = 140 г/моль.
Приклад 7.10. У 0,9л води розчинено 54г глюкози С6Н12О6. Розрахувати змінення тиску насиченої пари над розчином, а також температури кипіння і замерзання цього розчину.
Розв'язок. Маса 0,9л (або 900мл) води дорівнює 900г, вважаючи, що густина води 1г/мл. Молярна маса глюкози
М(С6Н12О6) = 180г/моль.
Для обчислення зниження тиску насиченої пари розчинника (тобто води – у нашому прикладі) над розчином глюкози скористаємось рівнянням (7.13):
![]()
Тиск насиченої пари води при її кипінні Р0Н2О = 101325Па, тоді
![]()
![]()
Ебуліоскопічна і кріоскопічна константи для води
КЕ = 0,520, КК = 1,860.
Згідно з другим законом Рауля підвищення температури кипіння і зниження температури замерзання розчину пропорційне моляльній концентрації розчиненої речовини:
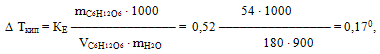
![]()
За умов атмосферного тиску температури кипіння і замерзання води відповідно становлять 373,15К (1000С) і 273,15К (00С), тому температури кипіння і замерзання розчину глюкози дорівнюватимуть:
Ткип = ТН2О + ΔТкип = 373,15 + 0,17 = 373,32К,
Тзам = ТН2О - ΔТзам = 273,15 – 0,62 = 272,53К.
За шкалою Цельсія це складає:
tкип = 100 + 0,17 = 100,17о С,
tзам =0 – 0,62 = –0,62оС.
Приклад 7.11. Яку масу гліцерину С3Н8О3 необхідно розчинити у 100г води, щоб одержаний розчин закипів при 1010С?
Розв'язок. Молярна маса гліцерину і підвищення температури кипіння розчину дорівнюють:
М(С2Н8О3) = 92г/моль;
ΔТкип = Ткип. розчину – Ткип. Н2О = 101–100= 1о.
Із другого закону Рауля
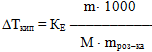
маємо масу гліцерину, яку необхідно розчинити у 100г води для підвищення температури кипіння на один градус:
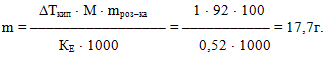
Приклад 7.12. Визначити молекулярну масу аніліну, якщо його розчин з концентрацією 1% і густиною 1г/мл при 00С має осмотичний тиск 244кПа.
Розв'язок. Нехай маса розчину дорівнює 100г. Оскільки густина розчину 1г/мл, то його об'єм складає:
V= m/ρ = 100г / 1г/мл= 100 мл = 0,1л.
За формулою (7.21) розрахуємо молярну масу аніліну
![]()
Відносна молекулярна маса чисельно співпадає з молярною масою, тому Mr(аніліну) = 93.
Приклад 7.13. Визначити осмотичний тиск при 7оС для розчину, у 200мл якого міститься 11,4г цукру С12Н22О11.
Розв'язок. Молярна маса цукру М(С12Н22О11) =342г/моль, об'єм розчину 200мл = 0,2л. Молярна концентрація цукрового розчину:
![]()
Після переведення температури до шкали Кельвіна (Т = 7 + 273 = 280К) знайдемо осмотичний тиск:
π = СМ RT = 0,17 • 8,314 • 280 = 388 кПа.



