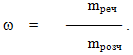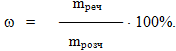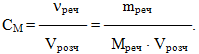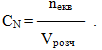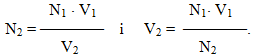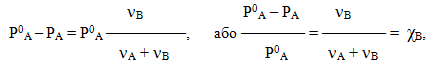7.1. Загальні уявлення про дисперсні системи
Дисперсна система – це суміш, що складається як мінімум з двох речовин, які хімічно не взаємодіють одна з одною і відрізняються практично повною взаємною нерозчинністю. Отже, Дисперсна система – це така система, в якій дуже подрібнені частинки однієї речовини рівномірно розподілені в об’ємі іншої. Дисперсна фаза – це диспергована речовина, тобто та частина дисперсної системи, яка рівномірно розподілена в об’ємі іншої речовини. Дисперсійне середовище – це середовище, в якому рівномірно розподілені частинки дисперсної фази. Ознакою дисперсійного середовища є його безперервність.
Класифікація за ступенем дисперсності:
- Грубодисперсні системи, в яких розмір частинок перебільшує 1-10 мкм (10–4-10–5м). До них належать суспензії, емульсії, пил, піна тощо.
- Тонкодисперсні (або мікрогетерогенні ) системи з розміром частинок 10–5–10–7 м. До них належать тонкі зависі, дими, поруваті тверді тіла.
- Колоїдно-дисперсні (або ультрамікрогетерогенні) системи, в яких частинки розміром 1–100 нм (10–9–10–7 м) складаються з 103_109 атомів і між ними та розчинником виникає поверхня поділу. Колоїдні розчини називають золями, або часто ліозолями, щоб підкреслити, що дисперсійним середовищем є рідина. Якщо дисперсійним середовищем є вода, такі золі називають гідрозолями, а якщо органічна рідина — органозолями.
7.2. Істинні розчини. Основні поняття
Якщо дисперсна фаза подрібнена до розмірів молекул та йонів (менш 10–9 м), між частинками дисперсної фази і дисперсійного середовища зникає поверхня поділу, система стає гомогенною. При цьому утворюється істинний розчин (або просто розчин) – гомогенна термодинамічно стійка система змінного складу, яка містить декілька компонентів: розчинник, розчинену речовину (одну чи декілька) та продукти їх взаємодії.
Відмінними ознаками істинних розчинів є відсутність поверхні поділу між компонентами, що зумовлює прозорість і високу стійкість розчинів, тому вони самочинно не розділяються на складові частини протягом тривалого часу.
Залежно від агрегатного стану розчини поділяються на три групи: 1) газоподібні розчини – суміш газів, що не взаємодіють між собою; 2) рідкі розчини – однофазні гомогенні системи, що утворюються при розчиненні газоподібних, рідких або твердих речовин у рідкому розчиннику; 3) тверді розчини, які поділяються на два типи: тверді розчини заміщення, компоненти яких мають однотипну кристалічну решітку і близькі розміри частинок, і тверді розчини вкорінення, що утворюються внаслідок закріплення молекул, атомів чи йонів однієї речовини у пустотах кристалічної решітки іншої речовини.
7.3. Утворення розчинів
Відповідно до сучасної теорії розчинів процес розчинення є складною сукупністю фізико-хімічних явищ, серед яких виділяють три основні етапи.
- Руйнування структури речовини, що розчиняється. На руйнування хімічних і міжмолекулярних зв’язків необхідно витратити певну енергію, тому цей етап супроводжується поглинанням теплоти і зростанням ентальпії: ΔНруйн>0;
- Хімічна взаємодія розчинника з частинками речовини –так звана сольватація (або гідратація, якщо розчинником є вода). При цьому утворюються сольвати (або гідрати) – нестійкі хімічні сполуки частинок розчиненої речовини з молекулами розчинника (або води). Завдяки виникненню нових зв’язків у процесі сольватації, енергія вивільняється і спостерігається виділення теплоти. Ентальпія системи при цьому зменшується: ΔНсольв<0;
- Самочинний процес рівномірного розподілення сольватів (гідратів) у розчиннику, що пов’язаний з дифузією і вимагає витрати енергії. Ентальпія системи при цьому зростає: ΔНдиф>0. Сумарний тепловий ефект процесу розчинення (ΔН=ΔНруйн+ΔНсольв+ΔНдиф) може бути додатним (ендотермічне розчинення) чи від’ємним (екзотермічне розчинення).
7.4. Концентрація розчинів
Концентрація розчинів – це величина, що характеризує кількість розчиненої речовини, яка міститься у певній кількості розчину або припадає на певну кількість розчинника. Для вираження концентрації розчину застосовують декілька способів.
-
Масова частка ω – це величина, яка визначається відношенням маси розчиненої речовини (mреч) до маси усього розчину (mрозч) і вимірюється у частках одиниці. Однак іноді масову частку виражають у відсотках. Відсоткова концентрація показує, скільки грамів розчиненої речовини mреч міститься у 100г розчину.
-
Молярна концентрація, або молярність СМ [моль/л] – це величина, що дорівнює відношенню кількості розчиненої речовини (νреч) до об'єму розчину (Vрозч), виміряному в літрах:
Розчини, в 1 л яких міститься 0, 1моль і 0,01 моль розчиненої речовини – це відповідно децимолярний розчин і сантимолярний розчин.
-
Молярна концентрація еквівалента, або нормальна концентрація, або нормальність СN[моль-екв/л] – це величина, що визначається відношенням кількості еквівалентів (nекв) розчиненої речовини до об`єму розчину (Vрозч), виміряному в літрах:
Розчини називають деци- і сантинормальними, якщо вони містять відповідно 0,1 моль і 0,01 моль еквівалентів розчиненої речовини в одному літрі.
За допомогою нормальної концентрації можна виразити закон еквівалентів щодо обмінних реакцій у розчинах: взаємодія між розчинами відбувається в об’ємних співвідношеннях, обернено пропорційних їх нормальностям (молярним концентраціям еквівалентів):
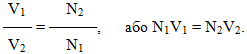
-
Моляльна концентрація, або моляльність Сm [моль/кг] – це величина, яка визначається відношенням кількості розчиненої речовини (νреч) до маси розчинника (mрозч-ка), виміряної у кілограмах:
- [TEX]C_m=\frac{\nu\cdot{1000}}{m_{розч-ка}} [/TEX]
-
Мольна частка χ (бо N) – це величина, що визначається відношенням кількості розчиненої речовини ν1 до загальної кількості всіх речовин у розчині (тобто суми числа молів розчиненої речовини ν1 і числа молів розчинника ν2):
7.5. Розчинність
Здатність речовини рівномірно розподілятися у всьому об’єму розчинника називається розчинність. За розчинністю у воді усі речовини поділяються на три групи: добре розчинні, малорозчинні. нерозчинні речовини.
Кількісною характеристикою розчинності можуть виступати дві величини: коефіцієнт розчинності γ і розчинність s.
Коефіцієнт розчинності γ – це величина, що показує, скільки грамів речовини може максимально розчинитися у 100 г розчинника при даній температурі.
Розчин, у якому за даної температури речовина більш не розчиняється і встановлюється динамічна рівновага між розчиненою речовиною у розчині та її осадом, називається насичений розчин, а молярна концентрація насиченого розчину – розчинність s [моль/л] (s = CM(насич)). Розчин, що містить менше розчиненої речовини, ніж необхідно для його насичення, називається ненасичений розчин. Розчин, в якому при певній температурі міститься більше розчиненої речовини, ніж це зумовлено межею розчинності, називається пересичений розчин.
7.5.1. Розчинність газів
Для газів характерна залежність розчинності від тиску і температури. Розчинність газів виражається кількістю літрів (а інколи кількістю грамів) розчиненого газу в 1 л розчинника. Залежність розчинності газів від тиску виражає закон Генрі: розчинність газів у рідині за умов сталої температури прямо пропорційна його парціальному тиску m = k • Р, де m – маса газу, що розчиняється в 1 л розчинника, Р – тиск газу (або парціальний тиск, коли має місце суміш газів), k – коефіцієнт, що характеризує природу розчину.
Розчин, що не розділяється на компоненти при температурі кипіння, називається азеотропний розчин, або азеотроп.
7.5.2. Розчинність рідин
При змішуванні двох рідин може спостерігатися декілька випадків:
- Рідини розчиняються одна в одній у будь яких масових чи об’ємних співвідношеннях;
- Рідини, здатні до обмеженої взаємної розчинності за певної температури. При нагріванні взаємна розчинність рідин збільшується і при деякій температурі настає необмежена взаємна розчинність компонентів системи. Температура, при якій обмежена розчинність компонентів переходить у необмежену, називається критична температура розчинення.
- Рідини практично не розчиняються одна в одній. Для цього випадку спостерігається цікаве явище: одночасна розчинність третього компоненту в двох рідинах, які перебувають у контакті, але не змішуються між собою. Це явище описує закон розподілення Нернста-Шилова: при сталій температурі незалежно від кількості внесеної речовини відношення рівноважних концентрацій цієї речовини між двома рідинами, що не змішуються, є сталою величиною:
Крозп = СА / СВ, де Крозп – коефіцієнт розподілення; СА і СВ – молярні концентрації третього компоненту у рідинах (фазах) А і В. Коефіцієнт розподілення показує, у скільки разів розчинність третього компонента більша у фазі А, ніж у фазі В.
7.5.3. Розчинність твердих речовин
Розчинність різних твердих речовин в одному і тому ж розчиннику може змінюватися у широких межах. При підвищенні температури здебільшого розчинність твердих тіл зростає, проте для деяких сполук вона може зменшуватися. Зменшення розчинності з підвищенням температури характерне для речовин, розчинення яких супроводжується виділенням теплоти. У деяких випадках змінення розчинності при підвищенні температури зумовлене зміною складу твердої фази, що насичує розчин. Дані щодо розчинності індивідуальних солей при різних температурах наводяться у спеціальних довідниках.
7.6. Загальні властивості розчинів
Загальні, або колігативні властивості розчинів - це такі, що залежать лише від їх концентрації та природи розчинника і не залежать від складу розчинених речовин. Колігативні властивості можуть повною мірою виявлятися тільки в ідеальних розчинах. Ідеальний розчин – це розчин, в якому не відбувається хімічної реакції між компонентами, а сили міжмолекулярної взаємодії між усіма молекулами однакові.
7.6.1. Закони Рауля
Якщо рідина перебуває в закритій посудині, то внаслідок випаровування молекули накопичуються над поверхнею, а частина з них – піддається зворотному процесу – конденсації і повертається в рідину, У деякий момент встановлюється динамічна рівновага між процесами випаровування і конденсації – отже, пара стає насиченою. При сталій температурі тиск насиченої пари чистої рідини (розчинника) – величина постійна. Але досвід свідчить, що при розчиненні у цій рідині якоїсь іншої речовини тиск насиченої пари завжди знижується.
На діаграмі фазового стану тиск насиченої пари над чистим розчинником А у широкому інтервалі температур дає певну криву (рис. 7.14). Однак при вимірюванні тиску насиченої пари розчинів А1 і А2, концентрації розчинених речовин в яких складають відповідно С1 і С2, криві на діаграмі тиск-температура будуть розташовуватися нижче кривої, що відносилася до чистого розчинника А (рис. 7.14). Цю залежність виражає перший (тонометричний) закон Рауля: зниження тиску насиченої пари розчинника над розчином пропорційне мольній частці нелеткої розчиненої речовини
- Р0А – РА = ΔРА = Р0А χВ,
- де Р0А і РА тиск насиченої пари розчинника А відповідно над чистим розчинником і над розчином,
- ΔРА – зниження (або депресія) тиску насиченої пари;
- χВ – мольна частка розчиненої речовини В.
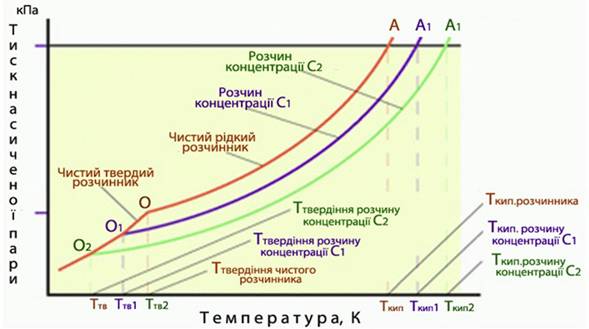
Рисунок 7.14 – Залежність тиску насиченої пари над чистим розчинником А і над розчинами А1 і А2, концентрації розчинених речовин в яких складають відповідно С1 і С2
Оскільки мольна частка розчиненої речовини дорівнює χB = νB/(νA + νB), математичний вираз першого закона Рауля можна переписати у вигляді:
звідки видно, що відносне зниження тиску, яке позначається виразом {(Р0А–РА)/Р0А}, дорівнює мольній частці розчиненої речовини.
Тиск насиченої пари розчинника над розчином впливає на температури кипіння і замерзання (кристалізації) розчинів. Цю залежність встановлює другий закон Рауля: підвищення температури кипіння або зниження температури замерзання розчину прямо пропорційне моляльній концентрації розчиненої речовини:
- Δ Ткип = КЕ • Сm,
- Δ Тзам = КК • Сm
де Сm – моляльна концентрація, що показує кількість речовини ν, розчиненої у 1кг розчинника; КЕ і КК – відповідно ебуліоскопічна і кріоскопічна константи, які визначаються природою розчинника і не залежать від складу та концентрації розчиненої речовини. Фізичний зміст ебуліоскопічної і кріоскопічної констант випливає, коли Сm=1моль/1кг. Тоді КЕ і КК чисельно дорівнюють відповідно підвищенню температури кипіння і зниженню температури замерзання одномоляльних розчинів порівняно з температурою кипіння і температурою замерзання чистого розчинника. Ебуліоскопічну КЕ і кріоскопічну КК константи вимірюють у градусах, їх значення для різних розчинників наводяться у довідниках.
7.6.2. Закон осмотичного тиску
Самочинний перехід розчинника через напівпроникну мембрану, що розділяє розчин і розчинник або два розчина різної концентрації, називається осмос. Осмос зумовлюється різницею тиску насиченої пари розчинника над розчином і над чистим розчинником (чи більш розведеним розчином). Якщо між такими розчинами поставити напівпроникну мембрану або перегородку, яка пропускає тільки молекули розчинника і затримує молекули розчиненої речовини, то молекули розчинника дифундують крізь неї із розчинника у розчин або з більш розведеного розчину у більш концентрований.
Кількісно осмос характеризується величиною осмотичного тиску. Осмотичний тиск – це такий тиск, що дорівнює силі, яка припадає на одиницю площини поверхні і примушує молекули розчинника проходити через напівпроникну мембрану.
Для обчислення осмотичного тиску використовують закон Вант-Гоффа: Осмотичний тиск розчину чисельно дорівнює тиску, який чинила б розчинена речовина, якби вона при тій самій температурі перебувала б у газоподібному стані і займала об'єм, що дорівнює об'єму розчину: π = СМ RT, де π – осмотичний тиск {[Па] = [Дж]/[м]3}, СМ – молярна концентрація розчину (СМ=ν/V=m/M•V).
Якщо до більш концентрованого розчину докласти зовнішній тиск, вищий за осмотичний, тобто Рзовн>π, то швидкість переходу молекул розчинника із концентрованого розчину почне переважати і розчинник буде переходити у розведений розчин (або у чистий розчинник). Цей процес називається зворотний осмос.