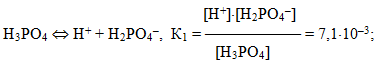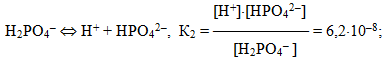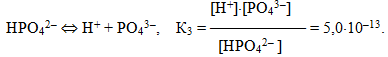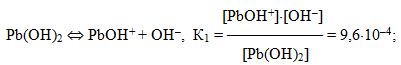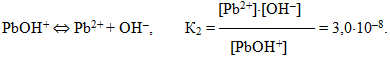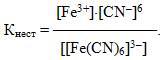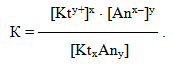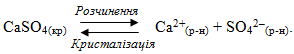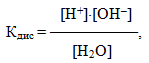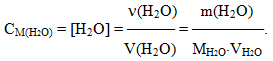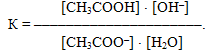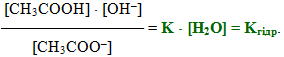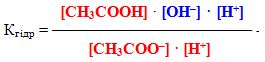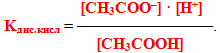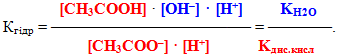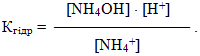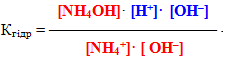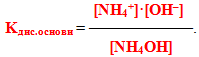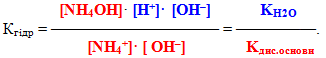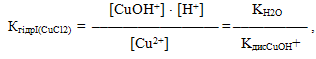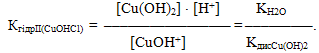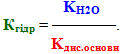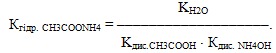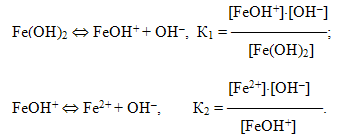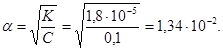- 8.1 Електроліти і неелектроліти
- 8.2 Теорія електролітичної дисоціації
- 8.3 Теорія сильних електролітів
- 8.4 Рівновага в розчинах електролітів
- 8.5 Приклади розв'язання типових задач
Ключові терміни:
Індикатор, Іонна атмосфера, Іонізація, Істинні електроліти, Істинні, або власно електроліти, Активність, Буферні розчини, Водневий показник рН, Гідроліз солей, Добуток розчинності, Електроліти, Електроліти середньої сили, Кислоти, Комплексні солі, Основи, Основні солі, Потенційні електроліти, Сильні електроліти, Слабкі електроліти, Солі, Ступінь гідролізу h, Ступінь дисоціації α, автопротоліз води, амфотерні гідроксиди (або амфоліти), аніон, асоціація, буферна ємність, гідроксильний показник рОН, електролітична дисоціація, закон розведення Оствальда, катіон, кислотність основ, кислі солі, константа гідролізу, константа дисоціації Кдис, константа нестійкості Кнест, луги, неелектроліти, основність кислот, позірний ступінь дисоціації, провідники другого роду, провідники першого роду, реакція нейтралізації, рекомбінація, середні солі, ізотонічний коефіцієнт і, іон гідроксонію, іонний добуток води8.1 Електроліти і неелектроліти
За електропровідністю та особливостями передачі електричного струму речовини поділяються на провідники першого роду (метали та їх сплави), в яких електрика переноситься за рахунок переміщення електронів, і провідники другого роду, де електрика передається за допомогою іонів (рис.8.1).
Речовини, які не проводять електричний струм ні у розплавленому, ні у розчиненому стані, називаються неелектроліти.

Рисунок 8.1 – Неелектроліти, в яких відсутні переносники електричного струму (як приклад – дистильована Н2О і кристалічний NaCl) і провідники другого роду – електроліти, в яких переносниками електричних зарядів є іони (водний розчин натрій хлориду – за рахунок іонів Na+ і Cl–)
До неелектролітів належать речовини з ковалентними неполярними чи малополярними зв’язками: сахароза, бензен, етанол. Для розчинів неелектролітів характерні колігативні властивості, які лінійно залежать від концентрації розчиненої речовини і не залежать від її хімічної природи.
Провідники другого роду – це електроліти.
Електроліти – це речовини, розчини або розплави яких проводять електричний струм.
Електроліти при розчиненні або розплавленні утворюють іони, рух яких і зумовлює їх електропровідність.
Важливою ознакою електролітів є відхилення їх розчинів від законів Рауля і Вант-Гоффа. Для оцінки цього відхилення було введено поправковий ізотонічний коефіцієнт і, який за умов однакової концентрації показує, у скільки разів кількісні характеристики колігативних властивостей розчинів, визначені експериментально, більші за відповідні теоретично обчислені величини:
-
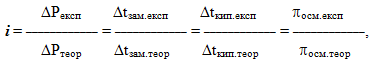
- де ΔР – зниження тиску насиченої пари розчинника над розчином,
- Δtзам і Δtкип – відповідно зниження температури замерзання та підвищення температури кипіння розчинів,
- πосм – осмотичний тиск.
Оскільки величини ΔР, Δt і πосм є функціями числа частинок розчиненої речовини, то відхилення поведінки розчинів електролітів від законів, що описують колігативні властивості, зумовлене збільшенням концентрації частинок (завдяки утворенню іонів) у розчинах електролітів.
Залежно від механізму виникнення іонів електроліти умовно поділяються на дві групи: істинні та потенційні.
-
Істинні електроліти – це розчини і розплави речовин з іонним зв'язком, які у твердому стані утворюють іонну кристалічну rратку і не мають електропровідності (рис.8.1).
Істинні, або власно електроліти– це речовини з іонною кристалічною решіткою, які розпадаються на іони при розплавленні або при розчиненні.
Виникнення іонів пояснюється послабленням, а потім і розривом хімічних зв’язків, (що спричиняє руйнування кристалічної решітки) під дією полярних молекул розчинника чи нагрівання. У процесі розчинення у воді (або в інших полярних розчинниках) молекули розчинника витягують у першу чергу менші за розмірами позитивно заряджені іони що, призводить до випадіння з решітки й негативно заряджених іонів. У розчині обидва види іонів піддаються гідратації (рис.8.2).
Процес розпаду істинного електроліту на іони при розплавленні або під дією полярних молекул розчинника називається електролітична дисоціація.
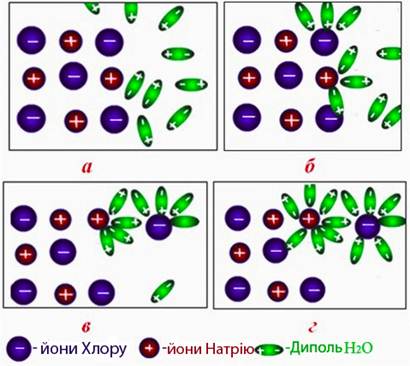
Рисунок 8.2 – Механізм утворення іонів при розчиненні у воді істинного електроліту (NaCl⇒Na++Cl–):
-
Потенційні електроліти. До них належать речовини з полярним ковалентним зв’язком: більшість кислот, деякі основи (водні розчини амоніаку NH3, гідразину N2H4, органічних амінів тощо).
Потенційні електроліти – це речовини з молекулярною кристалічною решіткою, які у розплавленому стані не проводять електричного струму, але утворюють іони при взаємодії їх молекул з відповідними розчинниками.
Механізм виникнення іонів у потенціальних електролітах має свої особливості (рис.8.3). Внаслідок диполь-дипольної взаємодії між полярною молекулою електроліту і диполями розчинника, полярні ковалентні зв’язки спочатку поляризуються ще сильніше, а потім і розриваються, утворюючи іони, які поступово сольватуються.
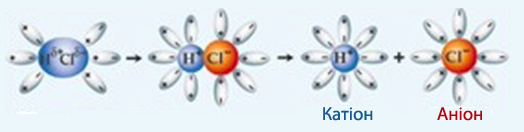
Рисунок 8.3 – Механізм утворення іонів внаслідок іонізації полярної молекули потенційного електроліту (НCl↔Н++Cl–) під впливом полярних молеул води і утворення гідратованих позитивно і негативно заряджених іонів (Н+.nH2O і Cl–.nH2O)
Отже, відносно процесу утворення іонів потенційними електролітами термін «дисоціація» використовується умовно. По суті відбувається процес іонізації.
Іонізація – утворення іонів із полярної молекули потенційного електроліту під дією диполів розчинника.
Однак надалі для спрощення ми будемо вживати термін «дисоціація» відносно обох випадків.
8.2 Теорія електролітичної дисоціації
Сучасна теорія електролітичної дисоціації складалася на основі гіпотези Арреніуса про розщеплення молекул на іони, гідратної теорії Менделєєва, яка стверджувала, що розчинена речовина обов’язково вступає у хімічну взаємодію з молекулами розчинника, і робіт Каблукова, присвячених сольватації іонів.
Теорія електролітичної дисоціації містить декілька положень.
-
Розчинення електроліту супроводжується його розкладанням на позитивно і негативно заряджені іони, які піддаються сольватації (або гідратації, якщо розчинником є вода). Щоб записати у загальному вигляді рівняння електролітичної дисоціації, яка відбуваєтьсяу водному розчині, символами Kt і An позначають відповідно позитивно заряджений іон (катіон) і негативно заряджений іон (аніон), а індексами x і y – кількості іонів кожного знака. З урахуванням процесу гідратації, внаслідок якої утворюється гідрат катіона з n молекулами води і гідрат аніона с m молекулами води, повне рівняння електролітичної дисоціації записують так:
- KtxAny + (xn + ym)H2O ↔ x[Kt(H2O)n]y+ + y[An(H2O)m]x–,
але частіше користуються спрощеним рівнянням дисоціації, не враховуючи процесу гідратації:
- KtxAny ⇔ xKty+ + yAnx–.
При цьому сумарний заряд аніонів за абсолютною величиною дорівнює сумарному заряду катіонів, тому електроліт в цілому електронейтральний. Наприклад, при дисоціації алюміній сульфату сумарний заряд аніонів дорівнює –6n, а сумарний заряд катіонів – +6n:
- nAl2(SO4)3 → 2nAl3+ + 3nSO42–.
Властивості іонів відрізняються від властивостей атомів, з яких вони утворилися. Сольватовані іони перебувають у стані невпорядкованого теплового руху і переміщуються у розчині за різними напрямками.
-
При пропусканні електричного струму через розчин чи розплав електроліту іони набувають напрямленого руху: позитивно заряджені переміщуються до катода (саме тому вони одержали назву катіон), а негативно заряджені – до анода, тому вони називаються аніон (рис.8.4).
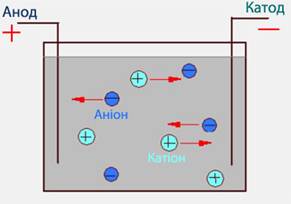
Рисунок 8.4 – Напрямок руху позитивно і негативно заряджених іонів в електричному полі
-
Електролітична іонізація є оборотним процесом, тобто одночасно з розпадом молекул на іони відбувається зворотний процес – сполучення іонів у молекули – асоціація, або рекомбінація.
-
Електрична провідність і колігативні властивості розчинів електролітів пропорційні загальній концентрації молекул та іонів.
Щоб урахувати збільшення кількості частинок (відносно недисоційованого стану) при обчисленні відповідних величин застосовують ізотонічний коефіцієнт і. Тому закони, що описують колігативні властивості, для розчинів електролітів набувають вигляду:
- І закон Рауля: ΔР = і Р0χрозч.реч;
- ІІ закон Рауля: Δtкип = і КЕ Сm; Δtзам = і КК Сm;
- закон Вант-Гоффа: πосм = і RTCM.
-
Кількісними характеристиками процесу дисоціації є ступінь і константа дисоціації.
8.2.1 Ступінь дисоціації
Різні речовини дисоціюють неоднаково, але і одна і та сама сполука може піддаватися дисоціації по-різному залежно від умов. Для оцінювання та порівняння міри розкладу речовин на іони користуються величиною ступеня дисоціації.
Ступінь дисоціації α – це відношення концентрації електроліту, що розпався на іони, до його загальної концентрації у розчині:
- α = Сдис/Сзаг,(8.1)
- де Сдис і Сзаг – відповідно молярна концентрація продисоційованого електроліту і загальна концентрація, моль/л.
Зважаючи на те, що молярна концентрація визначається відношенням кількості речовини ν до об’єму розчину (С=ν/V), то за умов постійного об’єму рівняння (8.1) набуває вигляду:
- α = νдис/νзаг.(8.2)
Ступінь дисоціації виражається у частках одиниці або у відсотках.
Ступінь дисоціації пов’язаний з ізотонічним коефіцієнтом Вант-Гоффа залежністю
-
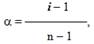
- де n – загальна кількість іонів, що утворюється при дисоціації електроліту, наприклад, для солі Bi2(SO4)3 n = 2 + 3 = 5.
Оскільки здатність речовин до дисоціації залежить від багатьох умов, то і ступінь дисоціації є функцією багатьох перемінних, тому на величину α впливають різні чинники.
Чинники, що впливають на ступінь дисоціації α.
-
Природа речовин. Залежно від здатності електроліту до дисоціації і, як наслідок, від величини ступеню дисоціації в розведених розчинах, всі електроліти поділяють на окремі групи: сильні, середньої сили і слабкі.
-
Сильні електроліти – це ті, для яких ступінь дисоціації у розведених розчинах має достатньо високі значення (α>0,3 або α>30%), що пояснюється майже повною дисоціацією. З цієї причини в рівняннях реакції дисоціації сильних електролітів замість знака оборотності (⇔) ставлять стрілку (⇒), наприклад: HI⇒Н++І–.
До сильних електролітів належать: більшість солей; сильні кислоти (H2SO4, HClО4, HNO3, HMnО4, HCl, HBr тощо); гідроксиди лужних (LiОН, NaОН, KОН, RbОН, CsОН) і лужноземельних металів (Ca(ОН)2, Sr(ОН)2, Ba(ОН)2); деякі комплексні основи, наприклад, [Cu(NH3)4](OH)2. Крім того, сильними електролітами є також розчини над осадами малорозчинних солей з іонною кристалічною решіткою. Незважаючи на погану розчинність таких солей, їх кристалічні решітки під дією диполей води піддаються частковому руйнуванню, внаслідок чого у розчині з'являється невелика кількість іонів, які зумовлюють електричну провідність розчинів і, отже, належність цих солей до групи сильних електролітів. Однак при оцінюванні сили конкретного електроліту завжди слід пам'ятати, що його здатність розпадатися на іони реалізується виключно в розчинах чи розплавах, а у твердому стані електрична провідність відсутня (рис.8.5г) і процес дисоціації не відбувається.
-
Електроліти середньої сили, для яких у розведених розчинах величина ступеня дисоціації коливається у межах 0,02<α<0,3 (або 2%<α<30%).
Представниками цієї групи електролітів є: сульфітна H2SO3, ортофосфатна H3PO4, арсенатна H3AsO4, мурашина HCOOH кислоти, деякі солі та основи, наприклад, гідроксид Ca(ОН)2, який в дуже розведених розчинах поводить себе як сильний електроліт, а при збільшенні концентрації – як електроліт середньої сили.
-
Слабкі електроліти, які навіть у розведених розчинах дисоціюють частково і мають невисокі значення ступеня дисоціації (α<0,02 або α<2%).
До них належать більшість органічних кислот і основ, слабкі неорганічні кислоти (Н2СО3, H2S, H2SiO3, H3AsO3, HCN, HF, HClO); основа NH3·H2O (або NH4ОН); деякі солі, особливо галогеніди, наприклад, Hg2Cl2, HgCl2, а також значна кількість комплексних іонів ([Fe(CN)6]4–, [Fe(CN)6]3–, [HgI4]2– та інші).
Іноді електроліти залежно від їх здатності до дисоціації (у розчинах концентрації 0,01–0,1н) поділяють тільки на дві групи: сильні і слабкі.
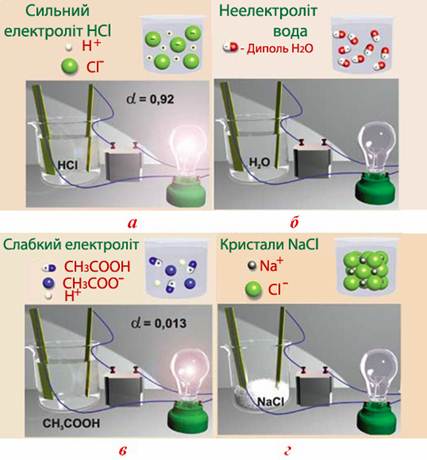
Рисунок 8.5 – Сильні та слабкі електроліти
-
Сильні електроліти – це ті, для яких ступінь дисоціації у розведених розчинах має достатньо високі значення (α>0,3 або α>30%), що пояснюється майже повною дисоціацією. З цієї причини в рівняннях реакції дисоціації сильних електролітів замість знака оборотності (⇔) ставлять стрілку (⇒), наприклад: HI⇒Н++І–.
-
Будова молекул речовин. Вплив молекулярної структури на силу електроліту наочно видно на прикладі однотипних молекул кислот HF, HCl, HBr, HI. За умов однакових концентрацій і температур α зростає майже вдвічі при збільшенні довжини і зниженні енергії зв’язку, тобто при переході від HF до HI.
Для молекул більш складної будови, здатних дисоціювати на декілька іонів, процес протікає ступінчасто, тому ступенів дисоціації може бути декілька. Наприклад, для сульфітної кислоти
- H2SO3 ⇔ H+ + HSO3– α1,
- HSO3– ⇔ Н+ + SO32– α2,
причому α1 >> α2, тому що відірвати іон Н+ від нейтральної молекули H2SO3 набагато легше, ніж від негативно зарядженого гідросульфіт-аніона HSO3–. Однак поведінка будь-якої кислоти характеризується концентрацією іонів Н+, тому якщо віднести загальну кількість іонів Н+ до кількості молекул Н2SO3 (яка була до початку дисоціації кислоти), можна одержати середнє значення α.
-
Природа розчинника: чим вища його діелектрична стала ε, тим більше значення α. Необхідно зауважити, що природа розчинника впливає і на утворення сольватів іонів: більш полярні молекули розчинника легше утворюють сольвати. Деякі іони навіть спроможні утворювити як би постійні сполуки з розчинником. Так, іон гідрогену у воді ізольовано існувати не може і приєднується до молекули води, перетворюючись на іон гідроксонію (рис.8.6):
- Н+ + Н2О ⇒ H3O+.
Але у рівняннях реакції для спрощення записують звичайно тільки формулу Н+, маючи на увазі іон гідроксонію Н3О+.
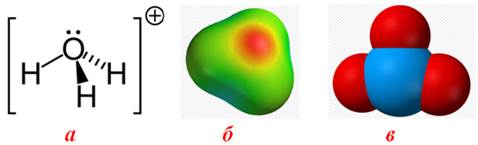
Рисунок 8.6 – Іон гідроксонію H3O+: а) просторова формула, в якій пунктиром показаний донорно-акцепторний зв'язок між іоном Н+ і атомом оксигену молекули Н2О; б) модель, що зображує локалізацію підвищеної електронної густини (у центрі іона H3O+) і дефіциту негативного заряду (на периферії); в) кулькова модель
-
Температура. Ця залежність завжди однозначна: згідно з принципом Ле-Шательє ступінь дисоціації підвищується при нагріванні, оскільки розпад молекул на іони відбувається з поглинанням енергії.
-
Концентрації розчину: у міру розведення розчину ступінь дисоціації зростає. Більш докладніше цю залежність ми розглянемо пізніше.
8.2.2 Константа дисоціації
Оскільки електролітична дисоціація слабких електролітів є оборотним процесом, то вона підкоряється закону діючих мас. Тому для загальної реакції електролітичної дисоціації слабкого електроліту
- Ktx Any ⇔ xKty++ yAnx–
константа рівноваги матиме вигляд:
-
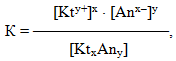
- де [Kty+] і [Anx–] – молярні концентрації відповідно катіонів і аніонів,
- [KtxAny] – молярна концентрація недисоційованих молекул.
Нагадаємо, що за допомогою квадратних дужок позначають молярну концентрацію речовини у рівноважному стані.
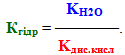
Константа рівноваги К слабкого електроліту називається константа дисоціації Кдис і характеризує здатність речовини розпадатися у розчині на іони.
Чим менше значення Кдис, тим слабкішим є електроліт, і навпаки, велике значення Кдис свідчить про його високу здатність до дисоціації.
Важливішою ознакою константи дисоціації є те, що вона не залежить від концентрації розчину, а залежить лише від природи розчиненої речовини і розчинника та від температури. Значення констант дисоціації наводяться у спеціальних довідниках.
Для електролітів, що дисоціюють ступінчасто, кожній стадії дисоціації відповідає своє значення константи дисоціації. Наприклад, для ортофосфорної кислоти:
Для загального процесу:
- Н3РО4 ⇔ 3Н+ + РО43–
сумарна константа дисоціації
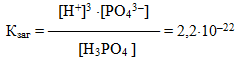
дорівнює добутку ступінчастих констант дисоціації:
- Кзаг = К1·К2·К3 = 7,1· 10–3 · 6,2 · 10–8 · 5,0 · 10–13 =2,2 · 10–22.
При цьому К1 > К2 > К3, оскільки відщеплення іона Н+ від нейтральної молекули відбувається значно легше, ніж від однозарядного негативного аніона Н2РО4–, тим більше, від двохзарядного негативного аніона НРО42–. З цього випливає, що Н3РО4 є значно сильнішою кислотою, ніж Н2РО4–, а Н2РО4–, у свою чергу, – ніж НРО42–.
Багатокислотні гідроксиди теж дисоціюють ступінчасто, наприклад:
Комплексні іони також піддаються ступінчастій дисоціації, однак частіше розглядають не постадійний, а сумарний процес і тому користуються загальним рівнянням дисоціації. Так, для комплексного іона [Fe(CN)6]3–, який є дуже слабким електролітом, сумарне рівняння дисоціації і загальна константа дисоціації мають вигляд:
- [Fe(CN)6]3– ⇔ Fe3+ + 6CN–,
Константа дисоціації комплексного іона називається константа нестійкості Кнест.
8.2.3 Закон розведення Оствальда
Зв’язок між ступенем дисоціації, концентрацією розчину і константою електролітичної дисоціації встановлює закон розведення Оствальда. Для його виведення запишемо рівняння електролітичної дисоціації слабкого бінарного електроліту KtAn, у якому символом Kt позначений катіон, а An – аніон:
- KtAn ⇔ Kt+ + An–.
Позначимо вихідну молярну концентрацію електроліту через С (моль/л), тоді концентрація тієї частини електроліту, яка піддалася дисоціації, з урахуванням ступеня дисоціації дорівнює αC. Як видно з рівняння реакції, утворюються однакові кількості іонів обох знаків, причому, їх концентрації дорівнюють концентрації продисоційованої частини електроліту:
- [Kt+] = [An–] = αC,
а концентрація недисоційованих молекул:
- [KtAn] = C – αC = C( 1 – α).
Підставляючи значення концентрацій у вираз константи дисоціації, одержимо:
-
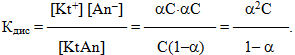 (8.3)
(8.3)
Рівнянням (8.3) математично виражений закон розведення Оствальда.
У тому випадку, коли електроліт дуже слабкий, ступінь дисоціації має невелике значення (a––>0), яким можна знехтувати, тоді знаменник у рівнянні (8.3) прирівнюється до одиниці (1– α)~1, а закон розведення набирає вигляду:
- K = α2 C,(8.4)
звідки ступінь дисоціації
-
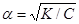 . (8.5)
. (8.5)
Рівняння (8.5) дає можливість сформулювати закон розведення Оствальда:
у міру розведення розчину (тобто зменшення концентрації електроліту) ступінь його електролітичної дисоціації підвищується.
8.2.4 Властивості кислот, основ і солей з позицій теорії електролітичної дисоціації
Кожний клас сполук має власні загальні властивості, зумовлені наявністю деякої спільної ознаки. Для кислот цією ознакою є іони гідрогену, які входять до їх складу.
Кислоти – це електроліти, що при дисоціації у якості позитивно зарядженого іона утворюють виключно катіони гідрогену Н+.
Кількість іонів гідрогену, що утворюються при дисоціації однієї молекули, визначає основність кислот. Так, HCl, HNO3, CH3COOH – одноосновні кислоти, Н2S, H2SO4, H2CO3 – двохосновні, Н3РО4, Н3AsO4 – триосновні. Кислоти з більшою основністю зустрічаються рідко.
Багатоосновні кислоти дисоціюють ступінчасто, наприклад, арсенатна кислота:
- I ступінь: H3AsO4 ⇔ H+ + H2AsO4–,
- II ступінь: Н2AsO4– ⇔ H+ + HАsO42–,
- IІІ ступінь: HAsO42– ⇔ H+ + AsO43–.
В розглянутому прикладі не тільки молекула Н3AsО4 є кислотою, але й утворені внаслідок її дисоціації аніони Н2AsО4– і НAsO42– належать до кислот, оскільки при їх дисоціації теж вивільняються іони Н+, що є головною ознакою класу кислот.
З позицій теорії електролітичної дисоціації кислоти – це не тільки нейтральні молекули кислоти, але й негативно заряджені аніони, які спроможні дисоціювати з утворенням катіона Н+.
У сильних кислот, які піддаються повній дисоціації, кислотні властивості виявляються більшою мірою, у слабких – меншою. Силу кислоти можна визначити за її константою дисоціації: якщо Кдис > 10–2, кислоту відносять до сильних, якщо Кдис < 10–4 – до слабких. Ті кислоти, константи дисоціації яких лежать у межах 10–2–10–4, називають кислотами середньої сили.
Завдяки наявності іонів Н+ (точніше, гідратованих іонів у вигляді катіона гідроксонію Н3О+), у водних розчинах усі кислоти тою чи іншою мірою виявляють спільні властивості:
- здатність реагувати з основами, тобто вступати у реакція нейтралізації, сутність яких виражається скороченою схемою: Н+ + ОН–⇒H2O;
- взаємодія з металами, розташованими в електрохімічному ряді напруг до водню, внаслідок чого внаслідок реакції виділяється водень Н2;
- кислий смак;
- змінення забарвлення індикатору (рис.8.7), наприклад, забарвлення нейтрального лакмусу у червоний колір.
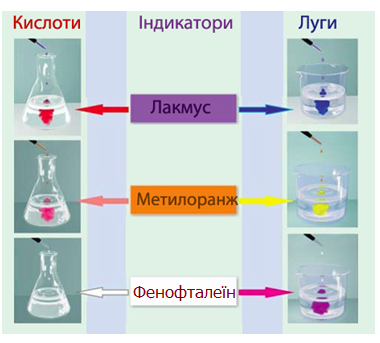
Рисунок 8.7 – Змінення забарвлення деяких індикаторів у розчинах кислот і лугів
Основи– це електроліти, що при дисоціації у якості негативно заряджених іонів утворюють виключно гідроксид-аніони.
Сила основ також характеризується величиною константи дисоціації: чим вище значення Кдис, тим основа сильніша.
Розчинні у воді основи називаються луги. До них належать гідроксиди лужних (Li, Na, K, Rb, Cs) і лужноземельних металів (Са, Sr, Ва), а також хоч і слабка, але розчинна основа NH4OH.
Кількість гідроксильних груп, що входять до складу основи, визначає кислотність основ. Так, КОН – однокислотна основа, Fe(OH)2 – двохкислотна.
Багатокислотні основи дисоціюють ступінчасто:
- І ступінь: Fe(OH)3 ⇔ Fe(OH)2+ + OH–,
- ІІ ступінь: Fe(OH)2+ ⇔ FeOH2+ + OH–,
- ІІІ ступінь: FeOH2+ ⇔ Fe3+ + OH–.
Гідроксильні групи надають основам певних спільних властивостей:
- здатність взаємодіяти з кислотами ( реакція нейтралізації);
- відчуття милкості під час дотику;
- змінення забарвлення індикатору (рис.8.7), наприклад, нейтрального лакмусу – у синій колір, фенолфталеїну – у малиновий.
Особливе місце посідають амфотерні гідроксиди (або амфоліти) (рис.8.8).
Амфотерні гідроксиди (амфоліти) – це слабкі електроліти, здатні залежно від умов виявляти властивості кислот або основ, тобто дисоціювати з утворенням катіонів Н+ чи аніонов ОН–:
- хН+ + МеОхх– ⇔ Ме(ОН)х ⇔ Мех+ + хОН–.
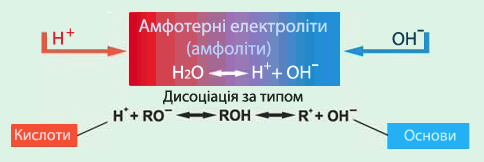
Рисунок 8.8 – Амфотерні основи
Наприклад, у випадку амфотерного цинк гідроксиду дисоціація у водних розчинах може відбуватися по типу кислоти з утворенням гідроксокомплексів чи по типу основи з утворенням аквакомплексів:
- 2Н+ + [Zn(ОH)4]2– ⇔ Zn(ОН)2 + 2H2O ⇔ [Zn(H2O)2]2+ + 2ОН–,
або у спрощеному вигляді:
- 2Н+ + ZnО22– ⇔ Zn(ОН)2 ⇔ Zn2+ + 2ОН–.
Отже, у розчині амфотерного електроліту встановлюється складна рівновага, в якій беруть участь продукти дисоціації як по типу кислоти, так і по типу основи. Як приклад амфотерних гідроксидів можна навести такі основи: Bе(ОН)2, Al(ОН)3, Cr(ОН)3, Pb(ОН)2, Pb(ОН)4 тощо.
Солі– це електроліти, при дисоціації яких утворюються катіони металів (або катіон амонію NH4+) і аніони кислотних залишків.
Проте, треба мати на увазі, що це визначення стосується тільки середні солі, наприклад:
- Na3PO4 ⇒ 3Na+ + PO43–.
Необхідно пам'ятати, що в рівняннях електролітичної дисоціації середніх солей, більшість яких належить до сильних електролітів і піддається повній дисоціації, замість знака оборотності (⇔) записують стрілку (⇒).
При ступінчастій дисоціації кислі солі (які є продуктами неповного заміщення іонів Н+ у багатоосновній кислоті на метал), утворюють, крім катіонів металу, і іони гідрогену:
- І ступінь: KHSO3 ⇒ K+ + HSO3–,
- ІІ ступінь: HSO3– ⇔ H+ + SO32–.
Основні солі (продукти неповного заміщення груп ОН– у багатокислотній основі на кислотний залишок) теж дисоціюють ступінчасто і утворюють не тільки аніони кислотних залишків, але й гідроксид-аніони:
- I ступінь: СаОНCl ⇒ CаOH+ + Cl–,
- ІI ступінь: СаОН+ ⇔ Cа2+ + ОН–.
Комплексні солі при дисоціації дають комплексний іон (первинна дисоціація), який у свою чергу дуже незначною мірою піддається вторинній дисоціації:
- первинна дисоціація: К3[Fe(CN)6] ⇒ 3K+ + [Fe(CN)6]3–,
- вторинна дисоціація: [Fe(CN)6]3– ⇔ Fe3+ + 6CN–.
8.3 Теорія сильних електролітів
Принципова відмінність сильних електролітів від слабких полягає в тому, що рівновага дисоціації сильних електролітів повністю зміщена вправо:
тому константа рівноваги (дисоціації) є величиною невизначеною.
Сучасна теорія сильних електролітів, найбільший внесок в розробку якої вніс П.Дебай, враховує електростатичну взаємодію між іонами. Головні ідеї теорії сильних електролітів можна звести до декількох основних положень.
-
Сильні електроліти у розведених розчинах (C<0,01моль·л–1) піддаються повному необоротному процесу дисоціації, тому не підкоряються закону діючих мас і закону розведення Оствальда. Оскільки дисоціація відбувається повністю, то можна б було очікувати, що ступінь дисоціації дорівнюватиме одиниці α=1. Проте при вивченні властивостей розчинів сильних електролітів значення α виявляється меншим.
Величина ступеня дисоціації сильних електролітів, встановлена експериментально, називається позірний ступінь дисоціації.
-
Відхилення у значенні ступеня дисоціації від одиниці (α<1) описується моделлю іонних атмосфер. Суть її полягає в тому, що незважаючи на наявність навколо кожного іона сольватної (гідратної) оболонки, утвореної молекулами розчинника, сили електростатичній взаємодії між іонами примушують їх координуватися певним чином. Внаслідок цього навколо кожного іона виникає своєрідна іонна атмосфера, яка складається з молекул розчинника та іонів протилежного знака. Сумарний заряд іонної атмосфери дорівнює за абсолютною величиною заряду центрального іона, але протилежний йому за знаком. Тому можна навести таке спрощене визначення:
Іонна атмосфера – це шар протилежно заряджених іонів, що оточують даний іон та прагнуть наблизитися до нього внаслідок електростатичного притягання.
-
Електростатична взаємодія іонів протилежного знаку відбувається з урахуванням впливу іонної атмосфери. Внаслідок дії сил міжіонної взаємодії електроліт поводить себе так, начебто його концентрація менша за реальну. Тому поняття концентрація стає неоднозначним і замінюється поняттям активної концентрації, або активності.
Активність a – це ефективна концентрація, відповідно до якої електроліт виявляє себе в дії. Під активністю розуміють величину, при підстановці якої у термодинамічні рівняння обчислені значення збігаються з експериментально визначеними.
Активність, як і молярна концентрація, має розмірність [моль/л] і пов’язана з нею залежністю:
a = f C, де f – коефіцієнт активності, безрозмірна величина, на яку необхідно помножити концентрацію, щоб дістати значення активності. Коефіцієнт активності формально ураховує всі види взаємодії між частинками, які призводять до відхилення від властивостей ідеального розчину. Тому коефіцієнт активності визначається експериментально.
Якщо f<1, іони у розчині перебувають під взаємним впливом і тоді a<C, а якщо f~1, то взаємодія між іонами практично відсутня і a~C. У дослідженнях і розрахунках, які не вимагають високої точності, можна застосовувати для обчислень замість f позірний ступінь дисоціації α: a = f C ~ α C. Коефіцієнт активності зростає з підвищенням температури та зі зниженням концентрації розчину.
8.4 Рівновага в розчинах електролітів
Завдяки наявності іонів рівновага у розчинах електролітів суттєво відрізняється від рівноваги оборотних реакцій у розчинах неелектролітів. Взаємодія іонів між собою і з недисоційованими молекулами, а також з полярним розчинником може приводити до змінення ступеня дисоціації та розчинності речовини.
Обов’язковою умовою перебігу реакцій між електролітами є видалення із розчину тих чи інших іонів, тобто реакції у розчинах електролітів завжди напрямлені у бік утворення найменш дисоційованих або найменш розчинних речовин.
8.4.1 Зміщення рівноваги дисоціації слабких електролітів
Якщо у розчин слабкого електроліту ввести інший електроліт, який має з першим загальний іон, то ступінь дисоціації слабкого електроліту стає ще меншим, оскільки рівновага зміщується у бік зворотної реакції згідно з принципом Ле-Шательє.
Введення одноіменних іонів у розчин слабкого електроліту зменшує його ступінь дисоціації.
Це явище використовується при одержанні буферних розчинів (від англ. buff – пом’якшувати удар), в яких зберігається постійна концентрація іонів Н+ навіть при додаванні до них невеликих кількостей кислот або лугів.
Буферні розчини – це такі, що мають певну стійку концентрацію іонів Н+, яка практично не змінюється при додаванні до них невеликих кількостей сильних кислот, лугів або при розведенні чи концентруванні.
Буферні розчини поділяються на кислотні та основні.
-
Кислотний буферний розчин – це суміш слабкої кислоти і солі, утвореної цією кислотою, наприклад, ацетатний буфер (суміш СН3СООН і СН3СООNa), у розчині якого кислота піддається лише частковій дисоціації, а сіль дисоціює повністю:
- CH3COOH ⇔ CH3COO– + H+,
- CH3COONa ⇒ CH3COO– + Na+.
Якщо до такого буферу додати сильну кислоту, наприклад HCl, відбувається її взаємодія з сіллю буферу:
- СН3СООNa + HCl ⇒ CH3COOH + NaCl,
або в іонному вигляді
- СН3СОО– + Na+ + H+ + Cl– ⇒ CH3COOH + Na+ + Cl–,
- CH3COO– + H+ ⇒ CH3COOH.
У результат сильна кислота HCl замінюється еквівалентною кількістю слабкої кислоти СН3СООН, тому концентрація іонів Н+ майже не збільшується і рН практично не змінюється.
При додаванні до ацетатної буферної суміші невеликої кількості лугу відбувається його взаємодія зі слабкою кислотою буферу, яка зв'язує іони ОН– в малодисоційовану сполуку – H2O:
- СН3СООН + NaOH ⇒ CH3COONa + H2O,
- СН3СООН + Na+ +OH– ⇒ CH3COO– + Na+ + H2O,
- СH3COOH + OH–⇒CH3COO– + H2O.
При цьому сильна основа NaOH замінюється еквівалентною кількістю солі СН3СООNa, тому значного зменшення концентрації іонів Н+ не спостерігається.
Значення рН кислотного буферу обчислюється за формулою:
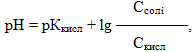
- де рКкисл = –lgКдис.кисл,
- Ссолі і Скисл – відповідно молярні концентрації солі та кислоти.
-
Основний буферний розчин – це суміш слабкої основи та її солі, утвореної сильною кислотою, наприклад, амоніачний буфер, що складається з NH4OH і NH4Cl. В такому буфері дисоціація слабкої основи відбувається частково, а дисоціація солі – повністю:
- NH4OH ⇔ NH4+ + OH–,
- NH4Cl ⇒ NH4+ + Cl–.
При додаванні до амоніачного буферу невеликої кількості сильної кислоти (HCl) відбувається її взаємодія з основою буферу, внаслідок чого утворюється сіль, а рН розчину майже не змінюється:
- HCl + NH4OH ⇒ NH4Cl + H2O,
- H+ + Cl– + NH4OH ⇒ NH4+ + Cl– + H2O,
- H+ + NH4OH ⇒ NH4+ + H2O.
При додаванні лугу (NaOH) в реакцію, навпаки, вступає сіль буферу:
- NaOH + NH4Cl ⇒ NH4OH + NaCl,
- Na+ + OH– + NH4+ + Cl– ⇒ NH4OH + Na+ + Cl–,
- OH– + NH4+ ⇒ NH4OH.
Значення рН для цього типу буферів розраховують за рівнянням:
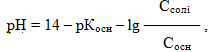
- де рКосн = –lgКдис.осн,
- Ссолі і Сосн – відповідно молярні концентрації солі та основи.
Важливою характеристикою буферних розчинів є їх буферна ємність – кількість еквівалентів сильної кислоти чи лугу, яку необхідно додати до 1л буферного розчину, щоб змінити його рН на одну одиницю.
Буферна ємність визначається відносно кислоти чи лугу за рівняннями:
-
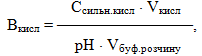
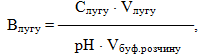
- де Ссильн.кислоти і Слугу – еквівалентні (нормальні) концентрації,
- рН – зміщення рН буферного розчину.
Буферні розчини відіграють важливу роль у природі та техніці. Наприклад, завдяки дії певних буферів у всіх фізіологічних системах організму людини pH змінюється неістотно, мало змінюється pH морської води (pH=8). При проведенні багатьох технологічних процесів pH середовища підтримують постійним за допомогою відповідних буферів.
8.4.2 Добуток розчинності
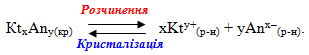
Речовини з обмеженою розчинністю схильні до утворення систем, в яких осад малорозчинної сполуки перебуває у стані рівноваги з її насиченим розчином. Завдяки динамічному характеру рівноваги швидкість розчинення осаду дорівнює швидкості зворотного процесу – кристалізації осаду з насиченого розчину. Наприклад, якщо помістити у воду осад малорозчинного електроліту КtxAny(кр), відбувається його часткове розчинення і у розчин переходить невелика кількість катіонів (Kty+(р-н)) і аніонів (Anx–(р-н)). Після досягнення насичення розчину, починається зворотний перехід іонів з насиченого розчину в осад. У якийсь момент встановлюється динамічна рівновага між обома процесами:
Для загального випадку константа рівноваги має вигляд:
Однак концентрація твердої речовини вважається постійною ([KtxAny]кр=const), тому вона вводиться у константу:
- [Kty+]x · [Anx–]y = К · [KtxAny].
Добуток К·[KtхAnу] називається добутком розчинності і позначається ДР:
- ДРKtxAny = [Kty+]x · [Anx–]y.
Добуток розчинності – це стала за даної температури величина, що кількісно характеризує здатність малорозчинних електролітів до розчинення і визначається добутком концентрацій іонів, піднесених до відповідних степенів.
Значення добутків розчинності для різних сполук наводяться у спеціальних довідниках чи обчислюються за розчинністю речовин. І навпаки, виходячи із величини ДР, можна розрахувати розчинність будь-якої малорозчинної солі.
Чим менша величина добутку розчинності ДР солі, тим гірше ця сіль розчиняється у воді.
Оскільки ДР солі при певній температурі є сталою величиною, то підвищення концентрації одного із іонів, що міститься у її розчині, призводить до зменшення концентрації іншого іона.
Наприклад, якщо до насиченого розчину малорозчинної солі CaSO4 долити невелику кількість сильного електроліту, який має спільний іон з CaSO4 (наприклад, CaCl2 чи Na2SO4) і повністю дисоціює на іони
- CaCl2 ⇒ Ca2+ + 2Cl–,
- Na2SO4 ⇒ 2Na+ + SO42–,
це викличе додаткову кристалізацію CaSO4, тому що згідно з принципом Ле-Шательє при збільшенні концентрації іонів Ca2+ або SO42– рівновага зміщується у бік зворотного процесу:
Введення одноіменного іона у розчин малорозчинного електроліту зменшує його розчинність.
8.4.3 Електролітична дисоціація води. Водневий показник
Хімічно чиста вода є дуже слабким електролітом, оскільки її дисоціація пригнічується дією водневих зв’язків, завдяки чому окремі молекули Н2О сполучаються в асоціати. З іншого боку, значна полярність ковалентних зв’язків О–Н деякою мірою спричиняє електролітичну дисоціацію (точніше – іонізацію):
- Н2О ⇔ Н+ + ОН–.
Завдяки малим розмірам та великій поляризувальній здатності іонів Н+, вони піддаються миттєвій гідратації з утворенням іонів гідроксонію Н3О+ (рис.8.6) за схемою:
- Н+ + Н2О ⇒ H3O+ + OH–,(8.8)
- або H2O + H2O ⇔ H3O+ + OH–.
Доведено, що гідратація іонів Н+ – це необоротний процес з константою рівноваги приблизно 10146, тобто іони Н+ гідратуються практично повністю.
Реакція, що відповідає рівнянню 2Н2О⇔Н3О++ОН–, називається автопротоліз води, під час якого одна молекула води відщеплює іон Н+ (протон) і відіграє роль кислоти, а друга, яка приєднує протон з утворенням Н3О+, – роль основи (рис.8.9).
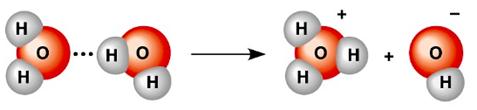
Рисунок 8.9 – Схема автопротолізу води
Однак для зручності при запису дисоціації води користуються скороченим рівнянням:
- Н2О ⇔ Н+ + ОН–.(8.9)
На основі експериментальних досліджень встановлено, що при температурі 220С ступінь дисоціації води дуже малий: αН2О=1,8·10–9, тобто на іони розпадається тільки одна молекула із приблизно 1800000000 молекул води. Зрозуміло, що вода належить до надзвичайно слабких електролітів і піддається закону діючих мас. Тому для неї можна записати вираз константи дисоціації:
- або [H+]·[OH–] = Kдис·[H2O].(8.10)
Невелике значення ступеня дисоціації води (αН2О=1,8·10–9) свідчить про сильне зміщення рівноваги дисоціації вліво, тому концентрацію H2O при постійній температурі можна вважати постійною. Отже, добуток постійних величин у правій частини рівняння (8.10) – теж величина стала (К·[H2O]=const). Тоді сталим є і добуток концентрацій іонів Н+ і ОН– в лівій частині рівняння. Цей добуток ([H+]·[OH–]) одержав назву іонний добуток води:
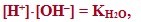
- де КН2О – іонний добуток води, для якого прийняті й інші позначення: Кв, або Кw.
Константа дисоціації води, визначена експериментально, при 22оС дорівнює: Кдис=1,8·10–16, а концентрацію недисоційованих молекул води [H2O] практично можна вважати рівною її загальній концентрації. З рівняння дисоціації води (Н2О⇔Н++ОН–) видно, що концентрації катіонів гідрогену і гідроксильних аніонів однакові і в той же час дорівнюють концентрації тієї частини води, яка продисоціювала і яка визначається добутком α·[H2O]:
- [H+] = [OH–] = α[H2O].
Молярна концентрація води обчислюється відношенням кількості речовини (ν=m/M) до об’єму V:
Беручи до уваги, що 1 л води при 220С має масу приблизно 1000 г, одержимо молярну концентрацію води:
- [H2O] = m / М·V = 1000 / 18·1= 55,56 моль/л.
Тоді концентрації іонів гідрогену і гідроксид-іонів складають
- [H+] = [OH–] = α·[H2O] = 1,8 · 10–9 · 55,56 = 1 · 10–7 моль/л,
звідки іонний добуток води дорівнює:
Іонний добуток води є сталою величиною за умов постійної температури. При підвищенні температури КН2О збільшується. Це зумовлено тим, що дисоціація води є ендотермічним процесом, який згідно з принципом Ле-Шательє посилюється із зростанням температури і послаблюється під час охолодження.
Для води і розведених водних розчинів за умов постійної температури добуток концентрацій іонів гідрогену і гідроксид-іонів є величиною сталою:
- KH2O = [H+] · [OH–] = 10–14 (220C).(8.11)
Таке саме значення КН2О при 220С мають і розведені водні розчини кислот і основ. Тому, якою б великою не була концентрація іонів Н+, концентрація іонів ОН– не буде дорівнювати нулю або навпаки. На основі (8.11) це дає змогу обчислити концентрацію [Н+] чи [OH–] , якщо одна з цих величин відома:
-
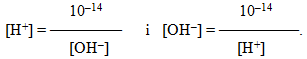 (8.12)
(8.12)
Проте, вести розрахунки концентрацій [H+] i [OH–] через від’ємний ступінь не зовсім зручно, тому за пропозицією Серенсена використовується інша величина – водневий показник, який позначається символом рН.
Водневий показник рН – це величина, що характеризує кислотність середовища і дорівнює від’ємному десятковому логарифму концентрації іонів гідрогену [H+]:
- рН = –lg[H+].(8.13)
По аналогії з ним було введено і гідроксильний показник рОН:
- pОН = – lg[OH–].(8.14)
Логарифмуючи рівняння (8.11): [H+] · [OH–] = 10–14), одержимо:
- lg [H+] + lg [OH–] = –14.
Якщо перемножити усі члени в останньому рівнянні на –1, то:
-
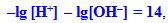 (8.15)
(8.15)
або з урахуванням (8.13) і (8.14):
-
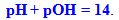 (8.16)
(8.16)
Рівняння (8.15) і (8.16) – це іонний добуток води у логарифмічному вигляді. Розглянемо можливі межі змінення водневого (pH) і гідроксильного (pOH) показників залежно від реакції середовища у розчині.
- У нейтральному середовищі концентрації іонів гідрогену і гідроксил-іонів однакові: [H+] = [OH–] = 10–7, тому водневий показник:
- рН = –lg[H+] = –lg10–7 = 7.
- У кислому середовищі концентрація іонів гідрогену завжди вища, ніж концентрація гідроксильних іонів: [H+] > [OH–], тому
- [H+] > 7, pН < 7.
- У лужному середовищі, навпаки, переважає концентрація гідроксильних іонів: [H+]<[OH–] i тому
- [H+]<10–7, pH > 7.
Розчини, значення рН яких змінюється від 0 до 3, вважаються сильнокислими, а при рН=4-6 – слабкокислими. Слабколужні розчини мають рН=8-10, а сильнолужні – рН=11-14. Якщо [H+]>1моль/л, то рН набуває від’ємних значень (рис.8.10). Так, при [H+]=2моль/л водневий показник рН= –lg2 = –0,3. Якщо [H+]<10–14моль/л, рН>14, наприклад, при концентрації іонів гідрогену [H+] = 0,5×10–14моль/л, водневий показник рН = 14,3.
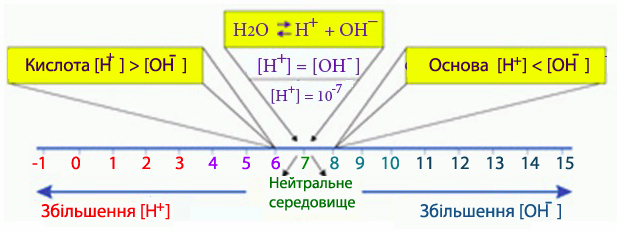
Рисунок 8.10 – Зв'язок між кислотністю середовища и величиною рН
Точне значення рН розчинів можна розрахувати або експериментально визначити за допомогою спеціальних електрохімічних методів. Однак для наближеного знаходження величини рН користуються індикаторами (від лат.слова indicator – той, хто вказує).
Індикатор – це хімічна сполука, яка дозволяє візуалізувати досягнення системою певного стану з відповідною величиною рН середовища, що виявляється у виникненні помітної ознаки (змінення забарвлення, випадіння осаду, поява люмінісценції тощо).
Існує декілька груп індикаторів, кожна з яких має своє призначення. Так, для визначення рН розчину використовують здебільшого кислотно-основні індикатори – найчастіше це складні органічні кислоти чи основи, які змінюють своє забарвлення залежно від реакції середовища. Інтервал значень pH (інтервал переходу), в якому спостерігається змінення забарвлення, пов'язаний з константою диссоціації індикатору (pK) співвідношенням pH=pK±1. Для проведення аналізу індикатор вибирають таким чином, щоб інтервал переходу кольору включав те значення pH, яке розчин має у точці еквівалентності (табл.8.1, рис.8.11).
Таблиця 8.1 – Кислотно-основні індикатори
|
Назва |
Інтервал переходу рН |
Забарвлення |
|
|---|---|---|---|
|
у кислому середовищі |
у лужному середовищі |
||
|
Фенолфталеїн |
8,2-10,0 |
Безбарвне |
Малинове |
|
Метиловий оранжевий |
3,1-4,4 |
Рожеве |
Жовте |
|
Метиловий червоний |
4,2-6,3 |
Червоне |
Жовте |
|
Лакмус |
6,0-8,0 |
Червоне |
Синє |
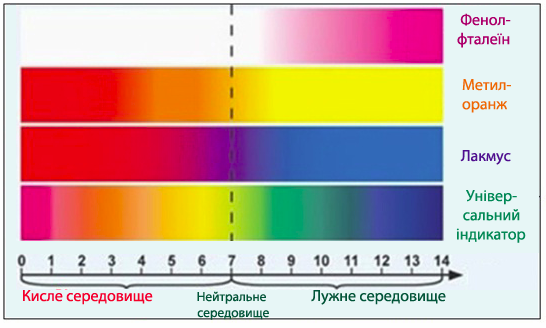
Рисунок 8.11 – Змінення забарвлення деяких індикаторів залежно від рН середовища
8.4.4 Реакції у розчинах електролітів
Згідно з теорією електролітичної дисоціації реакції у розчинах електролітів відбуваються між іонами, причому обов’язковою умовою перебігу таких реакції є виділення щонайменше одного продукту з реакційного середовища.
Реакції між іонами у розчинах відбуваються тільки у тому випадку, якщо внаслідок їх взаємодії утворюється осад, летка сполука або слабкий електроліт, що зумовлює зміщення рівноваги у бік прямої реакції.
Розглянемо окремі випадки перебігу іонних реакцій.
-
Утворення осаду. Якщо до розчину солі барію додати розчин, що містить сульфат-іони, то випадає осад BaSO4. Ця взаємодія відображається за допомогою молекулярних та іонних рівнянь реакції:
Скорочені іонні рівняння доводять, що фактично реакція відбувається між іонами Ва2+ і SO42–, тому саме скорочені іонні рівняння виражають сутність хімізму цієї реакції.
- Ba(NO3)2 + Na2SO4 ⇒BaSO4↓ + 2NaNO3,
- Ba2+ +2NO3– + 2Na+ + SO42–⇒BaSO4↓ + 2Na+ + 2NO3–,
- Ba2+ + SO42–⇒BaSO4↓;
- BaCl2 + K2SO4⇒BaSO4↓ + 2KCl,
- Ba2+ + 2Cl– + 2K+ + SO42–⇒BaSO4↓ + 2K+ + 2Cl–,
- Ba2+ + SO42–⇒BaSO4↓.
-
Утворення леткої речовини. Прикладами можуть бути реакції, внаслідок яких виділяються газоподібні речовини: H2S, NH3, CO2 тощо.
- Na2S + 2HCl ⇒ H2S↑ + 2NaCl,
- 2Na+ + S2– + 2H+ + 2Cl–⇒H2S↑ + 2Na+ + 2Cl–,
- H+ + S2–⇒H2S↑.
-
Утворення малодисоційовані сполуки внаслідок перебігу таких процесів:
- реакцій нейтралізації, в яких утворюється вода. Реакції нейтралізації можуть відбуватися при взаємодії різних речовин, наприклад:
- кислоти і основи
- HCl + NaOH ⇒ NaCl + H2O,
- H+ + Cl– + Na+ + OH–⇒Na+ + Cl– + H2O,
- H+ + OH–⇒H2O;
- кислої солі з лугом
- NaHCO3 + NaOH ⇒ Na2CO3 + H2O,
- Na+ + HCO3– + Na+ + OH–⇒2Na+ + CO32– + H2O,
- HCO3– + OH–⇒H2O + CO32–;
- основної солі з кислотою
- Fe(OH)2Cl + 2HCl ⇒ FeCl3 + 2H2O,
- Fe(OH)2+ + Cl– + 2H+ + 2Cl–⇒Fe3+ + 3Cl– + 2H2O,
- Fe(OH)2+ +2H+ ⇒ Fe3+ + 2H2O;
- кислотного оксиду з лугом
- CO2 + 2КOH ⇒ К2CO3 + H2O,
- CO2 + 2К+ + 2OH–⇒2К+ + CO32– + H2O,
- CO2 + 2OH–⇒H2O + CO32–;
- основного оксиду з кислотою
- СаO + 2HCl ⇒ СаCl2 + H2O,
- СаО + 2H+ + 2Cl–⇒Са2+ + 2Cl– + H2O,
- СаО +2H+ ⇒ Са2+ + H2O;
- реакції, в яких утворюється слабка кислота:
- NaClО + HNO3 ⇒ NaNO3 + HClО,
- Na+ + ClО– + H+ + NO3–⇒Na+ + NO3– + HClО,
- H+ + Cl–⇒HСlO; (Кдис = 3·10-8)
- (СH3COO)2Ca + 2HCl ⇒CaCl2 + 2CH3COOH,
- 2СH3COO– + Ca2+ + 2H+ + 2Cl– ⇒Ca2+ + 2Cl– + 2CH3COOH,
- СH3COO– + H+ ⇒ CH3COOH; (Кдис = 1,78 ·10-5);
- реакції утворення слабкої основи:
- NH4Cl + NaOH ⇒ NaCl + NH4OH,
- NH4+ +Cl– + Na+ + OH–⇒Na+ + Cl– + NH4OH,
- NH4+ + OH–⇒NH4OH; (Кдис = 1,76 · 10-5);
- реакції утворення комплексних іонів:
- Zn(OH)2 + 2KOH ⇒K2[Zn(OH)4],
- Zn(OH)2 + 2K+ + 2OH–⇒2K+ + [Zn(OH)4]2–,
- Zn(OH)2 + 2OH– ⇒ [Zn(OH)4]2–; (Кдис = 2·10-4).
8.4.5 Гідроліз солей
Більшість солей у водних розчинах не тільки піддається процесу гідратації, внаслідок якої катіони і аніони оточуються диполями води, але й процесу гідролізу – взаємодії з водою.
Гідроліз солей – це взаємодія їх складових частин з водою, яка приводить до утворення слабкого електроліту: слабкої кислоти чи слабкої основи, кислої чи основної солі.
Гідроліз являє собою реакцію обмінного розкладу солі водою, тобто процес, який є зворотним відносно реакції нейтралізації. Гідроліз – рівноважна реакція, тому можна зміщувати рівновагу у бажаний бік, створивши такі умови, за яких сіль або піддається повному гідролізу, або, навпаки, зовсім не буде гідролізуватися.
Якщо розглядати солі як продукти взаємодії кислот з основами, то в залежності від сили кислот і основ розрізняють чотири типи солей:
- солі, що утворені сильною кислотою і сильною основою;
- солі, що утворені слабкою кислотою і сильною основою;
- солі, що утворені сильною кислотою і слабкою основою;
- солі, що утворені слабкою кислотою і слабкою основою.
Сіль, що складається з катіонів сильних основ і аніонів сильних кислот (NaCI, KNO3, Na2SO4 тощо), ніколи не гідролізується, оскільки катіони і аніони таких солей не зв’язують складові частини води (Н+ і ОН–), а отже, не порушують її іонну рівновагу. Тому концентрація іонів Н+ і ОН– залишається звичайно такою, як у чистої води, а розчин має нейтральне середовище (рН=7). Отже, при розчиненні таких солей відбувається тільки їх дисоціація. Наприклад:
- NaCI ⇒ Na+ + CI–,
- KNO3 ⇒ K+ + NO3–.
Солі, утворені сильною основою та сильною кислотою, гідролізу не піддаються.
При гідролізі солей інших типів у розчині спостерігається змінення реакції середовища.
Ще раз слід наголосити, що в реакцію гідролізу вступають лише ті солі, які містять кислотні залишки слабких кислот чи катіони слабких основ. Залежно від природи солі гідроліз поділяють на три типи.
І тип – гідроліз солей, утворених сильними основами і слабкими кислотами, тобто гідроліз по аніону. До таких солей належать Na2CO3 , CH3COONa, KCN, K3PO4, Na2S та інші. Якщо сіль містить однозарядний кислотний залишок, то реакція гідролізу відбувається в одну стадію, наприклад, гідроліз натрій ацетату:
- СН3СООNa + H2O ⇔ CH3COOH + NaOH,
- СН3СОО– +Na+ + H2O ⇔ CH3COOH + Na+ + OH–,
- СН3СОО– + H2O ⇔ CH3COOH + OH–.
Із скороченого іонного рівняння видно, що іони Na+ не беруть участі в реакціїї – гідролізується лише аніон СН3СОО–, який зв’язує одну із складових частин води, і утворює малодисоційовану сполуку – слабку оцтову кислоту СН3СООН. При цьому у розчині накопичується надлишок незв’язаних гідроксид-іонів, який забезпечує лужну реакцію середовища і рН>7.
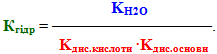
Оскільки гідроліз є оборотним процесом, то він підкоряється закону діючих мас і характеризується константою рівноваги:
Проте у розведених розчинах, в яких і відбуваєтьсяь гідроліз, кількість води порівняно з кількістю солі дуже велика, тому концентрацію води можна вважати постійною [H2O]=const і об'єднати її з константою рівноваги:
Добуток у правій частині одержаного рівняння (К·[H2O]) називається константа гідролізу. Помножимо чисельник лівої частини рівняння і знаменник на [H+]:
Однак добуток [H+]·[OH–] – це іонний добуток води (KH2O):
-
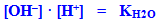 ,
,
а інша частина рівняння – вираз, оборотний константі дисоціації слабкої оцтової кислоти:
З урахуванням цього одержуємо:
Якщо у складі солі є багатозарядний аніон слабкої кислоти, то така сіль гідролізується ступінчасто, причому, на першому ступені утворюються кислі солі, наприклад, гідроліз натрій карбонату:
- I ступінь: Na2CO3 + H2O ⇔ NaHCO3 + NaOH,
- 2Na+ + CO32– + H2O ⇔ Na+ + HCO3– + Na+ + OH–,
- CO32– + H2O ⇔ HCO3– + OH–;
- ІІ ступінь: NaНCO3 + H2O ⇔ H2CO3 + NaOH,
- Na+ + НCO3– + H2O ⇔ H2CO3 + Na+ + OH–,
- НСО3– + Н2О ⇔ Н2СО3 + ОН–.
Завдяки наявності незв’язаних іонів ОН– у розчини цієї солі утворюється лужне середовище, рН>7.
За звичайних умов гідроліз, як правило, обмежується першою стадією, оскільки іони ОН–, що вивільняються під час першої стадії, зміщують згідно із принципом Ле-Шательє гідролітичну рівновагу другої стадії у бік зворотної реакції.
До такого самого висновку можна дійти, порівнюючи величини констант дисоціації кислот НСО3– і Н2СО3, які утворюються відповідно на першій та другій стадіях гідролізу: КНСО3–=4,8·10–11; КН2СО3=4,5·10–7. Зрозуміло, що сіль Na2CO3, що утворена слабкішою кислотою НСО3–, буде гідролізуватися сильніше, ніж сіль NaHCO3, що утворена менш слабкою кислотою Н2СО3. Отже, Кгідр Na2CO3>Kгідр NaHCO3. Однак, якщо з якихось причин необхідно посилити гідроліз, можна додати невелику кількість кислоти для зв’язування гідроксид-іонів (Н++ОН–⇒Н2О) або сильніше розвести розчин: збільшення кількості Н2О зміщує рівновагу вправо. Нарешті, зважаючи на те, що гідроліз належить до ендотермічних процесів, для зміщення рівноваги у напрямку прямої реакції необхідно підвищити температуру.
Із розглянутих прикладів випливає висновок щодо І типу гідролізу:
cіль, утворена сильною основою і слабкою кислотою, гідролізується по аніону, при цьому утворюється слабка кислота (чи кисла сіль), а розчин набуває лужної реакції середовища (рН>7). Вираз константи гідролізу за І типом доводить: чим менше значення константи дисоціації кислоти (тобто чим слабкіша кислота), тим більша величина Кгідр і тим сильніше гідролізується сіль.
ІІ тип – гідроліз солей, утворених слабкими основами і сильними кислотами, тобто гідроліз по катіону. Прикладами таких солей є: NH4NO3, FeCl2, FeCl3, Al(ClO4)3, CuSO4 та ін. При однозарядному катіоні гідроліз відбувається в одну стадію:
- NH4Сl + H2O ⇔ NH4OH + HCl,
- NH4+ + Сl– + H2O ⇔ NH4OH + H+ + Cl–,
- NH4+ + H2O ⇔ NH4OH + H+.
Надлишок іонів Н+ зумовлює кислу реакцію середовища і рН<7. Константа гідролізу, що описує гідролітичну рівновагу, для цієї солі має вигляд:
Перемножимо чисельник і знаменник рівняння на [OH–]:
Одержане рівняння складається з іонного добутку води і константи дисоціації основи
Тоді маємо ще один вираз константи гідролізу:
Для гальмування гідролізу солей цього типу необхідно підкислити розчин (збільшення концентрації Н+ згідно із принципом Ле-Шательє зміщує рівновагу вліво) чи підвищити концентрацію солі, оскільки зменшення кількості Н2О теж буде сприяти протіканню зворотної реакції. Можна також знизити температуру.
Якщо сіль має багатозарядний катіон, гідроліз відбувається ступінчасто:
- I ступінь: CuCl2 + H2O ⇔ CuOHCl + HCl,
- Cu2+ + 2Cl– + H2O ⇔ CuOH+ + Cl– + H+ + Cl–,
- Cu2+ + H2O ⇔ CuOH+ + H+;
- II ступінь: CuOHCl + H2O ⇔ Cu(OH)2 + HCl,
- CuOH+ + Cl–+ H2O ⇔ Cu(OH)2 + H+ + Cl–,
- CuOH+ + H2O ⇔ Cu(OH)2 + H+.
Надлишок іонів Н+ свідчить про кислу реакцію середовища і рН<7. Кожній стадії відповідає своя константа гідролізу:
Оскільки Кдис Cu(OH)2>Kдис CuOH+, то КгідрІ>КгідрІІ, тобто за першим ступенем сіль гідролізується значно більше, ніж за другим. Отже,
сіль, утворена слабкою основою і сильною кислотою, гідролізується по катіону, при цьому утворюється слабка основа (чи основна сіль), а розчин набуває кислої реакції середовища, рН<7. Вираз константи гідролізу показує: чим слабкішою є основа (або чим менше значення Кдис.осн), тим більша константа гідролізу і тим сильніше гідролізується сіль
ІІІ тип – гідроліз солей, утворених слабкими кислотами і слабкими основами. Гідроліз таких солей протікає досить повно, а іноді й необоротно, оскільки внаслідок гідролізу утворюються дві малодисоційовані, леткі чи малорозчинні сполуки. Реакція середовища у розчині солей цього типу найчастіше буває нейтральною (рН≈7), але може бути слабкокислою (рН≤7), або слабколужною (рН≥7).
Розглянемо кожний з таких випадків. Гідроліз ацетату амонію:
- СН3СООNH4 + H2O ⇔ CH3COOH + NH4OH,
- СН3СОО– + NH4+ + H2O ⇔ CH3COOH + NH4OH,
- CH3COO– + NH4+ + H2O ⇔ CH3COOH + NH4OH.
Внаслідок гідролізу ацетату амонію утворюються слабка кислота CH3COOH і слабка основа NH4OH. Для того, щоб зробити висновок про рН розчину солі СН3СООNH4, необхідно порівняти сили обох слабких електролітів за їх константами дисоціації:
- Кдис.СН3СООН = 1,74 · 10–5; Кдис.NH4OH = 1,76 · 10–5.
Обидві константи практично однакові, тому розчин солі СН3СООNH4 має нейтральну реакцію середовища, рН=7. Для цього типу солей константа гідролізу ураховує константи дисоціації як кислоти, так і основи:
Прикладом другого випадку, при якому розчин набуває слабкокислого середовища, є гідроліз меркурій (ІІ) ціаніду:
- І ступінь: Hg(CN)2 + H2O ⇔ HgOHCN + HCN,
- Hg2+ + 2CN– + H2O ⇔ HgOH+ + CN– + HCN,
- Hg2+ + H2O ⇔ HgOH+ + HCN,
- ІІ ступінь: HgOHCN + H2O ⇔ Hg(OH)2 + HCN,
- HgOH+ + CN– + H2O ⇔ Hg(OH)2 + HCN,
- HgOH+ + CN– + H2O ⇔ Hg(OH)2 + HCN.
Необхідно уточнити, що на практиці основа Hg(OH)2 дуже швидко розкладається на HgO i H2O, але в наведеному прикладі це не показано.
Порівняємо константи дисоціації відповідних електролітів:
- Кдис.Hg(OH)2 = 5 · 10–11, Kдис.HgOH+ = 3,6 · 10–14, Кдис.HCN = 5 · 10–10.
Величина Кдис.HCN на порядок перебільшує Кдис.Hg(OH)2, а це свідчить, що основа Hg(OH)2 по силі електроліта слабкіша, ніж електроліт HCN. З цієї причини гідроліз по катіону певною мірою переважає над гідролізом по аніону, зв’язування іонів ОН– відбувається значніше, тому реакція середовища – слабкокисла і рН≤7.
Слабколужне середовище може утворюватися, наприклад, при гідролізі солі плюмбум (ІІ) ацетату Pb(CH3COO)2:
- І ступінь: Pb(CH3COO)2 + H2O ⇔ (PbOH)(CH3COO) + CH3COOH,
- Pb2+ + 2CH3COO– + H2O ⇔ PbOH+ + CH3COO– + CH3COOH,
- Pb2+ + CH3COO– + H2O ⇔ PbOH+ + CH3COOH.
- ІІ ступінь: PbOHCH3COO + H2O ⇔ Pb(OH)2 + CH3COOH,
- PbOH+ + CH3COO– + H2O ⇔ Pb(OH)2 + CH3COOH.
Для визначення рН порівняємо константи дисоціації відповідних електролітів:
- КPbOH+ = 9,6 · 10–4; KCH3COOH = 1,74 · 10–5.
Оскільки кислота є значно слабшим електролітом, то реакція середовища у розчині солі Pb(CH3COOН)2 слабколужна, рН≥7.
На підставі розглянутих прикладів III типу гідролізу солей, утворених слабкими основами і слабкими кислотами, можна зробити загальний висновок:
Сіль, утворена слабкою основою та слабкою кислотою, гідролізується одночасно по катіону і по аніону, при цьому продуктами є слабка основа (або основна сіль) і слабка кислота ( або кисла сіль). Реакція середовища у розчині може бути:
1) нейтральною (рН≈7), якщо основа і кислота мають близькі значення констант дисоціації (Кдис.кислоти≈Kдис.основи);
2) слабкокислою (рН≤7), якщо основа є слабкішим електролітом у порівнянні з кислотою (Кдис.кислоти>Kдис.основи);
3) слабколужною (рН≥7), якщо кислота є слабкішим електролітом, ніж основа (Кдис.кислоти<Kдис.основи). Константа гідролізу визначається константами дисоціації як слабкої кислоти, так і слабкої основи:Деякі солі, що утворені дуже слабкими кислотами і дуже слабкими основами, гідролізуються не ступінчасто, а одразу піддаються повному необоротному гідролізу. Наприклад, алюміній сульфід, утворений слабкою амфотерною основою Al(OH)3 і слабкою сульфідною кислотою H2S, гідролізується майже миттєво навіть у невеликій кількості води, причому, гідроліз одночасно протікає і по катіону, і по аніону:
- Al2S3 + 6H2O ⇒ 2Al(OH)3↓ + 3H2S↑.
Кількісною мірою гідролізу, крім константи гідролізу, може бути й інша характеристика – ступінь гідролізу h.
Ступінь гідролізу h – це відношення концентрації гідролізованої солі до її загальної концентрації:
- h = Cгідр / Сзаг.
Для дуже розведених розчинів солей виконується залежність, аналогічна рівнянню Оствальда, яка пов’язує ступінь гідролізу з концентрацією і константою гідролізу:
- Кгідр = Сh2 i
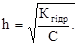
В повсякденній практиці слід пам’ятати, що розчини багатьох солей можуть мати значення рН, відмінні від 7, а це визначає особливості протікання тих чи інших хімічних реакцій і, зокрема, агресивність середовища при корозійних процесах. Крім того, необхідно знати засоби, за допомогою яких гідроліз може посилюватися чи пригнічуватися.
Чинники, що впливають на ступінь гідролізу h і зміщення гідролітичної рівноваги.
- Природа солі: чим слабкіша кислота, аніон якої входить до складу солі, тим повніше відбувається гідроліз; чим слабкішою є основа, катіон якої входить до складу солі, тим більшою є величина ступеню гідролізу h. Наприклад, з двох солей КClO і КCN, які гідролізуються по аніону, за однакових умов більшою мірою піддається гідролізу КCN, оскільки кислота HCN слабкіша за НClO (KHCN=7,9.10–10, KHClO=5.10–8). А з двох солей MgCl2 і ZnCl2 більше гідролізується ZnCl2, тому що ця сіль утворена слабкішою основою Zn(OH)2.
- Концентрація солі, яка безпосередньо зв'язана з кількістю води у розчині. В розведеніших розчинах води набагато більше, ніж у концентрованих. А згідно з принципом Ле-Шательє збільшення кількості води (розведення розчину) зміщує гідролітичну рівновагу вправо. Звідси випливає загальний висновок: при розведенні розчину гідроліз солей посилюється і ступінь гідролізу h зростає, а при концентруванні – гідроліз послаблюється.
- Температура. Оскільки реакція гідролізу належить до ендотермічних процесів, то підвищення температури зміщує гідролітичну рівновагу вправо і ступінь гідролізу зростає.
- Змінення реакції середовища шляхом додавання до розчину солі кислоти (+Н+) або лугу (+ОН–). При гідролізі по аніону, у результаті якого відбувається накопичення у розчині незв'язаних іонів ОН–, додавання лугу відповідно до принципу Ле-Шательє зміщує гідролітичну рівновагу вліво і гідроліз пригнічується. А підкислення розчину такої солі (введення додаткових іонів Н+) зв’язує вільні гідроксильні іони в малодисоційовану сполуку (Н++ОН–⇒Н2О) і зміщує гідролітичну рівновагу вправо, посилюючи перебіг гідролізу. Наприклад, якщо розчин солі Na2CO3, що створює лужну реакцію середовища за рахунок незв'язаних іонів ОН–, підкислити, то гідроліз посилиться, а якщо долити трохи лугу – послаблюється. Для солей, які гідролізуються по катіону і створюють у розчині кисле середовище, справедливою є зворотна залежність: підкислення пригнічує гідроліз, а додавання лугу – посилює.
- Додавання інших солей. Якщо до розчину солі, що гідролізується, долити розчин іншої солі, гідроліз якої відбувається за тим же типом і створює таке ж середовище (кислотне чи лужне), то спостерігається взаємне пригнічування гідролізу, оскільки обидві солі збільшують концентрацію однакових продуктів реакції (Н+ чи ОН–), а це призводить до зміщення гідролітичної рівноваги вліво, у бік зворотної реакції. А при зливанні розчинів двох солей, які гідролізуються за різними типами (тобто гідроліз однієї солі сприяє накопиченню надлишку іонів Н+, а гідроліз другої – надлишку іонів ОН–), відбувається взаємне посилення гідролізу. Зміщування гідролітичної рівноваги вправо, у бік прямої реакції, особливо помітно у достатньо розведених розчинах – в цьому випадку відбувається сумісний необоротний гідроліз, який, як правило, не обмежується першою стадією, а відбувається до кінця, до утворенні кінцевих продуктів. Наприклад, при змішуванні розведеного розчину хром(Ш) сульфату, який гідролізується по катіону, і натрій сульфіду, гідроліз якого відбувається по аніону, починається сумісний необоротний гідроліз обох солей, причому і катіон, і аніон гідролізуються до кінця, тому в рівнянні реакції сумісного необоротного гідролізу ставлять стрілку (⇒):
- Cr2(SO4)3 + 3Na2S + 6H2O ⇒ 2Cr(OH)3↓ + 3H2S↑ + 3Na2SO4,
- 2Cr+ + 3SO42– + 6Na+ + 6H2O ⇒ 2Cr(OH)3↓ + 3H2S↑ + 6Na+ + SO42–,
- Cr3+ + 3S2– + 6H2O ⇒ 2Cr(OH)3↓ + 3H2S↑.
Як видно з рівнянь гідролізу, іони Н+ і ОН– сполучаються у міцні недисоційовані сполуки (осад Cr(OH)3 і летка речовина H2S), тому реакція середовища нейтральна і рН=7.
Гідроліз відіграє важливу роль при здійсненні багатьох процесів. Наприклад, вилучення солей феруму з води методом аерації при очищенні питної води. При насиченні води киснем ферум (II) гідрогенкарбонат, що міститься у воді, окиснюється до солі феруму (III), який сильніше піддається гідролізу. У результаті відбувається повний гідроліз і залізо відокремлюється у вигляді осаду ферум (III) гідроксиду. На цьому засновано й застосування солей алюмінію в якості коагулянтів при очищенні питної води. Солі алюмінію в присутності гідрогенкарбонат-іонів повністю гідролізуються, утворюючи драглистий осад алюміній гідроксиду, який при коагуляції захвачує в осад ще й інші домішки.
8.5 Приклади розв'язання типових задач
Приклад 8.1. Написати рівняння дисоціації основ: калій гідроксиду і ферум (ІІ) гідроксиду, скласти вираз константи дисоціації.
Розв’язок. Калій гідроксид – луг, належить до сильних електролітів і піддається у розчинах повній дисоціації:
- KOH ⇒ K+ + OH–.
Оскільки КОН є сильним електролітом, він не підкоряється закону діючих мас і константа дисоціації для нього не записується.
Ферум (ІІ) гідроксид, навпаки, є слабким електролітом, дисоціює по двом ступеням, кожному з яких відповідає свій вираз константи дисоціації:
Приклад 8.2. Скласти рівняння електролітичної дисоціації для таких речовин: а) хлоридна кислота; б) ортоарсенатна кислота; в) купрум(ІІ) гідроксид; г) ферум(ІІІ) сульфат; д) кальцій дигідрогенортофосфат; е) гідроксокупрум(ІІ) хлорид.
Розв’язок. а) хлоридна (соляна) кислота – сильний електроліт, тому в водних розчинах дисоціює повністю
-
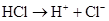 ;
;
б) ортоарсенатна кислота – слабкий електроліт, триосновна кислота, тому дисоціація відбуваєтьсяь частково, у три стадії, причому ступені дисоціації для окремих стадій перебувають в залежності α1>α2>α3. Рівняння дисоціації:
-
I ступінь:
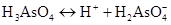 ,
,
-
II ступінь:
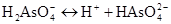 ,
,
-
III ступінь:
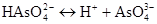 ;
;
в) купрум (ІІ) гідроксид – слабкий електроліт, піддається частковій дисоціації по двом ступеням:
-
I ступінь:
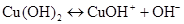 ,
,
-
II ступінь:
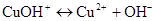 ;
;
г) ферум(ІІІ) сульфат – сильний електроліт, добре розчинна сіль, тому дисоціює повністю, в одну стадію:
-
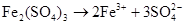 ;
;
д) кальцій дигідрогенортофосфат – кисла сіль, яка по першому ступеню дисоціює повністю як сильний електроліт, а по другій і третій – тільки частково, як слабкий електроліт:
-
I ступінь:
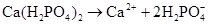 ,
,
-
II ступінь:
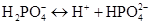 ,
,
-
III ступінь:
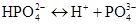 ;
;
е) гідроксокупрум(ІІ) хлорид – основна сіль, по першому ступеню дисоціює повністю, а по другому – частково:
-
I ступінь:
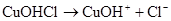 ,
,
-
II ступінь:
 .
.
Приклад 8.3. Як буде зміщуватися рівновага у розчині оцтової кислоти при додаванні до нього солі СН3СООNa?
Розв’язок. Оцтова кислота, яка є слабким електролітом, частково дисоціює на іони за рівнянням:
- СН3СООН ⇔ СН3СОО– + Н+.
Якщо до її розчину додати сильний електроліт – сіль СН3СООNa, то внаслідок майже повної дисоціації цієї солі зв’являється велика кількість іонів СН3СОО–:
- СН3СООNa ⇒ CH3COO– + Na+.
Ацетат-аніони будуть утворювати з катіонами Н+ недисоційовані молекули:
- СН3СОО– + Н+ ⇒ CH3COOH,
тобто концентрація оцтової кислоти буде зростати. А з підвищенням концентрації ступінь дисоціації зменшується, тому рівновага процесу дисоціації вихідної кислоти СН3СООН зміститься у напрямку зворотної реакції.
Приклад 8.4. Розрахувати рН розчину калій гідроксиду КОН концентрації 0,01 моль/л.
Розв’язок. Калій гідроксид належить до сильних електролітів, тому в розведених розчинах дисоціює повністю:
- КОН ⇒ K+ + OH–.
Як випливає з рівняння дисоціації, концентрація гідроксильних іонів дорівнює концентрації КОН, тобто
[OH– ] = CМ(KOH) = 0,01 моль/л = 10–2 моль/л.
Гідроксильний показник, який визначається від’ємним логарифмом концентрації іонів ОН–, пов’язаний з водневим показником співвідношенням
- рН + рОН = 14,
звідки - рН = 14 – рОН.
Однак, - рОН = – lg[OH–] = –lg10–2 = 2, тому
- рН = 14 – 2 = 12.
Це вказує на сильнолужне середовище.
Приклад 8.5. Обчислити ступінь дисоціації і концентрацію іонів гідрогену в розчині оцтової кислоти концентрації 0,1М, якщо Кдис = 1,8 · 10–5 .
Розв’язок. Оцтова кислота належить до слабких електролітів, дисоціює частково:
- СН3СООН ⇔ СН3СОО– + Н+,
тому для неї концентрація іонів гідрогену визначається добутком ступеня дисоціації на загальну концентрацію кислоти
- [H+] = α · CCH3COOH,
а ступінь дисоціації обчислюється згідно із законом розведення Оствальда:
Тоді концентрація іонів гідрогену:
- [H+] = 1,34 · 10–2 · 0,1 = 1,34 · 10–3 моль/л.
Приклад 8.6. Як буде зміщуватися рівновага у насиченому розчині ВаСl2 при додаванні соляної кислоти?
Розв’язок. Рівняння дисоціації солі та добуток розчинності:
- ВаСl2 ⇒ Ba2+ + 2Cl–;
- ДРBaCl2= [Ba2+]·[Cl–]2.
Збільшення концентрації Cl– при додаванні HСl зміщує рівновагу дисоціації солі BaCl2 вліво, внаслідок чого починається кристалізація осаду:
- Ba2+ + 2Cl– ⇒ BaCl2(кр).
Приклад 8.7. Написати рівняння реакцій між розчинами ферум(ІІІ) хлориду і натрій гідроксиду в молекулярній та іонній формах.
Розв’язок. Запишемо рівняння реакції в молекулярній формі, відмітивши випадіння осаду:
- FeCl3 + 3NaOH ⇒ Fe(OH)3↓+ 3NaCl
Складемо розгорнуте іонне рівняння, записуючи формули сильних електролітів у вигляді іонів, а малодисоційованих сполук – у молекулярній формі:
- Fe3+ + 3Cl– + 3Na+ + 3OH– ⇒ Fe(OH)3 ↓ + 3Na+ + 3Cl–.
Скоротимо з обох частин іонного рівняння однакові іони, які не беруть участі в реакції (їх формули підкреслені):
- Fe3+ + 3Cl– + 3Na+ + 3OH– ⇒ Fe(OH)3↓ + 3Na+ + 3Cl–.
Запишемо скорочене іонне рівняння реакції в остаточному вигляді:
- Fe3+ + 3OH– ⇒ Fe(OH)3↓.
Як видно з цього рівняння, суть реакції зводиться до взаємодії між іонами Fe3+ і OH–, внаслідок чого утворюється осад Fe(OH)3. При цьому зовсім не має значення, до складу яких електролітів входили ці іони до їх взаємодії.
Приклад 8.8. Які з вказаних пар іонів можуть одночасно знаходитися в розчині: а) Na+ і PO43–; б) Na+ і OH–; в) Ag+ і Cl–; г) Cu2+ і S2–?
Розв’язок. Одночасно знаходитися в розчині можуть лише такі іони, що разом утворюють сильні електроліти: сильні основи та кислоти, розчинні у воді солі.
а) пара іонів Na+ і PO43– є складовими розчинної у воді солі (Na3PO4), яка є сильним електролітом і повністю розпадається на іони; отже ці іони можуть одночасно знаходитися в розчині;
б) іони Na+ і OH– відповідають сильній основі, отже вони також можуть одночасно існувати в розчині;
в) іони Ag+ і Cl– не можуть одночасно знаходитися у розчині, тому що разом вони утворюють нерозчинну сіль згідно із схемою:
Ag+ + Cl–⇒ AgCl↓;
г) іони Cu2+ і S2– теж не можуть одночасно знаходитися у розчині, тому що разом вони утворюють нерозчинний у воді осад – сіль купрум(ІІ) сульфід:
- Cu2+ + S2– ⇒ CuS↓.
Приклад 8.9. Написати молекулярні та іонні рівняння реакцій (для тих випадків, коли вони відбуваються) при зливанні розчинів таких речовин: а) калій сульфіду і хлоридної кислоти; б) аргентум нітрату і калій ортофосфату; в) купрум(ІІ) гідроксиду і нітратної кислоти; г) натрій гідрогенкарбонату і сульфатної кислоти; д) барій гідроксиду і натрій гідроксиду.
Розв’язок. При виконанні подібних завдань необхідно підтримуватися наступного алгоритму.
- Спрогнозувати склад очікуваних продуктів реакції обміну з урахуванням перебігу необоротної взаємодії між вихідними реагентами (випадіння осаду,виділення газу чи утворення малодисоційованої сполуки) і зробити висновок про можливість або неможливість протікання хімічної реакції.
- При принциповій можливості протікання реакції записати молекулярне рівняння, розставити необхідні коефіцієнти.
- На основі молекулярного рівняння скласти повне іонне рівняння реакції, в якому формули сильних електролітів записувати у вигляді іонів, а неелектролітів, осаду і газу – в молекулярному.
- Записати скорочене іонне рівняння, попередньо скоротивши зліва і справа формули одних і тих самих іонів і залишивши тільки формули тих іонів і молекул, які брали участь у хімічнії взаємодії.
а)
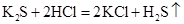 (молекулярне рівняння),
(молекулярне рівняння),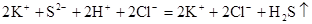 (повне іонне рівняння),
(повне іонне рівняння),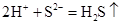 (скорочене іонне рівняння);
(скорочене іонне рівняння);б)
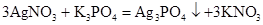 ,
,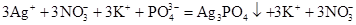 ,
,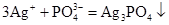 ;
;в)
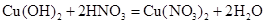 ,
,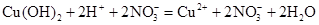 ,
,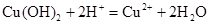 ;
;г)
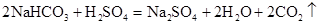 ,
,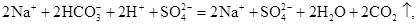
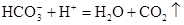 ;
;д) якщо уявити можливість перебігу реакції між двома сильними електролітами BaCl2 і NaOH, то її продуктами були б речовини Ba(OH)2 і NaCl. Але вони теж є сильними електролітами, тобто перебувають у розчині у вигляді іонів. Отже, не виконується умова необоротності, тому взаємодія між BaCl2 і NaOH не відбувається.
Приклад 8.10. Скласти молекулярні рівняння реакцій для запропонованих скорочених схем:
а)
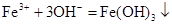 ; б)
; б) 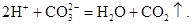
Розв’язок. Для складання молекулярного рівняння реакції згідно із заданим іонним рівнянням необхідно підібрати відповідні сильні електроліти, при дисоціації яких у водних розчинах утворюються зазначені іони.
а) очевидно, що катіони
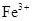 утворюються внаслідок дисоціації сильних електролітів, до яких належить більшість добре розчинних солей феруму(III), а гідроксид-іони – внаслідок дисоціації лугів (за винятком слабкого електроліту NH4OH). Тому в якості молекулярного рівняння можна вибрати такі варіанти:
утворюються внаслідок дисоціації сильних електролітів, до яких належить більшість добре розчинних солей феруму(III), а гідроксид-іони – внаслідок дисоціації лугів (за винятком слабкого електроліту NH4OH). Тому в якості молекулярного рівняння можна вибрати такі варіанти:- Fe(NO3)3 + 3KOH ⇒ Fe(OH)3↓ + 3KNO3,
- FeCl3 + 3KOH ⇒ Fe(OH)3↓ + 3KCl.
б) за скороченим іонним рівнянням можна припустити, що катіони Н+ утворюються у результаті дисоціації сильної кислоти, а аніони СО32– – при дисоціації розчинної карбонатної солі. Тому заданому іонному рівнянню можуть відповідати такі молекулярні рівняння:
- 2HCl + K2CO3 ⇒ 2KCl + CO2↑ + H2O,
- H2SO4 + Na2CO3 ⇒ Na2SO4 + CO2↑ + H2O.
Приклад 8.11. Скласти молекулярні та іонно-молекулярні рівняння реакцій, що протікають при змішуванні розведених розчинів (попарно): Cr(NO3)3, K2S, KOH, HCl.
Розв’язок. Спочатку розглянемо, які процеси будуть відбуватися, якщо до розчину, що містить Cr(NO3)3, додавати по черзі решту розчинів.
a) змішування водних розчинів Cr(NO3)3 i K2S призведе до протікання необоротного сумісного гідролізу, оскільки зазначені солі гідролізуються за протилежними типами, посилюючи гідроліз одна одної:
- 2Cr(NO3)3 + 3K2S + 6H2O ⇒2Cr(OH)3↓ + 3H2S↑ + +6KNO3,
- 2Cr3+ + 6NO3– + 6K+ + 3S2– + 6H2O ⇒ 2Cr(OH)3↓ + 3H2S↑ + 6K+ + 6NO3–,
- 2Cr3+ + 3S2– + 6H2O ⇒ 2Cr(OH)3 + 3H2S↑.
б) при змішуванні розчинів Cr(NO3)3 та КОН залежно від стехіометричного співвідношення реагентів можуть відбуватисяи реакції з утворенням різних продуктів, наприклад,
- кислої солі: Cr(NO3)3 + 2KOH ⇒ Cr(OH)2(NO3)↓ + 2KNO3,
- Cr3+ + 3NO3– + 2K+ + 2OH–⇒ Cr(OH)2(NO3)↓ + 2K+ + 2NO3–,
- Cr3+ + NO3–+ 2OH– ⇒ Cr(OH)2(NO3)↓;
- основи: Cr(NO3)3 + 3KOH ⇒ Cr(OH)3↓ + 3KNO3,
- Cr3+ + 3NO3– + 3K+ + 3OH–⇒Cr(OH)3↓ + 3K+ + 3NO3–,
- Cr3+ + 3OH–⇒Cr(OH)3,
- комплексної солі: Cr(NO3)3 + 6KOH(надл.) ⇒K3[Cr(OH)6] + 3KNO3,
- Cr3+ + 3NO3– + 6K+ + 6OH–⇒3K+ + [Cr(OH)6]3– + 3K+ + 3NO3–,
- Cr3+ + 6OH–⇒ [Cr(OH)6] 3–.
в) При додаванні до розчину K2S розчину лугу КОН реакція не відбувається, а при дії на цю сіль розчином хлоридної кислоти HCl утворюється слабка сульфідна кислота чи, більш імовірно, виділяється сірководень:
- K2S + 2HCl ⇒ 2KCl + H2S↑,
- 2K+ + S2– + 2H+ + 2Cl–⇒2K+ + 2Cl– + H2S↑ ,
- H+ + S2–⇒H2S↑.
г) При змішуванні розчинів лугу і кислоти відбувається реакція нейтралізації:
- KOH + HCl ⇒ KCl + H2O,
- K+ + OH– + H+ + Cl–⇒K+ + Cl– + H2O,
- H+ + OH–⇒H2O.
д) Між сполуками Cr(NO3)3 i HCl при змішуванні їх розчинів взаємодії не відбувається, оскільки обидві речовини належать до сильних електролітів, як і ті сполуки, що могли б утворитися, якщо б реакція була можливою:
- Cr(NO3)3 + 3HCl ⇔ CrCl3 + 3HNO3, (реакція не відбувається)
- Cr3+ + 3NO3– + 3H+ + 3Cl– ⇔ Cr3+ + 3Cl– + 3H+ + 3NO3–.
З наведеної схеми видно, що взаємодія між розчинами Cr(NO3)3 та HCl не відбувається, тому що у розчині містяться тільки іони (Cr3+, NO3–, H+. Cl–), протікання реакції між якими неможливе, оскільки не забезпечується умова необоротності.
Приклад 8.12. Скласти рівняння реакцій гідролізу солей а) Al2(SO4)3; б) Na2SO3; в) Al2(CO3)3 у молекулярній та іонно-молекулярній формах, вказати реакцію середовища у розчині та зазначити способи посилення гідролізу для солей Na2SO3 і Al2(SO4)3.
Розв’язок. Для складання рівнянь гідролізу необхідно спочатку встановити складові частини кожної солі і залежно від їх природи визначити тип гідролізу.
а) алюміній сульфат Al2(SO4)3 – сіль, утворена слабкою основою та сильною кислотою, гідролізується у три стадії по катіону (Al3+), який належить слабкій основі. Слід підкреслити, що за звичайних умов протікання гідролізу обмежується тільки першою стадією, а друга, тим паче третя, майже не спостерігається.
- І ступінь: Al2(SO4)3 + 2H2O ⇔ 2AlOHSO4 + H2SO4,
- 2Al3+ +3SO42– + 2H2O ⇔ 2AlOH2++ 2SO42–+ 2H+ + SO42–,
- Al3+ + H2O ⇔ AlOH2+ + H+.
Як видно зі скороченого іонного рівняння, внаслідок гідролізу в розчині з’являється надлишок іонів Н+, що зумовлює кислу реакцію середовища рН<7.
- ІІ ступінь: 2AOHSO4 + 2H2O ⇔ (Al(OH)2)2SO4 + H2SO4,
- 2AlOH2++2SO42–+2H2O ⇔ 2Al(OH)2++SO42–+ 2H++ SO42–,
- AlOH2+ + H2O ⇔ Al(OH)2+ + H+.
- ІІІ ступінь: (Al(OH)2)2SO4 + 2H2O ⇔ 2Al(OH)3↓ + H2SO4,
- 2Al(OH)2+ + SO42– + 2H2O ⇔ 2Al(OH)3↓ + SO42– + 2H+,
- Al(OH)2+ + H2O ⇔ Al(OH)3↓ + H+.
Посилити гідроліз Al2(SO4)3 можна за допомогою таких заходів:
- розведення розчину шляхом додавання води, що призводить до зміщування гідролітичної рівноваги вправо;
- додавання лугів, які будуть зв’язувати іони Н+, утворені внаслідок гідролізу, що теж спричиняє зміщення гідролітичної рівноваги;
- підвищення температури – згідно з принципом Ле-Шательє гідроліз, який належить до ендотермічних реакцій, буде посилюватися;
- додавання розчину іншої солі, яка гідролізується за протилежним типом (Na2CO3, Na2S, NaCN, CH3COONa тощо) і дає лужну реакцію середовища, це призводить до необоротності гідролізу обох солей, наприклад:
- Al2(SO4)3+3K2CO3+3H2O⇒2Al(OH)3↓ + 3CO2↑ + K2SO4,
- 2Al3+ + 3SO42– + 6K+ + 3CO32– + 3H2O ⇒ 2Al(OH)3↓ + 3CO2↑ + 6K+ + 3SO42–,
- 2Al3+ + 3CO32– + 3H2O ⇒ 2Al(OH)3↓ + 3CO2↑.
б) Na2SO3 –сіль, утворена катіоном сильної основи (NaOH) та аніоном слабкої кислоти (Н2SO3), гідроліз відбувається по аніону – переважно за першим ступенем. Внаслідок цього утворюється слабка кислота (гідросульфіт-аніон НSO3–) і накопичуються іони ОН–, які забезпечують лужну реакцію середовища,
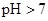 .
.- Na2SO3 + H2O ⇔ NaHSO3 + NaOH,
- 2Na+ + SO32– + H2O ⇔ Na+ + HSO3– + Na+ + OH–,
- SO32– + H2O ⇔ HSO3– + OH–.
Посилити гідроліз Na2SO3 можна за допомогою таких заходів:
- розведення розчину при додаванні води, що призводить до зміщування гідролітичної рівноваги вправо;
- підвищення температури;
- додавання невеликої кількості сильної кислоти, яка буде зв’язувати іони ОН–, зміщуючи гідролітичну рівновагу вправо;
- додавання розчину іншої солі, яка гідролізується за протилежним типом (тобто по катіону, наприклад, NH4Cl, ZnSO4, Cd(NO3)2, Cr(NO3)3) і дає кислотну реакцію середовища, що зумовлює перебіг сумісного необоротного гідролізу, наприклад:
- 2FeCl3 + 3Na2SO3 + 3H2O ⇒ 2Fe(OH)3↓ + 3SO2↑ + 6NaCl,
- 2Fe3+ + 3SO42– + 6Na+ + 3SO32– + 3H2O ⇒ 2Fe(OH)3↓ + 3SO2↑ + 6Na+ + 6Cl–,
- 2Fe3+ + 3SO32– + 3H2O ⇒ 2Fe(OH)3↓ + 3SO2↑.
в)
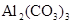 –сіль, утворена катіоном слабкої основи
–сіль, утворена катіоном слабкої основи 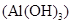 та аніоном слабкої кислоти
та аніоном слабкої кислоти 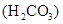 , тому гідролізується одночасно як по катіону, так і по аніону, причому одразу за всіма ступенями, повністю. Завдяки зв’язуванню іонів
, тому гідролізується одночасно як по катіону, так і по аніону, причому одразу за всіма ступенями, повністю. Завдяки зв’язуванню іонів 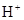 і
і 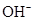 у недисоційовану сполуку H2O, а також утворенню осаду Al(OH)3 і газу CO2, гідроліз солі
у недисоційовану сполуку H2O, а також утворенню осаду Al(OH)3 і газу CO2, гідроліз солі 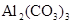 відбуваєтьсяь необоротно. Реакція середовища нейтральна,
відбуваєтьсяь необоротно. Реакція середовища нейтральна, 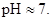
- реакцій нейтралізації, в яких утворюється вода. Реакції нейтралізації можуть відбуватися при взаємодії різних речовин, наприклад: