8.1. Електроліти і неелектроліти
За електропровідністю та особливостями передачі електричного струму речовини поділяються на провідники першого роду (метали та їх сплави), в яких електрика переноситься за рахунок переміщення електронів, і провідники другого роду, де електрика передається за допомогою іонів. Речовини, які не проводять електричний струм ні у розплавленому, ні у розчиненому стані, називаються неелектроліти.
Провідники другого роду – це електроліти. Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Електроліти при розчиненні або розплавленні утворюють іони, рух яких і зумовлює їх електропровідність.
1. Істинні електроліти – це речовини з іонною кристалічною решіткою, які розпадаються на іони при розплавленні або при розчиненні. Процес розпаду істинного електроліту на іони при розплавленні або під дією полярних молекул розчинника називається електролітична дисоціація.
2. Потенційні електроліти – це речовини з молекулярною кристалічною решіткою, які у розплавленому стані не проводять електричного струму, але утворюють іони при взаємодії їх молекул з відповідними розчинниками. Іонізація – утворення іонів із полярної молекули потенціального електроліту під дією диполів розчинника. Однак надалі для спрощення ми будемо вживати термін «дисоціація» відносно обох випадків.
8.2. Теорія електролітичної дисоціації
Теорія електролітичної дисоціації містить декілька положень.
1. Розчинення електроліту супроводжується його розкладанням на позитивно і негативно заряджені іони, які піддаються сольватації (або гідратації, якщо розчинником є вода). У загальному вигляді рівняння електролітичної дисоціації напозитивно заряджений іон Kt (катіон) і негативно заряджений іон An (аніон) записують так:
KtxAny + (xn + ym)H2O ⇔ x[Kt(H2O)n]y+ + y[An(H2O)m]x–,
але частіше користуються спрощеним рівнянням дисоціації:
KtxAny ⇔ xKty+ + yAnx–.
При цьому сумарний заряд аніонів за абсолютною величиною дорівнює сумарному заряду катіонів. Властивості іонів відрізняються від властивостей атомів, з яких вони утворилися. Сольватовані іони перебувають у стані невпорядкованого теплового руху і переміщуються у розчині за різними напрямками.
2. При пропусканні електричного струму через розчин чи розплав електроліту іони набувають напрямленого руху: позитивно заряджені катіон переміщуються до катода, а негативно заряджені аніон – до анода.
3. Електролітична іонізація є оборотним процесом, тобто одночасно з нею відбувається зворотний процес – сполучення іонів у молекули – асоціація, або рекомбінація.
4. Електрична провідність і колігативні властивості розчинів електролітів пропорційні загальній концентрації молекул та іонів.
5. Кількісними характеристиками процесу дисоціації є ступінь і константа дисоціації.
8.2.1. Ступінь дисоціації
Ступінь дисоціації α – це відношення концентрації електроліту, що розпався на іони, до його загальної концентрації у розчині: α = Сдис/Сзаг = νдис/νзаг, де Сдис і Сзаг – відповідно молярна концентрація продисоційованого електроліту і загальна концентрація [моль/л], ν – кількість речовини [моль].
Чинники, що впливають на ступінь дисоціації α.
1. Природа речовин. Залежно від здатності електроліту до дисоціації і, як наслідок, від величини ступеню дисоціації в розведених розчинах, всі електроліти поділяють на окремі групи: сильні електроліти, для яких ступінь дисоціації у розведених розчинах має достатньо високі значення (α>0,3 або α>30%); електроліти середньої сили, для яких у розведених розчинах величина ступеня дисоціації коливається у межах 0,02<α<0,3 (або 2%<α<30%); слабкі електроліти, які навіть у розведених розчинах дисоціюють частково і мають невисокі значення ступеня дисоціації (α<0,02 або α<2%).
2. Будова молекул речовин. За умов однакових концентрацій і температур α зростає майже вдвічі при збільшенні довжини і зниженні енергії зв'язку. Для молекул складної будови процес протікає ступінчасто, тому ступенів дисоціації може бути декілька. Наприклад, для сульфітної кислоти
H2SO3 ⇔ H+ + HSO3– (α1,); HSO3– ⇔ Н+ + SO32– (α2),
причому α1 >> α2.
3. Природа розчинника: чим вища його діелектрична стала e, тим більше значення α.
4. Температура: ступінь дисоціації підвищується при нагріванні.
5. Концентрації розчину: у міру розведення розчину ступінь дисоціації зростає.
8.2.2. Константа дисоціації
Електролітична дисоціація слабких електролітів є оборотним процесом, тому вона підкоряється закону діючих мас. Для загальної реакції електролітичної дисоціації слабкого електроліту Ktx Any ⇔ xKty++ yAnx– константа рівноваги матиме вигляд:
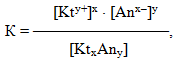
де [Kty+] і [Anx–] – молярні концентрації відповідно катіонів і аніонів, а [KtxAny] – молярна концентрація недисоційованих молекул.
Константа рівноваги К слабкого електроліту називається константа дисоціації Кдис і характеризує здатність речовини розпадатися у розчині на іони.
Чим менше значення Кдис, тим слабкішим є електроліт, і навпаки, велике значення Кдис свідчить про його високу здатність до дисоціації. Важливішою ознакою константи дисоціації є те, що вона не залежить від концентрації розчину, а залежить лише від природи розчиненої речовини і розчинника та від температури. Значення констант дисоціації наводяться у спеціальних довідниках.
Для електролітів, що дисоціюють ступінчасто, кожній стадії дисоціації відповідає своє значення константи дисоціації. Наприклад, для ортофосфатної кислоти:
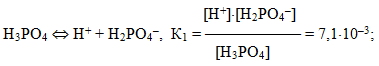
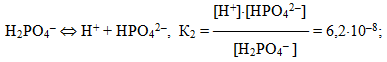
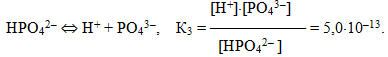
При цьому К1 > К2 > К3. Для загального процесу: Н3РО4 ⇔ 3Н+ + РО43– сумарна константа дисоціації
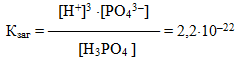
дорівнює добутку ступінчастих констант дисоціації:
Кзаг = К1· К2·К3 = 7,1· 10–3 · 6,2 · 10–8 · 5,0 · 10–13 =2,2 · 10–22.
8.2.3. Закон розведення Оствальда
Зв'язок між ступенем дисоціації, концентрацією розчину і константою електролітичної дисоціації встановлює закон розведення Оствальда: у міру розведення розчину (тобто зменшення концентрації електроліту) ступінь його електролітичної дисоціації підвищується. Математичний вираз закону розведення Оствальда має вигляд:
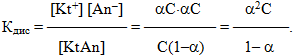
Якщо електроліт дуже слабкий, α––>0, тоді знаменник у рівнянні прирівнюється до одиниці (1– α)~1, а закон розведення Оствальда набирає вигляду: К = α2 C, звідки можна визначити ступінь дисоціації:
![]() .
.
8.2.4. Властивості кислот, основ і солей з позицій теорії електролітичної дисоціації
Кожний клас сполук має власні загальні властивості, зумовлені наявністю деякої спільної ознаки.
Кислоти - це електроліти, що при дисоціації у якості позитивно зарядженого іона утворюють виключно катіони гідрогену Н+. Кількість іонів гідрогену, що утворюються при дисоціації однієї молекули, визначає основність кислот.
Багатоосновні кислоти дисоціюють ступінчасто, наприклад, арсенатна кислота:
I ступінь: H3AsO4 ⇔ H+ + H2AsO4–,
II ступінь: Н2AsO4– ⇔ H+ + HАsO42–,
IІІ ступінь: HAsO42– ⇔ H+ + AsO43–.
З позицій теорії електролітичної дисоціації кислотою вважається не тільки нейтральна молекула кислоти, але й негативно заряджені аніони, які спроможні дисоціювати з утворенням катіона Н+.
Завдяки наявності іонів Н+, у водних розчинах усі кислоти тою чи іншою мірою виявляють спільні властивості: здатність реагувати з основами, тобто вступати у реакція нейтралізації, сутність яких виражається скороченою схемою: Н+ + ОН–→ H2O; взаємодія з металами, розташованими в електрохімічному ряді напруг до водню, внаслідок чого внаслідок реакції виділяється водень Н2; кислий смак; змінення забарвлення індикатор.
Основи – це електроліти, що при дисоціації у якості негативно заряджених іонів утворюють виключно гідроксид-аніони. Розчинні у воді основи називаються луги. Кількість гідроксильних груп, що входять до складу основи, визначає кислотність основи. Багатокислотні основи дисоціюють ступінчасто:
І ступінь: Fe(OH)3 ⇔ Fe(OH)2+ + OH–,
ІІ ступінь: Fe(OH)2+ ⇔ FeOH2+ + OH–,
ІІІ ступінь: FeOH2+ ⇔ Fe3+ + OH–.
Гідроксильні групи надають основам певних спільних властивостей: здатність взаємодіяти з кислотами (реакція нейтралізації); відчуття милкості під час дотику; змінення забарвлення індикатору.
Амфотерні гідроксиди (амфоліти) – це слабкі електроліти, здатні залежно від умов виявляти властивості кислот або основ, тобто дисоціювати з утворенням катіонів Н+ чи аніонов ОН–: хН+ + МеОхх– ⇔ Ме(ОН)х ⇔ Мех+ + хОН–.
Солі – це електроліти, при дисоціації яких утворюються катіони металів (або катіон амонію NH4+) і аніони кислотних залишків. Це визначення стосується тільки середніх солей.
Кислі солі є продуктами неповного заміщення іонів Н+ у багатоосновній кислоті на метал, при їх дисоціації утворюються, крім катіонів металу, і іони гідрогену:
І ступінь: KHSO3 → K+ + HSO3–,
ІІ ступінь: HSO3– ⇔ H+ + SO32–.
Основні солі – продукти неповного заміщення груп ОН– у багатокислотній основі на кислотний залишок; вони теж дисоціюють ступінчасто і утворюють не тільки аніони кислотних залишків, але й гідроксид-аніони:
I ступінь: СаОНCl → CаOH+ + Cl–,
ІI ступінь: СаОН+ ⇔ Cа2+ + ОН–.
8.4. Рівновага в розчинах електролітів
Обов'язковою умовою перебігу реакцій між електролітами є видалення із розчину тих чи інших іонів, тобто реакції у розчинах електролітів завжди напрямлені у бік утворення найменш дисоційованих або найменш розчинних речовин.
8.4.1. Зміщення рівноваги дисоціації слабких електролітів
Введення одноіменних іонів у розчин слабкого електроліту зменшує його ступінь дисоціації. Це явище використовується при одержанні буферні розчини, в яких зберігається постійна концентрація іонів Н+ навіть при додаванні до них невеликих кількостей сильних кислот, лугів, або при розведенні чи концентруванні.
8.4.2. Добуток розчинності
Речовини з обмеженою розчинністю схильні до утворення систем, в яких осад малорозчинної сполуки перебуває у стані рівноваги з її насиченим розчином, тому встановлюється динамічна рівновага між обома процесами:
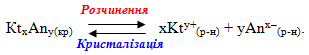
Добуток К· [Ktх· Anу] називається добутком розчинності і позначається ДР:
ДРKtxAny = [Kty+]x · [Anx–]y.
Добуток розчинності – це стала за даної температури величина, що кількісно характеризує здатність малорозчинних електролітів до розчинення і визначається добутком концентрацій іонів, піднесених до відповідних степенів.
Чим менша величина добутку розчинності ДР солі, тим гірше ця сіль розчиняється у воді. Значення добутків розчинності для різних сполук наводяться у спеціальних довідниках чи обчислюються за розчинністю речовин.
8.4.3. Електролітична дисоціація води. Водневий показник
Хімічно чиста вода є дуже слабким електролітом, однак дуже незначною мірою вона може піддаватися дисоціації (точніше – іонізації):
Н2О ⇔ Н+ + ОН–.
Завдяки малим розмірам та великій поляризувальній здатності іонів Н+, вони піддаються миттєвій гідратації з утворенням іонів гідроксонію Н3О+ за схемою:
Н+ + Н2О → H3O+ + OH–, або H2O + H2O ⇔ H3O+ + OH–.
Реакція, що відповідає рівнянню 2Н2О⇔ Н3О++ОН–, називається автопротоліз води, під час якого одна молекула води відщеплює іон Н+ (протон) і відіграє роль кислоти, а друга, яка приєднує протон з утворенням Н3О+, – роль основи.
Встановлено, що концентрації іонів гідрогену і гідроксид-іонів складають
[H+] = [OH–] = 1 · 10–7 моль/л,
а їх добуток, який називається іонний добуток води, дорівнює:
![]()
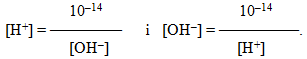
При підвищенні температури КН2О збільшується. Для води і розведених водних розчинів за умов постійної температури добуток концентрацій іонів гідрогену і гідроксид-іонів є величиною сталою.
Проте, вести розрахунки концентрацій [H+] i [OH–] через від'ємний ступінь не зовсім зручно, тому використовується інша величина – водневий показник. Водневий показник рН – це величина, що характеризує кислотність середовища і дорівнює від'ємному десятковому логарифму концентрації іонів гідрогену [H+]: рН = –lg[H+].
По аналогії з ним було введено і гідроксильний показник рОН: pОН = – lg[OH–].
Логарифмуючи рівняння [H+] · [OH–] = 10–14, одержимо: lg [H+] + lg [OH–] = –14.
Якщо перемножити усі члени в останньому рівнянні на –1, то:
![]()
![]()
Ці рівняння є логарифмічною формою іонного добутку води.
Можливі межі змінення pH і pOH показників залежно від реакції середовища у розчині.
- У нейтральному середовищі концентрації іонів гідрогену і гідроксил-іонів однакові: [H+] = [OH–] =10–7, тому водневий показник: рН = –lg[H+] = –lg10–7 = 7.
- У кислому середовищі концентрація іонів гідрогену завжди вища, ніж концентрація гідроксильних іонів: [H+] > [OH–], тому [H+] > 7, pН < 7.
- У лужному середовищі, навпаки, переважає концентрація гідроксильних іонів: [H+]<[OH–] i тому [H+]<10–7, pH > 7.
Точне значення рН розчинів можна розрахувати або експериментально визначити, однак для наближеного знаходження величини рН користуються індикатор – хімічною сполукою, яка дозволяє візуалізувати досягнення системою певного стану з відповідною величиною рН середовища, що виявляється у виникненні помітної ознаки (змінення забарвлення, випадіння осаду, поява люмінісценції тощо).
8.4.4. Реакції у розчинах електролітів
Реакції між іонами у розчинах відбуваються тільки у тому випадку, якщо внаслідок їх взаємодії утворюється осад, летка сполука або слабкий електроліт, що зумовлює зміщення рівноваги у бік прямої реакції.
Окремі випадки перебігу іонних реакцій:
1. Утворення осаду. Ця взаємодія відображається за допомогою молекулярних та іонних рівнянь реакції, причому, скорочені іонні рівняння виражають сутність хімізму реакції, наприклад:
Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3,
Ba2+ +2NO3– + 2Na+ + SO42–→ BaSO4↓ + 2Na+ + 2NO3–,
Ba2+ + SO42–→ BaSO4↓ ;
2. Утворення леткої речовини, наприклад:
Na2S + 2HCl → H2S↑ + 2NaCl,
2Na+ + S2– + 2H+ + 2Cl–→ H2S↑ + 2Na+ + 2Cl–,
2H+ + S2–→ H2S↑ .
3. Утворення малодисоційовані сполуки внаслідок перебігу таких процесів:
- реакцій нейтралізації, в яких утворюється вода:
HCl + NaOH → NaCl + H2O,
H+ + Cl– + Na+ + OH–→ Na+ + Cl– + H2O,
H+ + OH–→ H2O;
- реакції, в яких утворюється слабка кислота:
NaClО + HNO3 → NaNO3 + HClО,
Na+ + ClО– + H+ + NO3–→ Na+ + NO3– + HClО,
H+ + Cl–→ HСlO; (Кдис = 3· 10-8)
- реакції утворення слабкої основи:
NH4Cl + NaOH → NaCl + NH4OH,
NH4+ +Cl– + Na+ + OH–→ Na+ + Cl– + NH4OH,
NH4+ + OH–→ NH4OH; (Кдис = 1,76 · 10-5);
- реакції утворення комплексних іонів:
Zn(OH)2 + 2KOH → K2[Zn(OH)4],
Zn(OH)2 + 2K+ + 2OH–→ 2K+ + [Zn(OH)4]2–,
Zn(OH)2 + 2OH– → [Zn(OH)4]2–; (Кдис = 2· 10-4).
8.4.5. Гідроліз солей
Гідроліз солей – це взаємодія їх складових частин з водою, яка приводить до утворення слабкого електроліту: слабкої кислоти чи слабкої основи, кислої чи основної солі. Гідроліз являє собою реакцію обмінного розкладу солі водою, тобто процес, який є зворотним відносно реакції нейтралізації. Гідроліз – рівноважна реакція, тому можна зміщувати рівновагу у бажаний бік, створивши такі умови, за яких сіль або піддається повному гідролізу, або, навпаки, зовсім не буде гідролізуватися.
Розрізняють чотири типи солей: солі, що утворені сильною кислотою і сильною основою; солі, що утворені слабкою кислотою і сильною основою; солі, що утворені сильною кислотою і слабкою основою; солі, що утворені слабкою кислотою і слабкою основою. Солі, утворені сильною основою та сильною кислотою, гідролізу не піддаються.
Залежно від природи солі гідроліз поділяють на три типи.
І тип – гідроліз солей, утворених сильними основами і слабкими кислотами, тобто гідроліз по аніону. Наприклад, гідроліз натрій ацетату:
СН3СООNa + H2O ⇔ CH3COOH + NaOH,
СН3СОО– +Na+ + H2O ⇔ CH3COOH + Na+ + OH–,
СН3СОО– + H2O ⇔ CH3COOH + OH–.
Із скороченого іонного рівняння видно, що у розчині накопичується надлишок незв’язаних гідроксид-іонів, який забезпечує лужну реакцію середовища і рН>7.
Висновок щодо І типу гідролізу: cіль, утворена сильною основою і слабкою кислотою, гідролізується по аніону, при цьому утворюється слабка кислота (чи кисла сіль), а розчин набуває лужної реакції середовища (рН>7). Вираз константи гідролізу за І типом доводить: чим менше значення константи дисоціації кислоти (тобто чим слабкіша кислота), тим більша величина Кгідр і тим сильніше гідролізується сіль.
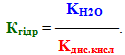
ІІ тип – гідроліз солей, утворених слабкими основами і сильними кислотами, тобто гідроліз по катіону. Наприклад:
NH4Сl + H2O ⇔ NH4OH + HCl,
NH4+ + Сl– + H2O ⇔ NH4OH + H+ + Cl–,
NH4+ + H2O ⇔ NH4OH + H+.
Надлишок іонів Н+ зумовлює кислу реакцію середовища і рН<7.
Висновок щодо ІІ типу гідролізу: сіль, утворена слабкою основою і сильною кислотою, гідролізується по катіону, при цьому утворюється слабка основа (чи основна сіль), а розчин набуває кислої реакції середовища, рН<7. Вираз константи гідролізу показує: чим слабкішою є основа (або чим менше значення Кдис.осн), тим більша константа гідролізу і тим сильніше гідролізується сіль
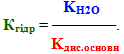
ІІІ тип – гідроліз солей, утворених слабкими кислотами і слабкими основами. Гідроліз таких солей протікає досить повно, а іноді й необоротно, оскільки внаслідок гідролізу утворюються дві малодисоційовані, леткі чи малорозчинні сполуки. Реакція середовища у розчині солей цього типу найчастіше буває нейтральною (рН=7), але може бути слабкокислою (рН≤ 7), або слабколужною (рН≥ 7). Наприклад, гідроліз ацетату амонію:
СН3СООNH4 + H2O ⇔ CH3COOH + NH4OH,
СН3СОО– + NH4+ + H2O ⇔ CH3COOH + NH4OH,
CH3COO– + NH4+ + H2O ⇔ CH3COOH + NH4OH.
Відносно III типу гідролізу солей можна зробити загальний висновок: Сіль, утворена слабкою основою та слабкою кислотою, гідролізується одночасно по катіону і по аніону, при цьому продуктами є слабка основа (або основна сіль) і слабка кислота ( або кисла сіль). Реакція середовища у розчині може бути: 1) нейтральною (рН=7), якщо основа і кислота мають близькі значення констант дисоціації (Кдис.кислоти≈Kдис.основи); 2)слабкокислою (рН≤ 7), якщо основа є слабкішим електролітом у порівнянні з кислотою (Кдис.кислоти>Kдис.основи); 3) слабколужною (рН≥ 7), якщо кислота є слабкішим електролітом, ніж основа (Кдис.кислоти<Kдис.основи). Константа гідролізу визначається константами дисоціації як слабкої кислоти, так і слабкої основи:
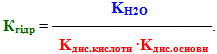
Кількісною мірою гідролізу, крім константи гідролізу, може бути й інша характеристика – ступінь гідролізу h. Ступінь гідролізу h – це відношення концентрації гідролізованої солі до її загальної концентрації: h = Cгідр / Сзаг.
Для дуже розведених розчинів солей виконується залежність, аналогічна рівнянню Оствальда, яка пов’язує ступінь гідролізу з концентрацією і константою гідролізу:
Кгідр = Сh2 i ![]()
Чинники, що впливають на ступінь гідролізу h і зміщення гідролітичної рівноваги.
- Природа солі: чим слабкіша кислота, аніон якої входить до складу солі, тим повніше відбувається гідроліз; чим слабкішою є основа, катіон якої входить до складу солі, тим більшою є величина ступеню гідролізу h.
- Концентрація солі: при розведенні розчину гідроліз солей посилюється і ступінь гідролізу h зростає, а при концентруванні – гідроліз послаблюється.
- Температура: підвищення температури зміщує гідролітичну рівновагу вправо і ступінь гідролізу зростає.
- Змінення реакції середовища шляхом додавання до розчину солі кислоти (+Н+) або лугу (+ОН–). При гідролізі по аніону підкислення розчину солі зміщує гідролітичну рівновагу вправо, посилюючи перебіг гідролізу. Для солей, які гідролізуються по катіону, справедливою є зворотна залежність: підкислення пригнічує гідроліз, а додавання лугу – посилює.
- Додавання інших солей. Якщо до розчину солі, що гідролізується, долити розчин іншої солі, гідроліз якої відбувається за тим же типом і створює таке ж середовище (кислотне чи лужне), то спостерігається взаємне пригнічування гідролізу. А при зливанні розчинів двох солей, які гідролізуються за різними типами, відбувається взаємне посилення гідролізу. Зміщування гідролітичної рівноваги вправо, у бік прямої реакції, особливо помітно у достатньо розведених розчинах – в цьому випадку відбувається сумісний необоротний гідроліз, який, як правило, не обмежується першою стадією, а відбувається до кінця, до утворенні кінцевих продуктів. Наприклад, при змішуванні розведеного розчину хром(III) сульфату, який гідролізується по катіону, і натрій сульфіду, гідроліз якого відбувається по аніону, починається сумісний необоротний гідроліз обох солей, причому і катіон, і аніон гідролізуються до кінця, тому в рівнянні реакції сумісного необоротного гідролізу ставлять стрілку (→ ), наприклад:
Cr2(SO4)3 + 3Na2S + 6H2O → 2Cr(OH)3↓ + 3H2S↑ + 3Na2SO4,
2Cr+ + 3SO42– + 6Na+ + 6H2O → 2Cr(OH)3↓ + 3H2S↑ + 6Na+ + SO42–,
2Cr3+ + 3S2– + 6H2O → 2Cr(OH)3↓ + 3H2S↑ .
Як видно з рівнянь гідролізу, іони Н+ і ОН– сполучаються у міцні недисоційовані сполуки (осад Cr(OH)3 і летка речовина H2S), тому реакція середовища нейтральна і рН=7.



