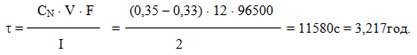- 10.1 Початкові поняття електрохімії
- 10.2 Подвійний електричний шар
- 10.3 Електродні потенціали
- 10.4 Електрохімічний ряд напруг металів
- 10.5 Хімічні джерела електричного струму
- 10.6 Електроліз
- 10.7 Напруга розкладання. Поляризація
- 10.8 Приклади розв’язання задач
Ключові терміни:
Іоногенний механізм, Адсорбційний механізм, Акумулятор, Анодні процеси при електролізі, Газова поляризація, Гальванічна комірка, Гальванічний елемент, Другий закон Фарадея, Електродний потенціал, Електроліз, Електрорушійна сила гальванічного елемента, Електрохімічна поляризація, Електрохімічний процес, Електрохімія, Зарядка акумулятора, Катодні процеси при електролізі, Коефіцієнт виходу за струмом, Концентраційна поляризація, Ліоелектричний механізм, Напруга розкладання електроліту, Паливні елементи, Перший закон Фарадея, Подвійний електричний шар (ПЕШ), Стала Фарадея, Стандартний електродний потенціал, Схема гальванічного елемента, Хімічна поляризація, Хімічне джерело електричного струму, адсорбційний шар, активні, анод, гальванічний елемент Якобі-Даніеля, деполяризатор, дифузійний шар, електрод, електрохімічна система, електрохімічний ряд напруг металів, енергія атомізації, енергія сольватації, енергія іонізації, катод, концентраційний гальванічний елемент, нерозчинні аноди, перенапруга, перший закон Фарадея, поляризація, розрядка акумулятора, розчинні аноди, рівняння Нернста, стандартний водневий електрод, інертні
10.1 Початкові поняття електрохімії
Електрохімія – це наука, що вивчає електрохімічні процеси та фізико-хімічні властивості іонних систем (розчинів, розплавів та твердих електролітів). Предметом вивчення електрохімії є електрохімічний процес і електрохімічна система.
Електрохімічний процес – це явище, яке відбувається за участю заряджених частинок на межі поділу фаз між електронним та іонним провідниками.
Електрохімічні процеси умовно поділяються на дві основні групи:
- перетворення хімічної енергії в електричну, при якому за рахунок хімічної окисно-відновної реакції виникає різниця потенціалів та виконується робота;
- перетворення електричної енергії в хімічну, при якому під дією електричного струму проходять хімічні реакції.
Сукупність всіх речовин, що беруть участь в окремому електрохімічному процесі, – це електрохімічна система.
Електрохімічна система обов’язково містить окиснену і відновлену форми, які у загальному випадку позначаються відповідно Ох і Red. Для умовного запису електрохімічної системи спочатку зазначають окиснену форму, а потім через скісну риску - відновлену (Ох/Red), наприклад: Zn2+/Zn; NO3- + 2H+/NO2- + H2O.
Оскільки електрохімічні процеси мають окисно-відновну природу, вони завжди супроводжуються просторовим переміщенням електронів. Однак, на відміну від звичайної окисно-відновної взаємодії, яка відбувається одночасно в усьому реакційному об’ємі, електрохімічні процеси проходять виключно на межі поділу двох контактуючих фаз - електронного та іонного провідників (тобто провідників відповідно першого роду і другого роду).
Електрохімічна система, що виникає при контакті електронного та іонного провідників, називається електрод.
Електрод, на якому відбувається окиснення, називається анод, а той електрод, на якому відбувається відновлення, - катод.
10.2 Подвійний електричний шар
При контакті електронопровідної та іонопровідної фаз (наприклад, система метал-розчин його солі) відбувається перехід заряджених частинок через межу поділу. Навіть при зануренні металевої пластинки у дистильовану воду йони металу під дією полярних молекул води теж можуть відриватися від поверхні й гідратованими переходити у рідину. Рушійними силами цього явища є прагнення електрохімічної системи до стану термодинамічної рівноваги і зростання ентропії при розчиненні (ΔS>0).
Перехід заряджених частинок із однієї фази в іншу супроводжується порушенням балансу зарядів у кожній фазі та спричиняє виникнення подвійного електричного шару.
Подвійний електричний шар (ПЕШ) – це тонкий шар просторово розділених електричних зарядів протилежних знаків, утворення яких на межі поділу фаз супроводжується виникненням різниці потенціалів.
Як випливає із визначення, ПЕШ утворюється на межі поділу фаз, коли тонкий приповерхневий шар кожної з них одержує заряд протилежного знаку, тому подвійний електричний шар деякою мірою подібний до обкладинок конденсатору. Він складається з двох частин (рис.10.1):
- адсорбційний шар – щільна внутрішня площина товщиною 10–10м, яка безпосередньо прилягає до поверхні металу і характеризується меншою діелектричною проникністю, ніж в об’ємі розчину. В адсорбційному шарі локалізуються жорстко орієнтовані диполі розчинника, а також ті йони з розчину, що частково десольватувалися внаслідок хімічної взаємодії з поверхнею металу;
- дифузійний шар товщиною 10–9-10–5м, в якому концентрація йонів поступово зменшується, але зберігається їх певна орієнтація відносно металу. Розподілення сольватованих йонів на поверхні металу зумовлюється протидією теплового руху і кулонівських сил – подібно до молекул газу в земній атмосфері. Ступінь дифузійності зростає з підвищенням температури та зменшенням концентрації розчину і заряду металу.
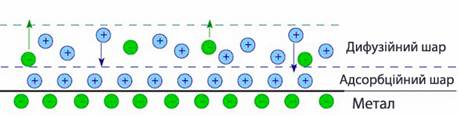
Рисунок 10.1 – Подвійний електричний шар
Механізм виникнення ПЕШ зумовлюється сукупністю багатьох окремих процесів, кожний з яких залежить від впливу певних чинників: природи металу і стану його поверхні, складу і концентрації електроліту, температури, швидкості дифузії, кількості розчиненого у рідкій фазі газу тощо. У реальних умовах подвійний електричний шар виникає одночасно за кількома паралельними схемами, але найчастіше зустрічається іоногенний механізм. Розглянемо граничні випадки, беручи до уваги дію одного-двох чинників і нехтуючи рештою.
- Іоногенний механізм виникнення подвійного електричного шару полягає у наступному. Після занурення металевої пластини у розчин електроліту починається складна взаємодія металу з компонентами розчину. Найбільш важливою є реакція поверхневих йонів і атомів металу, які містяться у вузлах кристалічної rратки, з йонами розчину та полярними молекулами води, що розміщуються біля поверхні електрода. Внаслідок цієї взаємодії може відбуватися як окиснення металу та перехід гідратованих йонів (Меz+•nH2O) у розчин, так і зворотний процес – відновлення катіонів металу Меz+ із розчину та осадження їх на пластинці у вигляді чистого металу Ме0. Коли швидкості обох процесів зрівнюються, встановлюється динамічна рівновага
[TEX]Me^0+nH_2O-z\overline{e} \Leftrightarrow Me^{z+}\cdot nH_2O[/TEX],
рівняння якої іноді записують у спрощеному вигляді
[TEX]Me^0-z\overline{e} \Leftrightarrow Me^{z+}[/TEX].
Зміщення цієї рівноваги у той чи інший бік залежить у першу чергу від природи металу та концентрації розчину. Для активних металів із сильними відновлюваними властивостями (Mg, Al, Fe, Zn) переважає окиснення поверхневих атомів металу (рис.10.2а).
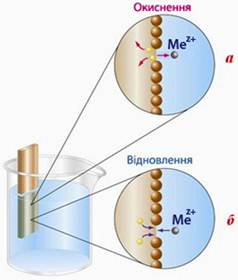
Рисунок 10.2 – Взаємодія металу з розчином:а) активний метал; б) малоактивний метал
Під впливом полярних диполів води деяка частина атомів металу, що знаходиться на поверхні, окиснюється (Ме0↔Меz++zē) та переходить у розчин у вигляді катіонів. Електрони, що при цьому вивільнюються, залишаються на пластинці, а катіони металу скупчуються у приелектродному просторі, причому, їх концентрація набагато більша, ніж у розчині. Сумарний заряд електронів на пластинці не компенсується позитивно зарядженими йонами, що містяться у вузлах кристалічної решітки, тому поверхня металу набуває негативного заряду. Катіони метала з розчину притягуються до неї, внаслідок чого приелектродна площа розчину заряджається позитивно. Разом вони складають ПЕШ, між обкладинками якого виникає стрибок потенціалу (рис.10.3a).
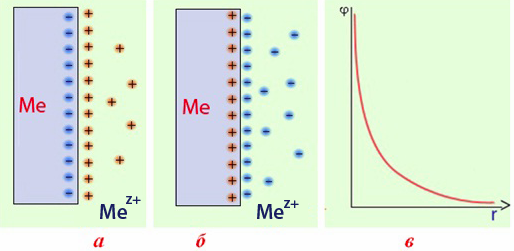
Рисунок 10.3 – Схема іоногеного механізму виникнення подвійного електричного шару в системі метал-електроліт: а) активний метал; б) малоактивний метал; в) зменшення потенціалу в міру віддалення від електрода на відстань r
Малоактивні метали (наприклад, Cu, Ag, Au, Bi, Hg) мають дуже слабкі відновлювальні властивості, а їх катіони (відповідно Cu2+, Ag+, Au3+, Bi3+, Hg2+), навпаки, виявляють помітну окиснювальну здатність. Для таких металів більш характерним є зворотний процес, тобто спостерігається не перехід йонів метала у розчин, а навпаки, частина катіонів із розчину переходить на пластинку, відновлюючись і осаджуючись на ній (рис.10.2б). Внаслідок цього пластина заряджається позитивно, а концентрація катіонів біля неї стає набагато меншою, ніж в об’ємі розчину. З цієї причини розчин біля поверхні набуває негативного заряду за рахунок надлишку аніонів. Таким чином, на межі поділу метал-розчин виникає ПЕШ (рис.10.3б). Слід зазначити, що малоактивні метали здатні «витягувати» свої йони навіть із дуже розведених розчинів, тому вони завжди заряджаються позитивно.
- Ліоелектричний механізм виникнення подвійного електричного шару частково здійснюється паралельно з іоногенним механізмом і полягає в утворенні ПЕШ за рахунок певної орієнтації адсорбованих на фазовій межі дипольних молекул розчинника, наприклад води (рис.10.4а).
- Адсорбційний механізм реалізується у тих випадках, коли інертні електроди (графіт, благородні метали) контактують з розчинами, що містять електроліти одночасно в окисненій та відновленій формах, наприклад: Fe3+/Fe2+, Cr2O72-+14H+/2Cr3++7H2O, 2H+/H2. Саме ці йони, адсорбуючись на поверхні електрода, утворюють подвійний електричний шар, а інертні електроди відіграють лише роль переносника електронів (рис.10.4б).
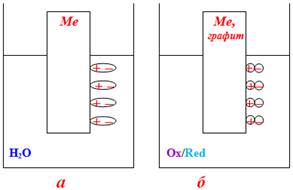
Рисунок 10.4 – Утворення подвійного електричного шару: а) за ліоелектричним механізмом; б) за адсорбційним механізмом
Подвійний електричний шар виявляє суттєвий вплив на швидкість електродних процесів, стійкість дисперсних систем, змочуваність твердих тіл, адсорбцію, коефіцієнт тертя та інші фізико-хімічні властивості міжфазних меж.
10.3 Електродні потенціали
Різниця потенціалів, що виникає у подвійному електричному шарі на межі метал-розчин електроліту, є кількісною характеристикою подвійного електричного шару і називається електродним потенціалом (позначається символами ε чи φ), який може набувати додатного або від’ємного значення.
Електродний потенціал – це певна різниця електростатичних потенціалів, що виникає між електродом і електролітом при їх контакті.
Абсолютне значення електродного потенціалу ε виміряти неможливо, оскільки введення будь-яких вимірювальних приладів неминуче призводить до появи нової контактної різниці потенціалів. Тому необхідно мати еталонний електрод, щоб відносно нього вимірювати електродні потенціали усіх електрохімічних систем. З цією метою створені електроди порівняння, за які найчастіше використовують водневий, хлорсрібний чи каломельний електроди.
Важливішим серед них є стандартний водневий електрод, що має досить просту конструкцію (рис.10.5). Він складається з посудини 3, заповненої розчином сульфатної кислоти концентрації 1моль/л, яка забезпечує активність йонів гідрогену Н+ [TEX]\alpha_{H^+}=1моль/л[/TEX]. В розчин занурена платинова пластина 1, покрита електролітично осадженою губчастою платиною для збільшення площини поверхні та кращої адсорбції водню. Через розчин H2SO4 під тиском 101325Па при 298К крізь трубку 2 пропускають ретельно очищений водень, який омиває платину і, адсорбуючись на ній, покриває всю поверхню суцільним шаром – цим і зумовлюється функціонування електрода у якості саме водневого, а не платинового. Надлишок водню виходить у верхній частині посудини через гідравлічний закрив 4. В конструкції передбачений сифон 5, завдяки якому водневий електрод сполучають з іншими вузлами при складанні гальванічного ланцюгу (рис.10.6). Платина каталізує розщеплення молекули водню на атоми (Н2↔2Н), тому на межі поділу метал-розчин між атомарним воднем, адсорбованим платиною, та йонами гідрогену Н+ у розчині встановлюється рівновага:
[TEX]2H^0-2\overline{e} \Leftrightarrow 2H^+[/TEX],
якій відповідає потенціал водневого електрода ![]() .За стандартних умов (298К, 101325Па, [TEX]\alpha_{H^+}=1моль/л[/TEX]) потенціал стандартного водневого електрода вважають таким, що дорівнює нулю,
.За стандартних умов (298К, 101325Па, [TEX]\alpha_{H^+}=1моль/л[/TEX]) потенціал стандартного водневого електрода вважають таким, що дорівнює нулю,![]() = 0.
= 0.
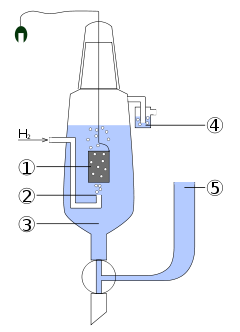
Рисунок 10.5 – Стандартний водневий електрод: 1 – платинова пластина, покрита губчастою платиною, 2 – трубка для вдування водню, 3 – розчин сульфатної кислоти, 4 – гідравлічний закрив, 5 – сифон
Для визначення електродного потенціалу будь-якої окисно-відновної системи, збирають гальванічний елемент з двох напівелементів – стандартного водневого електрода і досліджуваного електрода (рис.10.6). Як правило, вимірювання проводять за стандартних умов (Т=298К, Р=101325Па) і концентрації катіонів металу в розчині [Меz+]=1моль/л.
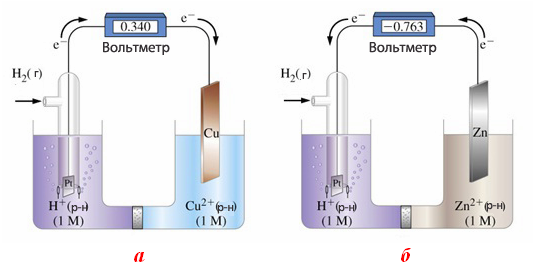
Рисунок 10.6 – Схема приладу для вимірювання електродних потенціалів металів: а) міді; б) цинку
Оскільки стандартний електродний потенціал водневого електрода дорівнює нулю, то електродний потенціал досліджуваної окисно-відновної системи (наприклад, деякого металу Меz+/Me0), дорівнює електрорушійній силі Е0 гальванічного елемента, складеного з досліджуваного напівелемента і водневого електрода порівняння:
![]()
У парі із стандартним водневим електродом метал відносно нього може заряджатися негативно чи позитивно. Залежно від цього електродному потенціалу металу приписують знак мінус або плюс відповідно.
На значення електродних потенціалів впливають різні чинники (природа металу і електроліту, температура і концентрація розчину тощо), тому для порівняльної характеристики хімічної активності металів необхідно знати їх потенціали, виміряні за однакових, стандартних умов.
Стандартний електродний потенціал ε0– це потенціал, виміряний відносно стандартного водневого електрода за стандартних умов при активності йонів металу в розчині 1моль/л.
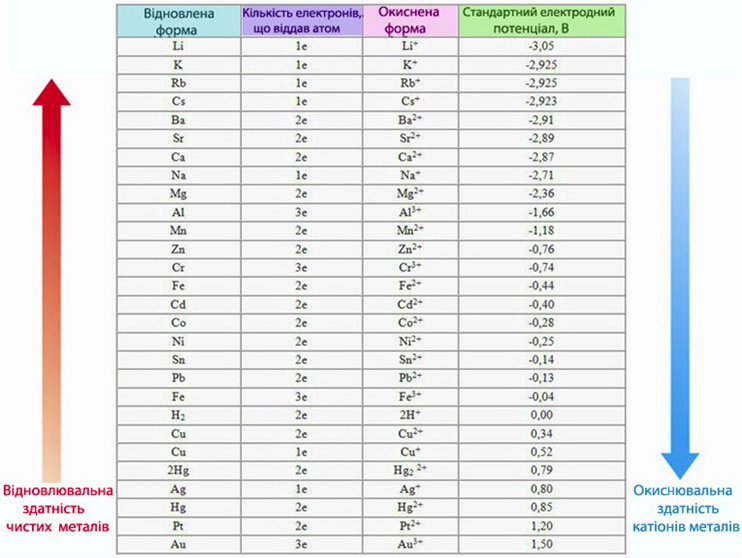
Значення стандартних електродних потенціалів для багатьох поширених металів наводять у спеціальних довідниках (табл.10.1).
Якщо електрохімічний процес перебігає у розчинах на інертних електродах за участю складних йонів та води і продуктів її дисоціації (йонів Н+ у кислому середовищі чи ОН- - у лужному), то електродний потенціал виникає переважно за адсорбційним механізмом. Для таких електрохімічних систем теж визначені стандартні електродні потенціали, наприклад:
[TEX]O_2+4H^++4\overline{e} \rightarrow 2H_2O[/TEX], ε0 = +1,228В;
[TEX]MnO_4^-+8H^++5\overline{e} \rightarrow Mn^{2+}+4H_2O[/TEX], ε0 = +1,52В.
Значення стандартних електродних потенціалів характеризують силу окисників і відновників: чим вище значення ε0, тим активнішим окисником є окиснена форма електрохімічної системи, і навпаки, чим нижче значення ε0, тим активнішим відновником є відновлена форма.
Для прикладу розглянемо електрохімічні системи Ag+/Ag (ε0=+0,80B) i Fe2+/Fe (ε0=-0,44B). Із порівняння значень стандартних електродних потенціалів випливає, що сильнішим окисником є окиснена форма срібла Ag+, а активнішим відновником - відновлена форма заліза Fe0.
Таблиця 10.1 – Стандартні електродні потенціали
На практиці електрохімічні процеси дуже рідко відбуваються за стандартних умов. А за реальних умов числове значення електродного потенціалу розраховують за рівняння Нернста
- [TEX]\varepsilon=\varepsilon^0+\frac{RT}{zF} ln\frac{[Ox]}{[Red]} [/TEX] (10.1)
- де ε0 - стандартний електродний потенціал;
- R - універсальна молярна стала, R=8,314Дж/моль•К;
- Т - температура, К; F - стала Фарадея, F=96500Кл/моль;
- z - кількість електронів, що беруть участь в елементарному акті електрохімічного процесу;
- [Ox] i [Red] - концентрація відповідно окисненої та відновленої форм.
- Для точних розрахунків замість концентрації у рівнянні Нернста необхідно брати активність, однак у розведених розчинах похибка, що вноситься змінюванням активності на концентрацію, дуже незначна, тому нею можна знехтувати.
Підстановка значень R, F i T=298K та перехід від натурального логарифма до десяткового спрощує рівняння Нернста
- [TEX]\varepsilon=\varepsilon^0+\frac{0.059}{z} lg\frac{[Ox]}{[Red]} [/TEX] (10.2)
- Для металевого електрода, зануреного у розчин власної солі, концентрація відновленої форми залишається сталою
- ([Me0] = const), тому рівняння Нернста набуває вигляду
- [TEX]\varepsilon=\varepsilon^0+\frac{RT}{zF} lg[Me^{m+}] [/TEX] (10.3)
А для водневого електрода, якому відповідає рівновага 2Н++2ē↔Н20, рівняння Нернста можна записати так:
- [TEX]\varepsilon_{2H^+/H_2}=\varepsilon^0_{2H^+/H_2}+\frac{0.059}{\varepsilon} lg\frac{[H^+]^2}{[H_2]} [/TEX] (10.4)
Зважаючи на те, що ![]() = 0, [H2] = const i -lg[H+]=рН, маємо
= 0, [H2] = const i -lg[H+]=рН, маємо
- [TEX]\varepsilon_{2H^+/H_2}=0.059 lg[H^+]=-0.059pH[/TEX] (10.5)
Рівняння (10.5) доводить, що значення водневого електродного потенціалу залежить від реакції середовища. Розглянемо граничні випадки:
- сильнокисле середовище, [H+] = 1 моль/л, рН = -lg1= 0, тоді
![]() = 0;
= 0;
- нейтральне середовище, [H+] = 10-7 моль/л, рН = -lg10-7 = 7, тоді
![]() = -0,059 • 7 = -0,413В;
= -0,059 • 7 = -0,413В;
- сильнолужне середовище, [H+] = 10-14моль/л, рН = -lg10-14 = 14, тоді
![]() = -0,059 • 14 = -0,826В.
= -0,059 • 14 = -0,826В.
10.4 Електрохімічний ряд напруг металів
Мірою електрохімічної активності металу є енергія, яку необхідно витратити для роботи по перетворенню металу із твердого кристалічного стану в стан гідратованих йонів у розчині. Ця енергія визначається сумою трьох складових:
- енергія атомізації, яка поглинається при переведенні металу із кристалічного стану в ізольовані атоми і залежить від міцності кристалічної решітки;
- енергія іонізації, що витрачається на відривання валентних електронів від вільних атомів металу і зумовлюється його положенням у періодичній системі елементів;
- енергія сольватації, яка виділяється при сольватації йонів металу і визначається електронною структурою, радіусом та зарядом йона, а також природою розчинника.
Загальна енергія перетворення металу з кристалічного стану в гідратовані йони у розчині залежить від співвідношення окремих складових. Чим менше значення має ця енергія, тим від’ємнішим є стандартний електродний потенціал (табл.10.1) і відповідно тим активнішим виявляє себе метал у електрохімічних процесах.
Послідовність розміщення металів у порядку зростання стандартних електродних потенціалів, якому відповідає зменшення електрохімічної активності металів, називається електрохімічний ряд напруг металів:

З огляду на зміст електрохімічної активності зрозуміло, чому взаємне розміщення металів у ряді напруг не завжди узгоджується з їх положенням у періодичній системі. Наприклад, справедливо було б очікувати, що згідно з розміщенням у періодичній системі калій К виявлятиме більшу хімічну активність, ніж літій Li, а мідь Cu і цинк Zn повинні мати подібні властивості. Однак в електрохімічному ряді напруг літій стоїть перед калієм, а цинк - перед міддю. Причина цього позірного протиріччя пояснюється так. Незважаючи на те, що енергія атомізації та енергія іонізації літію більші, ніж відповідні величини для калію, менший за розміром йон Li+ створює навколо себе сильніше електричне поле, тому і гідратується з виділенням більшої енергії. Внаслідок цього загальна енергія перетворення літію з кристалічного стану в гідратовані йони виявляється меншою, а стандартний електродний потенціал – від’ємнішим, ніж у калію.
Мідь і цинк не дуже відрізняються за значеннями як енергії іонізації, так і енергії гідратації. Однак завдяки міцнішій кристалічній гратці мідь потребує вищої енергії атомізації, тому і загальна енергія перетворення міді з кристалічного стану в гідратовані йони у розчині буде набагато більшою, а її стандартний електродний потенціал – додатнішим, ніж у цинку.
На відміну від періодичної системи елементів ряд напруг не дає всебічної характеристики властивостей металів, а визначає лише окисно-відновну здатність системи «метал-йон металу» за стандартних умов. Однак з аналізу електрохімічного ряду напруг металів випливає декілька важливих висновків.
- Метали, стандартні електродні потенціали яких нижчі, ніж водневий електродний потенціал у нейтральному середовищі [TEX](\varepsilon_{2H^+/H_2}=-0.059pH=-0.413B)[/TEX], термодинамічно здатні витісняти водень із води, наприклад:
[TEX]2Nа + 2Н_2О\rightarrow 2NaOH + H_2\uparrow [/TEX].
Але ті активні метали (ε0< -0,413В), що розміщуються у ряді напруг після Mg, за звичайних умов з Н2О не взаємодіють, тому що покриті нерозчинними у воді оксидними плівками.
- Метали, які розміщені у ряді напруг до Н2, витісняють водень з кислот-неокисників (HCl, H3PO4, CH3COOH, розведена H2SO4 тощо), наприклад:
[TEX]2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\uparrow .[/TEX]
Взаємодія алюмінію з хлоридною кислотою HCl при кімнатній температурі
- Для металів, що розміщуються у ряді напруг після Mg, характерна закономірність: більш активний метал витісняє менш активний із розчину його солі (рис. 10.7).
Або для загального випадку: метал, що розміщується ближче до початку ряду напруг, витісняє інший метал, що знаходиться правіше, з розчину його солі, наприклад:
[TEX]Zn + CuSO_4\rightarrow Cu\downarrow + ZnSO_4[/TEX]
А метали у ряді напруг до Mg настільки активні, що у водних розчинах солей взаємодіють не з сіллю, а з водою.

Рисунок 10.7 – Взаємодія металу з сіллю іншого металу в розчині: а) витіснення активнішою порівняно з сріблом міддю катіонів Ag+ з розчину солі AgNO3 внаслідок реакції [TEX]Cu + 2AgNO_3\rightarrow{Cu(NO_3)_2+2Ag\downarrow}[/TEX], при цьому срібло осаджується на мідній пластинці; б) при занурюванні мідної пластинки у розчин солі більш активного металу (ZnSO4) реакція не відбувається; в) витіснення активним алюмінієм катіонів Cu2+ з розчину солі внаслідок реакції [TEX]2Al + 3CuSO_4\rightarrow{Al_2(SO_4)_3+3Cu\downarrow} [/TEX], чиста мідь осідає на дні посудині
- Під час реакції у розчинах електролітів відновні властивості металів зменшуються від початку ряду напруг, а окисні властивості катіонів металів, навпаки, - від кінця ряду напруг. Так, метали Li, Na, Mg, Zn виявляють сильні відновні властивості і легко окиснюються, а катіони Pt2+, Au3+, Ag+, Cu2+ є сильними окисниками, які швидко відновлюються до вільних металів.
10.5 Хімічні джерела електричного струму
Для перетворення хімічної енергії в електричну та виникнення електричного струму необхідно, щоб виконувалися такі умови:
- просторове розділення процесів окиснення та відновлення;
- помітна різниця між значеннями електродних потенціалів відновника і окисника;
- наявність межі поділу між іонним і електронним провідниками;
- замкнений ланцюг.
Хімічне джерело електричного струму (ХДЕС) – це пристрій, в якому хімічна енергія окисно-відновної реакції безпосередньо перетворюється в електричну.
Основою будь-якого ХДЕС є гальванічна комірка.
Гальванічна комірка - це система, складена із двох сполучених між собою електродів (анода і катода), які контактують з іонопровідним матеріалом - електролітом.
Залежно від конструкційних особливостей ХДЕС поділяються на групи:
- первинні, або власно гальванічні елементи, що можуть використовуватися лише один раз, оскільки в основі їх роботи лежить необоротна окисно-відновна реакція;
- акумулятори - вторинні джерела струму, працездатність яких відновлюється багаторазово за допомогою зовнішнього джерела струму (зарядного пристрою);
- паливні елементи (або електрохімічні генератори) – пристрої, що по суті нагадують гальванічні елементи, але відрізняються від них тим, що речовини для електрохімічної реакції подаються в них ззовні, а продукти реакції видаляються, що дозволяє їм функціонувати безперервно.
Слід зазначити, що поділ хімічних джерел електричного струму на гальванічні елементи і акумулятори певною мірою є умовним, тому що деякі гальванічні елементи (наприклад, лужні батарейки) здатні піддаватися підзарядці, однак ефективність цього процесу дуже низька.
10.5.1 Гальванічні елементи
Гальванічний елемент – хімічне джерело електричного струму, названий на честь Луїджи Гальвані. Принцип дії гальванічного елемента ґрунтується на взаємодії двох металів через електроліт, яка приводить до виникнення у замкнутому ланцюгу електричного струму. Отже, гальванічний елемент містить дві пластини з різних металів, сполучених між собою дротяним провідником і занурених у розчин електроліту (рис.10.8). Така схема дозволяє просторово розділити напівреакції окиснення і відновлення, що відбуваються на поверхні поділу фаз метал-електроліт, на якій утворюється подвійний електричний шар.
Гальванічний елемент – це хімічне джерело електричного струму, що складається з однієї гальванічної комірки.

Рисунок 10.8 – Гальванічний елемент і схема утворення подвійного електричного шару на електродах
Щоб визначити, який електрод у гальванічному елементі відіграє роль анода, а який - катода, необхідно порівняти значення електродних потенціалів відповідних електрохімічних систем.
Окисно-відновна реакція самочинно перебігає у тому напрямку, при якому електрохімічна система з більшим значенням електродного потенціалу є окисником.
Отже, катодом (окисником) є електрод, виготовлений з менш активного металу, електродний потенціал якого має більш додатне значення, - саме тому катод у схемах гальванічних елементів позначається знаком плюс. І навпаки, анодом (відновником) є електрод, виготовлений з більш активного металу, у якого електродний потенціал має більш від’ємне значення, тому анод позначається знаком мінус.
Для прикладу розглянемо гальванічний елемент Якобі-Даніеля (рис.10.9), який складається з цинкової та мідної пластин, занурених у розчини відповідно ZnSO4 i CuSO4 концентрацій 1моль/л. Для запобігання перемішуванню розчини розділені напівпроникною поруватою перегородкою, через яку можуть проходити йони, але не проникають молекули розчинника (Н2О). Часто замість мембрани застосовується електролітний (сольовий) місток, через який йони можуть переміщуватися з одного електроліту в інший.
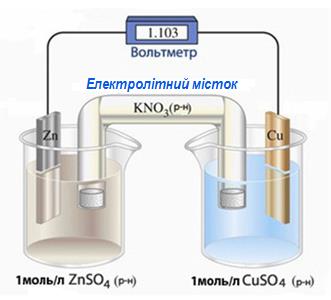
Рисунок 10.9 - Гальванічний елемент Якобі-Даніеля
Якщо ланцюг замкнути, то завдяки різниці потенціалів (![]() =-0,76В,
=-0,76В, ![]() =+0,34В) частина електронів переходить з більш активного цинку на менш активну мідь. Це спричиняє порушення подвійного електричного шару одночасно і на цинковому аноді (його потенціал підвищується), і на мідному катоді (потенціал зменшується). Однак обидві електрохімічні системи Zn2+/Zn i Cu2+/Cu знов прагнуть до стану рівноваги, який досягається за рахунок окиснення атомів цинку на аноді
=+0,34В) частина електронів переходить з більш активного цинку на менш активну мідь. Це спричиняє порушення подвійного електричного шару одночасно і на цинковому аноді (його потенціал підвищується), і на мідному катоді (потенціал зменшується). Однак обидві електрохімічні системи Zn2+/Zn i Cu2+/Cu знов прагнуть до стану рівноваги, який досягається за рахунок окиснення атомів цинку на аноді
(-)А: Zn0(тв) - 2ē →Zn2+(р-н)
і відновлення йонів купруму(ІІ) із розчину на катоді
(+)К: Cu2+(р-н) + 2ē → Cu0(тв).
Внаслідок перебігу обох напівреакцій зберігається різниця потенціалів між електродами і виникає постійний електричний струм - напрямлений рух електронів у зовнішньому ланцюгу від анода до катода.
Атоми цинку з поверхні електрода внаслідок окиснення перетворюються на йони і, гідратуючись, переходять у прианодний розчин, який повинен заряджатися позитивно. З іншого боку, катіони Cu2+, що містяться у прикатодному розчині, переміщуються до катода і відновлюються на ньому, тому за рахунок надлишкової, нескомпенсованої кількості йонів SO42- цей розчин має заряджатися негативно. Однак насправді цього не відбувається, оскільки електронейтральність розчинів забезпечується переходом йонів SO42- через сольовий місток (чи через порувату перегородку-мембрану) з прикатодного простору в прианодний, тобто у напрямку, протилежному рухові катіонів Zn2+ i Cu2+.
Схема гальванічного елемента Якобі-Даніеля зображується за допомогою умовного запису:
А(-) Zn| ZnSO4 || CuSO4 | Cu (+)K,
де однією вертикальною рискою позначається межа поділу між електродом і електролітом, а двома - між розчинами солей. За необхідності на таких схемах зазначаються концентрації розчинів електролітів, особливо якщо С(електроліту) ≠1моль/л.
Електричний струм, що проходить по зовнішньому ланцюгу гальванічного елемента, може виконувати роботу, яка набуває максимального значення при оборотному перебігу процесу. Для одного моля речовини максимальна корисна робота Аmax залежить від електрорушійної сили (ЕРС):
- [TEX]A_{max}=zFE[/TEX](10.6)
- де Е - електрорушійна сила гальванічного елемента, тобто максимальне значення напруги гальванічного елемента, яке відповідає оборотному перебігу реакції, z – кількість електронів, що беруть участь в елементарному акті окиснення-відновлення, F – стала Фарадея.
З іншого боку, за умов сталих температури і тиску максимальна корисна робота дорівнює взятій з протилежним знаком енергії Гіббса (Аmax = -ΔG), тому
- [TEX]\triangle{G}=-zFE[/TEX](10.7)
Якщо концентрації (точніше, активності) всіх речовин, що беруть участь в електрохімічному процесі, дорівнюють 1моль/л, то за стандартних умов ЕРС елемента називається стандартною електрорушійною силою. Тоді рівняння (10.7) набуває вигляду
- [TEX]\triangle{G^0}=-zFE^0[/TEX](10.8)
Зважаючи на те, що стандартна енергія Гіббса реакції пов'язана з константою рівноваги співвідношенням
- [TEX]\triangle{G^0}=-RTlnK[/TEX](10.9)
і зіставляючи рівняння (10.8) і (10.9), отримаємо зв’язок між стандартною ЕРС гальванічного елемента і константою рівноваги електрохімічного процесу:
- z F E0 = -RT lnK,
звідки можна знайти стандартну електрорушійну силу:
- [TEX]E^0=\frac{RT}{zF} ln K[/TEX](10.10)
Електрорушійна сила гальванічного елемента завжди додатна, її можна розрахувати за формулою
- [TEX]Е = \varepsilon_К - \varepsilon_А[/TEX](10.11)
- де εК і εА – електродні потенціали катода і анода відповідно.
Якщо гальванічний елемент працює у стандартних умовах (Р=105Па, Т=298К, С(електроліта)=1моль/л), то його електрорушійна сила називається стандартною ЕРС:
[TEX]Е^0 = \varepsilon^0_К - \varepsilon^0_А.[/TEX]
Величина ЕРС гальванічного елемента залежить як від матеріалу електродів, так і від природи електроліту.
З рівняння Нернста (10.1), перетвореного для розрахунків величини електродного потенціалу металу (ε0=(RT/zF)·ln[Mez+]), випливає, що потенціал металевого електрода залежить від концентрації йонів [Mez+] у розчині електроліту. Отже, і ЕРС гальванічного елемента теж залежить від концентрації. На цьому базується дія концентраційних гальванічних елементів.
Гальванічний елемент, складений з електродів одного і того самого металу, занурених у розчини солі цього металу різних концентрацій, називається концентраційний гальванічний елемент.
У концентраційному гальванічному елементі (рис.10.10) роль анода відіграє електрод, занурений у більш розведений розчин, а катода - той, що знаходиться у розчині вищої концентрації. У схемах таких елементів обов’язково зазначаються концентрації (моль/л) розчинів солей, наприклад:
[TEX]А(-) Zn| ZnSO_4(10^{-4} моль/л) || ZnSO_4 (1моль/л) | Zn (+) K.[/TEX]
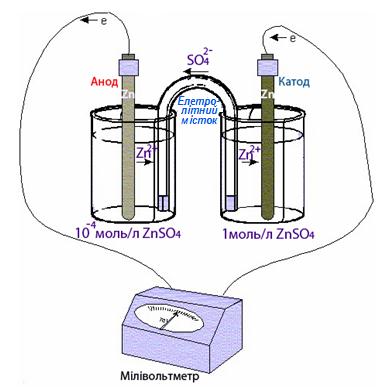
Рисунок 10.10 - Концентраційний гальванічний елемент
Виведемо формулу для обчислення ЕРС концентраційного гальванічного елемента з урахуванням рівняння Нернста (10.3):
- [TEX]E=\varepsilon_K-\varepsilon_A=(\varepsilon^0+\frac{0.059}{z} lg[Me^{m+}]_{катод})-(\varepsilon^0-\frac{0.059}{z} lg[Me^{m+}]_{анод})= \frac{0.059}{z} lg\frac{[Me^{m+}]_{катод}}{[Me^{m+}]_{анод}}[/TEX](10.12)
10.5.2 Акумулятори
Акумулятор (від лат. accumulatio – накопичення) – пристрій для накопичення енергії за рахунок оборотного хімічного процесу з метою подальшого використання.
Акумулятор - це прилад тривалого багаторазового використання, в якому під дією зовнішнього джерела струму накопичується хімічна енергія, здатна перетворюватися в електричну.
Процес перетворення хімічної енергії в електричну при роботі акумулятора називається розрядка акумулятора; при цьому акумулятор поводить себе як гальванічний елемент. Зарядка акумулятора – це накопичування хімічної енергії при пропусканні через систему зовнішнього електричного струму.
У процесі зарядки акумулятор працює як електролізер, а реагенти у ньому піддаються регенерації. Здатність до регенерації забезпечується підбором таких речовин, які в окисненій та відновленій формах фактично не розчиняються в електроліті, завдяки чому продукти регенерації осаджуються на тих електродах, на яких вони утворилися. Тому в акумуляторі продукти реакції не змішуються і цілісність електродів не порушується.
Найбільше практичне значення одержали свинцеві акумулятори, які іноді називають кислотними, оскільки в них використовується сульфатна кислота.
При роботі, тобто під час розрядки цього типу акумуляторів роль анода виконує негативно заряджений електрод із свинцевих перфорованих пластин, заповнених губчастим свинцем, а катода - позитивно заряджений електрод із PbO2. Схема гальванічного елемента, що утворюються при роботі акумулятора:
[TEX](-) Pb | H^+, SO_4^{2-} | PbO_2 (+).[/TEX]
Коли відбувається розрядка, на аноді проходить окиснення, а на катоді - відновлення:
(-)А: Pb0+ SO42- - 2ē →PbSO4, ![]() = -0,36В,
= -0,36В,
(+)K: PbО2 + 4H+ + SO42-+ 2ē →PbSO4 + 2H2O, ![]() = +1,68В.
= +1,68В.
Як видно з рівняння розрядки, і анод, і катод покриваються плівкою плюмбум(ІІ) сульфату, при цьому витрачається сульфатна кислота і одночасно утворюється вода (що приводить до зменшенню густини розчину електроліту).
Електрорушійна сила акумулятора, як і будь-якої електрохімічної системи, визначається різницею між потенціалами катода і анода:
- [TEX]E=\varepsilon_{PbO_2/PbSO_4}-\varepsilon_{PbSO_4/Pb}=E^0+\frac{RT}{2F} ln\frac{\alpha^4(H^+)\cdot \alpha^2(SO_4^{2-})}{\alpha^2(H_2O)} [/TEX] (10.13)
- де Е0 - стандартна ЕРС, що дорівнює
[TEX]E^0=\varepsilon^0_{PbO_2/PbSO_4}-\varepsilon^0_{PbSO_4/Pb}=1.68-(-0.36)=2.02B[/TEX]
Коли напруга на електродах спадає до 1,8В, акумулятор вважається розрядженим. При його зарядці полярність електродів не змінюється, але реакції перебігають у зворотному напрямку: негативний електрод, що при розрядці був анодом, тепер стає катодом, на ньому відбувається реакція відновлення. І навпаки, позитивний електрод, який був катодом, під час зарядки відіграє роль анода і окиснюється:
(-)K: PbSO4 + 2ē → Pb + SO42-,
(+)А: PbSO4 + 2H2O - 2ē →Pb2 + 4H+ + SO42-.
Сумарна реакція у свинцево-кислотному акумуляторі:
![]()
У процесі зарядки акумулятора вода «витрачається» на утворення Н2SO4, тому підвищується густина електроліту. Зростання концентрація сульфатної кислоти приводить до збільшення ЕРС, яка залежить від концентрації (точніше, активності а) згідно з рівнянням (10.13). Здавалось би, можна підвищити ЕРС свинцевого акумулятора, використовуючи більш концентровані розчини Н2SO4. Однак при збільшенні концентрації кислоти знижується її електрична провідність і одночасно покращується розчинність самого свинцю, тому оптимальними вважаються 32-39% розчини Н2SO4 (ρ = 1,24-1,30г/мл).
Під час зарядки на акумулятор подається напруга, яка перебільшує ЕРС. У міру перебігу процесу вона поступово зростає, досягаючи значень, достатніх для електролізу води, який супроводжується різким стрибком напруги (до 2,5-2,7В) і виділенням бульбашок газу (Н2 на катоді та О2 на аноді). Це і свідчить про закінчення зарядки.
У лужних акумуляторах електролітом є розчин КОН. Серед них найбільш поширеними є такі типи:
- нікель-кадмієві
- нікель-залізні
![]()
- срібно-цинкові
![]()
Акумулятори використовуються для живлення автокар, апаратури зв’язку, радіоприймачів, магнітофонів та електронних приладів. До самих поширених належать кислотні (наприклад, автомобільні) та «сухі» (для портативних комп’ютерів, сотових телефонів і т. і.) акумулятори, в яких електроліт або загерметизований, або зв’язаний твердим матеріалом, або перебуває в гелеподібному стані. Серед побутових акумуляторних елементів найчастіше зустрічаються три типи: нікель-кадмієві, нікель-металгідридні та літій-іонні. Однак останнім часом через велику токсичність кадмію нікель-кадмієві акумулятори стали менше застосовуватися.
10.5.3 Паливні елементи
Паливний елемент являє собою електрохімічний пристрій, деякою мірою подібний до гальванічного елемента, але з тією різницею, що речовини для електрохімічної реакції подаються в нього ззовні. Тому електрична енергія в паливних елементах виробляється протягом тривалого часу – на відміну від обмеженої кількості енергії в гальванічному елементі чи акумуляторі. Ще однією відмінністю від одноразових гальванічних елементів (в яких електричний струм зникає разом з припиненням електрохімічної реакції) є велика працездатність паливного елемента, яка теоретично може зберігатися як завгодно довго – до тих пір, поки в нього подаються реагенти і відводяться продукти реакції.
Паливні елементи – це гальванічні елементи, в яких електрична енергія утворюється за рахунок хімічної енергії відновника (палива) і окисника, що безперервно і окремо надходять на електроди ззовні.
Найчастіше відновником на негативному електроді буває водень або гідразин N2H4, а окисником на позитивному електроді - кисень чи повітря. Для прикладу розглянемо роботу киснево-водневого паливного елемента з лужним електролітом (рис.10.11), схема якого має вигляд
- [TEX]А(-) Н_2, Ме | KOH | Me, O_2 (+) K,[/TEX]
- де Ме - металічний провідник першого роду, який відіграє роль каталізатора електродного процесу і відводить струм.
-
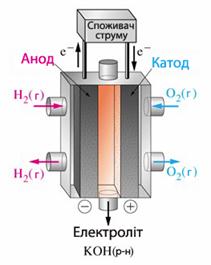
Рисунок 10.11 - Киснево-водневий паливний елемент
Звичайно застосовують дрібнопоруваті нікелеві електроди з напиленими каталізаторами (Pt i Pd – на тому, через який дифундує Н2, та Al i Co – на тому, через який дифундує О2). Електродні процеси у киснево-водневому паливному елементі протікають згідно з рівняннями:
(-) А: Н2 + 2ОН- - 2ē → 2Н2О,
(+) К: ½ О2 + Н2О + 2ē→ 2ОН-.
При складанні анодної та катодної напівреакцій одержуємо сумарне рівняння процесу, що відбувається у киснево-водневому паливному елементі:
Н2 + ½ О2 → H2O.
У зовнішньому ланцюгу електрони переміщуються, як і у будь-якому гальванічному елементі, від анода до катода, а у розчині, навпаки, переносники зарядів (гідроксильні йони ОН-) рухаються від катода до анода. Внаслідок перебігу хімічної реакції у ланцюгу генерується постійний струм, а хімічна енергія перетворюється безпосередньо в електричну. Оскільки енергія Гіббса утворення води дорівнює -237кДж/моль, можна розрахувати стандартну ЕРС киснево-водневого паливного елемента:
![]()
10.6 Електроліз
Якщо електроди, що занурені в розчин електроліту, сполучити з джерелом постійного електричного струму, то в одержаному пристрої, який називається електролізером (рис.10.12), рух йонів набуває напрямленості: катіони переміщуються до катода (негативно зарядженого електрода) і відновлюються на ньому, а аніони – до анода (позитивно зарядженого електрода) і окиснюються там.
Електроліз - це сукупність окисно-відновних процесів, які відбуваються у розчинах чи розплавах електролітів при пропусканні через них постійного електричного струму.
Електроліз, по суті, є процесом, зворотним роботі гальванічного елемента, напрямок якого змінюється під дією зовнішнього електричного струму. Як і в гальванічних елементах, під час електролізу на катоді проходить процес відновлення, а на аноді - окиснення, однак розподілення знаків заряду на електродах протилежне тому, що спостерігається у гальванічному елементі, тобто катод заряджений негативно, а анод - позитивно.
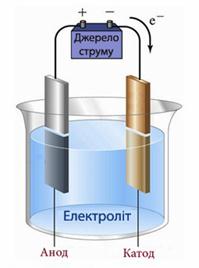
Рисунок 10.12 – Загальна схема електролізеру
Як приклад розглянемо електроліз розплаву натрій хлориду. Під дією електричного поля катіони натрію Na+ рухаються до катода і приєднують електрони із зовнішнього ланцюгу:
(-) К: Na+ + 1ē→ Na0,
а аніони хлору Cl- переміщуються до позитивно зарядженого анода і віддають надлишкові електрони:
(+) А: 2Cl- -2ē → Cl2.
Сумарне рівняння електролізу розплаву натрій хлориду можна записати так:
![]()
Зовсім інша картина спостерігається, якщо замість розплаву натрій хлориду помістити в електролізер водний розчин, що містить не тільки розчинену речовину NaCl, але й молекули Н2О. Очевидно, що наявність води в системі радикально змінює схему електролізу і зумовлює виникнення певних особливостей у перебігу електрохімічного процесу. На відміну від електролізу розплаву NaCl, продуктами якого є чистий металевий натрій і вільний хлор, при електролізі водного розчину на аноді теж утворюється Cl2, однак на катоді замість Na виділяється газ Н2, при цьому з прикатодного простору відводиться луг NaОН (з домішками непрореагувавшого NaCl).
10.6.1 Електродні процеси при електролізі водних розчинів електролітів
Під час електролізу водних розчинів електролітів на електродах поряд з йонами електролітів можуть розряджатися молекули води та йони Н+ і ОН-, що утворюються внаслідок дисоціації Н2О під дією електричного струму. Характер електролітичних процесів значною мірою залежить насамперед від співвідношення електродних потенціалів відповідних електрохімічних систем.
Серед кількох імовірних електродних процесів при електролізі відбувається той, що потребує витрати найменшої роботи і зумовлюється мінімальною енергією. Тому на катоді у першу чергу відновлюється окиснена форма системи з більшим значенням електродного потенціалу, а на аноді окиснюється відновлена форма системи з меншим електродним потенціалом.
Катодні процеси при електролізі водних розчинів електролітів підпорядковуються певним правилам розрядки.
1. За наявності у розчині катіонів металів, що стоять на початку ряду напруг і мають значення електродних потенціалів набагато менші, ніж значення водневого електрода в нейтральному середовищі при рН=7 (ε<-0,413В), на катоді виділяється тільки водень внаслідок відновлення води (із нейтральних або лужних розчинів):
2Н2О + 2ē→ Н2 + 2ОН-, ε0 = - 0,826В
або йонів гідрогену (із кислого середовища):
2Н+ + 2ē → Н2, ε0 = -0,413В.
2. Якщо катіон електроліту має більш додатний електродний потенціал, ніж -0,413В (приблизно від Sn до Au в електрохімічному ряді напруг металів), то на катоді розряджаються тільки катіони металу:
(-)К: Меm+ + mē → Me0, ε0 >> -0,413В.
- Якщо потенціал металу близький до величини -0,413В (метали середньої частини ряду напруг, від Al, Тi до ~Ni), то на катоді можуть одночасно відновлюватися і молекули води, і катіони металу:
![]()
Пріоритетний напрямок процесу в цьому випадку залежить від умов проведення електролізу: густини струму (відношення сили струму до робочої поверхні електрода), температури, складу розчину, концентрації електроліту, реакції середовища тощо. Так, у кислих розчинах найчастіше відбувається виділення водню, а у нейтральних і лужних розчинах – переважно відновлення катіонів металів з розчину.
За наявності в електроліті кількох видів катіонів у першу чергу відновлюються ті, що мають більш додатне значення електродного потенціалу.
Анодні процеси при електролізі водних розчинів електролітів визначаються у першу чергу матеріалом анода і природою аніона.
- Залежно від хімічного складу матеріалу аноди поділяють на дві групи:
-
інертні, нерозчинні аноди (графіт, Au, Pt, Ir, Ta), які не піддаються окисненню під час електролізу. Інертні аноди не беруть участі в електрохімічних процесах завдяки хімічній стійкості щодо розчину електроліту та продуктів електролізу, тому їх найчастіше використовують для електролізу солей тих металів, що розміщуються від початку ряду напруг до Аl включно;
- активні, розчинні аноди, що окиснюються у ході електролізу. У випадку розчинних анодів спостерігається розчинення металу, з якого виготовлений анод, якщо його стандартний електродний потенціал менший, ніж стандартний електродний потенціал кисневого електроду (+1,229 В), наприклад: Cu, Ag, Ni, Sn, Zn. При електролізі з розчинним анодом матеріал аноду розчиняється внаслідок окиснення
Ме0(тв) - mē → Mem+(р-н), ε0 < 1,229 B
і переходить у розчин у вигляді катіонів, які переміщуються до катода, а потім відновлюються та осідають на ньому. Для запобігання забрудненню електроліту сторонніми йонами при електролізі з розчинним анодом використовують розчин з одноіменним катіоном, наприклад, для срібного анода застосовують розчин AgNO3.
- Залежно від природи аніона на інертних електродах при електролізі можуть протікати різні процеси:
- Якщо у розчині присутні аніони безоксигенових кислот (S2-, Cl-, Br-, I-, за винятком F-), то відбувається їх окиснення:
Ann- - nē → An0.
- За наявності в електроліті оксигеновмісних аніонів (SO42-, PO43-, NO3-, OH- та ін.) та йонів фтору F- у кислому та нейтральному середовищах розряджаються молекули води:
2Н2О - 4ē → O20 + 4H+, ε0 = +1,229 B,
а у лужному середовищі - гідроксильні йони:
4ОН- - 4ē → О20 + 2Н2О, ε0 = -0,413 B.
Якщо розчин чи розплав електроліту містить декілька видів аніонів, то у першу чергу окиснюються ті, що мають менше значення електродного потенціалу.
У випадку розчинних анодів відбувається розчинення металу, з якого виготовлений анод, якщо його стандартний електродний потенціал менше, ніж стандартний електродний потенціал кисневого електрода (+1,229В).
10.6.2 Закони електролізу
Електрохімічні процеси, що відбуваються під час електролізу, кількісно описуються законами Фарадея (1833 р.).
Маса речовини m, яка піддається електрохімічному перетворенню на електроді, пропорційна кількості електрики q, що проходить через електроліт, і не залежить від інших чинників:
- [TEX]m = A_e\cdot q[/TEX] (10.14)
- де Ае - електрохімічна еквівалентна маса, яка визначається масою речовини, виділеною на електроді при проходженні через нього 1Кл електрики:
- [TEX]A_e=\frac{m}{q}[/TEX](10.15)
Однак електрохімічну еквівалентну масу зручніше розглядати як відношення еквівалентної маси mекв до сталої Фарадея F:
- [TEX]A_e=\frac{m_{екв}}{F} =\frac{M}{zF}[/TEX] (10.16)
Стала Фарадея має такий фізичний зміст: F характеризує заряд одного еквівалента речовини, яка піддається електрохімічному перетворенню. Це стає зрозумілим виходячи з того, що один моль еквівалентів речовини несе 6,022·1023 елементарних зарядів (стала Авогадро), а елементарний заряд дорівнює 1,6022×10-19 Кл. Звідси стала Фарадея:
[TEX]F = N_A\cdot{e} = 6,022\cdot{10^{23}}\cdot{1,6022}\cdot{10^{-19}}= 96485 Кл/моль\approx{96500 Кл/моль.}[/TEX]
Кількість електрики q (Кл) дорівнює добутку сили струму І (А) на тривалість електролізу τ (с), тому перший закон Фарадея можна записати у вигляді
- [TEX]m = A_e\cdot I\cdot \tau[/TEX] (10.17)
або з урахуванням (10.16):
- [TEX]m=\frac{m_{екв}\cdot I\cdot \tau}{F}[/TEX] (10.18)
Якщо речовина виділяється на електроді у газоподібному стані, то її об’єм обчислюють за рівнянням
- [TEX]V_{газу}=\frac{V_{екв}\cdot I\cdot \tau}{F}[/TEX] (10.19)
Для практичних розрахунків рівняння (10.18) уточнюють, використовуючи коефіцієнт виходу за струмом [TEX]\omega[/TEX]
- [TEX]m_{факт}=\frac{\omega m_{екв}\cdot I\cdot \tau}{F}[/TEX] (10.20)
- [TEX]V_{газу факт}=\frac{\omega V_{екв}\cdot I\cdot \tau}{F}[/TEX] (10.20a)
Коефіцієнт виходу за струмом ω показує відношення маси речовини, що фактично виділилась mфакт, до теоретично можливої mтеор:
- [TEX]\omega=\frac{m_{факт}}{m_{теор}}[/TEX] (10.21)
Маси речовин, що виділяються на електродах під дією однакової кількості електрики, пропорційні еквівалентним масам цих речовин:
- [TEX]\frac{m_1}{m_2}=\frac{m_{екв.1}}{m_{екв.2}}[/TEX], якщо q1 = q2. (10.22)
Із другого закону Фарадея випливає, що у послідовно підключених електролізерах (І=const, τ=const) маси речовин, що утворюються на електродах, прямо пропорційні їх хімічним еквівалентам:
- [TEX]\frac{m_1}{m_2}=\frac{E_1}{E_2}[/TEX] (10.23)
Отже, при електролізі на катоді та на аноді електрохімічному перетворенню піддаються однакові кількості еквівалентів за умови однакової кількості електрики:
- [TEX]n_{екв.1}=n_{екв.2}[/TEX], якщо q1 = q2. (10.24)
10.6.3 Застосування електролізу
Електроліз є основою багатьох виробничих процесів, широко розповсюджених майже в усіх галузях сучасної промисловості. Розглянемо найважливіші з них.
1. Добування хімічно чистих речовин. Електролізом розчинів солей одержують метали Cu, Zn, Cd, Ni та ін. При цьому на катоді відбувається відновлення катіонів металів із розчинів, отриманих при фізичній та хімічній переробці природничих руд згідно із загальною схемою:
(-) К: Меz+ + zē → Me0.
На аноді, як правило, виділяється кисень (якщо сировиною є сульфатні руди) або – рідше – хлор, якщо електролізу піддають хлориди металів:
(+) A: 2H2O - 4ē → O2 + 4H+.
(+)А: 2Cl‾ - 2ē → Cl2.
Електролізом розплавів сполук одержують Al, Mg, Na, Li, Ca, Be, а також тугоплавкі метали ( W, Mo, Ta, Ti, Zr, V, Nb) та сплави.
До найбільш багатотоннажних електролітичних виробництв належить електроліз водного розчину NaCl (рис.10.13), при якому одержують Н2 на катоді, Сl2 на аноді та розчин NaOH в електролізері за схемою:
![]()
(-)К: 2Н2О + 2ē → Н2 + 2ОН-,
(+)А: 2Cl‾- 2ē → Cl2.
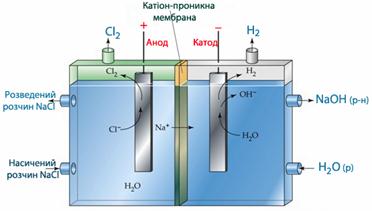
Рисунок 10.13 – Схема електролізу водного розчину натрій хлориду NaCl
Крім цих речовин, методом електролізу виробляють F2 із розплаву NaF, H2 i O2 із води (за наявності NaOH), MnO2 із розчину MnSO4, а також велику кількість окисників (KMnO4, K2CrO4, H2O2, KClO) і деякі органічні сполуки, наприклад, анілін із нітробензену.
2. Рафінування (очищення) металів застосовується для одержання високочистих Cu, Ni, Au, Ag, Pb, Sn, Fe. З цією метою пластину із забрудненого металу підключають анодно до джерела постійного електричного струму і поміщають в електролізер, який містить розчин солі цього металу та деякі технологічно необхідні компоненти. За катод використовують тонкий стрижень із попередньо обчищеного металу. Під час пропускання електричного струму відбувається розчинення анода. Метал окиснюється і переходить у розчин у вигляді катіонів, які переміщуються до катода і розряджаються на ньому, утворюючи компактний осад чистого металу. Домішки, що містились у забрудненому металі, частково випадають зі стрижня у вигляді шламу (якщо їх потенціал має більш додатне значення порівняно з основним металом), а частково розчиняються (якщо їх потенціал має більш від’ємне значення, ніж основний метал) і переходять у електроліт, звідки їх періодично вилучають спеціальними методами.
Найчастіше електролітичному рафінуванню піддають мідь. Спочатку її одержують хімічним шляхом при обпалюванні купрум(I) сульфіду Сu2S:
Cu2S + O2 → 2Cu + SO2.
Така мідь називається губчастою, її чистота не перебільшує 99% і містить домішки Fe, Zn, Au, Ag. Деяки домішки помітно знижують електропровідність металевої міді. Тому губчасту мідь поміщають в електролізер і сполучають анодно з джерелом постійного електричного струму (рис.10.14а), а тонкі листи попередньо очищеної міді відіграють роль катода. Електролітом є водний розчин, що містить суміш H2SO4 і CuSO4. При пропусканні електричного струму мідний анод розчиняється, а чиста мідь осаджується на катоді:
(+)А: Cu0(тв) – 2ē → Cu2+(р-н),
(-)К: Cu2+(р-н) + 2ē → Cu0(тв).
Деякі домішки (Zn і Fe), що окиснюються легше, ніж Cu, разом з міддю розчиняються на аноді (рис.10.14б). Оскільки вони відновлюються важче, ніж Cu, то регулюючи напруження струму в ланцюгу можна уникнути їх осадженню на катоді. Інші домішки (Ag і Au), що окиснюються важче, ніж Cu, не розчиняються, але у міру розчинення анода вони скупчуються на дні електролізеру у вигляді анодного мулу, який періодично вилучають звідти. Анодний мул є джерелом добування золота і срібла. Електролітична мідь містить до 99,95% Cu.
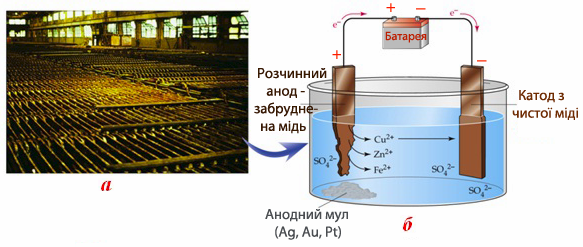
Рисунок 10.14 – Електролітичне рафінування міді: а) виробничий процес рафінування; б) схема процесу
Електролітичне рафінування дозволяє одержувати метали з дуже низьким вмістом домішок (0,02-0,005%). При утилізації анодного шламу добувають Au, Ag, Se, Te, а з рідкого електроліту - Ni, Fe, Zn та інші активні метали. Це значною мірою виправдовує великі витрати електроенергії на процес рафінування.
3. Гальваностегія - це електролітичний процес покриття одного металу іншим, більш стійким у механічному і хімічному відношенні. Гальванічними називають одержані за допомогою електролізу металеві покриття товщиною 1-100мкм на поверхні певного виробу чи деталі. Для цього придатні усі метали, які відповідно до правил розрядки здатні виділятися на катоді.
Покриття наносять при електролізі (рис.10.15) розчинів солей з використанням розчинного анода (нікелювання, кадміювання, цинкування, лудження оловом, сріблення) чи з використанням інертного анода (золочення, хромування). До золочення чи сріблення звичайно звертаються для покращення зовнішнього вигляду металевих виробів, а до нанесення металів, що виявляють стійкість до дії окисників (хром, нікель) – при необхідності зберігання металу від окиснення і надання йому додаткової міцності. Виріб, на який наноситься гальванічне покриття, завжди є катодом. Його попередньо очищують, полірують, знежирюють і занурюють в електролізер у якості катода. Електролітом беруть розчин солі того металу, яким здійснюється покриття, а анодом – пластину з того ж металу. Для досягнення більш рівномірної покривної плівки виріб поміщають між двома анодними пластинами.
Гальванічні покриття мають різні призначення: захист від корозії (покриття із Zn, Cd, Sn); захисно-декоративні функції (Ni, Cr, Au, Ag); підвищення електричної провідності (Сu, Ag, Au); збільшення стійкості до зношення (Cr, Rh, Pd); одержання магнітних плівок (сплави Ni-Co, Ni-Fe); покращення відбивальних властивостей поверхні (Ag, Rh, Pd, Cr); зменшення коефіцієнта тертя (Pb, Cr, Sr, Ir); покращення здатності до паяння (Sn, Pb).
4 Гальванопластика - це процес одержання точних металевих копій з рельєфних поверхонь методом катодного електроосаджування. За допомогою гальванопластики виготовляють копії монет, медалей, барельєфів, матриць для пресування різних виробів (грампластинок, ювелірних прикрас, скульптур, гравюр) і тиснення шкіри та паперу, а також відбитки радіотехнічних схем, друкарські кліше та інші предмети складної конфігурації.
Спосіб відрізняється виключно високою точністю відтворювання рельєфу виробу. Для одержання копій спочатку роблять зліпки деталі з пластичного матеріалу (наприклад, з воску), покривають зліпок графітовим пилом для надання йому електропровідності, а потім занурюють в електролізер у якості катода і нарощують на ньому шар металу необхідної товщини. Наприкінці при нагріванні зліпку розтоплюють віск. Як видно, гальванопластика принципово не відрізняється від гальваностегії (рис.10.15).

Рисунок 10.15 – Спрощена схема: а) гальваностегії; б) гальванопластики
5. Електрохімічна анодна обробка металів - електролітичний метод формування виробів складної конфігурації із твердих та тугоплавких металів, які важко піддаються механічній обробці. Метод використовується для оброблення лопатей турбін, штампів, прес-форм, одержання отворів і порожнин, для фрезування, гостріння та шліфування деталей, заточування інструментів.
При електрохімічній обробці та ділянка деталі, що підлягає видаленню, відіграє роль анода і розчиняється при проходженні електричного струму (рис.10.16). До негативного полюса джерела струму підключають катод, на якому виділяється водень. Між електродами зберігається невеликий зазор, для чого у міру розчинення анода катод автоматично переміщується. Мала відстань між електродами (до 0,1мм) і використання електроліту з великою електричною провідністю (розчини NaCl, NaNO3, NaOH) забезпечують високу швидкість процесу завдяки великій густині струму.
У зазор між електродами через порожнину всередині катода під тиском (106Па) подається електроліт, який проходить по міжелектродному простору і примусово виносить звідти продукти анодного розчинення і газоподібні продукти катодної реакції. Надзвичайно швидкий рух електроліту дозволяє знизити поляризацію та запобігти пасивації та перегріванню анода. Розмір і форма катода (інструмента) зумовлюють одержання виробу бажаної конфігурації.
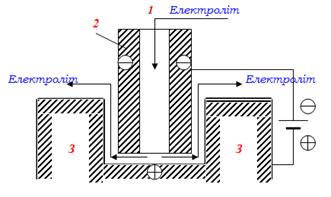
Рисунок 10.16 - Схема електрохімічної обробки металів: 1 - розчин електроліту; 2 - катод (інструмент); 3 - анод (виріб)
6. Анодне оксидування (анодування) найчастіше застосовується для обробки Mg, Al, Ti та сплавів на їх основі. У цьому методі деталь відіграє роль анода, а роль катода - свинець чи будь-який метал, що не взаємодіє з електролітом. За електроліт використовують розчин сульфатної, ортофосфатної, хроматної, борної або щавлевої кислот. При анодуванні на катоді виділяється Н2, а на аноді спостерігається складний процес. На прикладі алюмінію цей процес можна виразити сумарним рівнянням
2 Al + 3H2O - 6ē → Al2O3 + 6H+.
Поряд з утворенням оксиду відбувається його часткове розчинення у кислоті:
Al2O3 + 6H+ → 2Al3+ + 3H2O.
Внаслідок цього плівка набуває поруватості, йони алюмінію проникають через пори і процес нарощування плівки продовжується. Оксидна плівка має дуже цінні якості. Вона тверда, а завдяки малим розмірам пор легко просочується різними речовинами, які можуть підвищувати корозійну стійкість поверхні, стійкість до зношування або електричний опір (до 1014Ом×см).
7. Хемотроніка - використання електрохімічних процесів для хімічного перетворення інформації. Точність відтворення електрохімічних законів, зручність вимірювання та перетворення електричних величин дозволяє застосовувати електрохімічні явища для побудови спеціальних приладів - хемотронів. Їх робота базується на виникненні поляризації і змінюванні маси (об’єму) речовини при пропусканні електричного струму через систему електроліт-метал, а також на електрокінетичних явищах, зумовлених змінюванням поверхневого натягу на межі метал-електроліт залежно від величини потенціалу.
Простіший хемотроний прилад (електрохімічна комірка) уявляє собою мініатюрну скляну чи пластмасову ампулу, заповнену розчином електроліту (рис.10.17). Як електроліт застосовують водні розчини кислот, солей і основ, до яких додають різні модифікатори (наприклад, органічні розчинники – для розширення діапазону робочих температур до –60°С). Перспективним є використання твердих електролітів з аномально високою іонною провідністю. Електроди виготовлюють з Pt, Ag, Al, Zn чи їх сплавів; часто використовують ртутні електроди (Hg).

Рисунок 10.17 - Зовнішній вигляд одного з типів хемотронів
Хемотрони використовують як датчики механічних, акустичних і сейсмічних коливань, оптичних модуляторів, посилювачів, випрямлячів, реле часу, генераторів струму і напруги, запам’ятовуючих та інтегруючих елементів інформаційно-обчислювальних комплексів.
10.7 Напруга розкладання. Поляризація
Для практичного здійснення електролізу з конкретним електролітом необхідна певна мінімальна порогова напруга, значення якої тим вище, чим важче розряджаються на електродах аніони і катіони.
Напруга розкладання електроліту Uрозкл - це найменша різниця між електродними потенціалами анода і катода, при якій починається перебіг електролізу:
- [TEX]U_{розкл} = \varepsilon_А - \varepsilon_К[/TEX] (10.25)
Напруга розкладання за стандартних умов називається стандартною напругою розкладання:
- [TEX]U^0_{розкл} = \varepsilon^0_А - \varepsilon^0_К[/TEX] (10.26)
Фактична напруга розкладання завжди має більші значення, ніж розрахована Uрозкл. Це пояснюється так: рівноважні електродні потенціали характеризують стрибок потенціалу на межі поділу фаз метал-розчин електроліту за умов відсутності електричного струму. А за наявності електричного струму відбуваються різні додаткові процеси, які спричиняють змінення електродних потенціалів.
Відхилення фактичного електродного потенціалу εі від рівноважного ε, яке виникає внаслідок перебігу електрохімічних процесів під дією зовнішнього електричного струму, називається поляризація η:
- [TEX]\eta= \varepsilon_і - \varepsilon[/TEX] (10.27)
Поляризація спостерігається як на аноді, так і на катоді.
Анодна поляризація ηА зміщує потенціал анода у бік більш додатних значень, а катодна поляризація ηК зміщує потенціал катода у бік більш від’ємних значень.
Слід зазначити, що явище поляризації виникає не тільки при електролізі, але і під час будь-яких електрохімічних процесів, у тому числі при роботі гальванічного елемента і у випадку електрохімічної корозії.
З урахуванням поляризації напруга розкладання електроліту, при якій реально починається виділення кінцевих продуктів електролізу, буде більшою, ніж теоретично обчислена:
- [TEX]U_{розкл} = (\varepsilon_А + \eta_А) - (\varepsilon_К - \eta_К)[/TEX] (10.28)
На поляризацію впливають певні чинники: густина струму, природа і стан поверхні електрода, склад і концентрація електроліту, температура, швидкість перемішування тощо.
Залежно від того, вплив якого чинника відіграє найбільш помітну роль, розрізняють декілька видів поляризації:
1. Концентраційна поляризація зумовлюється різницею між концентрацією електроліту в об’ємі розчину і концентрацією безпосередньо поруч із електродом. Змінення приелектродної концентрації відбувається внаслідок протікання електрохімічних процесів та сповільнення дифузії, яка спричиняє зменшенню швидкості підведення реагуючих речовин до електрода і відведення від нього продуктів реакції. Концентраційна поляризація підвищується, якщо зростає густина струму, сповільнюється дифузія, зменшується концентрація реагенту або збільшується розмір дифузійного шару - тонкого шару біля поверхні електрода, де перемішування не відбувається (конвекція відсутня), а молекули переміщуються лише завдяки дифузії. Концентраційна поляризація при електролізі - шкідливе явище, яке призводить до непродуктивної витрати електроенергії. Певною мірою її можна знизити, перемішуючи електроліт і підвищуючи температуру, але повністю усунути її не вдається.
2. Хімічна поляризація виникає при зміненні поверхневого складу електрода внаслідок його реакції з середовищем чи з електролітом при проходженні електричного струму.
3. Газова поляризація спостерігається у тих випадках, коли внаслідок електрохімічних процесів виділяються газоподібні продукти.
При цьому утворення газу протікає у декілька стадій: розрядка йонів, сорбція на електроді, рекомбінація атомів у молекули, десорбція молекул, зародження газової кульки, її розвиток і відривання від поверхні електрода.
У результаті цих процесів поверхня електрода покривається шаром адсорбованого газу, що сприяє зміненню електродного потенціалу. При високій густині струму кількість газу, що виділяється, може бути настільки значною, що електрод повністю ізолюється і процес припиняється.
Газову поляризацію зменшують за допомогою деполяризатор - речовини, що реагує з атомарними газами, утворюючи рідку речовину. Наприклад, катодними деполяризаторами для атомарного водню можуть бути сильні окисники (КМnO4, K2Cr2O7, MnO2), які окиснюють Н0 до води, а анодними деполяризаторами для атомарного кисню - сильні відновники (Na2SO3, Na3PO3), які зв’язують атоми О у момент їх розрядки.
4. Електрохімічна поляризація, яку частіше називають перенапруга, зумовлюється сповільненістю власно електрохімічних стадій електродного процесу - окиснення та відновлення. Тобто перенапруга пов’язана лише з повільною кінетикою електрохімічних реакцій і залежить від густини струму.
Перенапруга виділення більшості металів на катоді, як правило, невелика. При мінімальній густині струму вона коливається у межах 10-3-10-1В, а деякі метали (Au, Hg, Sn, Pb) виділяються із водних розчинів їх солей майже зовсім без перенапруги.
Найбільш високих значень перенапруга досягає під час виділення водню і кисню. Водень на катоді виділяється при потенціалі, суттєво більш від’ємному, ніж рівноважний потенціал, який відповідає рН даного розчину. Перенапруга виділення водню залежить від природи катода і стану його поверхні. Найменшою є перенапруга виділення водню на золоті та гладкій платині, а на губчастій платині вона взагалі відсутня. Далі за збільшенням величини перенапруги виділення водню метали можна розташувати у ряд:
Ag, Ni, Fe, Cu, Cd, Pb, Zn, Hg.
Перенапруга виділення кисню на аноді за однією із схем
рН>7: 4ОH- - 4ē→ O2 + 2H2O, ε0 = +0,401B,
[TEX]p\leq 7[/TEX]: 2H2O - 4ē → O2 + 4H+, ε0= +1,23B
виявляється у зміщенні його потенціалу від рівноважного потенціалу кисневого електроду в бік додатних значень при відповідному рН. При цьому потенціал анодного виділення кисню набуває настільки великих значень, що задовго до їх досягнення більшість металевих анодів стають нестійкими і розчиняються.
Воднева і киснева перенапруги відіграють двоїсту роль в електрохімічних процесах. Їх негативна дія пов’язана з додатковою витратою електроенергії при промисловому одержанні Н2 і О2 електролітичним способом. Однак у деяких випадках перенапруга виявляється корисною, оскільки дозволяє проводити такі електрохімічні процеси, які без перенапруги неможливі. Наприклад, завдяки явищу перенапруги виділення водню вдається осаджувати із водних розчинів не тільки Pb, Sn, Ni, але і Fe, Cr, Zn. Здатність аніонів до розрядки теж значною мірою залежить від перенапруги. Так, завдяки великій перенапрузі виділення кисню при електролізі розчинів, що містять йони хлору чи брому, на платиновому аноді виділяється відповідно
Cl2 (![]() = +1,36B) i Br2 (
= +1,36B) i Br2 (![]() = +1,06В), а не О2, хоч у нейтральному і лужному середовищах рівноважний потенціал кисневого електрода нижчий, ніж у хлору і брому.
= +1,06В), а не О2, хоч у нейтральному і лужному середовищах рівноважний потенціал кисневого електрода нижчий, ніж у хлору і брому.
10.8 Приклади розв’язання задач
Приклад 10.1. Які процеси будуть спостерігатися, якщо шматочок металевого натрію помістити у розчин мідного купоросу CuSO4?
Розв’язок. Як випливає з електрохімічного ряду напруг металів, натрій є набагато активнішим від міді, однак при його контакті з розчином мідного купоросу Na взаємодіє не з CuSO4, а з водою. Отже, буде спостерігатися виділення водню:
[TEX]2Na + 2H_2O\rightarrow 2NaOH + H_2\uparrow[/TEX]
Приклад 10.2. Як зміниться маса цинкової пластини при зануренні її у розчини таких солей:
а) AgNO3; б)Ni(NO3)2; в)Al(NO3)3?
Розв’язок. Необхідно зауважити, що у випадку взаємодії Zn з сіллю пластина почне розчинятися, але одночасно на ній буде осаджуватися відновлений метал із розчиненої солі, тому змінення маси цинкової пластини залежить від співвідношення еквівалентних мас цинку і металу. Позначимо вихідну масу цинкової пластини через m.
а) Згідно з положенням у електрохімічному ряді напруг більш активний цинк витісняє малоактивне срібло із розчину його солі:
[TEX]Zn + 2AgNO_3\rightarrow 2Ag\downarrow + Zn(NO_3)_2.[/TEX]
З рівняння реакції випливає, що кількість речовини (ν) срібла вдвічі більша, ніж кількість речовини цинку. Нехай ν(Zn) = x, тоді ν(Ag) = 2ν(Zn) = 2x, а їх маси
m(Zn) = ν•M = 65x, m(Ag) = ν•M = 108•2x = 216x.
Кінцева маса пластини mкін визначається різницею між масою цинку, що розчинився, і масою осадженого на пластині срібла:
mкін = m - m(Zn) + m(Ag) = m - 65x + 216x = m + 151x.
Отже, маса пластини зростає на величину 151х, де х – кількість речовини цинку, що розчинився.
б) У електрохімічному ряді напруг цинк розміщується до нікелю, тому при зануренні цинкової пластини у розчин нікелевої солі протікає реакція [TEX]Zn + Ni(NO_3)_2 \rightarrow Ni\downarrow + Zn(NO_3)_2.[/TEX]
Нехай ν(Zn) = x, тоді ν(Ni) = ν(Zn) = x, m(Zn) = ν•M = 65x, m(Ni) = ν•M = 59x.
Кінцева маса пластини mкін = m - m(Zn) + m(Ni) = m - 65x + 59x = m - 6x.
У цьому випадку маса пластини зменшується.
в) Оскільки цинк у електрохімічному ряді напруг металів стоїть до алюмінію, він не може витісняти алюміній з розчину його солей, тому Zn не реагує з Al(NO3)3 і маса пластини не змінюється.
Приклад 10.3. Скласти схеми гальванічних елементів, в одному з яких нікель є анодом, а у другому - катодом. Написати для кожного з цих елементів електронні рівняння електродних процесів, загальне рівняння хімічної реакції, що проходить при роботі обраного гальванічного елемента. Обчислити стандартну ЕРС.
Розв’язок. У гальванічному елементі з нікелевим анодом за катод може бути метал з більшим значенням стандартного електродного потенціалу (табл.10.1), наприклад мідь:
![]() = -0,25В,
= -0,25В, ![]() = +0,34В.
= +0,34В.
Електролітами можна взяти розчинні солі NiSO4 i CuSO4 концентрації 1моль/л, оскільки мова йде про стандартну ЕРС. Схема гальванічного елемента:
(-) Ni| NiSO4 || CuSO4 | Cu (+).
Електронні рівняння електродних процесів і загальне рівняння хімічної реакції, що проходить при роботі гальванічного елемента
(-)А: Ni0 - 2ē → Ni2+,
(+)K: Cu2+ + 2ē → Cu0:
CuSO4 + Ni → Cu + NiSO4.
Стандартна електрорушійна сила цього гальванічного елемента
Е0 = εК0 - εА0 = 0,34 - (-0,25) = 0,59В.
Якщо нікель буде катодом, то анодом необхідно взяти більш активний метал (табл.10.1), наприклад, марганець
(![]() = -1,18В):
= -1,18В):
(-) Mn | MnSO4 || NiSO4 | Ni (+).
Електронні рівняння електродних процесів і загальне рівняння хімічної реакції, що проходить при роботі такого гальванічного елемента:
(-)А: Mn0 - 2ē → Mn2+,
(+)K: Ni2+ + 2ē→ Ni0;
NiSO4 + Mn → Ni + MnSO4.
Стандартна електрорушійна сила
Е0 = εК0 - εА0 = -0,25 - (-1,18) = 0,93В.
Приклад 10.4. Скласти схему і обчислити ЕРС концентраційного гальванічного елемента, складеного з нікелевих електродів, якщо концентрації солей дорівнюють (моль/л): [Ni2+]=0,01; [Ni2+]=1,0. При якій концентрації електролітів гальванічний елемент припинить свою роботу?
Розв’язок. Анодом у концентраційному гальванічному елементі є електрод, занурений у більш розведений розчин, а катодом - у більш концентрований. Отже, схема такого гальванічного елемента
(-) Ni | Ni2+ (0,01 моль/л) || Ni2+ (1,0 моль/л) | Ni (+).
Електронні рівняння електродних процесів:
(-)А: Ni0 - 2ē → Ni2+,
(+)K: Ni2+ + 2ē → Ni0.
Електрорушійну силу обчислимо за формулою (10.12):
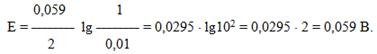
Концентраційний гальванічний елемент припинить свою роботу, коли електродні потенціали анода і катода зрівняються, а це відбудеться, якщо концентрації електролітів біля анода і катода стануть однаковими, тобто [Ni2+]K = [Ni2+]A.
Нехай у катодному просторі концентрація солі зменшилась на х моль/л, а в анодному - збільшилась на таку саму величину. Тоді
[Ni2+]K =1,0 - х, [Ni2+]A = 0,01 + х,
1,0 - х = 0,01 + х, х = 0,495,
[Ni2+]K = 1,0 - 0,495 = 0,505 моль/л,
[Ni2+]A = 0,01 + 0,495 = 0,505 моль/л.
Приклад 10.5. Які продукти і в якій послідовності утворюються на катоді при електролізі водного розчину, що містить суміш солей: NaNO3, AgNO3, Pb(NO3)2, Fe(NO3)3?
Розв’язок. Порівнюючи стандартні електродні потенціали відповідних систем (табл.10.1), можна визначити послідовність розрядки катіонів:

Після виділення перелічених металів розчин, який і спочатку мав кисле середовище внаслідок гідролізу солей AgNO3, Pb(NO3)2 і Fe(NO3)3, стає ще кислішим, тому наступним процесом буде відновлення йонів гідрогену за схемою
4) 2Н+ + 2ē→Н20, ![]() = -0,413B.
= -0,413B.
Катіони натрію, значення електродного потенціалу якого становить -2,714В, з водних розчинів відновлюватися не будуть.
Приклад 10.6. Які процеси будуть протікати на електродах при електролізі водного розчину купрум (ІІ) сульфату на інертному і на мідному анодах?
Розв’язок. Для визначення катодного процесу при електролізі розчину CuSO4 з інертними електродами, необхідно порівняти стандартні електродні потенціали окисно-відновних систем, що містяться у даному водному розчині:
2Н2О + 2ē → Н20 + 2ОН-, ε0 = -0,826В;
Cu2+ + 2ē → Cu0, ε0 = +0,34B.
Стандартний електродний потенціал системи Cu2+/Cu0 має більше значення, тому на катоді будуть відновлюватися катіони купруму (ІІ):
(-) К: Cu2+ + 2ē → Cu0.
На інертному аноді відбувається окиснення тої системи, що має, навпаки, найменше значення стандартного електродного потенціалу:
2Н2О - 4ē → O2 + 4H+, ε0= +1,229B;
2SO42- - 2ē → S2O82-, ε0= +2,010B,
тобто молекули води:
(+) А: 2Н2О - 4ē → О2 + 4Н+.
Сумарне рівняння електролізу:
![]()
Отже, при електролізі розчину CuSO4 з інертним анодом на катоді виділяється чиста мідь, на аноді - кисень, а у розчині залишається сульфатна кислота.
Тепер розглянемо електроліз того самого розчину CuSO4 з використанням розчинного анода – у даному випадку мідного. Щоб визначити, який процес відбувається на мідному аноді при електролізі розчину CuSO4, необхідно порівняти значення електродних потенціалів відповідних електрохімічних систем:
2Н2О - 4ē → O2 + 4H+, ε0= +1,229B;
2SO42- - 2ē → S2O82-, ε0= +2,010B;
Cu0 - 2ē→ Cu2+, ε0= +0,340B.
Окисненню міді відповідає найменше значення електродного потенціалу, тому буде протікати саме цей процес. Тоді зрозуміло, що електроліз розчину CuSO4 з мідним анодом зводиться до анодного розчинення металу, переміщення катіонів купруму (ІІ), що при цьому утворилися, до катода та їх відновлення на ньому до чистої міді.
(+) А: Cu0 - 2ē → Cu2+,
(-) К: Cu2+ + 2ē → Cu0.
Приклад 10.7. Складіть електронні рівняння електродних процесів, що проходять при електролізі розчину солі CuCl2.
Розв’язок. У розчині солі CuCl2 присутні катіони Cu2+, аніони Cl-і вода Н2О. Щоб встановити, які частинки будуть розряджатися на кожному електроді, слід порівняти величини стандартних електродних потенціалів. До катода (рис.10.18) будуть підходити катіони купруму (II) і вода, потенціали яких складають:
Cu2+ + 2ē → Cu0, ε0= +0,340B,
2Н2О + 2ē → Н20 + 2ОН-, ε0 = -0,826В.
Як випливає з правил розрядки, на катоді в першу чергу відновлюються ті частинки, що мають більші значення електродного потенціалу, тому катодний процес буде таким:
(-)К: Cu2+ + 2ē → Cu0.
Рисунок 10.18 – Схема електролізу водного розчину солі CuCl2
До анода (рис.10.18) у розчині солі CuCl2 переміщуються аніони Cl– і вода, що мають такі значення стандартних електродних потенціалів:
2Н2О - 4ē → O2 + 4H+, ε0= +1,229B;
2Cl– - 2ē → Cl2, ε0= +1,36B.
Незважаючи на те, що стандартний електродний потенціал розрядки для аніонов Cl– вищій, ніж для Н2О, деякі особливості кінетики зумовлюють переважне окиснення йонів Cl– (це пов’язано з явищем поляризації – перенапруги виділення О2). Крім того, за правилами розрядки на аноді спочатку окиснюються аніони безоксигенвмісних кислот (за винятком F–), тому анодна напівреакція буде такою:
(+)А: 2Cl– - 2ē → Cl2.
Загальне рівняння електролізу водного розчину солі купрум(II) хлориду має вигляд:
![]()
Приклад 10.8. Які продукти утворюються на електродах при електролізі водного розчину натрій флуориду з графітовими електродами? Як зміниться концентрація NaF протягом перебігу електролізу?
Розв’язок.
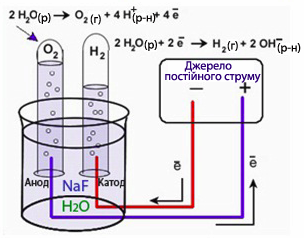
Рисунок 10.19 – Схема електролізу водного розчину NaF
Спочатку розглянемо катодні процеси, що проходять при електролізі системи NaF–Н2О, і порівняємо електродні потенціали відповідних окисно-відновних систем (табл.10.1):
2Н2О + 2ē → Н20 + 2ОН-, ε0 = -0,826В,
Na+ + 1ē → Na0, ε0 = -2,71В.
Оскільки потенціал відновлення води має більше значення, ніж потенціал відновлення катіонів Na+, то відповідно до правил розрядки на катоді буде відновлюватися вода і виділятися вільний Н2 (рис.10.19). Катодний процес:
(-)К: 2Н2О + 2ē → Н20 + 2ОН-.
Внаслідок відновлення води у катодному просторі накопичуються гідроксильні йони ОН- і катіони Na+, які не піддаються відновленню, – тобто фактично біля катода утворюється NaОН.
З порівняння стандартних електродних потенціалів відповідних окисно-відновних систем
F2 + 2ē → 2F–, ε0 = + 2,870B,
2Н2О - 4ē → O20 + 4H+, ε0 = + 1,229B
і з урахуванням правил розрядки видно, що на аноді виділяється вільний кисень (рис.10.19) згідно з електронним рівнянням
(+)А: 2Н2О - 4ē →O20 + 4H+,
а у прианодному просторі завдяки накопиченню йонів Н+ і F– утворюється НF. Сумарне рівняння реакції, що проходить при електролізі:
![]()
Практично при електролізі водного розчину натрій флуориду проходить розрядка води, тому кількість H2O протягом електролізу зменшується. Після припинення електролізу, відбувається змішування NaOH, що накопичувався навколо катода, і HF, що накопичувався біля анода:
NaOH + HF→ NaF + H2O.
Таким чином, внаслідок електролізу водного розчину натрій флуориду концентрація солі NaF в електролізері зростає.
Приклад 10.9. Який об’єм газу виділяється на інертному аноді та яка маса металу осаджується на катоді при електролізі водного розчину солі CuSO4, якщо процес проводять протягом 0,5 год. при силі струму 5А?
Розв’язок. Сумарне рівняння реакції при електролізі розчину солі CuSO4 має вигляд (див. приклад 10.6):
![]()
Об’єм кисню, що виділився на аноді, обчислюємо за першим законом Фарадея (рівняння 10.19). Але попередньо слід розрахувати еквівалентний об’єм кисню (Vекв(O2)=VМ(O2)/ч·B=22,4/2·2=5,6л/моль) і перевести одиниці вимірювання у відповідну розмірність ([TEX]\tau=0,5год.=1800с.[/TEX]).

З другого закону Фарадея (рівняння 10.24) випливає, що кількість еквівалентів міді, що осаджується на катоді, дорівнює кількості еквівалентів кисню, що виділяється на аноді:
![]()
Еквівалентна маса міді визначається відношенням її молярної маси М до валентності В:
mекв(Cu) = M(Cu) / B = 63,546/2 = 31,773г/моль,
звідки маса міді:
m(Cu) = nекв(Cu) · mекв(Cu) = 0,0373моль · 31,773г/моль, = 1,185г.
Приклад 10.10. Обчислити тривалість електролізу розчину бісмут(ІІІ) нітрату, якщо за цей час нормальна (еквівалентна) концентрація солі Bi(NO3)3 зменшилась від 0,35моль/л до 0,33моль/л.
Розв’язок. Згідно із законом Фарадея маса речовини, що виділяється при електролізі, дорівнює
[TEX]m=\frac{m_{екв}\cdot I\cdot\tau}{F}[/TEX].
З іншого боку, нормальна концентрація СN визначається відношенням кількості еквівалентів n речовини до об’єму усього розчину:
СN = n/ V = m / mекв• V, звідки m = CN • mекв • V.
Порівнюючи два рівняння, одержимо
mекв • Iτ/ F = CN • mекв • V,
звідки отримаємо формулу для обчислення тривалості електролізу:
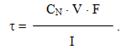
Оскільки різниця концентрацій відома, розрахуємо тривалість електролізу