Ключові терміни:
Акумулятор, Анодні процеси при електролізі, Газова поляризація, Гальванічний елемент, Гальванічний елемент Якобі-Даніеля, Другий закон Фарадея, Електродний потенціал, Електроліз, Електрорушійна сила гальванічного елемента, Електрохімічна поляризація, Електрохімічний процес, Електрохімія, Зарядка акумулятора, Катодні процеси при електролізі, Коефіцієнт виходу за струмом, Концентраційна поляризація, Напруга розкладання електроліту, Паливні елементи, Перший закон Фарадея, Подвійний електричний шар (ПЕШ), Стала Фарадея, Стандартний електродний потенціал, Схема гальванічного елемента, Хімічна поляризація, адсорбційний шар, активні, анод, дифузійний шар, електрод, електрохімічна система, електрохімічний ряд напруг металів, енергія атомізації, енергія сольватації, енергія іонізації, катод, концентраційний гальванічний елемент, нерозчинні аноди, перенапруга, перший закон Фарадея, поляризація, розрядка акумулятора, розчинні аноди, рівняння Нернста, стандартний водневий електрод, інертні, іоногенний механізм, ліоелектричний механізм , адсорбційний механізм.10.1 Початкові поняття електрохімії
Електрохімія – це наука, що вивчає електрохімічні процеси та фізико-хімічні властивості іонних систем (розчинів, розплавів та твердих електролітів). Предметом вивчення електрохімії є електрохімічний процес і електрохімічна система.
Електрохімічний процес – це явище, яке відбувається за участю заряджених частинок на межі поділу фаз між електронним та іонним провідниками.
Електрохімічні процеси умовно поділяються на дві основні групи:
- перетворення хімічної енергії в електричну, при якому за рахунок хімічної окисно-відновної реакції виникає різниця потенціалів та виконується робота;
- перетворення електричної енергії в хімічну, при якому під дією електричного струму проходять хімічні реакції.
Сукупність всіх речовин, що беруть участь в окремому електрохімічному процесі, – це електрохімічна система.
Електрохімічна система обов’язково містить окиснену і відновлену форми, які у загальному випадку позначаються відповідно Ох і Red. Для умовного запису електрохімічної системи спочатку зазначають окиснену форму, а потім через скісну риску - відновлену (Ох/Red).
Електрохімічна система, що виникає при контакті електронного та іонного провідників, називається електрод. Електрод, на якому відбувається окиснення, називається анод, а той електрод, на якому відбувається відновлення, - катод.
10.2 Подвійний електричний шар
При контакті електронопровідної та іонопровідної фаз (наприклад, система метал-розчин його солі) відбувається перехід заряджених частинок через межу поділу. Навіть при зануренні металевої пластинки у дистильовану воду йони металу під дією полярних молекул води теж можуть відриватися від поверхні й гідратованими переходити у рідину. Рушійними силами цього явища є прагнення електрохімічної системи до стану термодинамічної рівноваги і зростання ентропії при розчиненні (ΔS>0).
Перехід заряджених частинок із однієї фази в іншу супроводжується порушенням балансу зарядів у кожній фазі та спричиняє виникнення подвійного електричного шару.
Подвійний електричний шар (ПЕШ) – це тонкий шар просторово розділених електричних зарядів протилежних знаків, утворення яких на межі поділу фаз супроводжується виникненням різниці потенціалів.
Як випливає із визначення, ПЕШ утворюється на межі поділу фаз, коли тонкий приповерхневий шар кожної з них одержує заряд протилежного знаку, тому подвійний електричний шар деякою мірою подібний до обкладинок конденсатору. Він складається з двох частин:
- адсорбційний шар – щільна внутрішня площина товщиною 10–10м, яка безпосередньо прилягає до поверхні металу і характеризується меншою діелектричною проникністю, ніж в об’ємі розчину. В адсорбційному шарі локалізуються жорстко орієнтовані диполі розчинника, а також ті йони з розчину, що частково десольватувалися внаслідок хімічної взаємодії з поверхнею металу;
- дифузійний шар товщиною 10–9-10–5м, в якому концентрація йонів поступово зменшується, але зберігається їх певна орієнтація відносно металу. Розподілення сольватованих йонів на поверхні металу зумовлюється протидією теплового руху і кулонівських сил – подібно до молекул газу в земній атмосфері. Ступінь дифузійності зростає з підвищенням температури та зменшенням концентрації розчину і заряду металу.
Механізм виникнення ПЕШ зумовлюється сукупністю багатьох окремих процесів, кожний з яких залежить від впливу певних чинників: природи металу і стану його поверхні, складу і концентрації електроліту, температури, швидкості дифузії, кількості розчиненого у рідкій фазі газу тощо. У реальних умовах подвійний електричний шар виникає одночасно за кількома паралельними схемами:іоногенний механізм, ліоелектричний механізм , адсорбційний механізм.
Подвійний електричний шар виявляє суттєвий вплив на швидкість електродних процесів, стійкість дисперсних систем, змочуваність твердих тіл, адсорбцію, коефіцієнт тертя та інші фізико-хімічні властивості міжфазних меж.
10.3 Електродні потенціали
Різниця потенціалів, що виникає у подвійному електричному шарі на межі метал-розчин електроліту, є кількісною характеристикою подвійного електричного шару і називається електродним потенціалом (позначається символами ε чи φ), який може набувати додатного або від’ємного значення.
Електродний потенціал – це певна різниця електростатичних потенціалів, що виникає між електродом і електролітом при їх контакті.
Абсолютне значення електродного потенціалу e виміряти неможливо, оскільки введення будь-яких вимірювальних приладів неминуче призводить до появи нової контактної різниці потенціалів. Тому необхідно мати еталонний електрод, щоб відносно нього вимірювати електродні потенціали усіх електрохімічних систем. З цією метою створені електроди порівняння, за які найчастіше використовують водневий, хлорсрібний чи каломельний електроди.
Важливішим серед них є стандартний водневий електрод, що має досить просту конструкцію (рис.10.5). Він складається з посудини 3, заповненої розчином сульфатної кислоти концентрації 1моль/л, яка забезпечує активність йонів гідрогену Н+ [TEX]\alpha_{H^+}=1моль/л[/TEX]. В розчин занурена платинова пластина 1, покрита електролітично осадженою губчастою платиною для збільшення площини поверхні та кращої адсорбції водню. Через розчин H2SO4 під тиском 101325Па при 298К крізь трубку 2 пропускають ретельно очищений водень, який омиває платину і, адсорбуючись на ній, покриває всю поверхню суцільним шаром – цим і зумовлюється функціонування електрода у якості саме водневого, а не платинового. Надлишок водню виходить у верхній частині посудини через гідравлічний закрив 4. В конструкції передбачений сифон 5, завдяки якому водневий електрод сполучають з іншими вузлами при складанні гальванічного ланцюгу. Платина каталізує розщеплення молекули водню на атоми (Н2↔2Н), тому на межі поділу метал-розчин між атомарним воднем, адсорбованим платиною, та йонами гідрогену Н+ у розчині встановлюється рівновага:
[TEX]2H^0-2\overline{e} \Leftrightarrow 2H^+[/TEX],
якій відповідає потенціал водневого електрода ![]() .За стандартних умов (298К, 101325Па, [TEX]\alpha_{H^+}=1моль/л[/TEX]) потенціал стандартного водневого електрода вважають таким, що дорівнює нулю,
.За стандартних умов (298К, 101325Па, [TEX]\alpha_{H^+}=1моль/л[/TEX]) потенціал стандартного водневого електрода вважають таким, що дорівнює нулю,![]() = 0.
= 0.
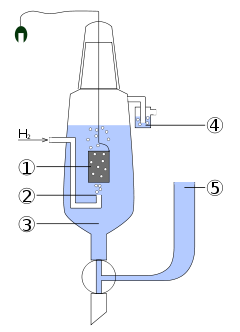
Рисунок 10.5 – Стандартний водневий електрод: 1 – платинова пластина, покрита губчастою платиною, 2 – трубка для вдування водню, 3 – розчин сульфатної кислоти, 4 – гідравлічний закрив, 5 – сифон
Для визначення електродного потенціалу будь-якої окисно-відновної системи, збирають гальванічний елемент з двох напівелементів – стандартного водневого електрода і досліджуваного електрода. Як правило, вимірювання проводять за стандартних умов (Т=298К, Р=101325Па) і концентрації катіонів металу в розчині [Меz+]=1моль/л.
Оскільки стандартний електродний потенціал водневого електрода дорівнює нулю, то електродний потенціал досліджуваної окисно-відновної системи (наприклад, деякого металу Меz+/Me0), дорівнює електрорушійній силі Е0 гальванічного елемента, складеного з досліджуваного напівелемента і водневого електрода порівняння:
![]()
У парі із стандартним водневим електродом метал відносно нього може заряджатися негативно чи позитивно. Залежно від цього електродному потенціалу металу приписують знак мінус або плюс відповідно.
На значення електродних потенціалів впливають різні чинники (природа металу і електроліту, температура і концентрація розчину тощо), тому для порівняльної характеристики хімічної активності металів необхідно знати їх потенціали, виміряні за однакових, стандартних умов.
Стандартний електродний потенціал ε0– це потенціал, виміряний відносно стандартного водневого електрода за стандартних умов при активності йонів металу в розчині 1моль/л.
Значення стандартних електродних потенціалів для багатьох поширених металів наводять у спеціальних довідниках.
Значення стандартних електродних потенціалів характеризують силу окисників і відновників: чим вище значення ε0, тим активнішим окисником є окиснена форма електрохімічної системи, і навпаки, чим нижче значення ε0, тим активнішим відновником є відновлена форма. На практиці електрохімічні процеси дуже рідко відбуваються за стандартних умов. А за реальних умов числове значення електродного потенціалу розраховують за рівняння Нернста
- [TEX]\varepsilon=\varepsilon^0+\frac{RT}{zF} ln\frac{[Ox]}{[Red]} [/TEX]
- де ε0 - стандартний електродний потенціал;
- R - універсальна молярна стала, R=8,314Дж/моль•К;
- Т - температура, К; F - стала Фарадея, F=96500Кл/моль;
- z - кількість електронів, що беруть участь в елементарному акті електрохімічного процесу;
- [Ox] i [Red] - концентрація відповідно окисненої та відновленої форм.
- Для точних розрахунків замість концентрації у рівнянні Нернста необхідно брати активність, однак у розведених розчинах похибка, що вноситься змінюванням активності на концентрацію, дуже незначна, тому нею можна знехтувати.
Підстановка значень R, F i T=298K та перехід від натурального логарифма до десяткового спрощує рівняння Нернста
- [TEX]\varepsilon=\varepsilon^0+\frac{0.059}{z} lg\frac{[Ox]}{[Red]} [/TEX]
- Для металевого електрода, зануреного у розчин власної солі, концентрація відновленої форми залишається сталою
- ([Me0] = const), тому рівняння Нернста набуває вигляду
- [TEX]\varepsilon=\varepsilon^0+\frac{RT}{zF} lg[Me^{m+}] [/TEX]
А для водневого електрода, якому відповідає рівновага 2Н++2ē↔Н20, рівняння Нернста можна записати так:
- [TEX]\varepsilon_{2H^+/H_2}=\varepsilon^0_{2H^+/H_2}+\frac{0.059}{\varepsilon} lg\frac{[H^+]^2}{[H_2]} [/TEX]
Зважаючи на те, що ![]() = 0, [H2] = const i -lg[H+]=рН, маємо
= 0, [H2] = const i -lg[H+]=рН, маємо
- [TEX]\varepsilon_{2H^+/H_2}=0.059 lg[H^+]=-0.059pH[/TEX]
Рівняння (10.5) доводить, що значення водневого електродного потенціалу залежить від реакції середовища. Розглянемо граничні випадки:
- сильнокисле середовище, [H+] = 1 моль/л, рН = -lg1= 0, тоді
![]() = 0;
= 0;
- нейтральне середовище, [H+] = 10-7 моль/л, рН = -lg10-7 = 7, тоді
![]() = -0,059 • 7 = -0,413В;
= -0,059 • 7 = -0,413В;
- сильнолужне середовище, [H+] = 10-14моль/л, рН = -lg10-14 = 14, тоді
![]() = -0,059 • 14 = -0,826В.
= -0,059 • 14 = -0,826В.
10.4 Електрохімічний ряд напруг металів
Мірою електрохімічної активності металу є енергія, яку необхідно витратити для роботи по перетворенню металу із твердого кристалічного стану в стан гідратованих йонів у розчині. Ця енергія визначається сумою трьох складових:
- енергія атомізації, яка поглинається при переведенні металу із кристалічного стану в ізольовані атоми і залежить від міцності кристалічної решітки;
- енергія іонізації, що витрачається на відривання валентних електронів від вільних атомів металу і зумовлюється його положенням у періодичній системі елементів;
- енергія сольватації, яка виділяється при сольватації йонів металу і визначається електронною структурою, радіусом та зарядом йона, а також природою розчинника.
Загальна енергія перетворення металу з кристалічного стану в гідратовані йони у розчині залежить від співвідношення окремих складових. Чим менше значення має ця енергія, тим від’ємнішим є стандартний електродний потенціал (табл.10.1) і відповідно тим активнішим виявляє себе метал у електрохімічних процесах.
Послідовність розміщення металів у порядку зростання стандартних електродних потенціалів, якому відповідає зменшення електрохімічної активності металів, називається електрохімічний ряд напруг металів:

З аналізу електрохімічного ряду напруг металів випливає декілька важливих висновків.
- Метали, стандартні електродні потенціали яких нижчі, ніж водневий електродний потенціал у нейтральному середовищі [TEX](\varepsilon_{2H^+/H_2}=-0.059pH=-0.413B)[/TEX], здатні витісняти водень із води, але ті активні метали (ε0< -0,413В), що розміщуються у ряді напруг після Mg, за звичайних умов з Н2О не взаємодіють, тому що покриті нерозчинними у воді оксидними плівками.
- Метали, розміщені у ряді напруг до Н2, витісняють водень з кислот-неокисників (HCl, H3PO4, CH3COOH, розведена H2SO4 тощо).
- Для металів, що розміщуються у ряді напруг після Mg, характерна закономірність: більш активний метал витісняє менш активний із розчину його солі. Або для загального випадку: метал, що розміщується ближче до початку ряду напруг, витісняє інший метал, що знаходиться правіше, з розчину його солі. А метали у ряді напруг до Mg настільки активні, що у водних розчинах солей взаємодіють не з сіллю, а з водою.
- Під час реакції у розчинах електролітів відновні властивості металів зменшуються від початку ряду напруг, а окисні властивості катіонів металів, навпаки, - від кінця ряду напруг. Так, метали Li, Na, Mg, Zn виявляють сильні відновні властивості і легко окиснюються, а катіони Pt2+, Au3+, Ag+, Cu2+ є сильними окисниками, які швидко відновлюються до вільних металів.
10.5.1 Гальванічні елементи
Принцип дії гальванічного елемента ґрунтується на взаємодії двох металів через електроліт, яка приводить до виникнення у замкнутому ланцюгу електричного струму. Отже, гальванічний елемент містить дві пластини з різних металів, сполучених між собою дротяним провідником і занурених у розчин електроліту. Така схема дозволяє просторово розділити напівреакції окиснення і відновлення, що відбуваються на поверхні поділу фаз метал-електроліт, на якій утворюється подвійний електричний шар.
Гальванічний елемент – це хімічне джерело електричного струму, що складається з однієї гальванічної комірки.
Щоб визначити, який електрод у гальванічному елементі відіграє роль анода, а який - катода, необхідно порівняти значення електродних потенціалів відповідних електрохімічних систем. Окисно-відновна реакція самочинно перебігає у тому напрямку, при якому електрохімічна система з більшим значенням електродного потенціалу є окисником.
Отже, катодом (окисником) є електрод, виготовлений з менш активного металу, електродний потенціал якого має більш додатне значення, - саме тому катод у схемах гальванічних елементів позначається знаком плюс. І навпаки, анодом (відновником) є електрод, виготовлений з більш активного металу, у якого електродний потенціал має більш від’ємне значення, тому анод позначається знаком мінус.
Гальванічний елемент Якобі-Даніеля складається з цинкової та мідної пластин, занурених у розчини відповідно ZnSO4 i CuSO4 концентрацій 1моль/л, тобто має дві електрохімічні системи Zn2+/Zn i Cu2+/Cu. Для запобігання перемішуванню розчини розділені напівпроникною поруватою перегородкою (або електролітичний місток), через яку можуть проходити йони. При замиканні ланцюгу завдяки різниці потенціалів Zn i Cu на цинковому аноді відбувається процес окиснення (-)А: Zn0(тв) - 2ē → Zn2+(р-н), а на мідному – відновлення йонів купруму(ІІ) із розчину (+)К: Cu2+(р-н) + 2ē → Cu0(тв). Внаслідок перебігу обох напівреакцій виникає постійний електричний струм - напрямлений рух електронів у зовнішньому ланцюгу від анода до катода.
Атоми цинку з поверхні електрода внаслідок окиснення перетворюються на йони і переходять у прианодний розчин. З іншого боку, катіони Cu2+, що містяться у прикатодному розчині, переміщуються до катода і відновлюються на ньому. Одночасно йони SO42- переходять через сольовий місток (чи через мембрану) з прикатодного простору в прианодний, тобто у напрямку, протилежному рухові катіонів Zn2+ i Cu2+.
Схема гальванічного елемента Якобі-Даніеля зображується за допомогою умовного запису:
А(-) Zn| ZnSO4 || CuSO4 | Cu (+)K,
де однією вертикальною рискою позначається межа поділу між електродом і електролітом, а двома - між розчинами солей. За необхідності на таких схемах зазначаються концентрації розчинів електролітів, особливо якщо С(електроліту) ≠1моль/л.
Електрорушійна сила гальванічного елемента завжди додатна, її можна розрахувати за формулою
- [TEX]Е = \varepsilon_К - \varepsilon_А[/TEX]
- де εК і εА – електродні потенціали катода і анода відповідно.
Якщо гальванічний елемент працює у стандартних умовах (Р=105Па, Т=298К, С(електроліта)=1моль/л), то його електрорушійна сила називається стандартною ЕРС:
[TEX]Е^0 = \varepsilon^0_К - \varepsilon^0_А.[/TEX]
Величина ЕРС гальванічного елемента залежить як від матеріалу електродів, так і від природи електроліту.На цьому базується дія концентраційних гальванічних елементів. Гальванічний елемент, складений з електродів одного і того самого металу, занурених у розчини солі цього металу різних концентрацій, називається концентраційний гальванічний елемент. У концентраційному гальванічному елементі (рис.10.10) роль анода відіграє електрод, занурений у більш розведений розчин, а катода - той, що знаходиться у розчині вищої концентрації. У схемах таких елементів обов’язково зазначаються концентрації (моль/л) розчинів солей, наприклад:
[TEX]А(-) Zn| ZnSO_4 (10^{-4} моль/л) || ZnSO_4 (1моль/л) | Zn (+) K.[/TEX]
Формула для обчислення ЕРС концентраційного гальванічного елемента виводиться на підставі рівняння Нернста :
- [TEX]E=\varepsilon_K-\varepsilon_A=(\varepsilon^0+\frac{0.059}{z} lg[Me^{m+}]_{катод})-(\varepsilon^0-\frac{0.059}{z} lg[Me^{m+}]_{анод})=\frac{0.059}{z} lg\frac{[Me^{m+}]_{катод}}{[Me^{m+}]_{анод}}[/TEX]
10.5.2 Акумулятори
Акумулятор - це прилад тривалого багаторазового використання, в якому під дією зовнішнього джерела струму накопичується хімічна енергія, здатна перетворюватися в електричну. Процес перетворення хімічної енергії в електричну при роботі акумулятора називається розрядка акумулятора; при цьому акумулятор поводить себе як гальванічний елемент. Зарядка акумулятора – це накопичування хімічної енергії при пропусканні через систему зовнішнього електричного струму.
Найбільше практичне значення одержали свинцеві акумулятори, які іноді називають кислотними, оскільки в них використовується сульфатна кислота. При роботі, тобто під час розрядки цього типу акумуляторів роль анода виконує негативно заряджений електрод із свинцевих перфорованих пластин, заповнених губчастим свинцем, а катода - позитивно заряджений електрод із PbO2. Схема гальванічного елемента, що утворюються при роботі акумулятора:
[TEX](-) Pb | H^+, SO_4^{2}- | PbO_2 (+).[/TEX]
Коли відбувається розрядка, на аноді проходить окиснення, а на катоді - відновлення:
(-)А: Pb0+ SO42- - 2ē →PbSO4, ![]() = -0,36В,
= -0,36В,
(+)K: PbО2 + 4H+ + SO42-+ 2ē →PbSO4 + 2H2O, ![]() = +1,68В.
= +1,68В.
Електрорушійна сила акумулятора, як і будь-якої електрохімічної системи, визначається різницею між потенціалами катода і анода:
- [TEX]E=\varepsilon_{PbO_2/PbSO_4}-\varepsilon_{PbSO_4/Pb}=E^0+\frac{RT}{2F} ln\frac{\alpha^4(H^+)\cdot \alpha^2(SO_4^{2-})}{\alpha^2(H_2O)} [/TEX]
- де Е0 - стандартна ЕРС, що дорівнює
[TEX]E^0=\varepsilon^0_{PbO_2/PbSO_4}-\varepsilon^0_{PbSO_4/Pb}=1.68-(-0.36)=2.02B[/TEX]
Коли напруга на електродах спадає до 1,8В, акумулятор вважається розрядженим. При його зарядці полярність електродів не змінюється, але реакції перебігають у зворотному напрямку: негативний електрод, що при розрядці був анодом, тепер стає катодом, на ньому відбувається реакція відновлення. І навпаки, позитивний електрод, який був катодом, під час зарядки відіграє роль анода і окиснюється:
(-)K: PbSO4 + 2ē → Pb + SO42-,
(+)А: PbSO4 + 2H2O - 2ē →Pb2 + 4H+ + SO42-.
Сумарна реакція у свинцево-кислотному акумуляторі:
![]()
10.5.3 Паливні елементи
Паливні елементи – це гальванічні елементи, в яких електрична енергія утворюється за рахунок хімічної енергії відновника (палива) і окисника, що безперервно і окремо надходять на електроди ззовні.
Найчастіше відновником на негативному електроді буває водень або гідразин N2H4, а окисником на позитивному електроді - кисень чи повітря. Для прикладу розглянемо роботу киснево-водневого паливного елемента з лужним електролітом (рис.10.11), схема якого має вигляд
- [TEX]А(-) Н_2, Ме | KOH | Me, O_2 (+) K,[/TEX]
- де Ме - металічний провідник першого роду, який відіграє роль каталізатора електродного процесу і відводить струм.
Звичайно застосовують дрібнопоруваті нікелеві електроди з напиленими каталізаторами (Pt i Pd – на тому, через який дифундує Н2, та Al i Co – на тому, через який дифундує О2). Електродні процеси у киснево-водневому паливному елементі протікають згідно з рівняннями:
(-) А: Н2 + 2ОН- - 2ē → Н2О,
(+) К: ½ О2 + Н2О + 2ē→ 2ОН-.
При складанні анодної та катодної напівреакцій одержуємо сумарне рівняння процесу, що відбувається у киснево-водневому паливному елементі:
Н2 + ½ О2 → H2O.
У зовнішньому ланцюгу електрони переміщуються, як і у будь-якому гальванічному елементі, від анода до катода, а у розчині, навпаки, переносники зарядів (гідроксильні йони ОН-) рухаються від катода до анода. Внаслідок перебігу хімічної реакції у ланцюгу генерується постійний струм, а хімічна енергія перетворюється безпосередньо в електричну.
10.6 Електроліз
Електроліз - це сукупність окисно-відновних процесів, які відбуваються у розчинах чи розплавах електролітів при пропусканні через них постійного електричного струму. Електроліз, по суті, є процесом, зворотним роботі гальванічного елемента, напрямок якого змінюється під дією зовнішнього електричного струму. Як і в гальванічних елементах, під час електролізу на катоді проходить процес відновлення, а на аноді - окиснення, однак розподілення знаків заряду на електродах протилежне тому, що спостерігається у гальванічному елементі, тобто катод заряджений негативно, а анод - позитивно.
10.6.1 Електродні процеси при електролізі водних розчинів електролітів
Під час електролізу водних розчинів електролітів на електродах поряд з йонами електролітів можуть розряджатися молекули води та йони Н+ і ОН-, що утворюються внаслідок дисоціації Н2О під дією електричного струму. Характер електролітичних процесів значною мірою залежить насамперед від співвідношення електродних потенціалів відповідних електрохімічних систем.
Серед кількох імовірних електродних процесів при електролізі відбувається той, що потребує витрати найменшої роботи і зумовлюється мінімальною енергією. Тому на катоді у першу чергу відновлюється окиснена форма системи з більшим значенням електродного потенціалу, а на аноді окиснюється відновлена форма системи з меншим електродним потенціалом.
Катодні процеси при електролізі водних розчинів електролітів підпорядковуються певним правилам розрядки.
1. За наявності у розчині катіонів металів, що стоять на початку ряду напруг і мають значення електродних потенціалів набагато менші, ніж значення водневого електрода в нейтральному середовищі при рН=7 (ε<-0,413В), на катоді виділяється тільки водень внаслідок відновлення води (із нейтральних або лужних розчинів):
2Н2О + 2ē→ Н2 + 2ОН-, ε0 = - 0,826В
або йонів гідрогену (із кислого середовища):
2Н+ + 2ē → Н2, ε0 = -0,413В.
2. Якщо катіон електроліту має більш додатний електродний потенціал, ніж -0,413В (приблизно від Sn до Au), то на катоді розряджаються тільки катіони металу:
(-)К: Меm+ + mē à Me0, ε0 >> -0,413В.
- Якщо потенціал металу близький до величини -0,413В (метали середньої частини ряду напруг, від Al, Тi до ~Ni), то на катоді можуть одночасно відновлюватися і молекули води, і катіони металу:
![]()
Пріоритетний напрямок процесу в цьому випадку залежить від умов проведення електролізу: густини струму (відношення сили струму до робочої поверхні електрода), температури, складу розчину, концентрації електроліту, реакції середовища тощо. Так, у кислих розчинах найчастіше відбувається виділення водню, а у нейтральних і лужних розчинах – переважно відновлення катіонів металів з розчину.
За наявності в електроліті кількох видів катіонів у першу чергу відновлюються ті, що мають більш додатне значення електродного потенціалу.
Анодні процеси при електролізі водних розчинів електролітів визначаються у першу чергу матеріалом анода і природою аніона.
- Залежно від хімічного складу матеріалу аноди поділяють на дві групи:
-
інертні, або нерозчинні аноди (графіт, Au, Pt, Ir, Ta), які не піддаються окисненню під час електролізу. Інертні аноди не беруть участі в електрохімічних процесах завдяки хімічній стійкості щодо розчину електроліту та продуктів електролізу, тому їх найчастіше використовують для електролізу солей тих металів, що розміщуються від початку ряду напруг до Аl включно;
- активні, або розчинні аноди, що окиснюються у ході електролізу. У випадку розчинних анодів спостерігається розчинення металу, з якого виготовлений анод, якщо його стандартний електродний потенціал менший, ніж стандартний електродний потенціал кисневого електроду (+1,229 В), наприклад: Cu, Ag, Ni, Sn, Zn. При електролізі з розчинним анодом матеріал аноду розчиняється внаслідок окиснення
Ме0(тв) - mē → Mem+(р-н), ε0 < 1,229 B
і переходить у розчин у вигляді катіонів, які переміщуються до катода, а потім відновлюються та осідають на ньому. Для запобігання забрудненню електроліту сторонніми йонами при електролізі з розчинним анодом використовують розчин з одноіменним катіоном, наприклад, для срібного анода застосовують розчин AgNO3.
- Залежно від природи аніона на інертних електродах при електролізі можуть протікати різні процеси:
- Якщо у розчині присутні аніони безоксигенових кислот (S2-, Cl-, Br-, I-, за винятком F-), то відбувається їх окиснення:
Ann- - nē → An0.
- За наявності в електроліті оксигеновмісних аніонів (SO42-, PO43-, NO3-, OH- та ін.) та йонів фтору F- у кислому та нейтральному середовищах розряджаються молекули води:
2Н2О - 4ē → O20 + 4H+, ε0 = +1,229 B,
а у лужному середовищі - гідроксильні йони:
4ОН- - 4ē → О20 + 2Н2О, ε0 = -0,413 B.
Якщо розчин чи розплав електроліту містить декілька видів аніонів, то у першу чергу окиснюються ті, що мають менше значення електродного потенціалу.
У випадку розчинних анодів відбувається розчинення металу, з якого виготовлений анод, якщо його стандартний електродний потенціал менше, ніж стандартний електродний потенціал кисневого електрода (+1,229В).
10.6.2 Закони електролізу
Маса речовини m, яка піддається електрохімічному перетворенню на електроді, пропорційна кількості електрики q, що проходить через електроліт, і не залежить від інших чинників: [TEX]m = A_e\cdot q[/TEX], де Ае - електрохімічна еквівалентна маса, яка визначається масою речовини, виділеною на електроді при проходженні через нього 1Кл електрики: [TEX]A_e=\frac{m}{q}[/TEX].
Однак електрохімічну еквівалентну масу зручніше розглядати як відношення еквівалентної маси mекв до сталої Фарадея F: [TEX]A_e=\frac{m_{екв}}{F} =\frac{M}{zF}[/TEX] .
Стала Фарадея має такий фізичний зміст: F характеризує заряд одного еквівалента речовини, яка піддається електрохімічному перетворенню. Це стає зрозумілим виходячи з того, що один моль еквівалентів речовини несе 6,022·1023 елементарних зарядів (стала Авогадро), а елементарний заряд дорівнює 1,6022×10-19 Кл. Звідси стала Фарадея:
[TEX]F = N_A\cdot{e} = 6,022\cdot{10^{23}}\cdot{1,6022}\cdot{10^{-19}}= 96485 Кл/моль\approx{96500 Кл/моль.}[/TEX]
Кількість електрики q (Кл) дорівнює добутку сили струму І (А) на тривалість електролізу τ (с), тому перший закон Фарадея можна записати у вигляді [TEX]m = A_e\cdot I\cdot \tau[/TEX], або:
- [TEX]m=\frac{m_{екв}\cdot I\cdot \tau}{F}[/TEX]
Якщо речовина виділяється на електроді у газоподібному стані, то її об’єм обчислюють за рівнянням
- [TEX]V_{газу}=\frac{V_{екв}\cdot I\cdot \tau}{F}[/TEX]
Для практичних розрахунків рівняння уточнюють, використовуючи коефіцієнт виходу за струмом [TEX]\omega[/TEX]
- [TEX]m_{факт}=\frac{\omega m_{екв}\cdot I\cdot \tau}{F}[/TEX] .
- [TEX]V_{газу факт}=\frac{\omega V_{екв}\cdot I\cdot \tau}{F}[/TEX]
Коефіцієнт виходу за струмом ω показує відношення маси речовини, що фактично виділилась mфакт, до теоретично можливої mтеор: [TEX]\omega=\frac{m_{факт}}{m_{теор}}[/TEX].
Маси речовин, що виділяються на електродах під дією однакової кількості електрики, пропорційні еквівалентним масам цих речовин:
- [TEX]\frac{m_1}{m_2}=\frac{m_{екв.1}}{m_{екв.2}}[/TEX]
Із другого закону Фарадея випливає, що у послідовно підключених електролізерах (І=const, τ=const) маси речовин, що утворюються на електродах, прямо пропорційні їх хімічним еквівалентам:
- [TEX]\frac{m_1}{m_2}=\frac{E_1}{E_2}[/TEX]
Отже, при електролізі на катоді та на аноді електрохімічному перетворенню піддаються однакові кількості еквівалентів за умови однакової кількості електрики:
- [TEX]n_{екв.1}=n_{екв.2}[/TEX] якщо q1 = q2.
10.6.3 Застосування електролізу
Найважливішими галузями застосування електролізу є такі:
1. Добування хімічно чистих речовин. Електролізом розчинів солей одержують метали Cu, Zn, Cd, Ni та ін. Крім цих речовин, методом електролізу виробляють F2 із розплаву NaF, H2 i O2 із води (за наявності NaOH), MnO2 із розчину MnSO4, а також велику кількість окисників (KMnO4, K2CrO4, H2O2, KClO) і деякі органічні сполуки, наприклад, анілін із нітробензену.
2. Рафінування (очищення) металів застосовується для одержання високочистих Cu, Ni, Au, Ag, Pb, Sn, Fe.
3. Гальваностегія - це електролітичний процес покриття одного металу іншим, більш стійким у механічному і хімічному відношенні.
4 Гальванопластика - це процес одержання точних металевих копій з рельєфних поверхонь методом катодного електроосаджування.
5. Електрохімічна анодна обробка металів - електролітичний метод формування виробів складної конфігурації із твердих та тугоплавких металів, які важко піддаються механічній обробці.
6. Анодне оксидування (анодування) найчастіше застосовується для обробки Mg, Al, Ti та сплавів на їх основі. У цьому методі деталь відіграє роль анода, а роль катода - свинець чи будь-який метал, що не взаємодіє з електролітом. Внаслідок анодування на поверхні виникає оксидна плівка з дуже цінними якостями. Вона тверда, а завдяки малим розмірам пор легко просочується різними речовинами, які можуть підвищувати корозійну стійкість поверхні, стійкість до зношування або електричний опір (до 1014Ом×см).
7. Хемотроніка - використання електрохімічних процесів для хімічного перетворення інформації. Хемотрони використовують як датчики механічних, акустичних і сейсмічних коливань, оптичних модуляторів, посилювачів, випрямлячів, реле часу, генераторів струму і напруги, запам’ятовуючих та інтегруючих елементів інформаційно-обчислювальних комплексів.
10.7 Напруга розкладання. Поляризація
Для практичного здійснення електролізу з конкретним електролітом необхідна певна мінімальна порогова напруга, значення якої тим вище, чим важче розряджаються на електродах аніони і катіони.
Напруга розкладання електроліту Uрозкл - це найменша різниця між електродними потенціалами анода і катода, при якій починається перебіг електролізу:
- [TEX]U_{розкл} = \varepsilon_А - \varepsilon_К[/TEX]
Напруга розкладання за стандартних умов називається стандартною напругою розкладання: [TEX]U^0_{розкл} = \varepsilon^0_А - \varepsilon^0_К[/TEX].
Відхилення фактичного електродного потенціалу εі від рівноважного ε, яке виникає внаслідок перебігу електрохімічних процесів під дією зовнішнього електричного струму, називається поляризація η: [TEX]\eta= \varepsilon_і - \varepsilon[/TEX].
З урахуванням поляризації напруга розкладання електроліту, при якій реально починається виділення кінцевих продуктів електролізу, буде більшою, ніж теоретично обчислена: [TEX]U_{розкл} = (\varepsilon_А + \eta_А) - (\varepsilon_К - \eta_К)[/TEX].
На поляризацію впливають певні чинники: густина струму, природа і стан поверхні електрода, склад і концентрація електроліту, температура, швидкість перемішування тощо.
Залежно від того, вплив якого чинника відіграє найбільш помітну роль, розрізняють декілька видів поляризації:
1. Концентраційна поляризація зумовлюється різницею між концентрацією електроліту в об’ємі розчину і концентрацією безпосередньо поруч із електродом.
2. Хімічна поляризація виникає при зміненні поверхневого складу електрода внаслідок його реакції з середовищем чи з електролітом при проходженні електричного струму.
3. Газова поляризація спостерігається у тих випадках, коли внаслідок електрохімічних процесів виділяються газоподібні продукти.
4. Електрохімічна поляризація, яку частіше називають перенапруга, зумовлюється сповільненістю власно електрохімічних стадій електродного процесу - окиснення та відновлення. Тобто перенапруга пов’язана лише з повільною кінетикою електрохімічних реакцій і залежить від густини струму.
Перенапруга виділення більшості металів на катоді, як правило, невелика. При мінімальній густині струму вона коливається у межах 10-3-10-1В, а деякі метали (Au, Hg, Sn, Pb) виділяються із водних розчинів їх солей майже зовсім без перенапруги. Найбільш високих значень перенапруга досягає під час виділення водню і кисню.



