- 11.1 Початкові відомості про комплексні сполуки
- 11.2 Координаційна теорія
- 11.3 Класифікація
- 11.4 Номенклатура
- 11.5 Ізомерія комплексних сполук
- 11.6 Стійкість копслексних сполук
- 11.7 Хімічний зв’язок у комплексних сполуках
- 11.8 Утворення та руйнування комплексів
- 11.9 Приклади розв’язання типових задач
Ключові терміни:
[TEX]\pi{}[/TEX]-дативна взаємодія, π-комплекси, Іонізаційна ізомерія, Бідентантні ліганди, Заряд внутрішньої сфери, Комплексні сполуки, Координаційна ізомерія, Монодентантні ліганди, Полідентантні ліганди, Просторова (або геометрична) ізомерія, Сольватна ізомерія, аквакомплекси, аміакати, аніонгалогенати, аніонні комплексні сполуки, ацидокомплекси, бікомплексні сполуки, внутрішньоорбітальні (або низькоспінові) комплекси, внутрішня сфера комплексної сполуки, вторинна дисоціація, гідроксокомплекси, змішані комплекси, зовнішньоорбітальні (або високоспінові) комлекси, зовнішня сфера, карбоніли, катіонні комплексні сполуки, комплекс, комплексний йон, комплексні кислоти, комплексні неелектроліти, комплексні основи, комплексні солі, комплексоутворювач, константа нестійкості, константа стійкості, координаційна теорія, координаційна ємність ліганду, координаційне число, координаційні зв’язки, ліганди, моноядерні комплекси, нейтральні комплексні сполуки, первинна дисоціаціація, поліядерні комплекси, центральний атом
11.1 Початкові відомості про комплексні сполуки
Перші речовини, віднесені до комплексних сполук, застосовувалися берлінськими художниками як фарби – це турнбулева синь і берлінська блакить (рис.11.1).

Рисунок 11.1 – Комплексні сполуки: а) турнбулева синь [TEX]Fe_{3}[Fe(CN)_{6}]_{2}[/TEX];
б) берлінська блакить [TEX]Fe_{4}[Fe(CN)_{6}]_{3}[/TEX]
Спочатку турнбулеву синь одержали випадково (а потім і використовували для фарбування тканин) на заводах Турнбуля при дії на солі феруму(ІІ) червоної кров’яної солі (рис.11.2):
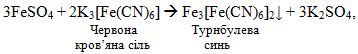
[TEX]3Fe^{2+}+2[Fe(CN)]^{3-}\rightarrow{Fe_{3}[Fe(CN)_{6}]_{2}\downarrow}[/TEX]
Берлінську блакить отримано теж випадково – берлінським майстром Дисбахом, який виготовляв фарби для художників на основі дуже отруйної жовтої кров’яної солі (рис.11.2):
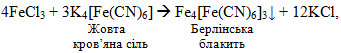
[TEX]4Fe^{3+}+3[Fe(CN)]^{4-}\rightarrow{Fe_{4}[Fe(CN)_{6}]_{3}\downarrow} [/TEX]

Рисунок 11.2 – Кристали кров’яної солі: а) червоної [TEX]К_{3}[Fe(CN)_{6}][/TEX]; б) жовтої [TEX]К_{4}[Fe(CN)_{6}][/TEX]
Ці речовини набули важливого значення в аналітичній хімії як якісні реагенти для розпізнавання та ідентифікації сполук, що містять катіони [TEX]Fe^{2+}[/TEX] і [TEX]Fe^{3+}[/TEX].
Пізніше були одержані та застосовані на практиці комплексні сполуки кобальту (ІІІ), які мають однаковий якісний склад, але відрізняються кількісним сполученням компонентів. Ці речовини стали основою кобальтових фарб, кожна з яких має характерне забарвлення:
| Склад комплексної сполуки |
Координаційна формула |
Забарвлення комплексної сполуки |
Вигляд комплексної сполуки |
|---|---|---|---|
| [TEX]CoCl_{3}\cdot{6NH_{3}}[/TEX] | [TEX][Co(NH_{3})_{6}]Cl_{3}[/TEX] | Оранжевий | |
| [TEX]CoCl_{3}\cdot{5NH_{3}}[/TEX] | [TEX][Co(NH_{3})_{5}Cl]Cl_{2}[/TEX] | Пурпуровий | |
| [TEX]CoCl_{3}\cdot{4NH_{3}}[/TEX] | [TEX][Co(NH_{3})_{4}Cl_{2}]Cl[/TEX] | Зелено-фіолетовий | |
| [TEX]CoCl_{3}\cdot{3NH_{3}}[/TEX] | [TEX][Co(NH_{3})_{3}Cl_{3}][/TEX] | Зелено-блакитний |
Комплексні сполуки входять до складу багатьох мінералів (наприклад, кріоліту [TEX]Na_{3}[AlF_{6}][/TEX]), на процесах комплексоутворення базується відділення золота від пустої породи (у вигляді комплексної солі [TEX]Na[Au(CN)_{2}][/TEX]), у фотосправі теж використовують комплексні сполуки [TEX](Na_{3}[Ag(S_{2}O_{3})_{2}])[/TEX]. Природні металоорганічні речовини гемоглобін і хлорофіл, без яких неможливо уявити життя на Землі, – також комплексні сполуки:
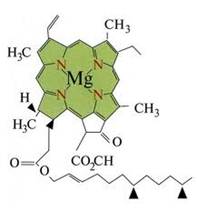 |
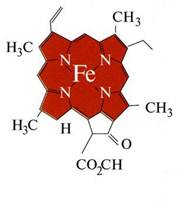 |
| Хлорофіл | Гемоглобін |
Отже, комплексні сполуки складають найбільш поширену і неоднорідну за складом і будовою групу хімічних речовин, що набули важливого значення у прикладній хімії, хімічній технології та майже в усіх без винятку галузях господарства.
Завдяки безлічі комплексних сполук та різноманітності притаманних для них властивостей, не вдається сформулювати однозначного остаточного визначення, що охоплювало б усі різновиди цього класу речовин. Однак інженер у практичній діяльності найчастіше має справу зі сполуками, для яких справедливою вважається така характеристика:
Між комплексними сполуками і деякими звичайними речовинами неможливо провести різких розмежувань. Наприклад, досі не існує однозначної думки щодо галунів (рис.11.3), які інколи відносять до кристалогідратів подвійних солей, а інколи – до комплексних сполук.
 |
 |
Рисунок 11.3 – Кристали галунів: а) хромово-калієвих [TEX]KCr(SO_{4})_{2}\cdot{12H_{2}O}[/TEX]; б) алюмо-калієвих [TEX]KAl(SO_{4})_{2}\cdot{12H_{2}O}[/TEX]
Більше того, одна й та ж сама речовина залежно від умов може поводити себе по-різному. Наприклад, у твердому стані сіль загального складу [TEX]Pb(CNS)_{2}\cdot{4KCNS}[/TEX] містить у вузлах кристалічної решітки складні йони [TEX][Pb(CNS)_{6}]^{4-}[/TEX], що не руйнуються і при його розчиненні в органічних розчинниках, в яких відбувається електролітична дисоціація:
[TEX]К_{4}[Pb(CNS)_{6}]\Leftrightarrow{4K^{+}+[Pb(CNS)_{6}]^{4-}}[/TEX].
Виходячи з цього, K4[Pb(CNS)6] слід було б віднести до комплексних сполук. Але одночасно у водних розчинах ця речовина дуже нестійка і швидко розпадається на більш прості йони, тобто поводить себе як подвійна сіль:
- [TEX]Pb(CNS)_{2}\cdot{4KCNS\Leftrightarrow{4K^{+}+Pb^{2+}+6CNS^{-}}}[/TEX]
11.2 Координаційна теорія
Наприкінці ХIХ ст. був накопичений величезний матеріал про властивості комплексних сполук, однак їх будова і склад неможливо пояснити з позицій класичної теорії валентності.
Засновник координаційної теорії А.Вернер (1893 р.) припустив, що на відміну від звичайних речовин у комплексних сполуках елементи виявляють, крім головної валентності, ще й додаткову, побічну. Завдяки дії сил саме побічної валентності відбувається процес комплексоутворення. Проте в побудованому комплексі відмінність між головною та побічною валентностями зникає, тому всі зв’язки стають рівноцінними, їх називають координаційні зв’язки.
Вернер підкреслив, що дія побічної валентності викликає зміцнення зв’язків між атомами. Наприклад, сполука PbCl4 є надзвичайно нестійкою, а комплексна сполука [TEX]K_{2}[PbCl_{6}][/TEX], що утворилась за рахунок побічної валентності плюмбуму (+2), – досить міцна. Отже, у комплексних сполуках спостерігається стабілізація як вищих, так і нижчих валентних форм елемента.
У сучасному вигляді координаційна теорія А.Вернера, яка постійно поглиблюється та доповнюється, містить декілька основних положень.
- У молекулі комплексної сполуки певний атом (чи йон), який за рахунок головної та побічної валентностей координує навколо себе певну кількість нейтральних молекул чи протилежно заряджених йонів, називається центральний атом, або комплексоутворювач (рис.11.4).
Найчастіше у ролі комплексоутворювача виступають позитивно заряджені йони (рідше – атоми) d- та р-металів, інколи – лужноземельних і навіть лужних металів, а також неметалів (В, Si, P, As). Наприклад, в комплексній сполуці К4[Fe(CN)6] комплексоутворювачем є йон феруму (ІІ), якій належить до d-металів, а у сполуці K[BF4] – атом неметалу бору.
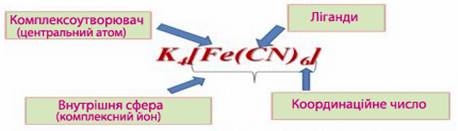
Рисунок 11.4 – Складові частини комплексної сполуки на прикладі [TEX]К_{4}[Fe(CN)_{6}][/TEX]
- З центральним атомом безпосередньо сполучаються молекули чи йони, які називаються координованими групами, адендами, або ліганди.
- Комплексоутворювач разом із лігандами складає головний фрагмент комлексной сполуки, який називають внутрішня сфера комплексної сполуки (рис.11.5).
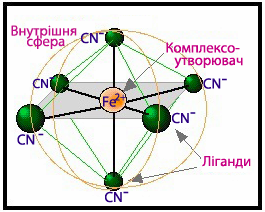
Рисунок 11.5 – Внутрішня сфера комплексної сполуки [TEX]К_{4}[Fe(CN)_{6}][/TEX]
Часто внутрішню сферу, яка має позитивний чи негативний заряд, називають комплексний йон, або просто комплекс, якщо заряд дорівнює нулю. Комплексний йон при написанні координаційної формули береться у квадратні дужки, щоб підкреслити монолітність внутрішньої сфери: [TEX]К_{4}[Fe(CN)_{6}][/TEX], [TEX]Na[BF_{4}][/TEX] .
Заряд внутрішньої сфери визначається алгебраїчною сумою ступеня окиснення комплексоутворювача і сумісних зарядів усіх лігандів, наприклад:
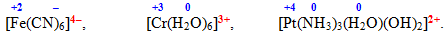
- Якщо ступінь окиснення комплексоутворювача за абсолютною величиною не дорівнює сумі зарядів усіх лігандів, то комплексна сполука містить – протиіон, або зовнішня сфера, яку записують поза квадратними дужками: [TEX][Ag(CN)_{2}]Cl[/TEX], [TEX]K[Ag(NH_{3})_{2}][/TEX]. Однак існують і нейтральні комплекси, позбавлені зовнішньої сфери, їх іноді називають комплексні неелектроліти:

-
Загальна кількість координаційних валентностей, за допомогою яких комплексоутворювач у внутрішній сфері сполучається із лігандами, називається координаційне число(к.ч.).
Відомі координаційні числа від 1 до 9 і 12. Найпоширенішими є комплексні сполуки з координаційними валентностями 2, 4 та 6. Досить часто к.ч. буває вдвічі більшим, ніж ступінь окиснення комплексоутворювача, наприклад:
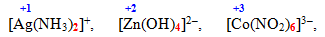
однак ця залежність не є суровою.
У загальному випадку к.ч. може мати змінну величину не тільки для різних комплексоутворювачів, але й для одного і того самого, тому що на кількість координованих лігандів впливають певні чинники:
-
Заряд ліганду. Наприклад, координаційне число нікелю (ІІ) з нейтральними лігандами дорівнює 6, а з негативно зарядженими аніонами CN–, між якими діють значні сили відштовхування, – тільки 4:

-
Розміри лігандів. Комплекси, що містять невеликі за радіусом ліганди, характеризуються більшими величинами координаційних чисел, наприклад, розмір негативно заряджених лігандів зростає у ряді:
[TEX]F^{-}{<}Cl^{-}{<}Br^{-} {<} I^{-}[/TEX],
тому координаційні числа одного комплексоутворювача з різними галогенід-іонами у якості лігандів різні:
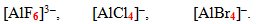
- Природа зовнішньої сфери. Наприклад, у комплексній сполуці [Cu(NH3)4]SO4 купрум (ІІ) має к.ч. 4, але якщо змінити йон SO42– на більш громіздку зовнішню сферу, то координаційне число може збільшитися: [Cu(NH3)6]3(PO4)2.
- Властивості розчинника, в якому утворюється комплексна сполука. Так, у полярному розчиннику – воді – найлегше виникають комплекси [TEX][Co(CNS)_{1}]^{+}[/TEX] i [TEX][Co(CNS)_{2}][/TEX], а у малополярному – ацетоні – при тих самих умовах – [TEX][Co(CNS)_{3}]^{-}[/TEX] i [TEX][Co(CNS)_{4}]^{2-}[/TEX].
- Концентрація реагуючих компонентів. При збільшенні концентрації помітно виявляється тенденція до утворення більш складніших комплексів. Наприклад, у розведених розчинах вдається ідентифікувати існування лише [TEX][Fe(CNS)_{1}]^{2+}[/TEX], у той час як із зростанням концентрацій реагуючих речовин утворюються складніші комплекси: від [TEX][Fe(CNS)_{3}][/TEX] аж до [TEX][Fe(CNS)_{6}]^{3-}[/TEX].
-
Заряд ліганду. Наприклад, координаційне число нікелю (ІІ) з нейтральними лігандами дорівнює 6, а з негативно зарядженими аніонами CN–, між якими діють значні сили відштовхування, – тільки 4:
- Різні ліганди можуть займати біля центрального атома різну кількість координаційних місць.
Кількість місць, що займає навколо комплексоутворювача окрема координована група, називається координаційна ємність ліганду.
Як правило, певний ліганд виявляє постійну координаційну ємність, але для багатозарядних лігандів вона може набувати змінних величин. Наприклад, у сполуці [TEX][Co(NH_{3})_{4}SO_{4}]Cl[/TEX] аніон [TEX]SO_{4}^{2-}[/TEX] займає два координаційних місця, а у [TEX][Co(NH_{3})_{4}(H_{2}O)SO_{4}]Cl[/TEX] – тільки одне, тому і координаційна ємність ліганду [TEX]SO_{4}^{2-}[/TEX] у цих сполуках дорівнює відповідно 2 і 1. З цієї причини один і той самий комплексоутворювач з різними лігандами за однакових умов дає комплекси різного вигляду, наприклад, для феруму (ІІІ):
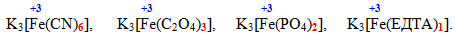
За координаційною ємністю розрізняють такі ліганди:
Етилендіамінтетраацетат (ЕДТА)
- Монодентантні ліганди, які займають одне координаційне місце, наприклад, аніони Cl–, CN–, Br–, F–, I– чи нейтральні молекули Н2О, NH3, CO.
- Бідентантні ліганди, які займають по два координаційних місця. До них належать деякі органічні сполуки: гідразин NH2–NH2, амінооцтова кислота NH2–CH2–COOH, етилендіамін NH2–CH2–CH2–NH2, а також йони [TEX]SO_{4}^{2-}[/TEX], [TEX]SO_{3}^{2-}[/TEX], [TEX]S_{2}O_{4}^{2-}[/TEX] та інші. Однак необхідно пам’ятати, що ці йони іноді можуть сполучатися з комплексоутворювачем лише одним координаційним зв’язком, як було показано на прикладі сполуки [TEX][Co(NH_{3})_{4}(H_{2}O)SO_{4}]Cl[/TEX].
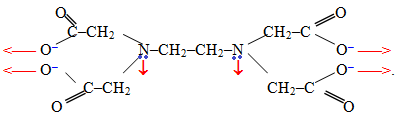
- Полідентантні ліганди, яким притаманна велика координаційна ємність (3–6). Одним із найважливіших полідентантних лігандів є аніон етилендіамінтетраоцтової кислоти (скорочено позначається ЕДТА), який має координаційну ємність 6. У структурній формулі ЕДТА стрілками показані атоми, за рахунок яких утворюється шість координаційних зв’язків з комплексоутворювачем:
11.3 Класифікація
Існує декілька класифікацій комплексних сполук. Залежно від ознаки, яку беруть до уваги, одну і ту саму комплексну сполуку можна віднести одночасно до різних видів.
Гліцинат-аніон [TEX]NH_{2}CH_{2}COO^{-}[/TEX] належить до категорії бідентатних лігандів, що утворюють два хімічних зв'язки з комплексоутворювачем – через атом оксигену карбоксильної групи (СООН) і через атом нітрогену аміногрупи (NH2). Внутрішня сфера гліцинатного комплексу містить два замкнутих п’ятичленних цикли, завдяки чому сполука має надзвичайну стійкість.
-
За належністю до певного класу неорганічних речовин комплексні сполуки поділяються на такі групи (табл.11.1):
- комплексні кислоти, зовнішньою сферою яких є катіони гідрогену Н+,
- комплексні основи, зовнішньою сферою яких є гідроксид-аніони ОН–,
- комплексні солі, зовнішньою сферою яких є катіон металу чи аніон кислотного залишку,
- комплексні неелектроліти, які не мають зовнішньої сфери.
Таблиця 11.1 – Класи комплексних сполук
Комплексні
кислотиКомплексні
основиКомплексні
соліКомплексні
неелектроліти[TEX]H[AuCl_{4}][/TEX] [TEX][Ag(NH_{3})_{2}]OH[/TEX] [TEX][Ni(NH_{3})_{6}](NO_{3})_{2}[/TEX] [TEX][Pt(NH_{3})_{2}Cl_{2}]^{0}[/TEX] [TEX]H_{2}[SiF_{6}][/TEX] [TEX][Cu(NH_{3})_{4}](OH)_{2}[/TEX] [TEX]Na_{3}[AlF_{6}][/TEX] [TEX][Ni(CO)_{4}]^{0}[/TEX] -
За знаком заряду внутрішньої сфери розрізняють такі комплексні сполуки:
- катіонні комплексні сполуки, які містять позитивно заряджену внутрішню сферу, наприклад: [TEX][Ag(NH_{3})_{2}]^{+}[/TEX], [TEX][Cr(H_{2}O)_{6}]^{3+}[/TEX];
- аніонні комплексні сполуки з негативно зарядженою внутрішньою сферою, наприклад: [TEX][Ag(CN)_{2}]^{-}[/TEX], [TEX][Cr(OH)_{6}]^{3-}[/TEX];
- нейтральні комплексні сполуки, які позбавлені зовнішньої сфери: [TEX][Ni(CO)_{4}]^{0}[/TEX], [TEX][Cr(H_{2}O)_{3}(OH)_{3}]^{0}[/TEX];
- бікомплексні сполуки, що складаються з двох комплексних йонів, наприклад: [TEX][Co(NH_{3})_{6}]\cdot{[Fe(CN)_{6}]}[/TEX]
-
Залежно від природи лігандів розрізняють:
Найвідомішим є фероцен – біс(циклопентадієніл) ферум(ІІ) складу [TEX][Fe(C_{5}H_{5})_{2}][/TEX]. За структурою комплекс нагадує сендвіч, в якому комплексоутворювач – Fe(II) знаходиться між двома циклопентадієнільними аніонами на однаковій відстані від всіх атомів карбону. У фероцені здійснюється донорно-акцепторний зв’язок за рахунок вакантних орбіталей sp3d2-гібридизованого атома феруму і шести р-електронних пар, які надаються атомами карбону двох циклопентадієнільних аніонів – по три р-електронні пари від кожного аніона. Отже, характерною ознакою π-комплексів є те, що в утворенні зв’язку між комплексоутворювачем і лігандами одночасно беруть участь р-електрони усього ліганду в цілому, а не окремого атома.

Фероцен
-
аквакомплекси – комплексні йони чи молекули, що як ліганди містять у внутрішній сфері молекули води, наприклад: [TEX][Cr(H_{2}O)_{6}]^{3+}[/TEX], [TEX][Cu(H_{2}O)_{4}]^{2+}[/TEX], [TEX][Be(H_{2}O)_{4}]^{2+}[/TEX], [TEX][Al(H_{2}O)_{6}]^{3+}[/TEX]. У водних розчинах майже всіх солей йони піддаються гідратації (оточуються полярними молекулами води) та існують у вигляді аквакомплексів. При кристалізації деяких гідратованих солей вода залишається сполученою з центральним атомом, внаслідок чого утворюються кристалогідрати, які теж належать до аквакомплексів (рис.11.6). Тому склад кристалогідратів правильніше записувати за допомогою координаційних формул:
- [TEX][Be(H_{2}O)_{4}]SO_{4}[/TEX] замість [TEX]BeSO_{4}\cdot{4H_{2}O}[/TEX],
- [TEX][K(H_{2}O)_{6}][Al(H_{2}O)_{6}](SO_{4})_{2}[/TEX] замість [TEX]KAl(SO_{4})_{2}\cdot{12H_{2}O}[/TEX],
- [TEX][Cr(H_{2}O)_{6}]Cl_{3}[/TEX] замість [TEX]CrCl_{3}\cdot{6H_{2}O}[/TEX].

Рисунок 11.6 – Комплексні кристалогідрати а) мідний купорос [TEX]CuSO_{4}\cdot{5H_{2}O}[/TEX]; б) залізний купорос [TEX]FeSO_{4}\cdot{7H_{2}O}[/TEX]; в) сіль Мора [TEX]FeSO_{4}\cdot{(NH_{4})_{2}SO_{4}}\cdot{6H_{2}O}[/TEX]
У деяких кристалогідратах частина молекул води входить до складу внутрішньої сфери, а решта міститься у зовнішній. Так, внутрішні сфери комплексних сполук [TEX]CuSO_{4}\cdot{5H_{2}O}[/TEX] і [TEX]NiSO_{4}\cdot{7H_{2}O}[/TEX] являють собою аквакомплексні йони – відповідно катіон тетрааквакупруму(II) [TEX][Cu(H_{2}O)_{4}]^{2+}[/TEX] і катіон гексаакванікелю(II) [TEX][Ni(H_{2}O)_{6}]^{2+}[/TEX]. Ще одна молекула води знаходиться у зовнішній сфері, вона сполучає катіони і аніони за допомогою водневих зв'язків (у структурних формулах водневі зв'язки показані пунктирними лініями):
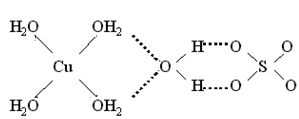
[TEX]CuSO_{4}\cdot{5H_{2}O}[/TEX], або [TEX][Cu(H_{2}O)_{4}]SO_{4}\cdot{H_{2}O}[/TEX] 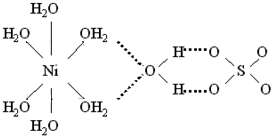
[TEX]NiSO_{4}\cdot{7H_{2}O}[/TEX], або [TEX][Ni(H_{2}O)_{6}]SO_{4}\cdot{H_{2}O}[/TEX] - аміакати, в яких лігандами є молекули амоніаку NH3, наприклад: [TEX][Cu(NH_{3})_{4}]^{2+}[/TEX], [TEX][Ag(NH_{3})_{2}]^{+}[/TEX];
- карбоніли, що мають за ліганди молекули карбон(ІІ) оксиду. Практично всі карбонільні комплекси належать до комплексних неелектролітів, оскільки роль комплексоутворювача в них відіграють атоми металів, що знаходяться у нульовому ступені окиснення, а лігандів – нейтральні молекули СО, наприклад [TEX][Fe(CO)_{5}][/TEX];
- гідроксокомплекси, до складу внутрішньої сфери яких входять гідроксильні йони [TEX]ОН^{-}[/TEX] наприклад: [TEX][Zn(OH)_{4}]^{2-}[/TEX], [TEX][Al(OH)_{6}]^{3-}[/TEX];
- ацидокомплекси, в яких лігандами є аніони різних кислот, у тому числі оксалатні [TEX](С_{2}О_{4}^{2-})[/TEX], галогенідні [TEX](F^{-}, Cl^{-}, Br^{-}, I^{-})[/TEX], ціанідні [TEX](CN^{-})[/TEX], сульфатні [TEX](SO_{4}^{2-})[/TEX], тіосульфатні [TEX](S_{2}O_{3}^{2-})[/TEX], нітратні [TEX](NO_{3}^{-})[/TEX], нітритні [TEX](NO_{2}^{-})[/TEX] тощо;
-
аніонгалогенати – комплекси, в яких і комплексоутворювач, і ліганди є атомами галогенів. Як ліганди атоми галогенів мають ступінь окиснення –1, а як комплексоутворювачі – можуть перебувати у додатному, від’ємному чи нульовому ступеню окиснення, наприклад:
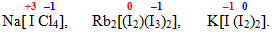
- змішані комплекси, у внутрішній сфері яких містяться ліганди різної природи, наприклад: [TEX]\left[Co(NH_{3})_{4}Cl_{2}\right][/TEX];
- π-комплекси, в яких лігандами є ненасичені органічні сполуки типу етилену, циклопентадієну, бензену.
-
аквакомплекси – комплексні йони чи молекули, що як ліганди містять у внутрішній сфері молекули води, наприклад: [TEX][Cr(H_{2}O)_{6}]^{3+}[/TEX], [TEX][Cu(H_{2}O)_{4}]^{2+}[/TEX], [TEX][Be(H_{2}O)_{4}]^{2+}[/TEX], [TEX][Al(H_{2}O)_{6}]^{3+}[/TEX]. У водних розчинах майже всіх солей йони піддаються гідратації (оточуються полярними молекулами води) та існують у вигляді аквакомплексів. При кристалізації деяких гідратованих солей вода залишається сполученою з центральним атомом, внаслідок чого утворюються кристалогідрати, які теж належать до аквакомплексів (рис.11.6). Тому склад кристалогідратів правильніше записувати за допомогою координаційних формул:
-
За кількістю ядер комплекси бувають:
- моноядерні комплекси, в яких міститься тільки один комплексоутворювач: [TEX][Ag(NH_{3})_{2}]^{+}[/TEX], [TEX][Fe(CN)_{6}]^{4-}[/TEX];
-
поліядерні комплекси, в яких є два чи більше комплексоутворювачів. Поліядерні комплекси у свою чергу поділяються на такі групи:
- кластери, в яких центральні атоми-ядра сполучені між собою безпосередньо: [TEX][(CO)_{5}Mn-Mn(CO)_{5}][/TEX];
- місткові, в яких ядра сполучаються через місткові групи – частинки з неподіленими електронними парами: F–, Cl–, O2–, S2–, SO42–, NH2–, NH2– та інші. Прикладом двоядерного комплексу може бути сполука [TEX][(NH_{3})_{5}Cr-OH-Cr(NH_{3})_{5}]Cl_{5}[/TEX], в якій два комплексоутворювачі [TEX](Cr^{3+})[/TEX] сполучаються через місткову зв’язувальну групу ОН. Поліядерні комплекси, в яких містки утворені гідроксильними групами, називаються оловими. За структурою місткова гідроксильна група відрізняється від лігандного гідроксилу в одноядерних комплексах. В олових комплексах координаційне число оксигену в ОН–групі дорівнює 3, оскільки атом О одночасно зв’язаний з двома комплексоутворювачами і одним атомом гідрогену;
-
ізо- і гетерокислоти – поліядерні комплекси, що можуть містити декілька місткових груп. В ізополікислотах ядра утворені атомами одного елемента, а в гетерокислотах містковий атом оксигену сполучає ядра, утворені атомами різних елементів, наприклад:
[TEX]H_{2}[O_{3}Cr-O-CrO_{3}][/TEX] – дихроматна кислота;
[TEX]H_{2}[-O-SiO_{2}-...-SiO_{2}-O-][/TEX] – поліметасилікатна кислота;
[TEX]H_{3}[O_{3}P-O-MoO_{3}][/TEX] – фосфорномолібдатна кислота.
Схильність до утворення полікислот виявляють деякі неметали (В, Р, As, Si) , а також d-метали V i VI груп періодичної системи.
- За відсутністю або наявністю замкнутих структур комплексні сполуки поділяють на прості та циклічні. У простих комплексах ліганди займають одне координаційне місце, а полідентантні ліганди, сполучені декількома зв’язками з одним і тим самим комплексоутворювачем, дають циклічні комплекси, або хелати, внутрішня сфера яких складається з замкнутих груп, сполучених з комплексоутворювачем. До хелатів належить вже розглянутий полідентантний комплекс ЕДТА. Іншими прикладами хелатів можуть бути оксалатний комплекс феруму(ІІІ) [TEX][Fe(C_{2}O_{4})_{3}]^{3-}[/TEX] чи комплекс купруму(ІІ) з гліцинат-аніоном (кислотним залишком амінооцтової кислоти [TEX]NH_{2}CH_{2}COOH)[/TEX]:
- Важливе значення в аналітичній хімії має ще один хелатний комплекс – так званий біс(диметилгліоксимато)нікель (II), в якому лігандами є аніони диметилгліоксимату:
В хелатному комплексі біс(диметилгліоксимато)нікель (II) завдяки наявності внутрішньомолекулярних водневих зв'язків між лігандами (на структурній формулі показані пунктиром) утворюються два додаткові цикли, що помітно стабілізує комплекс.
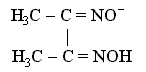
Диметилгліоксимат-аніон (ліганд)
Біс(диметилгліоксимато)нікель (II) – малорозчинна комплексна сполука яскраво-червоного кольору утворюється при проведенні реакції Чугаєва (рис.11.7) – якісної реакції на катіони [TEX]Ni^{2+}[/TEX] при взаємодії солей нікелю (ІІ) з диметилгліоксимом.

Біс (диметилгліоксимато) нікель (II) 
Рисунок 11.7 – Реакція Чугаєва: а) розчин вихідної солі, що містить катіони [TEX]Ni^{2+}[/TEX]; б) додавання якісного реагенту диметилгліоксиму; в) осад біс(диметилгліоксимато)нікелю (II)
11.4 Номенклатура
Згідно з Міжнародною номенклатурою IUPAC назви комплексних сполук утворюються відповідно до певних правил. Згідно з сучасною українською хімічною орфографією в назвах складних сполук спочатку подається назва катіона, а потім – аніона.
-
Порядок переліку йонів. У назві аніонної комплексної сполуки після назви катіона у називному відмінку окремим словом подається перелік лігандів і зазначається корінь латинської назви комплексоутворювача з додаванням закінчення -ат та його ступеня окиснення (римською цифрою у дужках), наприклад:

При називанні катіонної комплексної сполуки спочатку окремим словом перелічують ліганди, додаючи назву комплексоутворювача у називному відмінку та його ступінь окиснення, далі окремо наводять назву аніона, наприклад:

У назві нейтрального комплексу, яка записується одним словом, після переліку лігандів подають назву комплексоутворювача у називному відмінку та його ступінь окиснення:

-
Перелік лігандів та їх назви. Назви аніонних лігандів утворюються додаванням до назв аніонів закінчення «-о». Якщо назва аніона закінчується на «-ід», «-ид», «-ат», «-іт», «-ит», то після додавання закінчення «-о» утворюється відповідно «-ідо», «-идо», «-ато», «-іто», «-ито». Назви лігандів перелічують в алфавітному порядку, назва ліганда є єдиним цілим.
Нейтральні ліганди називають так: аква H2O, амін NH3, карбоніл CO, нітро NO2. Щодо катіонних лігандів, то для них застосовують такі назви: N2H5+ – гідразиній, NO2+ – нітроїлій, NO+ – нітрозилій, H+ – гідридо.
У прикладах, що наводяться нижче, аніонні ліганди виділені синім курсивом, а нейтральні – зеленим:

-
Префікси для позначення кількості лігандів. Для лігандів з простою назвою використовують префікси, що походять від грецьких числівників: ди-, три-, тетра-, пента-, гекса- тощо. Наприклад:

Якщо ліганд має складну назву, яка вже містить такі числівники, то використовують додаткові префікси біс, трис, тетрис. Наприклад:
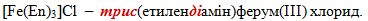
-
Назви місткових груп. Групи, що з’єднують два центри координації, позначають грецькою буквою μ (мю):
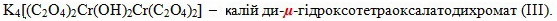
-
Геометричні ізомери. Цю групу комплексних сполук називають, використовуючи цифри або додаючи префікс цис (у випадку сусідніх положень однакових лігандів) чи транс, якщо однакові ліганди розміщуються з протилежних боків відносно комплексоутворювача:
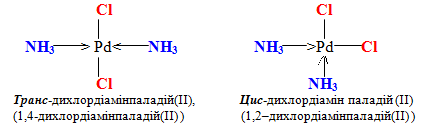
11.5 Ізомерія комплексних сполук
У хімії комплексних сполук поширене явище ізомерії, при якому речовини одного складу мають різну молекулярну будову і різні властивості. Розрізняють декілька видів ізомерії.
-
Просторова (або геометрична) ізомерія, що спостерігається лише у тому випадку, коли комплексний йон містить неоднорідні ліганди, які можуть займати різні положення навколо комплексоутворювача. У цис-ізомерах однакові ліганди розміщуються один біля одного, а в транс-ізомерах – один напроти одного.
Цис-транс-ізомерія характерна для октаедричних та квадратних комплексів (рис.11.8 і рис.11.9). Кількість ізомерів, що розрізняються розміщенням лігандів, залежить від будови комплексу і кількості неоднакових лігандів. Наприклад, існує два просторових ізомери [PtCl2(NH3)2] з різними властивостями: цис-ізомер утворює оранжові кристали, достатньо розчинні у воді, а транс-ізомер – жовті малорозчинні кристали. Крім того вони відрізняються і способами добування і деякими іншими властивостями.
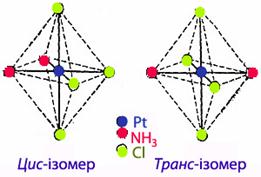
Рисунок 11.8 – Геометричні ізомери комплекса [TEX][PtCl_{4}(NH_{3})_{2}][/TEX], що має октаедричну будову
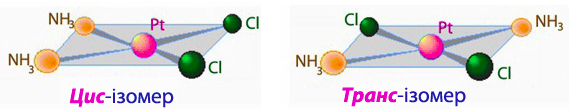
Рисунок 11.9 – Геометричні ізомери комплексу [TEX][PtCl_{2}(NH_{3})_{2}][/TEX], що має квадратну будову
Одночасно слід розуміти, що цис-транс-ізомерія неможлива для тетраедричних структур, а також для сполук з координаційними числами 2 і 3, оскільки в таких випадках при будь-якому просторовому розміщенні двох однакових лігандів навколо комплексоутворювача вони завжди будуть займати сусідні положення (рис.11.10).
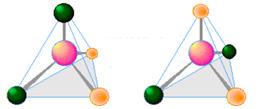
Рисунок 11.10 – Тетраедрична будова комплексів
-
Сольватна ізомерія зумовлюється неоднаковим розподілом молекул розчинника між внутрішньою і зовнішньою сферами комплексної сполуки. Якщо розчинником є вода, сольватну ізомерію називають гідратною. Наприклад, комплексна сполука загального складу [TEX]CrCl_{3}\cdot{6H_{2}O}[/TEX] має такі ізомери:
[TEX][Cr(H_{2}O)_{6}]Cl_{3}[/TEX] [TEX][Cr(H_{2}O)_{5}Cl]Cl_{2}\cdot{H_{2}O}[/TEX] [TEX][Cr(H_{2}O)_{4}Cl_{2}]Cl\cdot{2H_{2}O}[/TEX] Фіолетовий Блідо-зелений Темно-зелений Оскільки ці комплекси відрізняються за структурою, їм притаманні різні властивості: спектри поглинання, забарвлення кристалів, кількість хлору, що осаджується із їх розчинів.
-
Іонізаційна ізомерія зумовлюється різним розподілом аніонів між внутрішньою та зовнішньою сферами. Так, комплексна сполука загального складу [TEX]CoBrSO_{4}\cdot{5NH_{3}}[/TEX] має два іонізаційних ізомери: [TEX][Co(NH_{3})_{5}Br]SO_{4}[/TEX] червоно-фіолетового кольору і [TEX][Co(NH_{3})_{5}SO_{4}]Br[/TEX] червоного кольору. Для обох сполук координаційні ємності лігандів Br– i SO42– однакові і дорівнюють 1. Обидва ізомери розрізняються за своїми властивостями, наприклад:
[TEX][Co(NH_{3})_{5}Br]SO_{4}+BaCl_{2}\rightarrow{BaSO_{4}\downarrow{}}+[Co(NH_{3})_{5}Br]Cl_{2},[/TEX] [TEX][Co(NH_{3})_{5}Br]SO_{4}+2AgNO_{3}\rightarrow{Ag_{2}SO_{4}\downarrow{}}+[Co(NH_{3})_{5}Br](NO_{3})_{2},[/TEX] [TEX][Co(NH_{3})_{5}SO_{4}]Br+BaCl_{2}\nrightarrow{},[/TEX] [TEX][Co(NH_{3})_{5}SO_{4}]Br+AgNO_{3}\rightarrow{AgBr\downarrow{+}[Co(NH_{3})_{5}SO_{4}]NO_{3}}.[/TEX] -
Координаційна ізомерія, яка виявляється тільки у багатоядерних комплексах, коли різні комплексоутворювачі обмінюються своїми лігандами без зміни загального складу:

11.6 Стійкість копслексних сполук
Розчинні аніонні та катіонні комплексні сполуки у розведених водних розчинах найчастіше поводять себе як сильні електроліти і піддаються електролітичній дисоціації, при якій внутрішня та зовнішня сфери існують у вигляді самостійних йонів. Такий процес називається первинна дисоціаціація, яка у більшості випадків проходить повністю. При цьому комплексний йон, що утворюється, поводить себе як єдине ціле. Наприклад:
- [TEX]{[Ag(NH_{3})_{2}]Cl\rightarrow{[Ag(NH_{3})_{2}]^{+}+Cl^{-}}},[/TEX]
- [TEX]K[Ag(CN)_{2}]\rightarrow{K^{+}+[Ag(CN)_{2}]^{-}}.[/TEX]
Поряд з первинною дисоціацією дуже незначною мірою відбувається вторинна дисоціація – розклад внутрішньої сфери комплексу на складові частинки:
- [TEX][Ag(NH_{3})_{2}]^{+}\Leftrightarrow{Ag^{+}+2NH_{3}},[/TEX]
- [TEX][Ag(CN)_{2}]^{-}\Leftrightarrow{Ag^{+}}+2CN^{-}.[/TEX]
Оскільки комплексний йон виявляє себе як надзвичайно слабкий електроліт, вторинна дисоціація підлягає закону діючих мас. Тому можна записати вираз константи рівноваги, яка для комплексних йонів називається константа нестійкості:
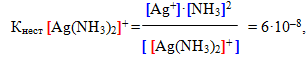
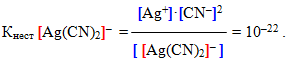
У виразі констант нестійкості одні квадратні дужки (які для наочності відмічені синім) позначають молярну концентрацію частинки, а інші (червоні) – комплексний йон.
Константа нестійкості є мірою міцності внутрішньої сфери: чим менша величина Кнест, тим міцніший комплекс. Отже, з двох наведених вище прикладів більшу стійкість виявляє другий комплекс [TEX]([Ag(CN)_{2}]^{-})[/TEX], тому що саме йому відповідає менше значення константи нестійкості.
Іноді замість константи нестійкості використовують обернену їй величину – константа стійкості:
- [TEX]K_{ст}=\frac{1}{K_{нест}}=\frac{[[Ag(NH_{3})^{2}]^{+}]}{[Ag^{+}]\cdot{[NH_{3}]^{2}}}=1,7\cdot{10^{7}}[/TEX]
- [TEX]K_{ст}=\frac{1}{K_{нест}}=\frac{[[Ag(CN_{2})]^{-}]}{[Ag^{+}]\cdot{[(CN)^{-}}]^{2}}=10^{22}[/TEX]
Більшому значенню константи стійкості відповідає більша концентрація комплексоутворювача у розчині під час стану рівноваги.
Детальніше вивчення комплексних сполук довело, що цей процес відбувається ступінчасто. Наприклад, від комплексного йона [Ag(NH3)2]+ відщеплюється спочатку одна молекула амоніаку:
- [TEX][Ag(NH_{3})_{2}]^{+}\leftrightarrow {[Ag(NH3)]^{+}+NH_{3}}.[/TEX]
Рівновага першого ступеня характеризується константою нестійкості:
- [TEX]K_{нестI}=\frac{[[Ag(NH_{3})]^{+}][NH_{3}]}{[[Ag(NH_{3})_{2}]^{+}]}=6\cdot{10^{-4}}.[/TEX]
Потім відривається друга молекула амоніаку:
- [TEX][Ag(NH_{3})]^{+}\Leftrightarrow{Ag^{+}+NH_{3}},[/TEX]
чому відповідає константа нестійкості другого ступеня:
- [TEX]K_{нестII}=\frac{[Ag]^{+}]\cdot{[NH_{3}]}}{[[Ag(NH_{3})]^{+}]}=1\cdot{10^{-4}}.[/TEX]
Добуток констант нестійкості за першим та другим ступенями дає загальну константу нестійкості комплексу в цілому:
- [TEX]K_{нест}=K_{нестI}\cdot{K_{нестII}}=6\cdot{10^{-4}}\cdot{1}\cdot{10^{-4}}=6\cdot{10^{-8}}.[/TEX]
Деякі комплексні сполуки мають дуже нестійку внутрішню сферу і досить великі значення констант нестійкості [TEX](K_{нест}>10^{-1})[/TEX]. До таких сполук, у першу чергу, належать подвійні солі, які у твердому стані та у висококонцентрованих розчинах мають координаційну структуру, а у розведених розчинах значною мірою розпадаються на йони, наприклад:
- [TEX]K_{2}[CuCl_{4}]\leftrightarrow{2K^{+}+Cu^{2+}+4Cl^{-}}[/TEX]
Величини констант нестійкості комплексів наводяться у спеціальних довідниках.
11.7 Хімічний зв’язок у комплексних сполуках
Для пояснення природи хімічного зв’язку в комплексних сполуках існує декілька сучасних теорій, які не містять протилежних тверджень, однак доповнюють одна одну, трактуючи одні й ті самі питання з різних точок зору. Всі вони, як правило, приводять до ідентичних результатів.
-
Електростатична модель Косселя і Магнуса, яка розглядає хімічний зв’язок у комплексних сполуках, виходячи із закону Кулона. При цьому припускається, що всі частинки у комплексному йоні є недеформованими кульками з певними зарядами і радіусами. Стійкий комплекс утворюється, коли сили притягання лігандів до комплексоутворювача зрівноважують сили відштовхування між лігандами. При збільшенні кількості лігандів сили відштовхування між ними починають переважати, і комплекс втрачає свою стійкість.
Електростатична теорія дозволяє оцінити стійкість комплексів та передбачити координаційні числа комплексоутворювачів і просторове розміщення лігандів. На основі кулонівської взаємодії заряджених частинок з урахуванням принципу найменшої енергії системи вдалося обчислити оптимальні значення координаційних чисел: вони дорівнюють 1 або 2, якщо ступінь окиснення центрального атома складає +1; 2 або 4, якщо ступінь окиснення +2; 4, 5 або 6 при ступені окиснення +3. Крім того, було показано, що просторова будова комплексу залежить від величини координаційного числа.
Відповідно до закону Кулона міцність комплексу зростає із збільшенням заряду комплексоутворювача і зменшенням радіусів лігандів. Наприклад, для галогенідних комплексів алюмінію (+3) стійкість зменшується у напрямку від [AlF4]– до [AlI4]–, оскільки у цьому ряді закономірно збільшується радіус лігандів (F–<Cl–<Br–<I–).
Встановлено, що стійкість комплексів з однаковими лігандами тим більша, чим вищий ступінь окиснення виявляє комплексоутворювач, як це випливає із порівняння констант нестійкості аміакатів купруму (+1) і купруму (+2) та ціанідних комплексів феруму (+2) і феруму (+3):
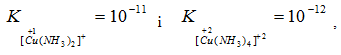
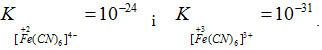
Електростатична модель обґрунтувала значення координаційних чисел залежно від природи лігандів. Оскільки сили відштовхування між однойменно зарядженими йонами більші, ніж між нейтральними лігандами, координаційне число у комплексі з нейтральними лігандами завжди вище, ніж у комплексі з аніонними лігандами, наприклад:
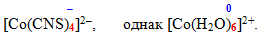
Незважаючи на простоту і наочність, електростатична теорія має певні недоліки і не може пояснити деякі факти: існування комплексів з комплексоутворювачем у нульовому ступені окиснення та нейтральними лігандами, наприклад, [Fe0(CO)50], [Ca0(NH3)60] та ін., більшу стійкість комплексів 4d- i 5d-металів порівняно з комплексами 3d-металів, магнітні та оптичні властивості комплексних сполук тощо.
-
Метод валентних зв’язків, запропонований Полінгом і Слейтером (1934р.), у застосуванні до комплексних сполук базується на декількох основних положеннях.
- Між комплексоутворювачем і лігандом у комплексі виникає донорно-акцепторний зв’язок, на утворення якого ліганди (донори) надають свої неподілені електронні пари (рис.11.11), а комплексоутворювач (акцептор) – вакантні орбіталі.
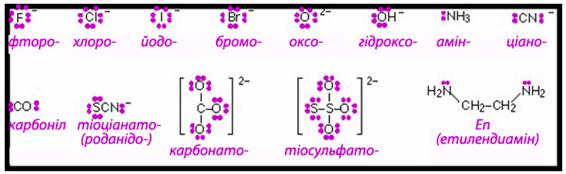
Рисунок 11.11 – Схематичне зображення неподілених електронних пар у деяких лігандах
Міцність зв’язків залежить від величини області перекривання орбіталей: чим вона більша, тим стійкіший комплекс. Наприклад, при утворенні донорно-акцепторного зв’язку в катіоні NH4+ sp3-гібридизований атом нітрогену (1s22s22p3), який витрачає три одноелектронні орбіталі на сполучення з трьома атомами гідрогену за обмінним механізмом, для утворення четвертого зв’язку надає свою двохелектронну орбіталь (неподілену електронну пару), а йон Н+ – вакантну орбіталь. Подібно побудований і комплекс [BF4]–, в якому донором електронної пари є аніон F–, а акцептором – атом бору з молекули BF3 (за рахунок вільної орбіталі на зовнішньому шарі).
- Атомні орбіталі комплексоутворювача, що беруть участь в утворенні зв’язків, піддаються гібридизації, тип якої зумовлюється кількістю, природою та електронною структурою лігандів і яка, в свою чергу, зумовлює геометричну будову комплексу.
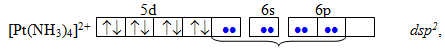
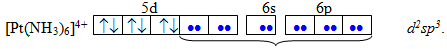
Якщо в утворенні донорно-акцепторного зв’язку беруть участь sp-гібридизовані орбіталі, то комплекс має лінійну будову, якщо sp3-гібридизовані – тетраедричну, якщо dsp2 – квадратну, якщо dsp3 – тригональну біпіраміду, якщо d2sp3 – октаедричну. Наприклад, катіони Pt2+ i Pt4+ у комплексах [Pt(NH3)4]2+ і [Pt(NH3)6]4+ оточені різною кількістю лігандів і зазнають різної гібридизації, тому і мають різну геометричну будову: квадратну за рахунок dsp2-гібридизації в [Pt(NH3)4]2+ і октаедричну за рахунок d2sp3-гібридизації в [Pt(NH3)6]4+. На схемі електронні пари комплексоутворювачів показані стрілками, а електронні пари лігандів – крапками:
- Додаткове зміцнення комплексу забезпечується виникненням поряд із [TEX]\sigma{}[/TEX]-зв’язками і [TEX]\pi{}[/TEX]-зв’язків. Це спостерігається, якщо зайнята електронами орбіталь комплексоутворювача перекривається з вакантною орбіталлю лігандів – так звана [TEX]\pi{}[/TEX]-дативна взаємодія. Перерозподіл електронної густини внаслідок [TEX]\sigma{}[/TEX]- і [TEX]\pi{}[/TEX]-перекривання має протилежні напрямки: при [TEX]\sigma{}[/TEX]-зв’язку електронна густина переноситься на комплексоутворювач, а при [TEX]\pi{}[/TEX]-зв’язку – на ліганди.
- Міцність і властивості комплексів значною мірою залежать від ступеня перекривання орбіталей комплексоутворювача і лігандів. Зокрема, при утворенні октаедричних комплексів гібридизація може здійснюватися або з використанням зовнішніх d-орбіталей, або внутрішніх d-орбіталей. У першому випадку комплекси типу sp3d2 називають зовнішньоорбітальні (або високоспінові) комлекси, а комплекси типу d2sp3 – внутрішньоорбітальні (або низькоспінові) комплекси. У високоспінових комплексах зв’язки утворюються більш віддаленими і менш щільними орбіталями, тому зв’язок комплексоутворювача з лігандами слабкіший, ніж при внутрішньоорбітальній гібридизації. Наприклад, у комплексі [Co(NH3)6]3+] катіон Со3+ зазнає внутрішньоорбітальної гібридизації, а у комплексі [CoF6]3– – зовнішньоорбітальної. З цієї причини [CoF6]3– більш реакційноздатний, у ньому легко проходить заміщення F– на інші ліганди.
- Магнітні властивості комплексу пояснюються характером забудови орбіталей комплексоутворювача. За наявності неспарених електронів комплекс виявляє парамагнітні властивості, а якщо всі електрони спарені, то комплекс діамагнітний.
- Між комплексоутворювачем і лігандом у комплексі виникає донорно-акцепторний зв’язок, на утворення якого ліганди (донори) надають свої неподілені електронні пари (рис.11.11), а комплексоутворювач (акцептор) – вакантні орбіталі.
Розглянемо за допомогою методу валентних зв'язків (ВЗ) електронну структуру комплексів, утворених деякими йонами 3d-металів з такими електронними конфігураціями:

При утворенні комплексу розподіл електронів на 3d-орбіталях може змінюватися чи залишатися таким самим, як і в ізольованому катіоні, як це бачимо з порівняння розглянутих структур з тими, що наведені в табл. 11.2, в якій стрілками показані електрони комплексоутворювача, а точками – ті, що надають ліганди за рахунок своїх неподілених електронних пар (рис.11.11). Деякі з комплексоутворювачів зберегли свою електронну структуру, тоді як в інших відбувалося спарювання електронів. Звільнені при цьому орбіталі піддаються гібридизації та беруть участь в утворенні [TEX]\sigma{}[/TEX]-зв’язків з лігандами за донорно-акцепторним механізмом.
Виходячи з забудови гібридизованих орбіталей комплексоутворювача (табл.11.2), можна прогнозувати магнітні властивості комплексних сполук, що містять ці комплексні йони. Наприклад, у комплексах [Fe(CN)6]3–, [FeF6]4–, і [CoF6]3– наявні неспарені електрони, тому сполуки з такими комплексними йонами виявлятимуть парамагнітні властивості. І навпаки, сполуки, до складу яких входять комплексні йони [Fe(CN)6]4–, [Cu(NH3)2]+ чи [Co(NH3)6]3+ – діамагнітні.
Таблиця 11.2 – Приклади будови деяких комплексів за методом ВЗ
Комплекс Забудова орбіталей комплексоутворювача Тип гібридизації орбіталей Геометрична структура комплексу [TEX][Cu(NH_{3})_{2}]^{+}[/TEX] 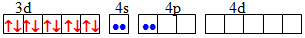
sp Лінійна [TEX][Zn(NH_{3})_{4}]^{2+}[/TEX] 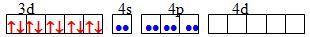
sp3 Тетраедрична [TEX][Ni(CN)_{4}]^{2-}[/TEX] 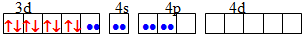
dsp2 Квадратна [TEX][NiCl_{4}]^{2-}[/TEX] 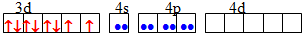
sp3 Тетраедрична [TEX][Co(NH_{3})_{6}]^{3+}[/TEX] 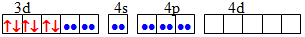
d2sp3 Октаедрична [TEX][CoF_{6}]^{3-}[/TEX] 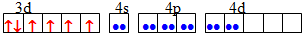
sp3d2 Октаедрична [TEX][Fe(CN)_{6}]^{4-}[/TEX] 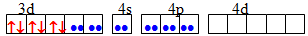
d2sp3 Октаедрична [TEX][FeF_{6}]^{4-}[/TEX] 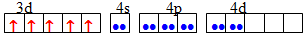
sp3d2 Октаедрична [TEX][Fe(CN)_{6}]^{3-}[/TEX] 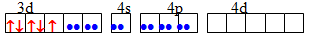
d2sp3 Октаедрична Метод ВЗ дає можливість зрозуміти будову комплексів з нейтральними лігандами. Наприклад, у карбонілах роль комплексоутворювачів відіграють атоми перехідних металів у нульовому ступені окиснення, а лігандів – нейтральні молекули карбон (ІІ) оксиду.
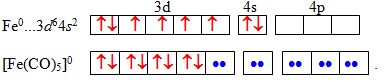
Значення координаційного числа визначають за правилом Сіджвика, відповідно до якого при утворенні карбонільних комплексів навколо комплексоутворювача створюється стійка вісімнадцятиелектронна конфігурація, що складається з s-, p- і d-електронів центрального атома і лігандів. Наприклад, атом феруму (0), електронна структура якого описується формулою [Ar]3d64s2, має вісім валентних електронів. До вісімнадцятиелектронної конфігурації не вистачає (18–8)=10 електронів, тобто п'яти електронних пар. Ці електронні пари центральний атом Fe0 одержує від п'яти молекул СО, кожна з яких є донором електронної пари. Звідси отримуємо формулу пентакарбонілферуму (0): [Fe(CO)5].
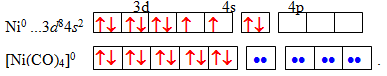
Подібним чином для атома нікелю (0) з конфігурацією [Ar]3d84s2 до стійкої вісімнадцятиелектронної структури не вистачає (18–10)=8 електронів, тоді кількість лігандів СО становить 8/2=4, а формула комплекса [TEX][Ni(CO)_{4}][/TEX] – тетракарбонілнікель (0):
Складніше пояснюється карбонільний комплекс кобальту (0). Центральному атому Co0 з електронною конфігурацією [Ar]3d74s2 до стійкої структури не вистачає (18–9)=9 електронів. Тоді кількість очікуваних карбонільних лігандів не дорівнює цілому числу (9/2=4,5). Оскільки кожний ліганд СО може надавати атому кобальту тільки одну електронну пару, то спочатку утворюється нестійкий комплексний радикал [•Co(CO)4], який містить сімнадцять електронів, у тому числі один неспарений у атома •Со0 (у формулі неспарений електрон відмічений точкою). У таких випадках утворення вісімнадцятиелектронної конфігурації відбувається шляхом димеризації – сполучення двох радикалів зв’язком метал-метал і утворенням кластерного комплексу складу [TEX][Co_{2}(CO)_{8}][/TEX].
Отже, якщо атом металу містить непарну кількість електронів, то виникає кластер – комплексна сполука з двома комплексоутворювачами, між якими існує безпосередній зв’язок метал–метал. Наприклад, карбоніл мангану [TEX][Mn_{2}(CO)_{10}][/TEX], що належить до кластерів:
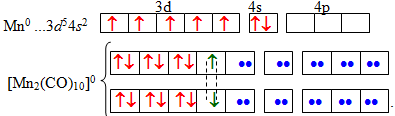
Як видно з розглянутих електронно-графічних схем, практично всі карбонільні комплекси є діамагнітними речовинами, оскільки містять виключно спарені електрони.
Метод ВЗ має деякі недоліки:
- Не розглядає комплексні сполуки з багатоцентровими зв’язками.
- Не може передбачити оптичні властивості комплексних сполук, оскільки не враховує збуджений стан комплексоутворювача.
- Не може пояснити, чому комплекси деяких металів, що побудовані у формі квадрата, мають достатню міцність і не переходять у більш симетричні тетраедричні комплекси.
11.8 Утворення та руйнування комплексів
Питання щодо утворення та руйнування комплексних сполук зручніше розглядати окремо для комплексів, різних за природою лігандів типів.
-
Аквакомплекси, роль лігандів у яких відіграють молекули води. Вже відмічалося, що у водних розчинах майже всіх солей їх йони знаходяться у формі аквакомплексів.
Утворюються аквакомплекси при розчиненні твердих солей, наприклад:
- [TEX]NiCl_{2(тв)}+6H_{2}O\rightarrow{[Ni(H_{2}O)_{6}]Cl_{2(р-н)},}[/TEX]
або внаслідок будь-якої реакції у водному розчині, продуктом якої є сіль, наприклад:
- [TEX]Ni(OH)_{2}+2HCl+4H_{2}O\rightarrow{[Ni(H_{2}O)_{6}]Cl_{2}}[/TEX]
Аквокомплекси не є стійкими, вони досить легко руйнуються при додаванні розчинів таких сполук, йони яких утворюють з центральним атомом комплексу нерозчинний осад, наприклад:
- [TEX]3[Са(H_{2}O)_{6}]Cl_{2}+2Na_{3}PO_{4}\rightarrow{Ca_{3}(PO_{4})_{2}\downarrow{+}6NaCl+18H_{2}O,}[/TEX]
- [TEX]3[Са(H_{2}O)_{6}]^{2+}+2PO_{4}^{3-}\rightarrow{Ca_{3}(PO_{4})_{2}\downarrow{+}18H_{2}O;}[/TEX]
- [TEX][Сu(H_{2}O)_{4}]SO_{4}+2NaOH\rightarrow{Cu(OH)_{2}\downarrow{+}Na_{2}SO_{4}+4H_{2}O,}[/TEX]
- [TEX][Сu(H_{2}O)_{4}]^{2+}+2OH^{-}\rightarrow{Ca(OH)_{2}\downarrow{+4H_{2}O.}}[/TEX]
-
Гідроксокомплекси, в яких лігандами є гідроксильні групи, існують тільки у лужному середовищі у вигляді прозорих розчинів. Здебільшого це нестійкі до нагрівання, добре розчинні сполуки за рідким винятком. Як приклад нерозчинної комплексної сполуки з гідроксокомплексним аніоном можна навести малорозчинний натрій гексагідроксостибат (V) Na[Sb(OH)6], що виділяється у вигляді дрібнокристалічного білого осаду. Цю властивість використовують в аналітичній хімії як якісну реакцію для ідентифікації йонів Na+:
- [TEX]NaNO_{3}+K[Sb(OH)_{6}]\rightarrow{Na[Sb(OH)_{6}]\downarrow{+}KNO_{3},}[/TEX]
- [TEX]Na^{+}+[Sb(OH)_{6}]^{-}\rightarrow{Na[Sb(OH)_{6}]\downarrow.}[/TEX]
Гідроксокомплекси найчастіше отримують при розчиненні амфотерних основ у розчині лугу, наприклад:
- [TEX]Zn(OH)_{2}+2NaOH\rightarrow{Na_{2}[Zn(OH)_{4}],}[/TEX]
- [TEX]Zn(OH)_{2}+2OH^{-}\rightarrow{[Zn(OH)_{4}]^{2-},}[/TEX]
або при дії великим надлишком лугу на розчин солі амфотерного металу:
- [TEX]Cr_{2}(SO_{4})_{3}+12NaOH\rightarrow{2Na_{3}[Cr(OH)_{6}]}+3Na_{2}SO_{4},[/TEX]
- [TEX]Cr^{3+}+6OH^{-}\rightarrow{[Cr(OH)_{6}]^{3-}.}[/TEX]
Гідроксокомплекси виявляють стійкість тільки у сильнолужних розчинах, а у нейтральному, тим більше у кислому середовищі вони руйнуються. Цей процес можна відобразити за допомогою спрощеної схеми:
- [TEX]2Na_{3}[Al(OH)_{6}]+6H_{2}SO_{4}\rightarrow{Al_{2}(SO_{4})_{3}}+3Na_{2}SO_{4}+12H_{2}O,[/TEX]
- [TEX][Al(OH)6]^{3-}+6H^{+}\rightarrow{Al^{3+}+6H_{2}O.}[/TEX]
Однак при точнішому написанні рівняння цієї реакції, слід відображати, що у кислому середовищі гідроксокомплекси переходять в аквакомплекси – відбувається поступове заміщення гідроксильних груп у внутрішній сфері молекулами води:
- [TEX]2Na_{3}[Al(OH)_{6}]+6H_{2}SO_{4}\rightarrow{([Al(H_{2}O)_{6}])_{2}(SO_{4})_{3}+3Na_{2}SO_{4},}[/TEX]
- [TEX][Al(OH)_{6}]^{3-}+6H^{+}\rightarrow{[Al(H_{2}O)_{6}]^{3+}.}[/TEX]
Руйнуються гідроксокомплекси і при нагріванні:
- [TEX]Na[Al(OH)_{4}]\rightarrow{NaAlO_{2}+2H_{2}O.}[/TEX]
Для руйнування гідроксокомплексу можна звернутися до загального методу, що застосовується до будь-якого типу комплексних сполук за умови, що центральний атом здатний утворювати з якимось аніоном нерозчинні осади, наприклад:
- [TEX]Na_{2}[Zn(OH)_{4}]+Na_{2}S\rightarrow{ZnS\downarrow{+}4NaOH,}[/TEX]
- [TEX][Zn(OH)_{4}]^{2-}+S^{2-}\rightarrow{ZnS\downarrow{+}4OH^{-},}[/TEX]
або змінювати свій ступінь окиснення при дії окисників чи відновників:
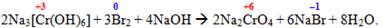
-
Аміакати, в яких лігандами є молекули амоніаку NH3. Серед них найстійкішими є такі комплекси (дужках наведені величини констант нестійкості):
- [TEX][Co(NH_{3})_{6}]^{3+} (К_{нест}= 6,25\cdot{10^{-36}}),[/TEX]
- [TEX][Cu(NH_{3})_{4}]^{2+} (К_{нест}= 4,57\cdot{10^{-14}),}[/TEX]
- [TEX][Zn(NH_{3})_{4}]^{2+} (К_{нест}= 2,58\cdot{10^{-10}).}[/TEX]
Амоніачні комплекси звичайно одержують при взаємодії солей чи гідроксидів металів з водним розчином амоніаку [TEX](NH _{3}\cdot{H_{2}O}, або NH_{4}OH)[/TEX]:
- [TEX]AgCl_{(тв)}+2NH_{3}\cdot{H_{2}O_{(р-н)}}\rightarrow{[Ag(NH_{3})_{2}]Cl+2H_{2}O,}[/TEX]
- [TEX]Cu(OH)_{2(тв)}+4NH_{3}\cdot{H_{2}O_{(р-н)}}\rightarrow{[Cu(NH_{3})_{4}](OH)_{2}+4H_{2}O,}[/TEX]
- [TEX]NiSO_{4(р-н)}+6NH_{3}\cdot{H_{2}O_{(р-н)}}\rightarrow{[Ni(NH_{3})_{6}]SO_{4}}+6H_{2}O[/TEX]
або в результаті дії газоподібним амоніаком на ці солі у кристалічному стані:
- [TEX]CoCl_{2(кр)}+6NH_{3(г)}\rightarrow{[Co(NH_{3})_{6}]Cl_{2}}.[/TEX]
Якщо амоніачний комплекс є нестійким у водному розчині, його отримують у середовищі рідкого амоніаку:
- [TEX]AlCl_{3(тв)}+6NH_{3(р)}\rightarrow{[Al(NH_{3})_{6}]Cl_{3(тв)}.}[/TEX]
Руйнуватися аміакати можуть різними способами:
- при нагріванні, наприклад:
- [TEX][Ni(NH_{3})_{6}]Cl_{2}\rightarrow{NiCl_{2}}+6NH_{3}\uparrow{},[/TEX]
- [TEX][Ni(NH_{3})_{6}]^{2}\rightarrow{Ni^{2+}}+6NH_{3}\uparrow{},[/TEX]
- при окисненні:
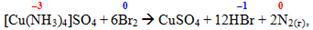
- при дії речовин, здатних переводити молекулу NH3 в стійкий йон NH4+ (який не містить неподілених електронних пар і тому не може виконувати функцію ліганду):
- [TEX][Ni(NH_{3})_{6}]SO_{4}+3H_{2}SO_{4}\rightarrow{NiSO_{4}}+ 3(NH_{4})_{2}SO_{4},[/TEX]
- [TEX][Ni(NH_{3})_{6}]^{2+}+6H^{+}\rightarrow{Ni^{2+}}+6NH_{4}^{+};[/TEX]
- при зв’язуванні центрального атома у вигляді малорозчинного осаду:
- [TEX][Cu(NH_{3})_{4}](OH)_{2}+Na_{2}S+4H_{2}O\rightarrow{CuS\downarrow{+}}2NaOH+ 4NH_{3}\cdot{H_{2}O}.[/TEX]
- [TEX][Cu(NH_{3})_{4}]^{2+}+S^{2-}+ 4H_{2}O\rightarrow{CuS\downarrow{+}}4NH_{3}\cdot{H_{2}O.}[/TEX]
-
Карбоніли, в яких лігандами є молекули карбон (ІІ) оксиду СО. За звичайних умов це кристалічні речовини чи леткі сполуки з низькими температурами плавлення та кипіння. Карбонильні комплекси d-елементів, як правило, діамагнитні та токсичні. Вони практично нерозчинні у воді (тому належать до неелектролітів), але добре розчинні в органічних розчинниках (наприклад, у тетрахлорометані). Карбонільні комплекси найчастіше одержують шляхом прямого синтезу:
- [TEX]Fe_{(т)}+5CO_{(г)}\rightarrow{[Fe(CO)_{5}]_{(р)}}[/TEX](при 200oС і 150 атм).
Руйнуються карбоніли при нагріванні:
- [TEX][Fe(CO)_{5}]_{(р)}\rightarrow{Fe_{(т)}}+5CO_{(г)}[/TEX](при 300oС);
при взаємодії з галогенами і кислотами, яка проходить достатньо енергійно:
- [TEX]2[Fe(CO)_{5}]+3Cl_{2}\rightarrow{2FeCl_{3}}+10CO,[/TEX]
- [TEX][Ni(CO)_{4}]+ Br_{2}\rightarrow{NiBr_{2}}+4CO,[/TEX]
- [TEX][Fe(CO)_{5}]+H_{2}SO_{4}\rightarrow{FeSO_{4}}+5CO+H_{2}.[/TEX]
-
Ацидокомплекси, в яких лігандами є аніони неорганічних і органічних кислот – найпоширеніша і дуже неоднорідна група комплексних сполук. Відомо багато способів добування комплексів цього типу. Один з них – утворення осаду малорозчинної сполуки і подальше його розчинення в надлишку реагенту, наприклад:
- [TEX]2AgNO_{3}+Na_{2}S_{2}O_{3}\rightarrow{Ag_{2}S_{2}O_{3}\downarrow{+}2NaNO_{3},}[/TEX]
- [TEX]2Ag^{+}+S_{2}O_{3}^{2-}\rightarrow{Ag_{2}S_{2}O_{3}\downarrow{,}}[/TEX]
- [TEX]Ag_{2}S_{2}O_{3}+3Na_{2}S_{2}O_{3}\rightarrow{2Na_{3}[Ag(S_{2}O_{3})_{2}],}[/TEX]
- [TEX]Ag_{2}S_{2}O_{3}+3S_{2}O_{3}^{2-}\rightarrow{[Ag(S_{2}O_{3})_{2}]^{3-};}[/TEX]
- [TEX]FeSO_{4}+2KCN\rightarrow{Fe(CN)_{2}\downarrow{+}}K_{2}SO_{4};[/TEX]
- [TEX]Fe^{2+}+2CN^{-}\rightarrow{Fe(CN)_{2}\downarrow{,}}[/TEX]
- [TEX]Fe(CN)_{2}\downarrow{+}4KCN\rightarrow{K_{4}[Fe(CN)_{6}],}[/TEX]
- [TEX]Fe(CN)_{2}+4CN^{-}\rightarrow{[Fe(CN)_{6}]^{4-};}[/TEX]
- [TEX]Hg(NO_{3})_{2}+2NaI\rightarrow{HgI_{2}\downarrow{+}2NaNO_{3},}[/TEX]
- [TEX]Hg^{2+}+2I^{-}\rightarrow{HgI_{2}\downarrow{,}}[/TEX]
- [TEX]HgI_{2}+2NaI\rightarrow{Na_{2}[HgI_{4}],}[/TEX]
- [TEX]HgI_{2}+2I^{-}\rightarrow{[HgI_{4}]^{2-}.}[/TEX]
Досить велика кількість ацидокомплексних сполук, які мають прикладне значення, отримують внаслідок окисно-відновних реакцій, наприклад, осадження калій гексанітритокобальтату(III) у вигляді дрібних жовтих кристалів. Ця реакція використовується для визначення домішок йонів К+ у розчинах натрієвої солі, до якого додають ацетатний розчин кобальт (II) хлориду:
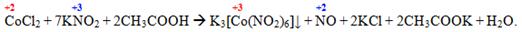
Інша важлива реакція – розчинення платини у суміші концентрованих нітратної і хлоридної кислот (у так званій «царській горілці”) з утворенням гідроген гексахлороплатинату(IV):
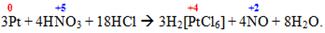
Гідроген гексахлороплатинат(IV) є реагентом на катіони калію, рубидію та цезію, які утворюють з гексахлороплатинат(IV)-аніоном малорозчинні осади [TEX]K_{2}[PtCl_{6}], Rb_{2}[PtCl_{6}] і Cs_{2}[PtCl_{6}].[/TEX]
Важливим є спосіб утворення ацидокомплексної сполуки заданого складу на основі іншого комплекса; при цьому відбувається заміщення одного комплексоутворювача іншим:
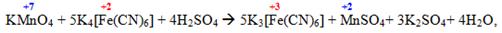
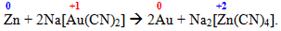
Перша з наведених реакцій дає змогу перейти від жовтої кров’яної солі [TEX]K_{4}[Fe(CN)_{6}][/TEX] до червоної кров’яної солі [TEX]K_{3}[Fe(CN)_{6}][/TEX], вони обидві є якісними реагентами на солі феруму(ІІ) і феруму(ІІІ) відповідно. А друга реакція застосовується у золотодобувній промисловості.
Крім того, перехід від одного комплексу до іншого здійснюють при заміщенні лігандів. Але реакції цього типу можливі лише за умови утворення міцнішого комплексу, який має меншу величину константи нестійкості, наприклад:
- [TEX][Ag(NH_{3})_{2}]NO_{3}+2KCN\rightarrow{K[Ag(CN)_{2}]}+KNO_{3}+2NH_{3},[/TEX]
- [TEX][Ag(NH_{3})_{2}]^{+}+2CN^{-}\rightarrow{[Ag(CN)_{2}]^{-}}+2NH_{3}.[/TEX]
Останні три реакції можна розглядати як утворення комплексу заданого складу, однак вони одночасно є реакціями руйнування вихідних комплексів.
Інший спосіб руйнування ацидокомплексів – зв’язування комплексоутворювача у вигляді важко розчинного осаду. Так, тетрайодомеркурат(II)-аніон [TEX][HgI_{4}]^{2-}[/TEX] руйнується під дією сульфід-іонів S2–:
- [TEX]K_{2}[HgI_{4}]+K_{2}S\rightarrow{HgS}+ 4KI,[/TEX]
- [TEX][HgI_{4}]^{2-}+S^{2-}\rightarrow{HgS+4I^{-}.}[/TEX]
Перебіг реакції зумовлюється утворенням більш стійкої сполуки, як це випливає з порівняння значення добутку розчинності осаду HgS і константи нестійкості комплексного йона [TEX][HgI_{4}]^{2-}[/TEX]:
- [TEX]ДР(HgS)=1,4\cdot{10^{-45}}, К_{нест}([HgI_{4}]^{2-})=1,4\cdot{10^{-31}.}[/TEX]
11.9 Приклади розв’язання типових задач
Приклад 11.1. Сховати Назвати комплексну сполуку за формулою: а)[TEX][Pt(NH_{3})_{3}CI]CI[/TEX]; б).[TEX]K_{3}[Co(NO_{2})_{6}][/TEX]Розв’язок. Комплексні сполуки називають, починаючи з катіона. Назву комплексного йона складають так: в алфавітному порядку перелічують ліганди, вказуючи перед назвою ліганду його кількість за допомогою грецьких числівників ( ди, три, тетра, пента, гекса і т.д.). Останнім називають комплексоутворювач та його ступінь окиснення (римськими цифрами після назви комплексоутворювача).
У назвах катіонних і нейтральних комплексних йонів не передбачено спеціальних закінчень, а назви аніонних комплексів мають суфікс -ат, що додається до кореня назви центрального атома. В цілому для складання назви комплексної сполуки необхідно визначити за формулою зовнішню сферу та її заряд, заряд комплексного йона, заряди лігандів і ступінь окиснення комплексоутворювача.
а) В комплексній сполуці [TEX][Pt(NH_{3})_{3}CI]CI[/TEX] зовнішня сфера представлена хлорид-аніоном CI–, комплексний йон – катіоном [TEX][Pt(NH_{3})_{3}CI]^{+}[/TEX], в якому комплексоутварювачем є Pt+2, а лігандамии – молекули NH3 та йон CI–. Називаємо сполуку відповідно до вимог номенклатури: триамінхлороплатина (ІІ) хлорид.
б) У комплексній сполуці K3[Co(NO2)6] роль зовнішньої сфери відіграють три катіони
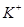 , комплексного йона – аніон [TEX][Co(NO_{2})_{6}]^{3-}[/TEX], в якому комплексоутворювачем є [TEX]Co^{3+}[/TEX], а лігандами – шість аніонів [TEX]NO_{2}^{-}[/TEX]. З урахуванням правил номенклатури називаємо сполуку: калій гексанітритокобальтат (ІІІ).Приклад 11.2. Сховати
, комплексного йона – аніон [TEX][Co(NO_{2})_{6}]^{3-}[/TEX], в якому комплексоутворювачем є [TEX]Co^{3+}[/TEX], а лігандами – шість аніонів [TEX]NO_{2}^{-}[/TEX]. З урахуванням правил номенклатури називаємо сполуку: калій гексанітритокобальтат (ІІІ).Приклад 11.2. СховатиСкладіть формулу сполуки за назвою: триамінаквадигідроксоплатина (IV) хлорид.
Розв’язок. Як випливає з назви сполуки, комплексоутворювачем в ній є йон Pt+4, а лігандами – дві гідроксильні групи ОН– (на що вказує частина слова «гідроксо», перед якою є множувальний префікс «ди»), одна нейтральна молекула H2O (аква) і три молекули амоніаку NH3 (триамін). З урахуванням всіх перелічених частинок одержуємо формулу комплексного йона [TEX][Pt(NH_{3})_{3}(H_{2}O)(OH)_{2}]^{х}[/TEX], а його заряд визначаємо як алгебраїчну суму зарядів всіх складових: [TEX]1\cdot{(+4)}+3\cdot{0}+1\cdot{0}+2\cdot{(-1)}=+2 ([Pt(NH_{3})_{3}(H_{2}O)(OH)_{2}]^{2+})[/TEX]. Координаційне число комплексоутворювача дорівнює загальній кількості всіх лігандів (3+1+2=6). Зовнішня сфера комплексної сполуки – протийон – повинна мати такий же за величиною, але протилежний за знаком заряд (–2), що забезбечується двома йонами Cl–. Остаточно формула триамінаквадигідроксоплатини (IV) хлориду має вигляд: [TEX][Pt(NH_{3})_{3}(H_{2}O)(OH)_{2}]Cl_{2}[/TEX].
Приклад 11.3. СховатиСкласти координаційну формулу комплексної сполуки, що містить частинки Cu2+, CN-, Sr2+, написати рівняння первинної та вторинної дисоціації, а також вираз константи нестійкості.
Розв’язок. Спочатку необхідно визначити центральний атом, або комплексоутворювач. Це може бути Cu2+ чи Sr2+. Однак зважаючи на те, що найчастіше у ролі комплексоутворювача виступають йони d-елементів, вважаємо, що центральним атомом буде йон Cu2+. Координаційне число, як правило, вдвічі більше за ступінь його окиснення, тому для Cu2+ воно дорівнюватиме 4. Лігандами можуть бути електронейтральні молекули, що містять атоми з неподіленими електронними парами, або негативно заряджені йони, до яких належать частинки CN-. Таким чином, одержуємо формулу [TEX]Sr[Cu(CN)_{4}][/TEX] – стронцій тетраціанокупрат (ІІ).
Первинна, або електролітична дисоціація відбувається згідно з рівнянням:
- [TEX]Sr[Cu(CN)_{4}]\rightarrow{Sr^{2+}+[Cu(CN)_{4}]^{2-},}[/TEX]
а вторинна (дисоціація комплексного йона) -
- [TEX][Cu(CN)_{4}]^{2-}\Leftrightarrow{Cu^{2+}+4CN^{-}.}[/TEX]
Вторинна дисоціація проходить дуже незначною мірою, тому підлягає закону діючих мас і характеризується константою рівноваги, яку у випадку комплексного йона називають константою нестійкості (табл.13.2):
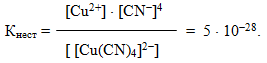 Приклад 11.4. Сховати
Приклад 11.4. СховатиВиходячи з частинок К+, Cr3+, OH–, H2O, складіть сім координаційних формул комплексних сполук і назвіть їх. Вкажіть комплексний неелектроліт. Для однієї з них зазначте тип за природою лігандів і за зарядом внутрішньої сфери.
Розв’язок. Серед наведених частинок найімовірніше у якості комплексоутворювача буде виступати Cr3+, який належить до d-металів, найбільшою мірою схильних до комплексоутворення. Ступінь окиснення +3 зумовлює координацій число 6, тому навколо Cr3+ повинно скупчуватися шість лігандів – негативно заряджених йонів чи нейтральних молекул, що містять неподілені електронни пари. Такими є OH– і H2O. Тоді зовнішньою сферою для аніонних комплексів може бути К+, а для катіонних – ОН–. При цьому слід дотримуватися рівності за величиною, але протилежності за знаком зарядів внутрішньої та зовнішньої сфер, регулюючи кількість частинок у зовнішній сфері. Виходячи з перелічених умов складаємо координаційні формули:
- [TEX]К_{3}[Cr(ОН)_{6}][/TEX] – калій гексагідроксохромат (+3);
- [TEX]К_{2}[Cr(ОН)_{5}(H_{2}O)][/TEX] – калій аквапентагідроксохромат (+3);
- [TEX]К[Cr(ОН)_{4}(H_{2}O)_{2}][/TEX] – калій діакватетрагідроксохромат (+3);
- [TEX][Cr(ОН)_{3}(H_{2}O)_{3}][/TEX] – калій триакватригідроксохром (+3), комплексний неелектроліт;
- [TEX][Cr(ОН)_{2}(H_{2}O)_{4}](ОН)[/TEX] –тетраквадигідроксохром (+3) гідроксид;
- [TEX][Cr(ОН)(H_{2}O)_{5}](ОН)_{2}[/TEX]– пентаквагідроксохром (+3) гідроксид;
- [TEX][Cr(H_{2}O)_{6}](ОН)_{3}[/TEX] – гексааквахром (+3) гідроксид, за зарядом належить до аніонних комплексів, за природою лігандів – до гідроксокомплексів.
Приклад 11.5. СховатиВкажіть тип гібридизації АО комплексоутворювача, визначте геометричну форму і магнітні властивості комплексного йона: [TEX][HgI_{4}]^{2-}[/TEX].
Розв’язок. В комплексі [TEX][HgI_{4}]^{2-}[/TEX]комплексоутворювач має електронну структуру:
[TEX]Hg^{2+}:[Xe]4f^{14}5d^{10}6s^{0}6p^{0}.[/TEX]
На утворення чотирьох зв’язків з лігандами (йодид-іонами) комплексоутворювач Hg2+ надає вакантні 6s- і 6р-орбіталі, які піддаються sp3-гібридизації і на які поступають неподілені електронні пари лігандів (на електронно-графічній схемі вони показані точками):

Тип гібридизації (sp3) зумовлює тетраедричну форму комплексного йона. Комплекс є діамагнітним, оскільки сумарний спіновий момент електронів дорівнює 0 (всі електрони спарені).
Приклад 11.6. СховатиНаписати рівняння обмінної реакції комплексної сполуки [TEX]Sr[Cu(CN)_{4}][/TEX] з розчином солі [TEX]Na_{2}SO_{4}[/TEX].
Розв’язок. Реакція обміну проходить згідно з рівнянням у молекулярній та йонній формах:
- [TEX]Sr[Cu(CN)_{4}]+Na_{2}SO_{4}\rightarrow{SrSO_{4}\downarrow}+Na_{2}[Cu(CN)_{4}],[/TEX]
- [TEX]Sr^{2+}+[Cu(CN)_{4}]^{2-}+2Na^{+}+SO_{4}^{2-}\rightarrow{SrSO_{4}}\downarrow{+} 2Na^{+}+[Cu(CN)_{4}]^{2-},[/TEX]
- [TEX]Sr^{2+}+SO_{4}^{2-}\rightarrow{SrSO_{4}\downarrow{}.}[/TEX]
Приклад 11.7. СховатиНаписати молекулярні та іонні рівняння реакцій утворення комплексної сполуки тетраамінцинк сульфату та її руйнування при додаванні відповідного реагенту.
Розв’язок. Склад комплексної сполуки тетраамінцинк сульфату відповідає формулі [TEX][Zn(NH_{3})_{6}]SO_{4}[/TEX]. Рівняння реакції її утворення має такий вигляд:
- [TEX]ZnSO_{4}+6NH_{4}ОН\rightarrow{[Zn(NH_{3})_{6}]SO_{4}}+ 6Н_{2}О,[/TEX]
- [TEX]Zn^{2+}+SO_{4}^{2-}+6NH_{4}ОН\rightarrow{[Zn(NH_{3})_{6}]^{2+}}+SO_{4}^{2-}+6Н_{2}О,[/TEX]
- [TEX]Zn^{2+}+6NH_{4}ОН\rightarrow{[Zn(NH_{3})_{6}]^{2+}+6Н_{2}О.}[/TEX]
Руйнування комплексу відбувається за умови утворення більш стійкої сполуки, наприклад, осаду сульфіду. Тому до розчину [TEX][Zn(NH_{3})_{6}]SO_{4}[/TEX] слід додати розчин добре розчинної солі [TEX]Na_{2}S[/TEX]. При цьому проходить реакція відповідно до рівняння:
- [TEX][Zn(NH_{3})_{6}]SO_{4}+Na_{2}S\rightarrow{ZnS\downarrow{}}+Na_{2}SO_{4}+6NH_{3}\uparrow{},[/TEX]
- [TEX][Zn(NH_{3})_{6}]^{2+}+SO_{4}^{2-}+2Na^{+}+S^{2-}\rightarrow{ZnS\downarrow{}}+2Na^{+}+SO_{4}^{2-}+6NH_{3}\uparrow{},[/TEX]
- [TEX][Zn(NH_{3})_{6}]^{2+}+S^{2-}\rightarrow{ZnS\downarrow{}}+6NH_{3}\uparrow{}.[/TEX]
Приклад 11.8. СховатиВизначити, яка основа є більш сильним електролітом: [TEX]Cu(OH)_{2}[/TEX] чи [TEX][Cu(NH_{3})_{4}](OH)_{2}[/TEX].
Розв’язок. Купрум (ІІ) гідроксид є малорозчинною сполукою, тому майже не розпадається на йони і належить до слабких електролітів. Дисоціація проходить дуже незначною мірою:
- [TEX]Cu(OH)_{2}\leftrightarrow{Cu^{2+}}+2OH^{-}.[/TEX]
Оскільки кількість йонів [TEX]OH^{-}[/TEX] обмежена, то [TEX]Cu(OH)_{2}[/TEX] є слабкою основою. На відміну від [TEX]Cu(OH)_{2}[/TEX]комплексна основа, в молекулі якій між внутрішньою та зовнішньою сферами здійснюється йонний зв’язок, у розчинах піддається повній первинній дисоціації, внаслідок чого відбувається накопичення гідроксильних йонів OH- – саме їх наявність визначає силу електроліту:
- [TEX][Cu(NH_{3})_{4}](OH)_{2}\rightarrow{[Cu(NH_{3})_{4}]^{2+}}+2OH^{-}.[/TEX]
-
Порядок переліку йонів. У назві аніонної комплексної сполуки після назви катіона у називному відмінку окремим словом подається перелік лігандів і зазначається корінь латинської назви комплексоутворювача з додаванням закінчення -ат та його ступеня окиснення (римською цифрою у дужках), наприклад:



