12.1. Початкові відомості про комплексні сполуки
Комплексні сполуки складають найбільш поширену і неоднорідну за складом і будовою групу хімічних речовин, що набули важливого значення у прикладній хімії, хімічній технології та майже в усіх без винятку галузях господарства. Завдяки безлічі комплексних сполук та різноманітності притаманних для них властивостей, не вдається сформулювати однозначного остаточного визначення, що охоплювало б усі різновиди цього класу речовин. Однак інженер у практичній діяльності найчастіше має справу зі сполуками, для яких справедливою вважається така характеристика:
Комплексні сполуки – це речовини, у вузлах кристалічних решіток яких містяться складні йони, побудовані за рахунок координації певних частинок навколо центрального атома (чи йона) та здатні до самостійного існування після переходу речовини у розчинений або розплавлений стан.
Між комплексними сполуками і деякими звичайними речовинами неможливо провести різких розмежувань.
12.2. Координаційна теорія
У сучасному вигляді координаційна теорія містить декілька основних положень.
- У молекулі комплексної сполуки певний атом (чи йон), який за рахунок головної та побічної валентностей координує навколо себе певну кількість нейтральних молекул чи протилежно заряджених йонів, називається центральний атом, або комплексоутворювач (рис.).
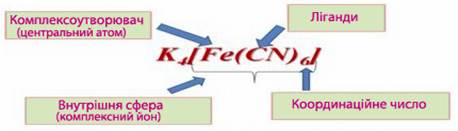
Рисунок – Складові частини комплексної сполуки на прикладі К4[Fe(CN)6]
- З центральним атомом безпосередньо сполучаються молекули чи йони, які називаються координованими групами, адендами, або ліганди.
- Комплексоутворювач разом із лігандами складає головний фрагмент комлексной сполуки, який називають внутрішня сфера комплексної сполуки. Часто внутрішню сферу, яка має позитивний чи негативний заряд, називають комплексний йон, або просто комплекс, якщо заряд дорівнює нулю. Комплексний йон при написанні координаційної формули береться у квадратні дужки, щоб підкреслити монолітність внутрішньої сфери. Заряд внутрішньої сфери визначається алгебраїчною сумою ступеня окиснення комплексоутворювача і сумісних зарядів усіх лігандів
- Якщо ступінь окиснення комплексоутворювача за абсолютною величиною не дорівнює сумі зарядів усіх лігандів, то комплексна сполука містить – протийон, або зовнішня сфера, яку записують поза квадратними дужками: [Ag(CN)2]Cl, K[Ag(NH3)2]. Однак існують і нейтральні комплекси, позбавлені зовнішньої сфери, їх іноді називають комплексні неелектроліти.
- Загальна кількість координаційних валентностей, за допомогою яких комплексоутворювач у внутрішній сфері сполучається із лігандами, називається координаційне число (к.ч.).
- Різні ліганди можуть займати біля центрального атома різну кількість координаційних місць. Кількість місць, що займає навколо комплексоутворювача окрема координована група, називається координаційна ємність ліганду. За координаційною ємністю розрізняють: монодентантні ліганди, які займають одне координаційне місце, бідентантні ліганди, які займають по два координаційних місця, полідентантні ліганди, яким притаманна велика координаційна ємність (3–6).
12.3. Класифікація
- За належністю до певного класу неорганічних речовин комплексні сполуки поділяються на такі групи: комплексні кислоти, зовнішньою сферою яких є катіони гідрогену Н+, комплексні основи, зовнішньою сферою яких є гідроксид-аніони ОН–, комплексні солі, зовнішньою сферою яких є катіон металу, чи аніон кислотного залишку, комплексні неелектроліти, які не мають зовнішньої сфери.
- За знаком заряду внутрішньої сфери розрізняють такі комплексні сполуки: катіонні комплексні сполуки, які містять позитивно заряджену внутрішню сферу; аніонні комплексні сполуки з негативно зарядженою внутрішньою сферою; нейтральні комплексні сполуки, які позбавлені зовнішньої сфери; бікомплексні сполуки, що складаються з двох комплексних йонів.
- Залежно від природи лігандів розрізняють: аквакомплекси – комплексні йони чи молекули, що як ліганди містять у внутрішній сфері молекули води; аміакати, в яких лігандами є молекули амоніаку NH3; карбоніли, що мають за ліганди молекули карбон(ІІ) оксиду; гідроксокомплекси, до складу внутрішньої сфери яких входять гідроксильні йони ОН–; ацидокомплекси, в яких лігандами є аніони різних кислот, у тому числі оксалатні (С2О42–), галогенідні (F–, Cl–, Br–, I–), ціанідні (CN–), сульфатні (SO42–), тіосульфатні (S2O32–), нітратні (NO3–), нітритні (NO2–) тощо; змішані комплекси, у внутрішній сфері яких містяться ліганди різної природи; π-комплекси, в яких лігандами є ненасичені органічні сполуки типу етилену, циклопентадієну, бензену.
- За кількістю ядер бувають: моноядерні комплекси, в яких міститься тільки один комплексоутворювач; поліядерні комплекси, в яких є два чи більше комплексоутворювачів.
- За відсутністю або наявністю замкнутих структур комплексні сполуки поділяють на прості та циклічні. У простих комплексах ліганди займають одне координаційне місце, а полідентантні ліганди, сполучені декількома зв’язками з одним і тим самим комплексоутворювачем, дають циклічні комплекси, або хелати, внутрішня сфера яких складається з замкнутих груп, сполучених з комплексоутворювачем.
12.4. Номенклатура
Згідно з Міжнародною номенклатурою IUPAC назви комплексних сполук утворюються відповідно до певних правил. Згідно з сучасною українською хімічною орфографією в назвах складних сполук спочатку подається назва катіона, а потім – аніона.
- Порядок переліку йонів. У назві аніонної комплексної сполуки після назви катіона у називному відмінку окремим словом подається перелік лігандів і зазначається корінь латинської назви комплексоутворювача з додаванням закінчення -ат та його ступеня окиснення (римською цифрою у дужках). При називанні катіонної комплексної сполуки спочатку окремим словом перелічують ліганди, додаючи назву комплексоутворювача у називному відмінку та його ступінь окиснення, далі окремо наводять назву аніона. У назві нейтрального комплексу, яка записується одним словом, після переліку лігандів подають назву комплексоутворювача у називному відмінку та його ступінь окиснення.
-
Перелік лігандів та їх назви. Назви аніонних лігандів утворюються додаванням до назв аніонів закінчення «-о». Якщо назва аніона закінчується на «-ід», «-ид», «-ат», «-іт», «-ит», то після додавання закінчення «-о» утворюється відповідно «-ідо», «-идо», «-ато», «-іто», «-ито». Назви лігандів перелічують в алфавітному порядку, назва ліганда є єдиним цілим. Нейтральні ліганди називають так: аква H2O, амін NH3, карбоніл CO, нітро NO2. Щодо катіонних лігандів, то для них застосовують такі назви: N2H5+ – гідразиній, NO2+ – нітроїлій, NO+ – нітрозилій, H+ – гідридо. У прикладах, що наводяться нижче, аніонні ліганди виділені синім курсивом, а нейтральні – зеленим:

-
Префікси для позначення кількості лігандів. Для лігандів з простою назвою використовують префікси, що походять від грецьких числівників: ди-, три-, тетра-, пента-, гекса- тощо. Наприклад:

12.5. Ізомерія комплексних сполук
У хімії комплексних сполук поширене явище ізомерії, при якому речовини одного складу мають різну молекулярну будову і різні властивості. Розрізняють декілька видів ізомерії.
- Просторова (або геометрична) ізомерія, що спостерігається лише у тому випадку, коли комплексний йон містить неоднорідні ліганди, які можуть займати різні положення навколо комплексоутворювача. У цис-ізомерах однакові ліганди розміщуються один біля одного, а в транс-ізомерах – один напроти одного.
- Сольватна ізомерія зумовлюється неоднаковим розподілом молекул розчинника між внутрішньою і зовнішньою сферами комплексної сполуки. Якщо розчинником є вода, сольватну ізомерію називають гідратною.
- Іонізаційна ізомерія зумовлюється різним розподілом аніонів між внутрішньою та зовнішньою сферами. Так, комплексна сполука загального складу CoBrSO4×5NH3 має два іонізаційних ізомери: [Co(NH3)5Br]SO4 червоно-фіолетового кольору і [Co(NH3)5SO4]Br червоного кольору.
-
Координаційна ізомерія, яка виявляється тільки у багатоядерних комплексах, коли різні комплексоутворювачі обмінюються своїми лігандами без зміни загального складу:

12.6. Стійкість копслексних сполук
Розчинні аніонні та катіонні комплексні сполуки у розведених водних розчинах поводять себе як сильні електроліти і піддаються електролітичній дисоціації, при якій внутрішня та зовнішня сфери існують у вигляді самостійних йонів. Такий процес називається первинна дисоціаціація, яка у більшості випадків проходить повністю. При цьому комплексний йон, що утворюється, поводить себе як єдине ціле. Наприклад:
- [TEX]K[Ag(CN)_{2}]\rightarrow{K^{+}+[Ag(CN)_{2}]}.[/TEX]
- [TEX]{[Ag(NH_{3})_{2}]Cl\rightarrow{[Ag(NH_{3})_{2}]^{+}+Cl^{-}}},[/TEX]
Поряд з первинною дисоціацією дуже незначною мірою відбувається вторинна дисоціація – розкладання внутрішньої сфери комплексу на складові частинки:
- [TEX][Ag(NH_{3})_{2}]^{+}\Leftrightarrow{Ag^{+}+2NH_{3}},[/TEX]
- [TEX][Ag(CN)_{2}]^{-}\Leftrightarrow{Ag^{+}}+2CN^{-}.[/TEX]
Оскільки комплексний йон виявляє себе як надзвичайно слабкий електроліт, вторинна дисоціація підлягає закону діючих мас. Тому можна записати вираз константи рівноваги, яка для комплексних йонів називається константа нестійкості:
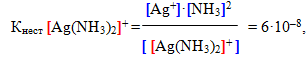
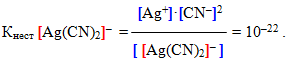
Константа нестійкості є мірою міцності внутрішньої сфери: чим менша величина Кнест, тим міцніший комплекс. Отже, з двох наведених вище прикладів більшу стійкість виявляє другий комплекс ([Ag(CN)2]–), тому що саме йому відповідає менше значення константи нестійкості.
Іноді замість константи нестійкості використовують обернену їй величину – константа стійкості:
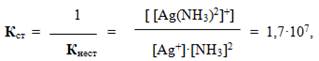
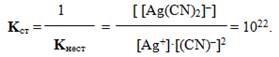
Більшому значенню константи стійкості відповідає більша концентрація комплексоутворювача у розчині під час стану рівноваги.
12.7. Хімічний зв’язок у комплексних сполуках
Для пояснення природи хімічного зв’язку в комплексних сполуках існує декілька сучасних теорій, які не містять протилежних тверджень, однак доповнюють одна одну, трактуючи одні й ті самі питання з різних точок зору. Всі вони, як правило, приводять до ідентичних результатів.
-
Електростатична модель Косселя і Магнуса розглядає хімічний зв’язок у комплексних сполуках, виходячи із закону Кулона. При цьому припускається, що всі частинки у комплексному йоні є недеформованими кульками з певними зарядами і радіусами. Стійкий комплекс утворюється, коли сили притягання лігандів до комплексоутворювача зрівноважують сили відштовхування між лігандами. При збільшенні кількості лігандів сили відштовхування між ними починають переважати, і комплекс втрачає свою стійкість.
Електростатична теорія дозволяє оцінити стійкість комплексів та передбачити координаційні числа комплексоутворювачів і просторове розміщення лігандів. На основі кулонівської взаємодії заряджених частинок з урахуванням принципу найменшої енергії системи вдалося обчислити оптимальні значення координаційних чисел: вони дорівнюють 1 або 2, якщо ступінь окиснення центрального атома складає +1; 2 або 4, якщо ступінь окиснення +2; 4, 5 або 6 при ступені окиснення +3. Крім того, було показано, що просторова будова комплексу залежить від величини координаційного числа.
Відповідно до закону Кулона міцність комплексу зростає із збільшенням заряду комплексоутворювача і зменшенням радіусів лігандів. Встановлено, що стійкість комплексів з однаковими лігандами тим більша, чим вищий ступінь окиснення виявляє комплексоутворювач.
Електростатична модель обґрунтувала значення координаційних чисел залежно від природи лігандів. Оскільки сили відштовхування між однойменно зарядженими йонами більші, ніж між нейтральними лігандами, координаційне число у комплексі з нейтральними лігандами завжди вище, ніж у комплексі з аніонними лігандами.
-
Метод валентних зв’язків у застосуванні до комплексних сполук базується на декількох основних положеннях.
- Між комплексоутворювачем і лігандом у комплексі виникає донорно-акцепторний зв’язок, на утворення якого ліганди (донори) надають свої неподілені електронні пари, а комплексоутворювач (акцептор) – вакантні орбіталі. Міцність зв’язків залежить від величини області перекривання орбіталей: чим вона більша, тим стійкіший комплекс.
- Атомні орбіталі комплексоутворювача, що беруть участь в утворенні зв’язків, піддаються гібридизації, тип якої зумовлюється кількістю, природою та електронною структурою лігандів і яка, в свою чергу, зумовлює геометричну будову комплексу.
Якщо в утворенні донорно-акцепторного зв’язку беруть участь sp-гібридизовані орбіталі, то комплекс має лінійну будову, якщо sp3-гібридизовані – тетраедричну, якщо dsp2 – квадратну, якщо dsp3 – тригональну біпіраміду, якщо d2sp3 – октаедричну.
- Додаткове зміцнення комплексу забезпечується виникненням поряд із [TEX]\sigma{}[/TEX]-зв’язками і [TEX]\pi{}[/TEX]-зв’язків. Це спостерігається, якщо зайнята електронами орбіталь комплексоутворювача перекривається з вакантною орбіталлю лігандів – так звана [TEX]\pi{}[/TEX]-дативна взаємодія. Перерозподіл електронної густини внаслідок [TEX]\sigma{}[/TEX]- і [TEX]\pi{}[/TEX]-перекривання має протилежні напрямки: при [TEX]\sigma{}[/TEX]-зв’язку електронна густина переноситься на комплексоутворювач, а при [TEX]\pi{}[/TEX]-зв’язку – на ліганди.
- Міцність і властивості комплексів значною мірою залежать від ступеня перекривання орбіталей комплексоутворювача і лігандів. Зокрема, при утворенні октаедричних комплексів гібридизація може здійснюватися або з використанням зовнішніх d-орбіталей, або внутрішніх d-орбіталей. У першому випадку комплекси типу sp3d2 називають зовнішньоорбітальні (або високоспінові) комлекси, а комплекси типу d2sp3 – внутрішньоорбітальні (або низькоспінові) комплекси. У високоспінових комплексах зв’язки утворюються більш віддаленими і менш щільними орбіталями, тому зв’язок комплексоутворювача з лігандами слабкіший, ніж при внутрішньоорбітальній гібридизації
- Магнітні властивості комплексу пояснюються характером забудови орбіталей комплексоутворювача. За наявності неспарених електронів комплекс виявляє парамагнітні властивості, а якщо всі електрони спарені, то комплекс діамагнітний.



