- 3.1.Протолітичні рівноваги. Поняття про протолітичну теорію кислот і основ
- 3.2. Протолітичні рівноваги в воді
- 3.3. Обчислення рН сильних кислот і основ
- 3.4.Обчислення рН слабких кислот і основ
- 3.5.Буферні розчини. Значення pH буферних розчинів
- 3.6. Кислотний буферний розчин
- 3.7. Основний буферний розчин
Ключові терміни:
Буферниє розчини, Кислотний буферний розчин, Основний буферний розчин, Реакція протолізу, буферна ємність, кислота, константа автопротоліза води, основа, протоліт, рівняння Гендерсона-Гассельбаха3.1.Протолітичні рівноваги. Поняття про протолітичну теорію кислот і основ
З часу становлення (1883-1887) теорії електролітичної дисоціації С. А. Аррениуса прийнято вважати, що кислота - це речовина, що виділяє при іонізації (дисоціації на іони) іон водню, а основа- це речовина, що виділяє при іонізації гідроксид-іон (гідроксильний іон) OH-.
Згідно з цими уявленнями типовими кислотами є мінеральні кислоти (хлороводнева HCl, нитратна HNО3, сульфатна H2SО4. ортофосфосфатна Н3РО4 і ін.), Органічні кислоти, наприклад, одноосновні карбонові кислоти RCOOH, де R - органічний радикал. Всі вони при дисоціації виділяють іон водню:
HCl→ H+ + Cl;
H2SО4→ 2H+ + SО42-;
CH3COOH → CH3COO- + H+
Відповідно до уявлень теорії електролітичної дісоціаціі до типових основ відносяться гідроксиди натрію NаОН, калію КОН, кальцію Са (ОН) 2, аміак NН3 • Н2О у водних розчинах. При іонізації вони виділяють гідроксид-іони:
NаОН → Na+ + OH- ;
KOH → K⁺ + OH⁻.
Однак в рамках цих уявлень в число основ не включалися багато речовин, які в розчинах поводяться якоснови. Так, наприклад, піридин, молекула якого не має гідроксильних груп, реагуючи з водою, дає групи ОН
C5H5N +H2O → C5H5N⁺ + OH⁻
і веде себе в розчині як слабка основа, хоча джерелом гідроксильних груп є не сама молекула піридину, а молекула води, в реакцію з якої вступила молекула піридину.
Більш загальна протолітична теорія кислот і основ, вільна від подібних недоліків, була запропонована в 1923 р і розвинена в наступні роки датським фізико-хіміком Й. М. Бренстедом (1879-1947). За теорією Й. Н. Бренстеда кислота є донором протона, а основа- акцептором протона; кислоти і основи існують як спряжені пари; протон Н + у водному розчині не існує, а утворює іон Н3О +.
Подібні уявлення розвивав дещо пізніше (1928) англійскій хімік Т. М Лоурі (1874-1936). Тому протолітичну теорію кислот і основ іноді називають теорією Бренстеда, а іноді - теорією Бренстеда-Лоурі. Ми надалі будемо дотримуватися останньої термінології.
Слід зазначити, що ще в 1907 р швейцарський хімік А. Вернер (1866-1919) розвинув теорію кислот і основ, згідно з якою до кислот відносяться сполуки, що зв'язують гідроксильні іони ОН з води, а до підстав - з'єднання, які не здатні приєднувати іони водню Н +. Ці погляди близькі до уявлень протолітичнії теорії кислот і основ Бренстеда-Лоурі.
Таким чином, згідно протолітичної теорії кислот і основ Бренстеда-Лоурі, кислота - це речовина, що виділяє при іонізації протони, а основа- речовина, що приєднує протони. В рамках цієї теорії кислотами і основами можуть бути катіони, аніони або нейтральні молекули.
Речовини - переносники протонів називають протолітами.
Розглянемо, слідуючи протолітичної теорії Бренстеда-Лоурі, процес оборотного переходу одноосновної кислоти в однокіслотну основу в розчині:
HB → H⁺ + B⁻ (3.1)
кислота основа
Тут НВ і В- є відповідно кислотою і основою, причому вони називаються спряженими кислотою іосновою :НВ - кислота, спряжена з основою В +,В + - основа, спряжена з кислотою НВ.
Для водних розчинів рівняння (3.1) можна представити у вигляді:
НВ + Н2О → Н3О+ + В- (3.2)
кислота 1 основа2 кислота 2 основа 11
В даному випадку спряженими є: НВ (кислота 1) і В- (основа 1),Н3О + (кислота 2) і Н2О (основа 2). наприклад:
CH3COOH → CH3COO- + H+
кислота основа
NH3+ H⁺ → NH4⁺
основа кислота
Відповідно до теорії Бренстеда-Лоурі кислоти і основи знаходяться в протолітичної рівновазі.
Протолітична рівновага в широкому сенсі слова - рівновага, в якому бере участь протон - іон водню Н +. У вузькому сенсі слова протолітичними (на відміну від прототропних) називають реакції, в яких беруть участь молекули води, що віддають або приймають протони:
H2O = H⁺ + OH⁻
H2O + H⁺ = H3O⁺
У самій рідкої воді встановлюється протолітична рівновага:
H2O + H2O = H3O⁺ +OH⁻
Надалі під протолітичними реакціями і рівновагами будемо мати на увазі будь-які реакції і рівноваги за участю протонів, тобто будемо використовувати ці поняття в широкому сенсі слова.
Реакціями протолізу будемо називати реакції кислот або основ з розчинником за участю протонів.
Речовини, здатні як приєднувати, так і віддавати протони, називаються амфолітами (або амфотерними речовинами). Прикладами амфолітов можуть служити вода, бікарбонат-іон, гидросульфид-іон і ін. Так, бікарбонат-іон може віддавати протони:
HCO3⁻→ H⁺ + CO32-
або приймати їх:
HCO3⁻ + H⁺ = H2CO3= H2O + CO2
Існують і інші погляди на природу і класифікацію кислот і основ.
Однак ми надалі будемо користуватися переважно протолітичну теорією кислот і основ Бренстеда-Лоурі.
3.2. Протолітичні рівноваги в воді
Відповідно до сучасних уявлень в рідкій воді здійснюється протолітична рівновага - автопротоліз води:
H2O + H2O = H3O⁺ +OH⁻ (3.3)
або спрощено для стислості запису
H2O = H⁺ + OH⁻
За деякими даними в рівновазі з іонами гідроксонію Н3О + в рідкій воді можуть знаходитися також іони
Н3О+·Н2О,
Н3О+·2Н2О,
проте їх рівноважна концентрація, мабуть, невелика.
Вода - слабкий електроліт, тому за константу хімічної рівноваги (3.3) можна наближено прийняти концентраційну константу хімічної рівноваги Kc, виражену через рівноважні концентрації учасників реакції
Кс = ( [H3O⁺] [OH⁻])/ [H2O]2
і далі: Кс [H2O] = [H3O⁺] [OH⁻]
При постійній температурі Т = const константа хімічної рівноваги постійна: Кс = const. Концентрація води в чистій воді також є сталою і дорівнює 55,55 моль / л, тобто [Н2О] = 55,55 = const. Добуток Кс· [Н2О] двох постійних величин - також постійна величина, яку позначимо символом KW
Кс [Н2О]= const = KW.
Тоді для автопротоліза води маємо:
або спрощенно:
KW = [H⁺] [OH⁻] (3.4)
Величина KW, називається константа автопротоліза води або іонний добуток води. Вона постійна при постійній температурі. При кімнатній температурі (25 ° С = 298,15 К) числове значення KW дорівнює
KW= 1∙ 10⁻14
Так як числові значення KW дуже маленькі, то замість них прийнято використовувати негативний десятковий логарифм («силовий показник») величини KW. При кімнатній температурі
р KW= -lgKW= - lg10-14 = 14 (3.5)
Оскільки відповідно до формули (3.3) в чистій рідкій воді концентрації іонів водню і іонів гідроксилу однакові [Н3О +] = [ОН], то при кімнатній температурі, з огляду на (3.4), (3.5) і те, що KW = 1·10 -14, маємо для чистої рідкої води:
[Н3О+] = [ОН-] = 10⁻⁷,
pH = -lg[Н3О+] = -lg10⁻⁷=7 (3.6)
pOH= -lg[OH⁻] =-lg10⁻⁷=7
p KW= pH + pOH = 14 (3.7)
Таким чином, при кімнатній температурі:
- в кислих водних розчинах pH <7,
- в нейтральних водних розчинах pH = 7,
- в лужних водних розчинах pH> 7.
3.3. Обчислення рН сильних кислот і основ
Сильні кислоти у водних розчинах дисоціюють повністю. Для бінарних кислот можна записати
НА ↔ Н⁺ + А⁻.
Як видно з рівняння реакції дисоціації сильної кислоти рівноважна молярна концентрація кислоти [HA] = CA дорівнює концентрації іонів водню:
Прологаріфміруем це вираження з протилежним знаком і замінимо негативний десятковий логарифм на рН
- lg [H⁺ ] = pH = - lg CA
Отримуємо формулу для обчислення рН сильних кислот
pH = -lg CA (3.8).
Міркуючи аналогічно, отримуємо для сильних основ:
[OH⁻ ] = CB, де CB – рівноважна молярна концентрація сильної основи.
Прологаріфміруем це вираження з протилежним знаком і замінимо негативний десятковий логарифм на рОН
- lg [ОH⁻ ] = pОH = -lg CВ
Використовуючи вираз (3.7), отримуємо формулу для обчислення рН сильних основ
pH = 14 + lg CВ (3.9)
3.4.Обчислення рН слабких кислот і основ
У загальному випадку відповідно до протолітичнії теорією Бренстеда-Лоурі згідно рівняння (3.2) маємо для дисоціації слабкої одноосновної кислоти:
НА + Н2О ↔ Н3О⁺ + А⁻
Сила кислоти HА кількісно характеризується її константою кислотності КА:
КА = ([A⁻ ] [Н₃О⁺])/CA
Якщо у водному розчині присутня тільки розглянута кислота HA, то, з огляду на, що в стані рівноваги [A⁻]=[H3O+], а також прийнявши, що рівноважна концентрація [A⁻] в першому наближенні дорівнює вихідної концентрації цієї кислоти, [A⁻] = CA,маємо
КА = [Н3О⁺]2/CA ; [Н3О⁺]=√ КА∙ CA
Прологаріфміруем це рівняння c зворотним знаком і зробимо алгебраїчні перетворення отримуємо формулу для обчислення слабких кислот:
-lg[Н₃О⁺] = -1/2lg КА – 1/2lg CA
pH = 1/2pKA - 1/2lg CA (3.10)
-lg КА = рКА- силовий показник (або просто показник кислотності). Чим більше КA (тобто чим менше рКа),тим сильніше кислота.
Коли маємо розчин слабкої основи B, то в ньому встановлюється рівновага
В + Н₂О ↔ ВН⁺ + ОН⁻,
яке характеризується константою основності:
КВ = ([ВН+][OH-])/[B]
З врахуванням того, что [BH+] = [OH–], а [B] = CB, маємо:
КВ= [OH–]2/ CB
з виткі [OH-] =√ КВ∙ CB
Прологаріфмірував це вираження і зробивши відповідні перетворення, отримаємо формулу для обчислення рН слабких основ:
рН = 14 – 1/2рКв + 1/2lg CB (3.11)
Величина рКВ= -lg КВ називається силовим показником (або просто показником) константи основності.
У табл. 3.1 наведені числові значення констант кислотності і основності деяких слабких кислот і основ.
Таблица 3.1 Справжні термодинамічні константи іонізації в водних розчинах деяких кислот і основ.
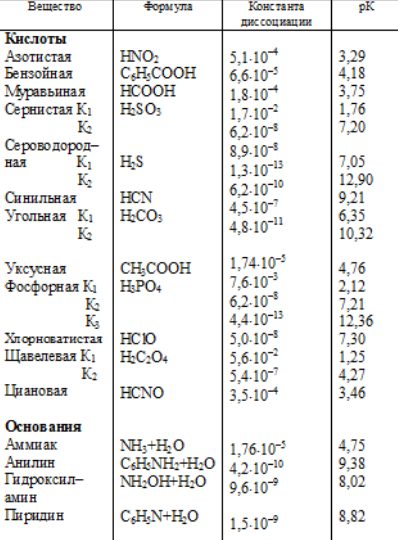
3.5.Буферні розчини. Значення pH буферних розчинів
Якщо у розчин слабкого електроліту ввести інший електроліт, який має з першим загальний йон, то ступінь дисоціації слабкого електроліту стає ще меншим, оскільки рівновага зміщується у бік зворотної реакції згідно з принципом Ле - Шательє.
Введення однойменних йонів у розчин слабкого електроліту зменшує його ступінь дисоціації.
Це явище використовується при одержанні буферних розчинів (від англ. buff – пом’якшувати удар), в яких зберігається постійна концентрація Н+ навіть при додаванні до них невеликих кількостей кислот або лугів.
Буферні розчини це розчини з певною стійкою концентрацією йонів Н+, яка практично не змінюється при додаванні до них невеликих кількостей сильних кислот, лугів або при розведенні чи концентруванні.
Буферні розчини поділяються за хімічним складом на кислотні, основні, амфолітні.
Прикладами буферних систем з суміші речовин можуть служити водні розчини, які містять:
хлороводневу кислоту і гліцин
НС1 + NН2СН2СООН
(Сталість pH можна підтримувати при заданому значенні в інтервалі 1,10-3,50);
гідроксид натрію і гідрофталат калію
NаОН + КНС8Н404
(Сталість pH можна підтримувати при заданому значенні в інтервалі pH = 4,00-6,20);
однозаміщений ортофосфат калію і двозаміщений ортофосфат натрію
КН2РO4 + Nа2НРO4
(Сталість pH можна підтримувати при заданому значенні в інтерва¬ле pH = 4,80-8,00);
ацетатний буфер - водний розчин оцтової кислоти і ацетату натрію
СН3СООН + СН3СОONa
(Сталість pH можна підтримувати при заданому значенні в інтервалі pH = 3,8-6,3);
універсальна буферна суміш (готують, змішуючи розчини ортофосфорної, оцтової і борної кислот з розчином гідроксиду натрію), яка дозволяє підтримувати сталість pH при заданому значенні в широкому інтервалі pH = 1,81-11,98.
Часто використовують буферні розчини, які містять суміш слабкої кислоти і її солі (наприклад, мурашина кислота і форміат натрію НСООН + НСООNа - форміатний буфер) або суміш слабкої основи і солі цього підстави (наприклад, аміак і хлорид амонію NH4OH + NH4OH - амоніачний буфер).
Щоб в буферній системі підтримувалося заданне постійне значення pH, її готують, змішуючи розраховані кількості компонентів, з яких складається буферна суміш.
Розглянемо докладніше два типу буферних систем: систему,яка містить слабку кислоту і її сіль, і систему, яка містить слабку основу і його сіль.
3.6. Кислотний буферний розчин
Кислотний буферний розчин – це суміш слабкої кислоти і солі, утвореної цією кислотою, наприклад, ацетатний буфер (суміш СН3СООН і СН3СООNa), у розчині якого кислота піддається лише частковій дисоціації, а сіль дисоціює повністю:
СН₃СООNa ↔ СН₃СОО⁻ + Na⁺
СН3СООН + H₂O ↔ H₃O⁺ + CH₃COO⁻
При додаванні до такого буферу сильної кислоти, відбувається її взаємодія з сіллю буферу:
Н3О+ + СН3СОО- = СН3СООН + Н2О
У результаті сильна кислота замінюється еквівалентною кількістю слабкої кислоти СН3СООН, тому концентрація йонів Н+ майже не збільшується і рН практично не змінюється.
При додаванні до ацетатної буферної суміші невеликої кількості лугу відбувається його взаємодія зі слабкою кислотою буферу, яка зв'язує йони ОН– в малодисоційовану сполуку:
При цьому сильна основа замінюється еквівалентною кількістю солі, тому значного зменшення концентрації йонів Н+ не спостерігається.
ОН- + СН3СООН = СН3СОО- + Н2О
Розрахуємо величину pH в ацетатному буферном розчині. Концентраційна константа кислотної дисоціації оцтової кислоти дорівнює
KA = ([CH₃COO⁻] [H₃O⁺])/ [ СН3СООН], відкіля
[H₃O⁺] = KA ∙ ([ СН3СООН]/ [CH₃COO⁻])
Оскільки ступінь дисоціації оцтової кислоти α ≤ 1, то рівноважна концентрація [СН3СООН] приблизно дорівнює вихідної концентрації с (СН3СООН), а рівноважна концентрація ацетат-іонів СН3СОО-наближено дорівнює вихідної концентрації ацетату натрію (СН₃СООNa):
[СН3СООН] = с(СН3СООН), [СН3СОО-] = с (СН₃СООNa) .
Тоді [H₃O⁺]= KA (с(СН3СООН)/ с (СН₃СООNa))
Після логарифмування і множення на -1 маємо:
-lg [H₃O⁺] = -lg KA - lg(с(СН3СООН)/ с (СН₃СООNa))
Переходячи до показників, одержуємо:
pH = pKA- lg(с(СН3СООН)/ с (СН₃СООNa))
.
Аналогічні міркування в загальному випадку для буферної системи, що містить слабку одноосновну кислоту НВ і її сіль KatB (Каt + - однозарядний катіон), призводять до формули (3.12):
pH = pKA- lg(сA/ сB), (3.12)
Таке рівняння називається рівнянням Гендерсона-Гассельбаха для кислотного буферного розчину.
3.7. Основний буферний розчин
Основний буферний розчин – це суміш слабкої основи та її солі, утвореної сильною кислотою, наприклад, амоніачний буфер NH4OH і NH4Cl, в якому дисоціація слабкої основи відбувається частково, а дисоціація солі – повністю:
NH₄Cl = NH₄⁺ + Cl⁻
При додаванні до амоніачного буферу невеликої кількості сильної кислоти (HCl) відбувається її взаємодія з основою буферу, внаслідок чого утворюється сіль, а рН розчину майже не змінюється:
HCl + NH4OH à NH4Cl + H2O,
H+ + Cl– + NH4OH à NH4+ + Cl– + H2O,
H+ + NH4OH à NH4+ + H2O
При додаванні лугу (NaOH) в реакцію, навпаки, вступає сіль буферу:
NaOH + NH4Cl à NH4OH + NaCl,
Na+ + OH– + NH4+ + Cl– à NH4OH + Na+ + Cl–,
OH– + NH4+ à NH4OH
Знайдемо величину pH аміачного буфера.
Концентраційна константа рівноваги
NH3 + H2O = NH₄OH = NH₄+ +OH⁻
дорівнює
KB = ([NH₄+] [OH⁻])/ [ NH3], відкіля [OH⁻] = KB ([ NH3]/ ([NH₄+])
При незначному ступені іонізації α ≤ 1 рівноважна концентрація аміаку [NH3], практично дорівнює його вихідної концентрації [NH3], а рівноважна концентрація катіонів амонію [NH₄ +] - приблизно дорівнює вихідної концентрації хлориду амонію (NH₄Cl):
[NH3] ≈ с(NH3), [NH₄+]≈ с(NH₄Cl)
Тоді концентрація гідроксильних іонів [ОН-] дорівнюватиме:
[ОН-] = KB c(NH3) /c( ).
Після логарифмування і множення на -1 отримуємо:
pOH = p KB - lg(c(NH3)/ с(NH₄Cl))
З урахуванням співвідношення (3.7) маємо:
рН = 14 – рОН = 14- p KB + lg(c(NH3)/ с(NH₄Cl))
У загальному випадку для буферної суміші, що містить слабке однокіслотну основу В і його сіль ВА (An- - аніон), аналогічним шляхом можна прийти до формули (3.13):
рН =14 - p KB + lg(cB/ сA) (3.13)
де рКb - показник константи основності слабкого однокіслотної основи В; СВ і Сa - відповідно вихідні концентрації слабкої основи В і його солі А.
Важливою характеристикою буферних розчинів є їх буферна ємність – кількість еквівалентів сильної кислоти чи лугу, яку необхідно додати до 1л буферного розчину, щоб змінити його рН на одну одиницю.
Приклади розв'язання задач
Приклад 1. Розрахуйте рН і рОН 0,1 розчину соляної кислоти НCl.
- Так як хлоридна кислота є сильною кислотою, для розрахунку рН використовуємо формулу (3.8):
pH = - lg CA = - lg0.1= 1
рОН = 14 – рН = 14 – 1 = 13
Приклад 2. Розрахуйте рН і рОН 1 М розчину гідроксиду калію.
Рішення . Гідроксид калію є сильною основою, тому
рН = 14 + lg CВ = 14 + lg1 = 14
рОН = 14 – рН = 14 – 14 = 0
Приклад 3. Розрахуйте рН 0,1 розчину оцтової кислоти CH₃COOH.
Рішення. Оцтова кислота є слабкою кислотою, тому для вирішення використовуємо формулу (3.10):
pH = 1/2pKA - 1/2lg CA
Значення показника кислотності CH₃COOH знаходимо в таблиці 3.1: pKA = 4,76.
рН = 1/2 ∙4,46 -1/2lg0.1= 2.23 + 0.5 = 2.73
рН = 1/2 ∙ 4,46 -1 / 2lg0.1 = 2.23 + 0.5 = 2.73
Приклад 4. Обчислити рН буферного розчину, що містить 0,01 М оцтової кислоти і 0,01 М ацетату натрію.
Рішення. Буферний розчин складається з слабкої кислоти і солі цієї кислоти, для вирішення використовуємо формулу (3.12):
pH = pKA- lg(сA/ сB).
Значення показника кислотності CH₃COOH знаходимо в таблиці 3.1: pKA = 4,76.
Звідси рН = 4,76 - lg (0,01 / 0,01) = 4,76



