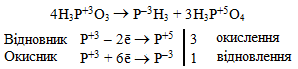- 2.1 Рівняння хімічних реакцій
- 2.2 Класифікація хімічних реакцій
- 2.3 Загальні уявлення про окисно-відновні процеси. Ступінь окиснення
- 2.4 Відновна і окисна здатність речовин
- 2.5 Рівняння окисно-відновних реакцій
- 2.6 Напрямок перебігу окисно-відновних реакцій
- 2.7 Приклади розв'язання типових задач
Ключові терміни:
вищий (максимальний) ступінь окиснення, внутрішньомолекулярна конмутація, внутрішньомолекулярні окисно-відновні реакції, відновлення, відновник, гетерогенні реакції, гомогенні реакції, дисмутація, диспропорціонування, екзотермічні реакції, електронегативність, електрорушійна сила окисно-відновної системи, електрохімічні реакції, ендотермічні реакції, каталітичні реакції, кількісний склад, молекулярні реакції, міжмолекулярна конмутація, міжмолекулярні окисно-відновні реакції, необоротні реакції, нижчий (мінімальний) ступінь окиснення, оборотні реакції, окислення, окисник, окисно-відновна двоїстість, окисно-відновні реакції, правила визначення ступенів окиснення, проміжний ступінь окиснення, радикальні реакції, реакції заміщення, реакції невалентних перетворень, реакції нейтралізації, реакції обміну, реакції розкладу, реакції сполучення, ряд напруг металів, рівняння хімічної реакції, ступінь окиснення, термохімічні реакціі, фаза, фотохімічні реакції, хімічна формула, якісний склад, іонні реакції2.1 Рівняння хімічних реакцій
Для опису хімічних реакцій застосовують рівняння хімічних реакцій.
Рівняння хімічної реакції – це умовний запис, в якому за допомогою хімічних формул сполук і стехіометричних коефіцієнтів зазначають склад і кількість вихідних речовин і продуктів реакції.
Хімічна формула – це умовний запис складу речовин за допомогою хімічних символів та індексів (рис. 2.1).
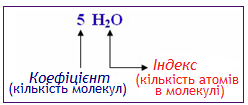
Рисунок 2.1 – Хімічна формула; відмінність між поняттями коефіцієнт та індекс
Хімічна формула дає інформацію про: якісний склад (з атомів яких елементів складається речовина); кількісний склад (скільки атомів кожного елемента входить до складу молекули чи іона); одну молекулу або один моль речовини. Наприклад, з формули (NH4)2Cr2O7 видно, що речовина утворена елементами Нітрогеном N, Гідрогеном Н, Хромом Cr і Оксигеном О (якісний склад); до складу молекули входять два атоми Нітрогену, вісім атомів Гідрогену, два атоми Хрому і сім атомів Оксигену (кількісний склад). Крім того, формула (NH4)2Cr2O7 позначає одну молекулу складної речовини амоній дихромату.
В рівнянні хімічної реакції формули вихідних речовин записують в лівій частині, а кінцевих продуктів, що утворилися у результаті реакції, – в правій (рис. 2.2).
Слід пам’ятати, що під час хімічної взаємодії відбувається перегрупування атомів чи атомних груп, при якому можуть зазнати змін лише електронні оболонки атомів, але ядра атомів лишаються незмінними, тобто нові елементи не утворюються. Для прикладу розглянемо реакцію згоряння метану СН4 в кисні О2, внаслідок чого утворюється вуглекислий газ і вода (рис. 2.2). При цьому розриваються зв’язки С–Н в молекулі метану СН4 і О–О в молекулі кисню О2. На схемі видно, що ті самі атоми С, Н і О, що містилися у вихідних сполуках, після реакції перегрупувалися і входять до складу продуктів реакції – нових сполук з новими властивостями, відмінними від властивостей вихідних речовин.
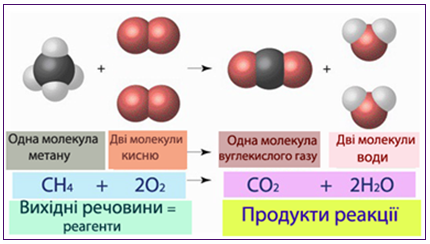
Рисунок 2.2 – Хімічна символіка: рівняння хімічної реакції
2.2 Класифікація хімічних реакцій
Різноманітність хімічних реакцій, кількість яких не піддається підрахункам, неможливо охопити єдиною універсальною класифікацією, тому існує декілька класифікацій, в яких реакції поділяються на окремі групи за певними спільними ознаками (рис. 2.3).
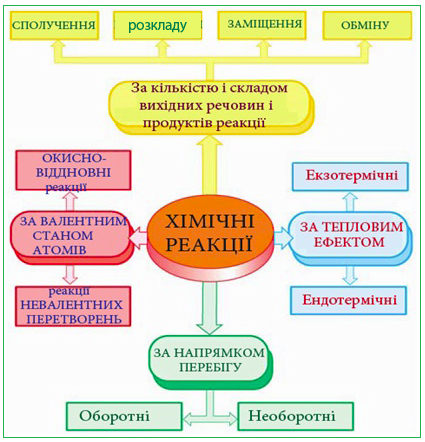
Рисунок 2.3 – Класифікація хімічних реакцій за окремими ознаками
2.2.1 Класифікація за ознакою зміни кількості і складу речовин
Поділ реакцій на типи за ознакою змінення кількості і складу вихідних речовин та кінцевих продуктів реакції наведений в табл. 2.1.
Таблиця 2.1 – Тип хімічних реакцій
|
Умовна схема реакції |
Тип реакції |
Приклад |
|---|---|---|
|
|
Реакції розкладу |
Cu(OH)2 → CuO + H2O 2HgO → 2Hg + O2 |
|
|
Реакції сполучення |
2Fe + O2 → 2FeO SO3 + H2O → H2SO4 |
|
|
Реакції заміщення |
2HCl + Zn → ZnCl2 + H2 CuO + H2 → Cu + H2O |
|
|
Реакції обміну |
AgNO3 + HCl → AgCl + HNO3 NaOH + HNO3 → NaNO3 + H2O |
Розглянемо окремі типи реакцій докладніше.
У загальному вигляді: А → В + С + D, наприклад:
2HI → I2 + H2,
Ca(HCO3)2→ CaO + 2CO2 + H2O;
-
реакції сполучення, в яких з декількох речовин відносно простого складу утворюється одна складніша речовина.
У загальному вигляді: А + В + С → D, наприклад, реакція утворення нітратної кислоти:
4NO2 + O2 + 2H2O → 4HNO3;
-
реакції заміщення, в яких проста речовина заміщує одну з складових частин складної речовини, при цьому утворюються нова проста і нова складна речовини: А + ВС → АВ + С, наприклад:
CuO + H2→ Cu + H2O;
-
реакції обміну, в яких молекули складних речовин обмінюються своїми складовими частинами: АВ + СD → АD + ВС. Наприклад, обмінна реакція між двома солями у водному розчині, внаслідок чого утворюються дві нові солі:
AgNO3 + NaCl → NaNO3 + AgCl↓.
Поширеними типами реакцій обміну вважаються реакції нейтралізації – взаємодія між кислотою і лугом, внаслідок якої утворюються сіль і вода:
H3PO4 + 3KOH → K3PO4 + 3H2O.
2.2.2 Класифікація за валентним станом атомів
За ознакою зміни валентних станів атомів виділяють:
-
окисно-відновні реакції, під час яких відбувається змінення ступенів окиснення у атомів одного чи декількох вихідних речовин. Цей тип реакцій докладно буде розглядатися пізніше, а тут ми обмежимося тільки прикладом рівняння окисно-відновної реакції, в якому вказані ступені окиснення елементів:
![]()
-
реакції невалентних перетворень, в процесі яких змінюється тільки склад речовин, а електронні оболонки окремих атомів залишаються незмінними, а отже й ступені окиснення в атомах всіх елементів не змінюються. Типовими випадками реакцій невалентних перетворень є реакції обміну, а також деякі реакції сполучення та розкладу, наприклад:
![]()
2.2.3 Класифікація за напрямком перебігу реакції
Залежно від напрямку перебігу хімічні процеси поділяються на такі типи:
-
оборотні реакції, при яких пряма і зворотна реакції можуть відбуватися або одночасно, або за певних умов, наприклад, реакція
2Н2 + О2↔ 2Н2О
при температурі 800-1500°С проходить в прямому напрямку, а при 3000-4000°С – у зворотному. А для реакції
Н2 + І2↔ 2НІ
при 300-400°С перебіг проходить одночасно як у прямому, так і зворотному напрямках. Слід пам’ятати, що при запису рівнянь оборотних реакцій замість знаків рівності чи стрілочки (= чи →) використовують дві стрілки, напрямлені у протилежні боки (↔ або ⇔).
-
необоротні реакції, що йдуть в одному напрямку до повного витрачання хоча б одного з реагентів. Необоротні реакції мають свої особливі ознаки (рис. 2.4):
а) продукти реакції виходять з реакційного середовища у вигляді осаду чи газу, наприклад:
![]()
![]()
b) утворюються малодисоційовані сполуки (тобто слабкі електроліти: вода, слабка кислота чи слабка основа), наприклад:
![]()
![]()
![]()
с) змінюється забарвлення реакційного середовища. Наприклад, внаслідок взаємодії натрій хромату з сульфатною кислотою розчин з жовтого перетворюється на яскраво оранжевий:
![]()
d) виділяється велика кількість теплоти (горіння, вибух), наприклад:
![]()

Рисунок 2.4 – Ознаки необоротних реакцій
|
Виділення газу |
Утворення осаду |
|
Змінення забарвлення |
Виділення енергії |
2.2.4 Класифікація за фазовим станом
Необхідно зазначити, що іноді цей вид поділу реакції на типи невірно називають класифікацією за агрегатним станом. Деколи поняття «агрегатний стан» і «фазовий стан» співпадають, однак таке трапляється не завжди.
Фаза – це однорідна частина реакційної системи, що характеризується однаковими фізичними і хімічними властивостями та складом і відокремлюється від інших частин системи поверхнею поділу, при переході через який відбувається стрибкоподібна зміна властивостей.
Виходячи з цього визначення, можна прогнозувати, що, наприклад, у випадку взаємодії між двома газами або між водними розчинами двох речовин відбувається майже миттєве змішування реагентів, тому вся реакційна система завдяки своїй однорідності уявляє собою одну суцільну фазу, в якій рівномірно перемішані і вихідні речовини, і продукти реакції.
Однак якщо у порошок сірки покласти срібний виріб, він досить швидко вкриється чорною плівкою арґентум (І) сульфіду внаслідок реакції
2Ag(тв) + S(тв)→ Ag2S(тв).
Вихідні речовини Ag і S перебувають у твердому агрегатному стані, але між ними існує поверхня поділу, тому вони утворюють дві різні фази – саме на поверхні поділу і відбувається власно хімічна взаємодія. А продукт реакції Ag2S – це ще одна тверда фаза.
Аналогічна ситуація складається і при взаємодії двох рідин, що не змішуються між собою, наприклад, нерозчинної у воді олеїнової кислоти С17Н33–СООН з водним розчином лугу КОН. Більш важкий розчин лугу займає нижню частину посудини, олеїнова кислота, яка має меншу густину, зосередиться зверху, а хімічна взаємодія проходить на межі поділу двох рідин, які утворюють самостійні фази, незважаючи на те, що обидві рідини перебувають в однаковому агрегатному стані.
Отже, за фазовим станом реакції поділяються на такі групи (рис. 2.5):
-
гомогенні реакції, при яких речовини, що містяться в системі, не відокремлюються одна від одної поверхнею поділу. При гомогенних реакціях всі речовини повинні перебувати чи у розчиненому, чи у газуватому стані. Якщо необхідно підкреслити, що деяка реакція є гомогенною, у рівнянні після формул речовин у дужках зазначають їх фазові стани, наприклад, реакція конверсії метану:
CH4(г)+Н2О(г)↔ СО(г)+3H2(г),
чи реакція розчинення рідкого хлор (IV) оксиду з утворенням суміші хлоритної та хлоратної кислот:
Н2О(р) + 2СlO2(p)↔ HClO2(p-н) + HClO3(p-н);
-
гетерогенні реакції, що характеризуються наявністю поверхні поділу фаз, тобто хоч одна сполука знаходиться в іншому агрегатному стані, ніж решта речовин, наприклад:
2NO(г)+H2SO3(p-н)→ N2O(г)+ H2SO4(p-н).
Рисунок 2.5 – Приклади реакцій: а) гомогенна реакція між розчином лугу і хлоридною кислотою (рожеве забарвлення зумовлене додаванням фенолфталеїну)
KOH(р-н) + HCl(р-н) → KCl(р-н) + H2O(р);
б) гетерогенна реакція HCl(р-н) + NH4ОН(р-н) → NH4Cl↑(пари) + H2O(р);
в) гетерогенна реакція, що проходить при змішуванні двох безбарвних розчинів вихідних речовин, внаслідок чого випадає жовтий осад за схемою:
(CH3COO)2Pb(р-н) + 2KI(р-н) → 2CH3COOK(р-н) + PbI2↓
2.2.5 Класифікація за енергетичними ефектами
За характером енергетичної дії виділяють такі реакції:
-
термохімічні реакціі, які супроводжуються тепловим ефектом, тобто енергія підводиться до реакційної системи чи відводиться від неї у формі теплоти. За знаком теплових ефектів термохімічні реакції поділяються на такі типи:
2C4H10 + 13O2→ 8CO2 + 10H2O, ΔH<0;
Знак ΔH < 0 в рівняннях екзотермічних реакцій вказує на виділення теплоти, внаслідок чого тепловміст реакційної системи зменшується.
-
ендотермічні реакції, при яких теплота поглинається, наприклад, утворення нітроген (ІІ) оксиду, яка може перебігати тільки за умов дуже високих температур, тобто при поглинанні значної кількості теплоти:
N2 + O2→ 2NO, ΔH > 0.
Знак ΔH > 0 в рівняннях ендотермічних реакцій вказує на поглинання теплоти, внаслідок чого тепловміст реакційної системи зростає.
-
фотохімічні реакції, які відбуваються під дією світла чи супроводжуються випромінюванням світлової енергії. Прикладом фотохімічної реакції може бути хлорування метану при опромінюванні світлом (позначається hν):
![]()
чи окиснення фосфору, внаслідок чого спостерігається свічення:
10Р + 5О2→ 2Р2О5;
Фотохімічна реакція
-
електрохімічні реакції - це такі хімічні процеси, що відбуваються при пропусканні електричного струму через реакційне середовище (наприклад, при електролізі), або такі хімічні процеси, які викликають виникнення електричного струму (наприклад, при при роботі гальванічних елементів, акумуляторів та при корозії металів).
Електрохімічна реакція
2.2.6 Класифікації за іншими ознаками
Залежно від природи реагуючих частинок реакції поділяються на такі типи:
-
молекулярні реакції, при яких взаємодія між речовинами проходить внаслідок зіткнення окремих молекул реагуючих речовин, наприклад:
2NO + H2→ N2O + H2.
BaCl2 + Na2SO4→ BaSO4↓+ 2NaCl;
Ba2+ + 2Cl– + 2Na++ SO42–→ BaSO4↓+ 2Na+ + 2Cl–;
Ba2+ + SO42–→ BaSO4↓;
-
радикальні реакції, при яких однією з взаємодіючих частинок є радикал – частинка підвищеної реакційної здатності, яка містить неспарений електрон. Радикали при запису позначають за допомогою точки поруч з формулою (•), наприклад:
![]()
За наявності стороннього впливу на швидкість взаємодії реакції поділяються на:
-
каталітичні реакції, що відбуваються за наявності каталізаторів – спеціальних речовин, які прискорюють реакцію, але самі при цьому не витрачаються, наприклад, розклад гідроген пероксиду в присутності манган (IV) оксиду:
![]()
-
некаталітичні реакції, в яких вплив каталізатору відсутній. Наприклад, без каталізатора проходять реакції:
![]()
![]()
Одна й та ж сама реакція залежно від ознаки, що розглядається, може класифікуватися по-різному. Наприклад, синтез NH3(г) із газів N2 і H2 у присутності залізного каталізатора є реакцією сполучення і одночасно належить до окисно-відновних, гомогенних, молекулярних, каталітичних, термохімічних і оборотних реакцій.
Наведені класифікації охоплюють лише більшість неорганічних реакцій, але ними не вичерпуються всі типи хімічних реакцій. Реакції, що відбуваються за участю органічних сполук, можуть класифікуватися ще й за іншими ознаками.
2.3 Загальні уявлення про окисно-відновні процеси. Ступінь окиснення
У природі та техніці більшість реакцій супроводжується зміщенням чи повним передаванням електронів від одних взаємодіючих частинок до інших. Ці процеси мають надзвичайно важливе значення і являють собою особливий вид хімічної взаємодії, яка називається окисно-відновними реакціями.
Окисно-відновні реакції – це хімічні процеси, при яких відбуваються змінення ступенів окиснення у атомів одного чи декількох елементів.
Під час окисно-відновних реакцій змінюється валентний стан взаємодіючих атомів завдяки перерозподілу електронної густини при утворенні хімічних зв’язків, а це спричиняє зміну ступенів окиснення атомів.
Ступінь окиснення – це умовний заряд атома в молекулі, який визначається, виходячи з припущення, що молекула складається з одноатомних іонів.
Знак заряду такого гіпотетичного іона встановлюється з урахуванням полярності ковалентного зв’язку та зміщення спільних електронних пар у бік атома більш електронегативного елемента, який набуває від’ємного ступеня окиснення, а атом з меншою електронегативністю – додатного.
Доречно згадати поняття «електронегативність».
Електронегативність [TEX]{\chi}[/TEX] – це величина, що характеризує здатність атома одного елемента зміщувати в свій бік від атома іншого елемента електронну густину зв’язку, яка хімічно сполучає обидва атоми.
Внаслідок зміщення електронної густини на атомі елемента з більшою електронегативністю формується частковий негативний заряд, а на сполученому з ним атомі іншого елемента – частковий позитивний заряд. За електронегативністю елементи розташовуються у ряд:
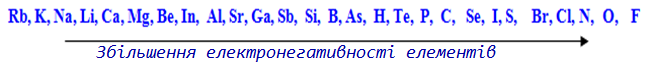
Ступінь окиснення записується арабськими цифрами угорі над символом хімічного елемента з попереднім знаком « +» або «–», наприклад,
![]()
Слід пам’ятати, що заряди іонів у сполуках на відміну від ступенів окиснення атомів записуються арабськими цифрами із знаком «+» або «–» після цифри і розміщуються угорі праворуч від символів хімічних елементів, наприклад,
![]()
Для знаходження ступенів окиснення атомів елементів у сполуці спираються на певні правила визначення ступенів окиснення.
-
Атоми елементів у простій сполуці мають ступінь окиснення, що дорівнює нулю:
![]()
-
Cтупінь окиснення атомів Оксигену O в складних сполуках дорівнює –2, за винятком:
![]()
![]()
-
Атоми Гідрогену H у складних сполуках мають ступінь окиснення +1, крім гідридів активних металів:
![]()
-
Атоми Флуору F як найбільш електронегативного елемента в складних сполуках завжди виявляють ступінь окиснення –1:
![]()
-
Ступінь окиснення атомів лужних металів у складних сполуках дорівнює +1, а лужноземельних – +2, наприклад:
![]()
-
У нейтральних молекулах та кристалах алгебраїчна сума ступенів окиснення всіх атомів дорівнює нулю (рис. 2.6 а), а у будь-якому іоні – заряду іона (рис. 2.6 б). Виходячи з цього, визначають ступені окиснення атомів усіх елементів у молекулі або іоні. Наприклад, ступені окиснення атомів S і Cr в молекулі BaSO4 та в іоні Cr2O72– можна обчислити за методом простих алгебраїчних рівнянь з одним невідомим:
![]()
![]()
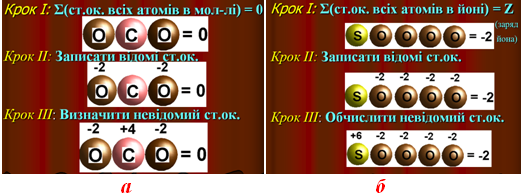
Рисунок 2.6 – Схема алгоритму визначення невідомого ступеню окиснення на прикладі молекули СО2 та іона SО42–
-
Вищий (максимальний) ступінь окиснення для атомів більшості елементів, за невеликим винятком (елементи VІІІ групи, F, O, Br) визначається за номером групи періодичної системи: max. ст.ок. = № групи. Наприклад, елементи N, Mn, Ge, Se, Cr і Ga розміщуються відповідно у VA-, VIIВ-, IVA-, VIA-, VIB- і IIIA-підгрупах, тому для кожного з них максимальний ступінь окиснення є таким:
![]()
Однак цьому правилу не підкоряється частина d-елементів (рис. 2.7), а також наведені нижче р-елементи, над символами яких зазначений максимальний ступінь окиснення:
![]()
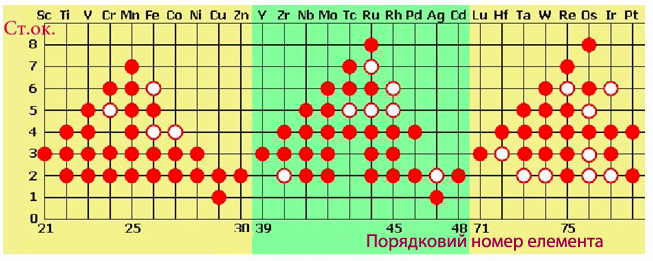
Рисунок 2.7 – Ступені окиснення d-елементів
-
Нижчий (мінімальний) ступінь окиснення для атомів елементів ІVА-VІІА-підгруп розраховується із співвідношення: min. ст.ок. = (№ групи – 8), наприклад, селен є елементом VІА-підгрупи, тому його нижчий ступінь окиснення: 6 – 8 = –2. Для d-елементів нижчий ступінь окиснення дорівнює нулю. Приклади мінімальних ступенів окиснення деяких елементів:
![]()
Розглянемо особливості визначення ступенів окиснення на прикладі сполук NH3 i NO2. В амоніаку атоми більш електронегативного елемента N мають більш від’ємний умовний заряд порівняно з атомами елемента Н (значення електронегативностей цих елементів складають: [TEX]\chi_{(\rm{N})}=3,0[/TEX] і [TEX]\chi_{(\rm{H})}=2,1[/TEX]). У нітроген (ІV) оксиді більш електронегативним є Оксиген ([TEX]\chi_{(\rm{O})}=3,5[/TEX], [TEX]\chi_{(\rm{N})}=3,0[/TEX]), тому атом N набуває вже позитивного ступеня окиснення:
![]()
![]()
У цілому ступінь окиснення атомів у сполуках може бути позитивним, негативним, дорівнювати нулю, набувати цілочислових або дробових значень, наприклад:
![]()
Ступінь окиснення не слід ототожнювати з валентністю атомів навіть тоді, коли їх абсолютні значення випадково збігаються. Валентність визначається кількістю зв’язків, якими даний атом сполучається з іншими атомами, тому вона не може мати від’ємних значень або дорівнювати нулю. Як приклад можна розглянути ряд органічних сполук, в яких чотиривалентний атом Карбону виявляє різні ступені окиснення (для наочності в структурних формулах кожний зв’язок позначений рисочкою):
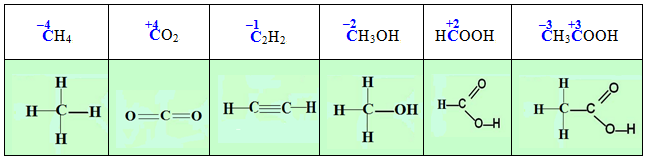
З іншого боку, ступінь окиснення не має нічого спільного з дійсним, або ефективним зарядом атомів у сполуках. Наприклад, у сполуках CrCl3 і K2CrО4 атоми Хрому (+3) і Хрому (+6) мають ефективні заряди відповідно +1,2 і 0,2.
Зрозуміло, що ступінь окиснення є поняттям умовним і певною мірою формальним, однак широко використовується при вивченні окисно-відновних властивостей речовин, при встановленні коефіцієнтів, а також при стехіометричних розрахунках для окисно-відновних реакцій.
В окисно-відновних реакціях змінення ступенів окиснення зумовлене зміщенням електронів від атомів одного елемента до атомів іншого, але формально це зміщення зручно вважати повним переходом електронів від атомів одного елемента до атомів іншого. Для прикладу візьмемо горіння металевого магнію за рівнянням
2Mg + О2 [TEX]\rightarrow [/TEX] 2MgO,
яке супроводжується переходом двох електронів від атома Магнію до атома Оксигену. Внаслідок приєднання двох електронів атоми Оксигену набувають стабільної електронної конфігурації, що складається з восьми електронів (2s22p6):
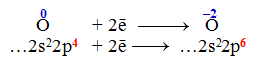
З іншого боку, в атомі Магнію після втрати двох електронів з зовнішнього 3s-підрівня електронна конфігурація (2s22p6) теж стає стабільною:
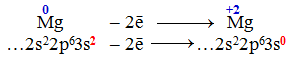
Процес віддавання атомом електронів, що супроводжується підвищенням ступеня окиснення, називається окислення, а процес приєднання електронів, при якому ступінь окиснення зменшується, – відновлення. Атом, який приєднує електрони і зменшує свій ступень окиснення, називається окисник, а атом, що віддає електрони і підвищує свій ступінь окиснення, називається відновник.
Терміни «окисник» і «відновник» поширюються і на сполуки, що містять відповідно атоми-окисники і атоми-відновники.
Отже, при згорянні магнію речовиною-окисником є кисень, якій відновлюється внаслідок реакції, а речовиною-відновником – магній, який піддається окисленню:
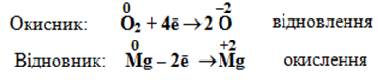
Горіння магнію
Підвищення ступеня окиснення при віддаванні електронів і зниження ступеня окиснення при їх приєднанні зручно уявити, користуючись графічною шкалою (рис. 2.8) і пам’ятаючи про негативний заряд саміх електронів.
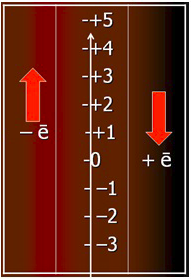
Рисунок 2.8 – Підвищення та зниження ступеню окиснення
Терміни «окислення» і «відновлення» зберігаються і в тому випадку, коли електрони лише зміщуються від якогось атома (процес окислення) або до нього (процес відновлення). Обидва процеси є обов’язковими та взаємозалежними складовими однієї загальної реакції і відбуваються одночасно, тому неможливий перебіг відновлення без окислення і навпаки (рис. 2.9).
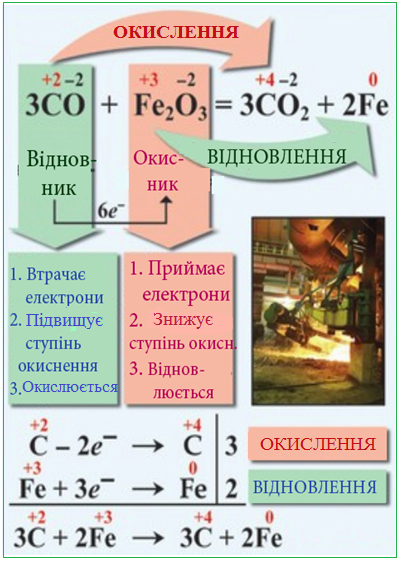
Рисунок 2.9 – Взаємозалежність процесів окислення та відновлення
2.4 Відновна і окисна здатність речовин
Окисно-відновні властивості речовин залежать від багатьох чинників: будови атомів і положення елементів у періодичній системі, а також від значення ступеня окиснення елементів, що входять до складу сполуки.
У малих періодах із зростанням порядкового номера елемента зменшується атомний радіус, а кількість валентних електронів на зовнішньому шарі збільшується, тому послаблюється здатність атома віддавати електрони і, навпаки, посилюється здатність приєднувати їх, тобто відновні властивості зменшуються, а окисні – зростають.
У головних підгрупах у міру збільшення заряду ядра зростає як кількість електронних шарів, так і радіус атома, зовнішні електрони розміщуються все далі від ядра і дужче екрануються внутрішніми електронними шарами. Через те полегшується віддавання електронів (отже, посилюється відновна активність) і ускладнюється їх приєднання (послаблюються окисні властивості атомів елементів).
2.4.1 Типові відновники
До типових відновників належать такі групи сполук.
-
Нейтральні атоми, на зовнішньому рівні яких міститься невелика кількість електронів (1-4): метали та деякі неметали (Н2, В, С, Si). У цій групі відновників особливо важливими є метали ІА-, ІІА-підгруп, Al, Zn, Fe, а також лантаноїди і актиноїди. Відновні властивості металів у реакціях, що протікають у водних розчинах, зменшуються від початку до кінця певної послідовності, яка називається ряд напруг металів:
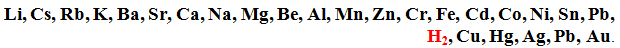
У хімічних реакціях неметали Е0 і метали Ме0 віддають електрони і окислюються за однією з загальних схем:
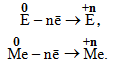
-
Негативно заряджені іони неметалів En–, які здатні віддавати не тільки надлишкові електрони, але і власні електрони зі свого зовнішнього електронного шару. Наприклад, сульфід-іон може окислюватися до вільної сірки і навіть до більш високих ступенів окиснення, включаючи максимальний:
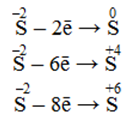
При однаковому негативному заряді відновна властивість іонів зростає із збільшенням атомного радіуса. Так, серед галогенід-іонів відновні властивості посилюються в ряді: Cl–1 < Br–1 < I–1, а фторид-іон F–1 відновних властивостей взагалі не виявляє. До цієї ж групи відновників належать також гідриди лужних та лужноземельних металів (NaH, CaH2), що містять гідрид-іон Н–1, який легко окислюється:
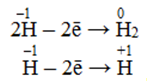
-
Іони деяких металів у низьких ступенях окиснення, які здатні виявляти і більш високі ступені окиснення, наприклад:
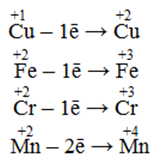
-
Cкладні іони або молекули, що містять атоми у проміжних ступенях окиснення, теж виявляють відновні властивості, наприклад:
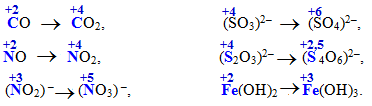
2.4.2 Типові окисники
До типових окисників належать такі групи сполук.
-
Нейтральні атоми і молекули неметалів. Найсильніші окисники серед простих речовин містяться у VІІА- і VІА-підгрупах (атоми цих елементів можуть приєднувати відповідно один або два електрони), а найслабкіші – атоми елементів ІVА-підгрупи, яким до набуття стабільної електронної конфігурації необхідно приєднати аж чотири електрони. У межах однієї підгрупи із зростанням порядкового номера окисні властивості зменшуються. Так серед галогенів окисна здатність послаблюється в ряді: F02 > Cl02 > Br02 > I02, а найактивнішим окисником є фтор.
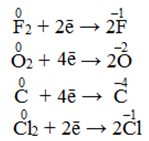
-
Позитивно заряджені іони металів, які здатні приєднувати електрони і відновлюватися. Окисні властивості іонів металів у реакціях, що перебігають у водних розчинах, зменшуються від кінця ряду напруг до його початку, тобто найсильнішими окисниками серед позитивно заряджених іонів металів є катіони Ауруму (+3):
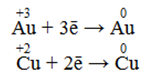
Якщо металу притаманні змінні ступені окиснення, то його окисна властивість тим сильніша, чим вищий ступінь окиснення виявляють атоми метала. Наприклад, Cu3+ є більш сильним окисником, ніж Cu2+.
-
Позитивно заряджені іони Гідрогену Н+, що містяться у розчинах неокиснювальних кислот (H2SO4(розв), H3РO4, HCl, HBr, H2S, органічні кислоти), виявляють окисні властивості, тому можуть окислювати метали, які стоять у ряді напруг до водню, а самі при цьому відновлюються:
![]()
-
Складні молекули чи іони, що містять атоми елементів у максимальному (або достатньо високому) ступені окиснення: кислоти H2SO4(конц) i HNO3 та їх солі; іони ClО3–, MnО4–, MnО42–, CrО42–, Cr2O72– тощо. При цьому глибина і характер відновлення залежать від умов реакції: типу відновника, концентрації реагенту, реакційного середовища, природи розчинника, температури. Наприклад, концентрована сульфатна кислота може відновлюватися металами різним чином залежно від їх положення в ряді напруг: чим активніший метал і чим вища концентрація H2SO4, тим глибше її відновлення, яке відбувається за однією із схем:
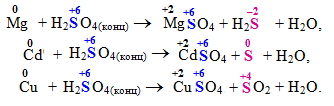
Розведена нітратна кислота HNO3 теж може відновлюватися металами до різних продуктів, які містять атоми N в невисоких ступенях окиснення, наприклад:
![]()
Слід зазначити, що амоній нітрат NH4NO3 утворюється тоді, коли HNO3 береться у великому надлишку (NH3 + HNO3(надл) → NH4NO3 + H2O). У цьому випадку спостерігається зворотна залежність: чим активніший метал і чим сильніше розведена нітратна кислота HNO3, тим глибше вона відновлюється.
Характер відновлення перманганат-іона (MnО4–) – сильного окисника, що широко застосовується в хімічних процесах, – залежить від середовища: в кислому MnО4– відновлюється до Mn+2, у нейтральному – до Mn+4, у лужному – до Mn+6.
Характер відновлення калій перманганату залежно від реакції середовища
2.4.3 Окисно-відновна двоїстість
Ступінь окиснення атомів певного елемента у конкретній сполуці суттєво впливає на окисно-відновні властивості.
При підвищенні ступеня окиснення збільшується окисна здатність атомів елемента, а при зниженні – навпаки, посилюються відновні властивості.
Розглянемо ряд нітрогенвмісних сполук:
![]()
Нітратна кислота HNO3, в якій Нітроген (+5) виявляє максимальний ступінь окиснення, характеризується виключно окисними властивостями і може тільки відновлюватися за однією із схем:
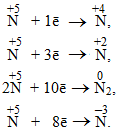
Амоніак NH3 містить атоми Нітрогену (–3) в мінімальному ступені окиснення, тому він може бути лише відновником і здатний тільки окислюватися, наприклад:
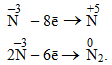
Сполуки, в яких N має проміжний ступінь окиснення (від +4 до –2), залежно від умов можуть виявляти як окисний, так і відновний характер – така властивість називається окисно-відновна двоїстість, наприклад:
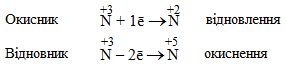
Деякі речовини, що містять атоми елементів у проміжному ступені окиснення, залежно від складу сполуки, з якою вони взаємодіють, можуть виявляти відновні або окисні властивості. Наприклад, Н2О2 та інші пероксиди з більш сильними відновниками поводять себе як окисники і відновлюються внаслідок реакції, наприклад:
![]()
а з більш сильними окисниками – як відновники і окислюються під час реакції, наприклад:
![]()
Окисно-відновна двоїстість гідрогенпероксиду Н2О2
Аналогічні властивості характерні і для багатьох інших сполук:
-
нітритна (азотиста) кислота HNO2 та її солі нітрити, до складу яких входить нітрит-іон NO2–, наприклад:
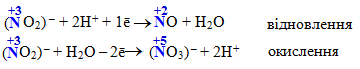
-
сульфітна (сірчиста) кислота H2SO3 та її солі сульфіти, що містять сульфіт-аніон SO32–:
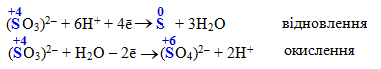
-
вільні галогени хлор, бром, йод (крім фтору F2!), наприклад, йод:
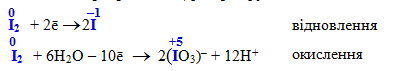
-
вільний фосфор:
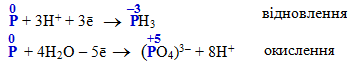
-
вільна сірка:
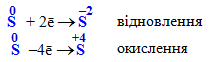
Підсумовуючи розглянуті відомості про окисники та відновники, можна зробити загальний висновок: Атоми елементів, що мають найвищий (максимальний) ступінь окиснення, можуть лише приєднувати електрони і тому в окисно-відновних реакціях виявляють виключно окисні властивості. Наприклад:
![]()
Атоми елементів, які мають найнижчий (мінімальний) ступінь окиснення, можуть лише віддавати електрони і тому виявляють тільки відновні властивості. Наприклад:
![]()
Атоми елементів, які мають проміжний ступень окиснення, можуть як приєднувати електрони, так і віддавати їх, тому залежно від умов реакції здатні виявляти як окисні, так і відновні властивості – окисно-відновна двоїстість. Наприклад:
![]()
2.5 Рівняння окисно-відновних реакцій
Будь-який окисно-відновний процес можна умовно поділити на дві складові: напівреакція окислення і напівреакція відновлення. Для складання рівнянь окисно-відновних реакцій необхідно оцінити окисно-відновні властивості реагентів і визначити речовину-окисник, до складу якої входять атоми елемента у максимальному (або близькому до нього) ступені окиснення, та речовину-відновник, що містить атоми елемента в низькому ступені окиснення. Далі, виходячи з хімічного характеру кожного з цих елементів, слід спрогнозувати склад сполук, що утворюються внаслідок напівреакцій окислення та відновлення, а також склад побічних продуктів, і розставити коефіцієнти.
При складанні окисно-відновних реакцій застосовують два методи: електронного балансу та іонно-електронний. Обидва методи ґрунтуються на обов’язковій умові: в окисно-відновних реакціях кількість електронів, що віддає відновник, повинна дорівнювати кількості електронів, яку приймає окисник.
2.5.1 Метод електронного балансу
Досить велику кількість окисно-відновних реакцій неможливо урівняти простим підбором коефіцієнтів, тому частіше звертаються до метода електронного балансу. Для прикладу запишемо схему взаємодії між алюмінієм і киснем:
Al + O2 → Al2O3.
Оскільки баланс – це рівність, необхідно зрівняти кількість електронів, що віддає відновник, з кількістю електронів, що приєднує окисник. Для цього спочатку визначають ступені окиснення елементів до і після реакції:
![]()
З порівняння ступенів окиснення видно, що атоми Al віддають електрони і набувають позитивного ступеня окиснення, а атоми О, навпаки, приєднують електрони і набувають негативного ступеня окиснення. Для досягнення ступеню окиснення +3 атом Алюмінію повинний віддати три електрони, а двом атомам Оксигену для набуття ступеня окиснення –2 необхідно прийняти чотири електрони, як показано на схемі:
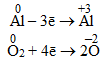
Щоб кількості прийнятих і відданих електронів зрівнялися, кожний член першої напівреакції необхідно помножити на 4, а другої – на 3. Ці множники записують справа від напівреакцій за вертикальною рискою:
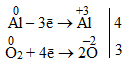
Якщо помножити кожний член обох напівреакцій на відповідні множники, загальна кількість втрачених відновником і прийнятих окисником електронів стає рівною 12:
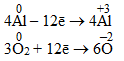
Отже, електронний баланс досягнуто. Одночасно зрівнялися кількості атомів кожного елемента до і після реакції. Після цього одержані коефіцієнти переносять у рівняння реакції:
4Al + 3O2 = 2Al2O3.
Алгоритм методу електронного балансу розглянемо докладніше на іншому прикладі – взаємодії калій дихромату з концентрованою соляною (хлоридною) кислотою.
-
Записують формули вихідних речовин і вказують ступені окиснення всіх елементів:
![]()
-
Визначають, яка сполука виступатиме у ролі окисника, а яка – відновника. У наведеному прикладі К2Cr2O7 містить Хром (+6) у максимальному ступені окиснення, тому він може бути тільки окисником, який у кислому середовищі звичайно відновлюється до Cr+3. А сполука HCl, в якій Хлор (–1) виявляє мінімальний ступень окиснення, буде відновником. Найімовірніше, що Хлор (–1) окислюється до вільного хлору. Очевидно, що продуктами реакції будуть такі речовини:
![]()
-
Зазначають елементи зі змінними ступенями окиснення, вказуючи елемент-окисник і елемент-відновник. При цьому враховують кількість атомів кожного елемента, що міститься у сполуці. Оскільки К2Cr2O7 має два атоми Хрому (+6), то згідно із законом збереження маси і утворюватися будуть два атоми Хрому, але вже в іншому ступені окиснення (+3), що обов’язково відображається коефіцієнтами. Подвоєння кількості атомів за допомогою індексів застосовується тільки у випадку простої речовини:
![]()
-
Розраховують загальні кількості електронів, що приймають атоми окисника і віддають атоми відновника:
![]()
-
Підбирають множники (основні коефіцієнти) для обох напівреакцій так, щоб після множення на них загальна кількість електронів, які приймає окисник, дорівнювала загальній кількості електронів, які віддає відновник. У схемі електронного балансу ці множники записуються за вертикальною рискою напроти відповідних напівреакцій:
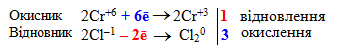
-
Помножують кожний член обох напіреакцій на знайдені основні коефіцієнти. Після цього складають рівняння напівреакцій (записуючи разом ліві частини, а потім через стрілку – праві) та скорочують електрони:
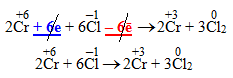
-
Переносять одержані коефіцієнти в схему окисно-відновної реакції:
K2Cr2O7 + 6HCl → 2CrCl3 + 3Cl2 + KCl + H2O.
-
Визначають коефіцієнти для тих речовин, атоми яких не змінили своїх ступенів окиснення. З рівняння реакції видно, що тільки шість атомів Хлору хлоридної кислоти відновилися до Cl2, а на утворення солей CrCl3 i KCl витрачається ще деяка кількість HCl, тому коефіцієнт перед формулою HCl повинний ураховувати й ті атоми Хлору (–1), які не змінили свого ступеня окиснення, як це показано на схемі:
![]()
Остаточно рівняння розглянутої окисно-відновної реакції набуває вигляду:
K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
2.5.2 Іонно-електронний метод
В основі іонно-електронного метода теж лежить принцип балансу електронів і однакової кількості атомів кожного елемента у лівій та правій частинах рівнянь напівреакцій окислення та відновлення. Однак при складанні цих напівреакцій спираються не на кількість окремих атомів, а на кількість іонів і молекул, до складу яких входять атоми елементів зі змінними ступенями окиснення. Оскільки іони і молекули найчастіше містять атоми О і Н, то для зрівнювання кількості атомів Оксигену і Гідрогену ліворуч і праворуч дописують формули іонів Н+, ОН– або молекули Н2О.
Застосуємо іонно-електронний метод на тому ж самому прикладі взаємодії калій дихромату з концентрованою соляною (хлоридною) кислотою.
-
Визначають ступені окиснення атомів елементів і виділяють формули іонів або нейтральних молекул (в тому випадку, коли сполука не дисоціює на іони), що містять атоми елементів зі змінними ступенями окиснення. На схемі відповідні молекули та іони підкреслені:
![]()
-
Записують окремо формули іонів-окисників (у нашому прикладі це Cr2O72–) та іонів-відновників (Cl1–), а після стрілки – формули частинок, що є продуктами процесів відновлення і окислення:
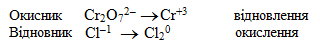
-
За допомогою проміжних коефіцієнтів зрівнюють у лівій і правій частинах напівреакцій кількості атомів елементів, що змінили ступені окиснення:
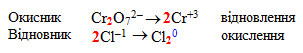
-
В напівреакції окислення кількість атомів Хлору в обох частинах рівняння однакова, а в напівреакції відновлення праворуч не вистачає семи атомів О, тому там слід дописати 7Н2О. Однак при цьому додатково з’являється чотирнадцять атомів Гідрогену, тому ліворуч дописують 14Н+:
![]()
-
Після зрівнювання кількості атомів всіх елементів слід досягти рівності сумарних зарядів у лівих і правих частинах обох напівреакцій шляхом додавання чи віднімання відповідної кількості електронів:
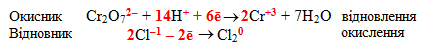
-
Підбирають множники для обох напівреакцій так, щоб після множення на них загальна кількість електронів, які приймає окисник, дорівнювала загальній кількості електронів, які віддає відновник.
![]()
-
Перемножують на знайдені множники кожний член обох напівреакцій і складають окремо ліві та праві частини:
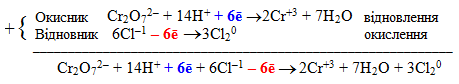
Після скорочення електронів одержуємо:
![]()
-
Переносять коефіцієнти у молекулярне рівняння реакції і підбирають необхідні коефіцієнти перед формулами решти речовин (у цьому прикладі – КCl):
![]()
2.5.3 Типи окисно-відновних реакцій
Окисно-відновні реакції поділяють на три основні типи.
-
Міжмолекулярні окисно-відновні реакції, в яких атоми елемента-окисника і атоми елемента-відновника входять до складу різних сполук, наприклад (про складання електронного балансу для цієї реакції див. §2.1, приклад 2.10):
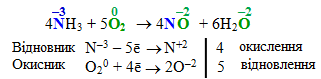
До цього типу належить ще один вид взаємодії: міжмолекулярна конмутація – окисно-відновна реакція, що проходить між різними речовинами, які містять атоми одного елемента у різних ступенях окиснення, наприклад:
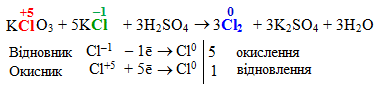
Як інші приклади міжмолекулярної конмутації можна навести процеси, що відбуваються при нагріванні до різних температур суміші амоній сульфату і кальцій нітрату. При цьому окисно-відновні взаємодії перебігають між атомами Нітрогену (–3) сполуки-відновника ((NH4)2SO4) та іншими атомами Нітрогену (+5) сполуки-окисника (Ca(NO3)2):
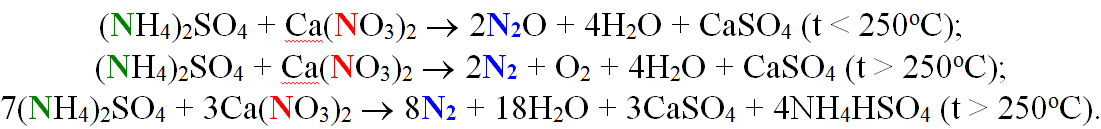
Досить часто міжмолекулярні реакції проходять за участю декількох окисників чи відновників, що необхідно ураховувати при складанні електронного балансу. Наприклад, під час вибуху чорного пороху одночасно відбуваються три реакції (в рівняннях відновники виділені синім, а окисники – зеленим шрифтом).
Для першої з цих реакцій наводимо всі рівняння електронного балансу:
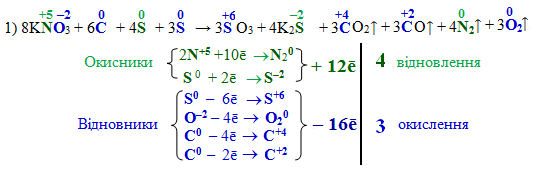
![]()
![]()
Горіння чорного пороху
-
Внутрішньомолекулярні окисно-відновні реакції, в яких атоми елемента-окисника і атоми елемента-відновника входять до складу однієї сполуки, наприклад:
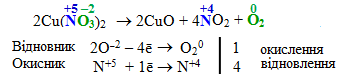
Яскравим прикладом внутрішньомолекулярного типу окисно-відновних реакцій є розклад амоній дихромату; при цьому окисник ([TEX]\rm{\color{green} {Cr^{+6}}}[/TEX]) і відновник ([TEX]\rm{\color{blue} {N^{–3}}}[/TEX]) входять до складу однієї сполуки:
![]()
Внутрішньомолекулярна окисно-відновна реакція
До цього типу належать і так звана внутрішньомолекулярна конмутація – розклад речовин, які містять атоми одного елемента у різних ступенях окиснення. Як приклад внутрішньомолекулярної конмутації можна згадати розклад амоній нітрату (NH4NO3), який містить атоми Нітрогену (–3) і Нітрогену (+5). Залежно від умов реакція проходить різним чином. Так, при температурі близько 200oС вона перебігає за схемою:
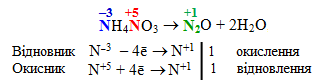
-
Диспропорціонування (або дисмутація) – окисно-відновні реакції, які супроводжуються одночасним зменшенням і збільшенням ступеня окиснення атомів одного й того ж самого елемента, що входить до складу молекул однієї сполуки. Реакціям диспропорціонування підлягають лише речовини, що містять атоми елемента у проміжному ступені окиснення, наприклад:
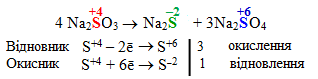
2.6 Напрямок перебігу окисно-відновних реакцій
Обидва методи – і електронного балансу, й іонно-електронний – дозволяють розставити коефіцієнти і встановити стехіометричні співвідношення між речовинами в окисно-відновних реакціях, але не дають ніяких відомостей про реальну можливість їх перебігу. Для визначення напрямку перебігу окисно-відновних реакцій зручно користуватися електрохімічним методом. Сутність його полягає в тому, що кожна окисно-відновна система характеризується власним значенням стандартного електродного потенціалу ε0 (інколи він позначається іншою грецькою буквою – φо), величини яких наводяться у спеціальній літературі (табл. 2.2).
Таблиця 2.2 – Стандартні електродні потенціали деяких окисно-відновних систем
|
Напівреакція |
Стандартний електродний |
|---|---|
|
F2 + 2ē → 2F– |
+2,87 |
|
2HBrO + 2H+ + 2ē → Br2 + 2H2O |
+1,574 |
|
MnO4– + 8H+ + 5ē → Mn2+ + 4H2O |
+1,531 |
|
BrO3– +5H+ + 4ē → HBrO + 2H2O |
+1,495 |
|
Сг2072– 14Н++ 6ē →2Сг3+ + 7Н20 |
+1,360 |
|
Cl2 + 2ē → 2Cl– |
+1,36 |
|
O20 + 4H+ + 4ē → 2Н2О |
+1,229 |
|
Br2 + 2ē → 2Br– |
+1,07 |
|
I2 + 2ē → 2I– |
+0,54 |
|
NO3– + 2H+ +3ē → NO + 2H2O |
+0,78 |
|
О20 + 2Н2О + 4ē → 4ОН− |
+0,401 |
|
SO42–+ 4H+ +2ē → SO2 + 2H2O |
+0,20 |
|
SO42–+ 8H+ +8ē → S2–+ 4H2O |
+0,15 |
|
S + 2H+ + 2ē → H2S |
+0,14 |
|
S + 2ē → S2– |
-0,48 |
|
2Н2О + 2ē → Н2 + 2ОН− |
-0,826 |
|
SO42–+ H2O + 2ē → SO32– + 2OH– |
-0,93 |
В умовному запису стандартного електродного потенціалу окисно-відновної системи спочатку вказують її окислену форму, а потім через косу риску – відновлену, не зважаючи на те, якому процесу (окислення чи відновлення) піддається система. Наприклад, у прямій реакції
4HCl(р-н) + O2(г)↔ 2Cl2(г) + 2H2O(р),
окисником є кисень, відновником – хлороводень, а у зворотній реакції окисником є хлор і відновником – вода. Однак і для прямої, і для зворотної реакції стандартні електродні потенціали мають однаковий вигляд:
ε0(Cl2/2Cl–) =1,36 В, ε0(O20+4H+/2Н2О) = +1,229 В.
З позицій електрохімії можливий самочинний перебіг такої окисно-відновної реакції, для якої електрорушійна сила окисно-відновної системи є додатною, тобто Е > 0. А ЕРС обчислюється за різницею електродних потенціалів окисника і відновника:
Е = ε0окисника – ε0відновника.
Тоді для прямої реакції, в якій окисником є О2, електрорушійна сила дорівнює:
Епрям = ε0(O20+4H+/2Н2О) – ε0(Cl2/2Cl–) = 1,229 – 1,36 = –0,131 В,
а для зворотної, в якій роль окисника відіграє Cl2, ЕРС становить:
Езвор = ε0(Cl2/2Cl–) – ε0(O20+4H+/2Н2О) = 1,36 – 1,229 = +0,131 В.
Оскільки додатною є величина ЕРС зворотної реакції, то відбувається саме вона:
2Cl2(г) + 2H2O(р)→ 4HCl(р-н) + O2(г).
Отже, для визначення напрямку перебігу реакції на основі обчислення ЕРС прямої та зворотної реакцій, спочатку необхідно встановити, яка сполука відіграє роль окисника, а яка – відновника для обох напрямків. Для прикладу розглянемо систему
![]()
Внаслідок прямої реакції
![]()
ступінь окиснення знижується у атомів Мангану (від +7 до +2), тому речовиною-окисником у прямій реакції є калій перманганат КMnО4, для якого довідкове значення стандартного окисно-відновного потенціалу складає:
ε0(MnО4−+8Н+/Mn2++4Н2О) = +1,531 В.
Якщо взяти зворотну реакцію
![]()
то внаслідок неї ступінь окиснення зменшується у атомів Сульфуру (від +6 до –2), тому речовиною-окисником для зворотної реакції є вже інша сполука – натрій сульфат Na2SO4, для якого стандартний окисно-відновний потенціал дорівнює:
ε0(SO42–+8H+/S2–+4H2O) = +0,15 В.
Тепер необхідно обчислити величини електрорушійної сили для прямої (Епрям) та зворотної реакцій (Езвор):
![]()
![]()
Як видно, значення ЕРС для прямої реакції є додатним (Епрям > 0), а для зворотної – від’ємним (Езвор < 0), тому можна написати відповідне рівняння реакції і розставити коефіцієнти за допомогою іонно-електронного методу:
![]()
![]()
2.7 Приклади розв'язання типових задач
Приклад 2.1. Визначити, до якого типу належить реакція, що проходить згідно з рівнянням
[TEX]\rm{2NaHCO_3}\xrightarrow[]{\;\;\;\;\it{t^{\circ}C}\;\;\;\;}Na_2CO_3+CO_2\uparrow +H_2O[/TEX].
Розв’язок. Внаслідок реакції з однієї складної речовини утворюється три менш складні сполуки, тому за ознакою зміни кількості та складу речовин дана реакція є реакцією розкладу. Оскільки ступені окиснення у атомів не змінюються, то за ознакою валентного стану речовин реакція належить до типу невалентних перетворень. Реакція проходить при нагрівання, тобто супроводжується поглинанням теплоти, тому за тепловим ефектом реакція є ендотермічною. Внаслідок реакції одночасно виділяється газ і утворюється малодисоційована сполука – вода, отже, за напрямком перебігу реакція є необоротною, а за фазовим складом – гетерогенною. Відсутність каталізатора свідчить, що вона належить до некаталітичних реакцій.
Приклад 2.2. До якого типу за природою реагуючих частинок належить реакція окислення нітроген (ІІ) оксиду?
Розв’язок. Окислення нітроген (ІІ) оксиду проходить згідно з рівнянням
2NO + О2→ 2NO2.
Як видно, у взаємодію вступають окремі молекули газів, тому реакція за природою реагуючих частинок належить до типу молекулярних.
Приклад 2.3. Закінчити рівняння реакції Ca(OH)2 + H3PO4 → ... та визначити її належність до певного типу за такими ознаками: а) зміни кількості та складу вихідних речовин, б) зміни валентного стану вихідних речовин, в) напрямку перебігу реакції, г) фазового стану сполук.
Розв’язок. Взаємодія між кальцій гідроксидом і фосфатною кислотою проходить за схемою:
![]()
Як видно з наведеного рівняння, це реакція обміну, оскільки вихідні речовини обмінюються своїми складовими частинами. Атоми всіх елементів не змінюють ступені окиснення, тому реакція є реакцією невалентних перетворень. Внаслідок взаємодії випадає осад кальцій фосфату і утворюється малодисоційована сполука – вода, отже, запропонована реакція є необоротною. Крім того, випадіння осаду свідчить про належність реакції до гетерогенною типу.
Приклад 2.4. Визначити ступені окиснення елементів в сполуках: NH3, NO2, HNO3, Na3HP2O7.
Розв’язок. В амоніаку NH3 атоми Гідрогену виявляють ступінь окиснення +1, отже, сумарний ступінь окиснення на всіх атомах Гідрогену в сполуці дорівнює: +1 · 3 = +3. Щоб молекула в цілому була електронейтральною, атом Нітрогену повинний мати ступінь окиснення –3. Маємо:
![]()
У нітроген (IV) оксиді NO2 ступінь окиснення Оксигену дорівнює –2, тоді в сумі на двох атомах Оксигену буде –2 ⋅ 2 = –4, а на атомі Нітрогену – такий же за абсолютною величиною, але протилежний за знаком ступінь окиснення, тобто +4. Отже:
![]()
В нітратній кислоті HNO3 ступені окиснення Гідрогену і Оксигену дорівнюють відповідно +1 і –2, а ступінь окиснення Нітрогену позначимо через х: H+1NхO–23. Сумарний ступінь окиснення на трьох атомах Оксигену дорівнює: –2 ⋅ 3 = –6, тоді підрахуємо ступінь окиснення Нітрогену: +1 + x – 6 = 0, звідки х = +5. Одержали:
![]()
У натрій гідрогендифосфаті Na3HP2O7 постійні ступені окиснення виявляють елементи Na (+1),H (+1), О (–2). У атомів Р повинний бути такий ступінь окиснення, який забезпечуватиме електронейтральність всієї молекули. Складаємо просте алгебраїчне рівняння, позначивши через х ступінь окиснення атома Р:
3 · (+1) + 1 · (+1) + 2х + 7 · (–2) = 0,
звідки 2х = +10, х = +5.
Отримуємо:
![]()
Приклад 2.5. Визначити ступені окиснення елементів в іонах: NH4+, NO3–, Р2О74–.
Розв’язок. При обчисленні невідомого ступеня окиснення в іоні необхідно виходити з правила: алгебраїчна сума ступенів окиснення всіх атомів в іоні дорівнює його заряду.
Тоді для NH4+: х + 4 ⋅ (+1) = +1, звідки х = –3.
Аналогічно знаходимо ступені окиснення в інших іонах.
В NO3–: х + 3 · (–2) = –1, звідки х = +5.
В іоні Р2О74–: 2 х + 7 · (–2) = –4, звідки 2х = +10, х = +5.
Таким чином одержали:
![]()
Приклад 2.6. Який процес – окислення чи відновлення – відбувається внаслідок перетворення I2 → IO65–?
Розв’язок. Для відповіді визначаємо ступені окиснення Йоду в молекулі I2 та в іоні IO65–. Вони дорівнюють відповідно 0 і +7. Видно, що атоми Йоду підвищили ступень окиснення, отже, I2 окислився і втратив електрони. Зважаючи на кількість атомів у простій речовини, при складанні напівреакції необхідно подвоїти кількість електронів і кількість атомів Йоду в продукті.
I20 – 14ē → 2I+7 (процес окислення).
Приклад 2.7. Заповнити пропуски в напівреакціях: а) As+3 …ē → As–3; б) 2Br–1 – 2ē → ....
Розв’язок. а) У правій та лівій частинах електронного рівняння (As+3 … ē → As–3) кількість атомів Арсену однакова, а ступінь окиснення знижується (від +3 до –3). Це відбувається внаслідок приєднання електронів (процес відновлення). Кількість прийнятих електронів визначаємо з урахуванням ступенів окиснення атомів As до і після реакції:
+3 + хē = –3,
звідки хē = –6, а х = 6 (беручи до уваги, що заряд електрона дорівнює –1).
Тоді задана схема має вигляд:
As+3 + 6ē → As–3 (процес відновлення).
б) В лівій частині схеми (2Br–1 – 2ē → ...) знаходяться два атоми Брому, тому і в правій теж повинно бути стільки ж. Але втрата двох електронів двома атомами Br–1 (процес окислення) свідчить про те, що тепер вони набули нульового ступеня окиснення, а це відповідає утворенню простої речовини Br20. Отже, схема напівреакції:
2Br–1 – 2ē → Br20 (процес окислення).
Приклад 2.8. На основі обчислень ступенів окиснення Телуру в сполуках MgTeO4, H2Te, TeO2 встановити, яка з наведених сполук може бути тільки окисником, яка – тільки відновником, а яка здатна до диспропорціонування. Відповідь підтвердити за допомогою електронних рівнянь.
Розв’язок. В зазначених сполуках Телуру ступені окиснення інших елементів дорівнюють: Н+1, О–2, Mg+2 (оскільки Магній є елементом ІІА-підгрупи і має постійний ступень окиснення). Тоді з урахуванням того, що сума ступенів окиснення атомів усіх елементів у нейтральній сполуці повинна дорівнювати нулю, ступені окиснення Телуру будуть такими:
![]()
Телур знаходиться в головній підгрупи шостої групи періодичної системи, тому для нього мінімальним є ступінь окиснення –2, а максимальним – +6.
У максимальному ступені окиснення (Te+6) атоми елемента можуть бути тільки окисниками, тобто лише приєднувати електрони і відновлюватися за однією з таких схем:
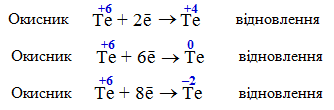
У мінімальному ступені окиснення (Te–2), навпаки, атоми елемента можуть бути тільки відновниками – лише віддавати електрони і окислюватися за однією з таких схем:
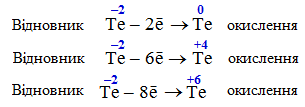
У проміжному ступені окиснення (Te+4) атоми елемента можуть бути залежно від умов реакції як окисниками, так і відновниками, та можуть піддаватися реакції диспропорціонування, тобто або окислюватися
![]()
або відновлюватися:
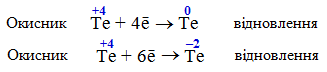
Приклад 2.9. Які з наведених речовин: а) KMnO4; б) MnO2; в) КІ – та чому можуть виявляти тільки окисні властивості; тільки відновні властивості; окисно-відновну двоїстість?
Розв’язок. а) Визначаємо ступені окиснення атомів елементів у сполуці:
![]() .
.
Елемент сьомої групи періодичної системи Манган Mn у заданій сполуці перебуває у вищому ступені окиснення, який більше не може підвищуватися. Тому атоми Mn+7 не спроможні віддавати електрони, але здатні приєднувати їх, тобто речовина KMnO4 за рахунок Mn+7 може виявляти тільки окисні властивості;
б) Визначаємо ступені окиснення елементів в сполуці:
![]() .
.
Елемент Mn в сполуці MnO2 виявляє проміжний ступінь окиснення, тому він здатний як віддавати, так і приєднувати електрони. Отже, ця речовина за рахунок атомів Mn+4 може виявляти окисно-відновну двоїстість і піддаватися реакціям диспропорціонування;
в) Визначаємо ступені окиснення елементів у сполуці:
![]() .
.
Атоми елемента Йоду І знаходяться у мінімальному ступені окиснення, тому не можуть знижувати його ще сильніше за рахунок приєднання електронів, але здатні підвищувати ступінь окиснення внаслідок віддавання електронів. Таким чином, речовина КІ за рахунок І–1 може виявляти виключно відновні властивості.
Приклад 2.10. Написати рівняння реакції, що відбувається при окисленні амоніаку киснем у присутності каталізатора – Pt, розставити коефіцієнти методом електронного балансу.
Розв’язок. Складемо схему реакції та визначимо ступені окиснення всіх елементів:
![]()
Аналізуючи змінення ступенів окиснення на атомах N і О, встановимо, який елемент є відновником, а який – окисником. У сполуці NH3 атом Нітрогену перебуває в мінімальному ступені окиснення (–3), що свідчить про надлишок електронів, які містяться на зовнішньому енергетичному рівні. Як відомо, атоми у негативному ступені окиснення здатні віддавати електрони, тому атом Нітрогену (–3) в молекулі NH3 буде відновником. Оскільки його ступінь окиснення підвищується від –3 до +2 (в сполуці NO), Нітроген як відновник віддає 5 електронів.
Кисень O02 – проста речовина, активний неметал, здатний приєднувати електрони, отже кисень – окисник зі ступенем окиснення 0. Після реакції Оксиген в усіх сполуках набуває однакового ступеня окиснення (–2), тобто один атом Оксигену приєднує 2 електрони. Враховуючи, що проста речовина O2 складається з двох атомів О, збільшимо кількість електронів вдвічі.
Складемо електронні рівняння напівреакцій окислення і відновлення і знайдемо найменше спільне кратне для кількості електронів, відданих відновником і прийнятих окисником. Для чисел 5 і 4 воно дорівнює 20. Щоб кількість відданих і приєднаних електронів була однаковою, для них необхідно визначити множники. Для відновника: 20/5 = 4, а для окисника: 20/4 = 5. Тоді схема електронного балансу:
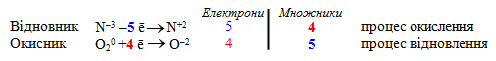
Якщо помножити кожний член обох напівреакцій на знайдені множники, а потім скласти обидві напівреакції (окремо ліві та праві частини), то одержимо:
![]()
Скорочуємо електрони
![]()
і переносимо множники вже в якості основних коефіцієнтів у ліву частину рівняння реакції:
4NH3 +5O2 → NO + H2O.
Порівнюючи кількості атомів Нітрогену до і після реакції, встановлюємо, що перед продуктом NO також має бути коефіцієнт 4. Щодо атомів Оксигену, то слід звернути увагу, що після реакції вони входять до складу різних сполук – це необхідно ураховувати при розстановці коефіцієнтів:
4NH3 +5O2 → 4NO + 6H2O.
Останній етап – перевірка кількості атомів Гідрогену, які не змінили своїх ступенів окиснення до і після реакції: до реакції кількість атомів Н дорівнювала 4 ⋅ 3 = 12, після реакції 6 ⋅ 2 = 12. Однакова кількість атомів всіх елементів у лівій та правій частинах свідчить, що рівняння окисно-відновної реакції складено вірно.
Приклад 2.11. Розставити коефіцієнти і визначити тип окисно-відновної реакції, що проходить за схемою
HClO2 + HCl → Cl2 + H2O
Розв’язок. Спочатку визначимо ступені окиснення всіх елементів в сполуках:
![]()
Ступені окиснення змінили атоми одного елемента, що входили до складу різних речовин: Хлору (+3) в сполуці HClO2 і Хлору (–1) в сполуці HCl. Вони разом утворили один продукт – вільний хлор Cl2, тому запропонована реакція належить до типу міжмолекулярної конмутації.
Розставимо коефіцієнти вже відомим методом електронного балансу. Відновник – Хлор (–1), щоб набути нульового ступеня окиснення, віддає один електрон. Але оскільки внаслідок реакції утворюється проста сполука (Cl2), то згідно з правилами кількість вихідних атомів і кількість електронів подвоюється:
2Cl–1 – 2ē → Cl02.
Аналогічно необхідно провести подвоювання і в напівреакції відновлення окисника Хлору (+3) із сполуки HClO2 і додати не 3електрони, а 6, тобто:
2Cl+3 + 6ē → Cl02.
Для знаходження множників в електронному балансі, які зрівнюють загальні кількості відданих (2) і приєднаних (6) електронів, встановлюємо найменше спільне кратне. Воно дорівнює 6. Коефіцієнти визначаються як відношення найменшого спільного кратного до кількості електронів. Отже, для відновника (HCl) маємо: 6/2 = 3, для окисника (HClO2): 6/6 = 1. Початкова схема електронного балансу матиме вигляд:
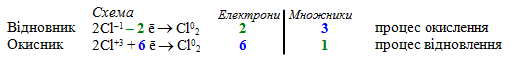
А сумарне рівняння після перемноження кожного члена на відповідні множники і складання напівреакцій виглядає так:
![]()
У правій частині продукт повторюється двічі (3Cl2 + Cl2), тому необхідно скласти його і скоротити електрони:
6Cl–1 + 2Cl+3 → 4Cl02.
Очевидно, що одержані коефіцієнти потребують скорочення на два:
3Cl–1 + 1Cl+3 → 2Cl02.
Виходячи з наведених викладок, можна прийти до висновку: якщо окисленню та відновленню піддаються атоми одного елемента, що входять до складу різних вихідних реагентів, але утворюють внаслідок реакції двохатомний газ як єдиний спільний продукт, то немає необхідності подвоювати кількість атомів в рівняннях електронного балансу.
Тому правильнішим буде складання кожної напівреакції з розрахунку тільки на один атом:
![]()
Визначені таким шляхом коефіцієнти переносимо у рівняння окисно-відновної реакції. При цьому коефіцієнт 1 не ставиться, а решту коефіцієнтів (перед формулою H2O) знаходять методом підбору, порівнюючи кількості атомів Н і О до і після реакції:
HClO2 + 3HCl → 2Cl2 + 2H2O.
Приклад 2.12. За допомогою іонно-електронного методу розставити коефіцієнти в реакції, що проходить згідно зі схемою:
![]()
Розв’язок. Знаходимо елементи, атоми яких змінили ступінь окиснення, і встановлюємо, до складу яких іонів вони входять:
![]()
Визначаємо окисник, ступінь окиснення якого знизився, і відновник, який підвищив свій ступінь окиснення:
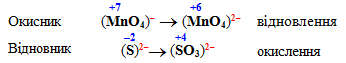
Зрівнюємо кількості атомів О в напівреакції окислення шляхом додавання іонів ОН– і молекул Н2О:
![]()
Додаючи або віднімаючи електрони, зрівнюємо заряди у лівій та правій частинах обох напівреакції і знаходимо множники для електронного балансу:
![]()
Помножуємо кожний член обох напівреакцій на знайдені множники і складаємо обидві напівреакції:
![]()
Після скорочення електронів переносимо одержані коефіцієнти в рівняння реакції:
![]()
Приклад 2.13. Порівняти методи а) електронного балансу і б) іонно-електронний для розстановки коефіцієнтів у рівнянні реакції, що проходить за схемою:
FeS + HNO3→ Fe(NO3)3 + SO2 + NO + H2O.
Розв’язок. а) Для застосування методу електронного балансу спочатку слід визначити ступені окиснення атомів елементів
![]()
Зрозуміло, що в запропонованій схемі окисно-відновної реакції міститься два відновники: атоми Феруму (+2) і Сульфуру (–2), які підвищують свої ступені окиснення, і один окисник – Нітроген (+5), що знижує ступінь окиснення. Для кожного елемента-відновника необхідно скласти окрему напівреакцію окислення
Fe+2 – 1ē → Fe+3
S–2 – 6ē → S+4
і підрахувати спільну кількість відданих електронів. Вона дорівнює 1 + 6 = 7. Саме цю кількість слід ураховувати при знаходженні множника для електронів окисника. Таким чином, електронні рівняння для заданої схеми мають вигляд:
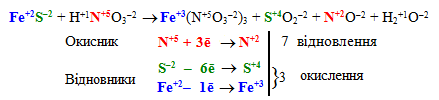
Перемножуючи кожний член всіх напівреакцій на знайдені множники (7 і 3) і послідовно складуючи ліві та праві частини, одержимо:
![]()
Або після узагальнення всіх електронів, відданих обома відновниками:
![]()
Наступний етап – скорочення електронів і перенесення коефіцієнтів, визначених для елементів-відновників і елемента-окисника, в молекулярну схему реакції:
3FeS + 7HNO3 → 3Fe(NO3)3 + 3SO2 + 7NO + H2O.
Однак із схеми випливає, що не вся нітратна кислота виступала в ролі окисника, частина HNO3 витрачалася для зв’язування катіонів Fe+3 у сіль ![]() – на це пішло 3 · 3 = 9 моль HNO3. Тобто в цілому на взаємодію з 3 моль FeS витратилося 7 + 9 = 16 моль HNO3. Це число і визначає остаточний коефіцієнт перед формулою HNO3, а коефіцієнт перед формулою Н2О знаходимо за кількістю атомів Н у правій частині рівняння. Остаточно рівняння окисно-відновної реакції між окисником HNO3 і відновником FeS має вигляд:
– на це пішло 3 · 3 = 9 моль HNO3. Тобто в цілому на взаємодію з 3 моль FeS витратилося 7 + 9 = 16 моль HNO3. Це число і визначає остаточний коефіцієнт перед формулою HNO3, а коефіцієнт перед формулою Н2О знаходимо за кількістю атомів Н у правій частині рівняння. Остаточно рівняння окисно-відновної реакції між окисником HNO3 і відновником FeS має вигляд:
3FeS + 16HNO3 → 3Fe(NO3)3 + 3SO2 + 7NO + 8H2O.
б) Для застосування іонно-електронного методу виділимо у схемі іони і молекули (для тих речовин, що не розкладаються на іони), які містять атоми елементів із змінними ступенями окиснення. На відміну від методу електронному балансу, в якому проставляють ступені окиснення над символами відповідних елементів, в іонно-електронному методі проставляють заряди іонів чи нейтральних молекул угорі справа від формули:
![]()
Згідно з вимогами іонно-електронного методу дописуємо в лівих і правих частинах обох напівреакцій відповідну кількість Н2О і Н+, щоб компенсувати кількості атомів О і Н. Після цього напівреакції відновлення нітратної кислоти і окиснення ферум (ІІ) сульфіду матимуть вигляд:
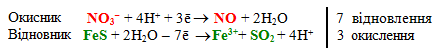
Перемножимо кожний член обох напівреакцій на знайдені множники:
![]()
Після скорочення
![]()
одержуємо коефіцієнти і переносимо їх у молекулярне рівняння реакції:
![]()
Аналіз методу електронного балансу та іонно-електронного методу доводить, що зручнішим і більш вдалим є саме іонно-електронний метод, який дозволяє уникати зайвих розрахункових операцій.
Приклад 2.14. Виходячи зі ступенів окиснення атомів елементів у запропонованих схемах, визначити, до якого типу окисно-відновних реакцій належить кожна з них:
а) K3[Cr(OH)6] + K2O2 → K2CrO4 + KOH + H2O;
б) NH4NO3 → N2O + H2O;
в) Au(NO3)3 → Au + NO2 + O2;
г) H2S + SO2 → S + H2O;
д) H3PO3 → PH3 + H3PO4.
Розв’язок. Для встановлення належності окисно-відновної реакції до певного типу необхідно визначити ступені окиснення елементів і проаналізувати, до складу яких речовин входять атоми елементів, що змінили свої ступені окиснення. Для спрощення ходу розв’язку завдань далі будуть вказані ступені окиснення тільки для елементів-окисників і елементів-відновників.
а) Елемент-окисник (O–1) і елемент-відновник (Cr+3) входять до складу молекул різних сполук – K2O2 і K3[Cr(OH)6], тому тип реакції – міжмолекулярна ОВР:
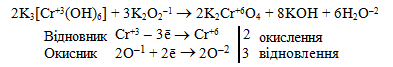
б) Елемент-окисник (N+5) і елемент-відновник (N–3) мають різні ступені окиснення, але входять до складу однієї речовини (NH4NO3), тому окисно-відновна реакція проходить за типом внутрішньомолекулярної конмутації:
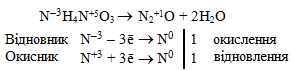
в) Елементи-окисники (Au+3 і N+5) і елемент-відновник (O–2) входять до складу однієї сполуки (Au(NO3)3), але належать до різних елементів, тому тип реакції – внутрішньомолекулярна ОВР:
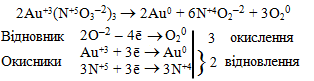
г) Атоми окисника (S+4) і атоми відновника (S–2) входять до складу різних сполук, але належать одному елементу – Сульфуру, тому окисно-відновна реакція протікає за типом міжмолекулярної конмутації:
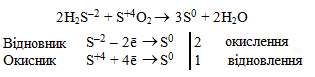
д) Атоми окисника (P+3) і атоми відновника (P+3) не тільки входять до складу однієї сполуки (H3PO3) і належать до одного елемента – Фосфору, але й виявляють однаковий ступінь окиснення (+3), тому тип цієї ОВР – диспропорціонування: