Ключові терміни:
активатор (промотор), активность катализатора (А), катализатор, механическая прочность, носитель (трегер), отравление катализатора, пористость, селективность (избирательность), температура зажигания катализатора, устойчивость к контактным ядам5.1 Промышленный катализ
В химической промышленности и смежных с ней отраслях (нефтехимия и др.) более 90% существующих и вновь вводимых технологий представляют каталитические процессы. С использованием катализаторов производятся десятки тысяч наименований неорганических и органических продуктов, в том числе, такие как аммиак, азотная и серная кислоты, метанол, бутадиен, стирол и др., осуществляются перспективные методы производства моторных топлив, очистка сточных вод и газовых выбросов.
Большинство каталитических процессов могут быть организованы как непрерывные, безотходные, малоэнергоемкие. Они отличаются высокими технико-экономическими показателями, обеспечивают высокий выход целевого продукта. Использование катализаторов позволяет интенсифицировать химико-технологические процессы, осуществлять превращения, которые не могут быть реализованы на практике без катализатора вследствие весьма высокой энергии активации, направлять процесс в нужную сторону, регулировать структуру и свойства производимых продуктов (например, стереоспецифические катализаторы в производстве синтетических каучуков и пластических масс). Особое значение имеет применение катализаторов в обратимых экзотермических процессах, в которых повышение температуры с целью ускорения реакции резко снижает равновесную степень превращения и делает реакцию термодинамически неразрешенной. В подобных процессах роль катализаторов является первостепенной.
В отличие от других факторов, интенсифицирующих химический процесс, катализатор влияет только на скорость химической реакции и не влияет на термодинамику, лишь ускоряя достижение состояния равновесия.
Катализатор - вещество, изменяющее скорость химической реакции, и остающееся к концу реакции неизменным. При этом катализатор не ускоряет диффузионных процессов и оказывает влияние только на скорость процессов, протекающих в кинетической области.
Каталитические процессы подразделяются на:
- гомогенные, в которых реагирующие вещества и катализатор составляют одну фазу;
- гетерогенные, в которых реагирующие вещества и катализатор находятся в разных фазах;
- микрогетерогенные, протекающие в жидкой фазе с участием катализаторов в коллоидном состоянии;
- ферментативные, протекающие в биологических системах под воздействием ферментов.
В химической промышленности наиболее распространены гетерогенные каталитические процессы, в которых границей раздела фаз является поверхность твердого катализатора, находящегося в контакте с газообразной или жидкой фазой.
Химические реакции на поверхности катализатора представляют собой сложный процесс, состоящий из нескольких последовательно протекающих элементарных стадий, различающихся по химической и физической природе:
- диффузия реагентов из потока к поверхности зерен катализатора (стадия внешней диффузии);
- диффузия молекул реагентов внутрь пор катализатора (стадия внутренней диффузии);
- абсорбция молекул реагентов на поверхности катализатора, протекающая в форме физической абсорбции или хемосорбции (активированной абсорбции); стадия хемосорбции заключается в образовании активированного комплекса реагента и катализатора и определяет специфичность действия катализатора в каталитических реакциях;
- поверхностная химическая реакция в результате перегруппировки активированного комплекса или взаимодействия молекул одного адсорбированного реагента с молекулами другого;
- десорбция образовавшихся продуктов реакции с поверхности катализатора;
- диффузия продуктов из пор катализатора к внешней поверхности его (обратная внутренняя диффузия);
- диффузия продуктов от поверхности катализатора в поток.
В химико-технологических процессах применяют не индивидуальные каталитически активные вещества, а контактные массы, представляющие сложные системы, состав и природа компонентов которых должны обеспечить наиболее эффективное устойчивое протекание каталитического процесса. Контактная масса состоит из каталитически активного вещества (катализатора), активатора и носителя.
Природа гетерогенных катализаторов весьма разнообразна и зависит от типа катализируемых реакций. В качестве катализаторов используют, главным образом, металлы в свободном состоянии (платина, серебро, медь, железо) и оксиды металлов (цинка, хрома, алюминия, молибдена, ванадия). В тех случаях, когда в системе одновременно протекают две реакции, катализируемых различными веществами, применяют бифункциональные катализаторы, состоящие из двух соответствующих компонентов (например, оксид цинка и оксид алюминия в процессе дегидратации и дегидрирования этанола до бутадиена).
Активатор (промотор) - называется вещество, вводимое в контактную массу для повышения активности катализатора и увеличения срока его действия. Активаторы обладают избирательным действием, поэтому природа их зависит от природы катализатора.
Носитель (трегер) - называется материал, на который наносят катализатор с целью увеличения его поверхности, придания массе пористой структуры, повышения ее механической прочности и снижения себестоимости контактной массы. В качестве носителей в контактных массах используются пемза, асбест, силикагель, кизельгур, пористая керамика.
Контактные массы изготавливаются методами:
- осаждения гидроокисей и карбонатов из растворов солей с последующим формированием и прокаливанием;
- совместным прессованием смеси компонентов с вяжущим веществом;
- сплавлением компонентов;
- пропиткой пористого носителя растворами катализатора и активатора.
Контактные массы формуют в виде гранул, таблеток или элементов различной конфигурации. Металлические катализаторы изготавливают и применяют в виде тонких сеток.
5.2 Технологические характеристики твердых катализаторов
Эффективность использования катализаторов в промышленных гетерогенно-каталитических процессах существенно зависит от их технологических характеристик. К ним относятся: активность, температура зажигания, селективность действия, устойчивость к ядам, пористость, механическая прочность, теплопроводность, доступность и дешевизна.
1. Активность катализатора (А) - мера ускоряющего воздействия его по отношению к данной химической реакции. Она определяется как отношение констант скоростей каталитической и некаталитической реакций:
-
(5.1) где Е - энергия активации реакции без катализатора, ЕК - энергия активации реакции с катализатором.
Для тех случаев, когда каталитическая и некаталитическая реакции имеют один порядок и, следовательно, предэкспоненциальные коэффициенты в уравнении Аррениуса для них равны (а1=а2), активность катализатора определится из (1) как:
-
(5.2) где ∆Е = Е - Ек.
Снижая энергию активации реакции, катализатор ускоряет ее на много порядков. Так, например, для реакции:
активность применяемого в ней ванадиевого катализатора , то есть скорость реакции возрастает в сотни миллиардов раз.
В большинстве случаев катализатор также снижает порядок реакции, при этом тем сильнее, чем выше его активность. Так, например, если порядок приведенной выше реакции без катализатора равен 3, то в присутствии ванадиевого катализатора он составляет всего 1,8.
2. Температура зажигания катализатора Т3 - минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. Чем выше активность катализатора, тем ниже температура его зажигания, то есть:
-
, (5. 3)где К - константа, зависящая от природы катализатора.
При низкой температуре зажигания расширяется рабочий интервал между Т3 и режимом температуры процесса, упрощается конструкция реактора, уменьшается расход тепла на подогрев реагентов, стабилизируется технологический режим. Для экзотермических каталитических реакций при некотором значении Т3 скорость выделения тепла становится равной скорости отвода тепла (расход тепла на нагрев реакционной смеси и унос тепла с продуктами реакции). В этом случае Т3 представляет ту минимальную температуру, при которой обеспечивается автотермичность процесса.
3. Селективность (избирательность) катализатора - его способность избирательно ускорять одну из реакций, если в системе термодинамически возможно протекание нескольких реакций. Для сложной параллельной реакции, протекающей по схеме:
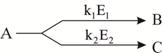
и включающей реакции А→В и А→С, которые характеризуются, соответственно, константами скорости k1 и k2 и энергиями активации Е1 и Е2, селективность по направлению А→В определится как:
-
(5.4)
Из нее следует, что при некоторой заданной температуре Т можно путем подбора катализатора изменять разность Е2 - Е1 и, следовательно, направлять процесс в сторону образования целевого продукта.
Селективность катализатора имеет большое значение в таких химико-технологических процессах как окисление аммиака в производстве азотной кислоты, различных процессах органического синтеза. Используя катализаторы, становится возможным получать из общего сырья различные целевые продукты, например:
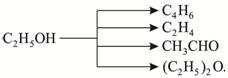
Пористость катализатора характеризует его удельную поверхность и, следовательно, влияет на поверхность контакта катализатора с реагентами. Для каталитических процессов большое значение имеет доступность поверхности твердого катализатора для реагирующих веществ, так как чем больше поверхность контакта, тем выше скорость превращения их в целевые продукты в единицу времени на том же катализаторе.
Пористость катализатора выражается отношением свободного объема пор к общему объему катализатора и характеризуется удельной его поверхностью, то есть поверхностью, отнесенной к единице массы или объема катализатора. Современные катализаторы имеют весьма развитую удельную поверхность, достигающую 10-100 м2/г.
5. Механическая прочность контактной массы должна быть такой, чтобы она не разрушалась под действием собственного веса в аппаратах с неподвижным слоем катализатора и не истиралась в аппаратах с движущимся слоем катализатора и аппаратах «КС».
6. Устойчивость к контактным ядам.Практическому использованию гетерогенно-каталитических процессов препятствует явление снижения активности катализатора в ходе процесса. Причинами этого являются:
- уменьшение активной поверхности катализатора при осаждении на нем пыли или продуктов реакции;
- механическое разрушение катализатора;
- отравление катализатора каталитическими (контактными) ядами
Отравление катализатора - частичная или полная потеря его активности под воздействием незначительного количества некоторых веществ -контактных ядов. Контактные яды образуют с активированными центрами катализатора поверхностные химические соединения и блокируют их, снижая активность катализатора. Для каждой группы катализаторов существуют определенные виды контактных ядов.
Отравление катализатора может быть обратимым, когда контактные яды снижают активность катализатора временно, пока они находятся в зоне катализа, и необратимым, когда активность катализатора не восстанавливается после удаления контактных ядов из зоны катализа. Контактные яды могут содержаться в реагентах, поступающих на каталитический процесс, а также образовываться в качестве побочных продуктов в самом процессе. Устойчивость к контактным ядам является важнейшим свойством промышленных катализаторов. Для удлинения срока службы контактных масс в химико-технологических процессах предусматривается стадия тщательной очистки реагентов от вредных примесей и операция регенерирования катализатора (например, выжигание высокоуглеродистой полимерной пленки, обволакивающей зерна катализатора, в процессах каталитического крекинга, нефтепродуктов, изомеризации и дегидрирования органических соединений).



