- 6.1 Общие сведения
- 6.2 Технологические свойства серной кислоты
- 6.3 Применение серной кислоты и олеума
- 6.4 Сырье для производства серной кислоты
- 6.5 Общая схема сернокислотного производства
6.1 Общие сведения
Серная кислота – один из основных многотоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета и запаха, при обычной температуре находится в жидком состоянии, в концентрированном виде не корродирует черные металлы. В то же время серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли, дешева.
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги)[3]. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[4]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994
6.2 Технологические свойства серной кислоты
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава: nSO3 ·mH2O. При n = m = 1 это моногидрат серной кислоты (100% кислота), при m > n – водные растворы моногидрата, при m < n – растворы оксида серы (VI) в моногидрате (олеум):
| H2SO4· (n-1)SO3 | H2SO4 |
|
|
| Олеум | Моногидрат | Водная кислота |
Моногидрат серной кислоты – бесцветная маслянистая жидкость с температурой кристаллизации 10,370С, температурой кипения 296,20С и плотностью 1,85 т/м3. С водой и оксидом серы (VI) он смешивается во всех отношениях, образуя гидраты состава H2SO4· H2O и соединения с оксидом серы (VI) состава H2SO4·SO3 и H2SO4·4SO3.
Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из них имеют температуру кристаллизации ниже нуля или близкие к нулю. Из диаграммы кристаллизации системы «оксид серы (VI) – вода» (рис.6.1) следует, что этому условию отвечают эвтектики, образованные соединениями H2SO4·4SO3 и H2SO4·2SO3; H2SO4· H2O и H2SO4; H2SO4·2SO3 и H2SO4·2SO3.
Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации.
Температура кипения серной кислоты также зависит от состава системы «оксид серы (VI) – вода». C повышением концентрации водной серной кислоты температура кипения ее возрастает и достигает максимума 336,50С при концентрации 98,3 %, что отвечает азеотропному составу, после чего снижается. Температура кипения олеума с увеличением содержания свободного оксида серы (VI) снижается от 296,20С (температура кипения моногидрата) до 44,70С, отвечающей температуре кипения 100% оксида серы (VI).
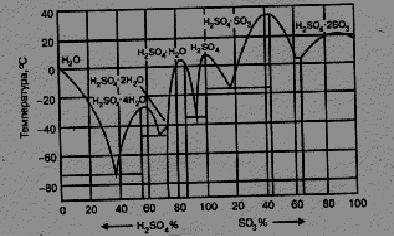
Рисунок 6.1 – Диаграмма кристаллизации системы “SO3–H2O”
При нагревании паров серной кислоты выше 4000С она подвергается термической диссоциации по схеме
2H2SO4 ⇔ 2H2O + 2SO3 ⇔ 2H2O + 2SO3 + O2.
6.3 Применение серной кислоты и олеума
Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за последние 25 лет выросло более чем в три раза, составляя в настоящее время более 160 млн. т в год.
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60%), а также в производстве красителей (от 2 до 16%), химических волокон (от 5 до 15%) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других отраслях промышленности. На рис. 6.2 представлено применение серной кислоты и олеума в народном хозяйстве.
6.4 Сырье для производства серной кислоты
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых могут быть получены сера или непосредственно оксид серы (IV).
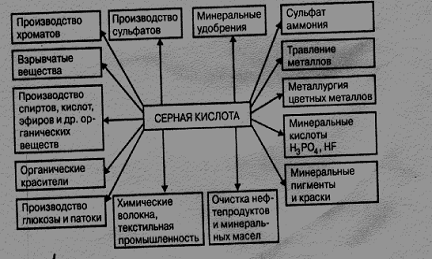
Рисунок 6.2 – Применение серной кислоты
Природные залежи самородной серы невелики, хотя кларк ее равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV).
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени определяет сложность технологического производства серной кислоты.
6.4.1 Железный колчедан
Природный железный колчедан - сложная порода, состоящая из сульфида железа FeS2, сульфидов других металлов (меди, цинка, свинца, никеля, кобальта и др.), карбонатов металлов и пустой породы.
Процесс подготовки рядового колчедана к производству ставит целью извлечения из него ценных цветных металлов и повышение концентрации дисульфида железа. Схема подготовки рядового колчедана представлена на рис. 6.3.
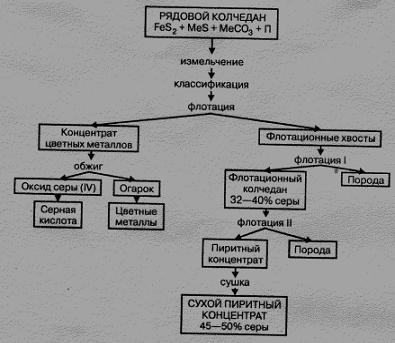
Рисунок 6.3 – Схема подготовки железного колчедана
Сера

6.4.2 Сера
Элементарная сера может быть получена из серных руд или газов, содержащих сероводород или оксид серы (IV). В соответствии с этим различают серу самородную и серу газовую (комовую):
Таким образом, газовая сера – сера, полученная при очистке природного газа от сернистых соединений; самородная сера –сера, встречающаяся в природе в свободном состоянии.
На территории СНГ залежей самородной серы практически нет. Источниками газовой серы являются Астраханское газоконденсатное месторождение, Оренбургское и Самарское месторождения попутного газа. На предприятии ОАО «Сумыхимпром» сырьём в производстве серной кислоты является газовая сера Астраханского газоконденсатного месторождения.
На рис. 6.4 представлена схема подготовки самородной серы.
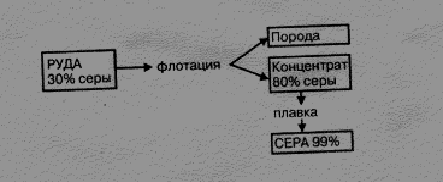
Рисунок 6.4 – Схема подготовки самородной серы
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного окисления его над твердым катализатором. При этом протекают реакции:
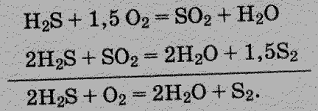
Значительные количества серы могут быть получены из продуктов медеплавильного производства, содержащих различные соединения серы. При этом в процессе плавки протекают реакции, приводящие к образованию элементарной серы:
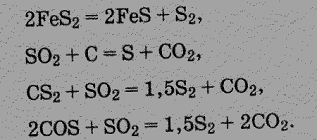
6.4.3 Сероводород
Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы нефтепереработки. Извлекаемый при их очистке сероводородный газ достаточно чист, содержит до 90% сероводорода и не нуждается в специальной подготовке.
6.4.4 Газы цветной металлургии
В этих газах содержится от 4 до 10% оксида серы (IV) и они могут непосредственно использоваться для производства серной кислоты.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика, поэтому технико–экономические показатели этого производства существенно зависят от вида используемого сырья. В табл. 6.1 приведены основные ТЭП производства серной кислоты из различного сырья (за 100% взяты показатели производства на основе железного колчедана).
Таблица 6.1 – Технико–экономические показатели сернокислотного производства, %
|
Показатель |
Сырье |
|||
|
железный колчедан |
самород–ная сера |
газовая сера | серо–водород | |
| Удельные капиталовложения в произ–водство | 100 | 57 | 57 | 63 |
| Себестоимость кислоты | 100 | 125 | 67 | 80 |
| Приведенные затраты | 100 | 118 | 75 | 72 |
Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу.
6.5 Общая схема сернокислотного производства
Производство серной кислоты из серосодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы:
S0
FeS2-2
H2S-2 [TEX]\rightarrow [/TEX] S+4 [TEX]\rightarrow [/TEX] S+6
S+4O2
-
где I – стадия получения печного газа (оксида серы (IV));
II – стадия каталитического окисления оксида серы (IV) до оксида серы (VI) и абсорбции его (переработка в серную кислоту).
В результате производства к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа и другие механические и физико–химические операции. В общем случае схема производства серной кислоты может быть выражена в следующем виде:
Сырье ––> подготовка сырья ––> сжигание (обжиг сырья) ––>
очистка печного газа ––> контактирование ––> абсорбция
контактированного газа ––> СЕРНАЯ КИСЛОТА.
Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV) , наличия или отсутствия стадии абсорбции оксида серы (VI).



