- 1.1. Вступ
- 1.2. Предмет органічної хімії
- 1.3. Особливості органічних сполук
- 1.4. Приклади розв'язання задач
Ключові терміни:
π-діастереомерія, σ-діастереомери, асиметричний атом С*, геометрична ізомерія, гомологи, гомологічна різниця, гомологічний ряд, діастереомери, енантіомери, епімери, конформаційна стереоізомерія, конформації, конфігураційна стереоізомерія, метамери, оптична активність, оптична ізомерія, оптичні антиподи, органічна хімія, проекційні формули Фішера, просторова ізомерія, рацемат, раціональні структурні формули, стереоізомерія, структурна ізомерія, структурні формули, хіральний центр, ізомери, ізомерія1.1. Вступ
Величезна кількість органічних сполук, різноманітність їх складу, особливості будови молекул (включаючи як послідовність сполучення атомів у ланцюгу, так і взаємне розташування окремих атомів і атомних груп у просторі) не дозволяє в рамках обмеженої кількості лекцій докладно викласти відомості про структуру, властивості, способи добування, області використання, а також екологічні наслідки виробництва і застосування органічних речовин. Для прикладу наведемо структуру сполуки, що має достатньо просту будову, – амінокислоти цистеїну:

Ланцюг молекули цистеїну складається з трьох атомів Карбону, сполучених одинарними σ-зв’язками, тому справедливо очікувати, що цистеїн повинний мати деякі спільні властивості з насиченим аліфатичним вуглеводнем пропаном (СН3–СН2–СН3). Карбоксильна група (СООН) передбачає хімічні ознаки класу карбонових кислот, аміногрупа (NН2) – аміносполук, меркаптогрупа (SH) – тіоспиртів. Але всі перелічені групи виявляють, з одного боку, взаємний вплив одна на одну, а з іншого – сукупний ефект, який позначається на індивідуальних властивостях сполуки в цілому. До того ж просторове розташування атомів в молекулі вносить свій внесок в специфіку реакційної здатності цистеїну.
Однак крім згаданого цистеїну, органічна хімія охоплює в своїх дослідженнях ще майже 20 млн. сполук, переважна більшість яких має значно складнішу будову. Очевидно, що орієнтуватися в такому масиві можливо тільки, по-перше, спираючись на чітку класифікацію і, по-друге, вивчаючи характерні родові ознаки, які притаманні великим групам сполук залежно від особливостей їх будови і складу. Інакше кажучи, слід набути певного комплексу знань з основ органічної хімії, які при зіткненні з якоюсь конкретною органічною сполукою одночасно стануть і теоретичним фундаментом і практичним інструментом для її детального дослідження. Саме на допомогу в оволодінні мінімальним комплексом таких знань і направлений запропонований курс органічної хімії.
1.2. Предмет органічної хімії
Найдавніше визначення органічної хімії належить Берцеліусу, який ще в 1827 р. видав підручник, де виділив всю відому на той час інформацію про утворені Карбоном сполуки в окрему главу, названу «Керування з органічної хімії». Саме в цьому підручнику і зустрічається перше формулювання предмету органічної хімії як самостійної науки:
Органічна хімія – це частина хімічної науки про речовини рослинного та тваринного походження.
Берцеліус та його прихильники вважали, що органічні сполуки утворюються виключно внаслідок життєдіяльності організмів під впливом так званої «життєвої сили». Однак послідовники берцеліусівської теорії віталізму дуже швидко зазнали поразки, коли німецький хімік Велер (1828 р.) вперше в історії науки синтезував органічну сполуку – сечовину – із неорганічної речовини ціанату амонію. Це дало поштовх до бурного розвитку органічного синтезу: Зінін одержав анілін (1842 р.), Кольбе – оцтову кислоту (1845 р.), Бертло – жироподібні сполуки (1854 р.), Бутлеров – штучні цукрові речовини (1861 р.). На базі експериментів поступово доводилося, що невірно вважати органічну хімію наукою тільки про продукти життєдіяльності живих організмів. І хоч спочатку предметом вивчення органічної хімії були переважно саме природні сполуки, поступово збільшувалося значення органічного синтезу, за допомогою якого одержувалися якісно нові матеріали, що не мали природних аналогів. Тому Кекуле (середина XIX ст.) запропонував таке визначення: Органічна хімія – це наука про сполуки Карбону з іншими елементами.
Пізніше Шорлеммер (1889 р.) уточнив це формулювання: Органічна хімія – це наука про вуглеводні та їх похідні.
З того часу винайдено велику кількість природних речовин (гормонів, вуглеводів, жирів, вітамінів, алкалоїдів тощо) і синтезовано ще більшу кількість штучних органічних сполук (пластмаси, синтетичні волокна, барвники, каучуки, антибіотики та інші лікарські препарати). Більш того, успіхі органічної хімії в останні десятиріччя сприяли виділенню окремих розділів у самостійні наукові дисципліни, наприклад: елементоорганічна хімія, хімія високомолекулярних сполук і полімерів, хімія нафти і газу, біохімія та біоорганічна хімія, стереохімія тощо.
Тому зрозуміло, що не можна обмежувати предмет органічної хімії вивченням лише продуктів життєдіяльності рослин і тварин. У зв’язку з цим найбільш узагальненим визначенням можна вважати таке:
Органічна хімія – це наука, що вивчає сполуки Карбону, їх будову, властивості, способи одержання і закони їх взаємних перетворень, а також шляхи практичного застосування.
До органічних речовин належать сполуки Карбону з Гідрогеном, Оксигеном, Нітрогеном, Фосфором, галогенами та іншими хімічними елементами, за виключенням оксидів карбону СО, СО2, вугільної кислоти Н2СО3 та її солей, які традиційно відносять до неорганічних сполук.
1.3. Особливості органічних сполук
Розвиток органічної хімії як самостійної науки зумовлений специфічними особливостями органічних сполук. Розглянемо найважливіші з них.
- Величезна кількість органічних речовин, яка пояснюється унікальною здатністю атомів Карбону сполучатися один із одним, утворюючи ланцюги і кільця. За різними джерелами кількість органічних сполук оцінюється від 17 до 20 млн., у той час як неорганічних речовин достовірно відомо десь близько 500 тис.
- Органічні сполуки поряд з водою є головним будівельним матеріалом тваринних і рослинних організмів, і – одночасно – основним харчовим компонентом, що забезпечує постійну підтримку їх життєдіяльності на відповідному рівні. Крім того, величезна кількість органічних сполук є основою для створення багатьох виробів з широким спектром властивостей, які набули застосування у всіх без виключення галузях промисловості, у будівництві, а також у повсякденному побуті.
- Молекули органічних речовин, в яких атоми сполучені між собою переважно за рахунок неполярних чи малополярних ковалентних зв’язків як правило належать до неелектролітів. Іонний тип зв’язку зустрічається рідко, найчастіше в солях органічних кислот, наприклад, в ацетаті натрію.
- Органічні сполуки, що містять тільки прості одинарні зв’язки С–С, С–Н, за звичайних умов взаємодіють між собою надзвичайно повільно або не взаємодіють зовсім.
- При нагріванні до підвищених температур органічні речовини обвуглюються, а у присутності кисню – згоряють. Це пояснюється невисокою міцністю зв’язків між атомами Карбону.
- Органічні сполуки всіх класів утворюють ряди сполук, які називаються гомологи – речовини, що мають спільні ознаки в будові молекул та у властивостях; для органічних сполук характерне явище ізомерії.
- Будову органічних сполук виражають за допомогою структурних формул. Структурні формули – це умовне зображення будови органічної сполуки, в якому кожний ковалентний зв’язок позначається рисочкою. Наприклад, пропан, склад якого відповідає емпіричній брутто-формулі С3Н8, можна зобразити структурною формулою
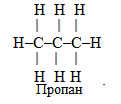
Однак доцільніше і зручніше користуватися скороченими формулами, що називаються раціональні структурні формули, в яких зазначають тільки зв’язки між атомами Карбону та між Карбоном і гетероатомом (O, N, S і т.і.), а зв’язки між атомами С і Н не показують, а просто приписують символ Гідрогену поруч із символом Карбону, наприклад:

Для тих органічних сполук, які мають розгалужену будову, інколи допускається така форма запису скороченої структурної формули, при якій бокові ланцюги записуються у дужках після сполученого з ними атома С, наприклад:

Раціональні структурні формули циклічних сполук зображують багатокутниками з відповідною кількістю кутів. Наприклад, структуру циклобутану С4Н8, замкнутий ланцюг якого містить чотири атома С, показують за допомогою квадрата:
Структуру бензену прийнято зображувати одним з двох способів:

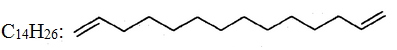
Для сполук з довгими карбоновими ланцюгами часто замість раціональних структурних формул застосовують скорочені зигзагоподібні структури, в яких кожний кут відповідає атому С, а подвійні зв'язки позначають двома рисочками, наприклад:
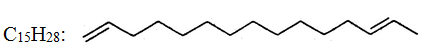
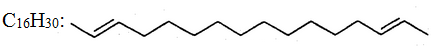
1.3.1. Поняття про гомологію
Однією з причин великої чисельності органічних сполук є існування гомологів, які утворюють гомологічні ряди.
Гомологічний ряд – це послідовність подібних за будовою та властивостями речовин, в якій кожний наступний член відрізняється від попереднього на постійну структурну одиницю СН2, яка називається гомологічна різниця.
Генетичною основою гомологічних рядів для більшості класів органічних сполук є гомологічний ряд насичених незамкнутих вуглеводнів – алканів (табл. 1.1).
Таблиця 1.1 — Гомологічний ряд алканів
| Склад (брутто-формула) |
Раціональна структурна формула |
Назва |
|---|---|---|
| СН4 | СН4 | Метан |
| С2Н6 | СН3–СН3 | Етан |
| С3Н8 | СН3–СН2–СН3 | Пропан |
| С4Н10 | СН3–(СН2)2–СН3 | Бутан |
| С5Н12 | СН3–(СН2)3–СН3 | Пентан |
| С6Н14 | СН3–(СН2)4–СН3 | Гексан |
| С7Н16 | СН3–(СН2)5–СН3 | Гептан |
| С8Н18 | СН3–(СН2)6–СН3 | Октан |
| С9Н20 | СН3–(СН2)7–СН3 | Нонан |
| С10Н22 | СН3–(СН2)8–СН3 | Декан |
| С11Н24 | СН3–(СН2)9–СН3 | Ундекан |
| С12Н26 | СН3–(СН2)10–СН3 | Додекан |
| С20Н42 | СН3–(СН2)18–СН3 | Ейкозан |
| С30Н62 | СН3–(СН2)28–СН3 | Триаконтан |
| С40Н82 | СН3–(СН2)38–СН3 | Тетраконтан |
| С100Н202 | СН3–(СН2)88–СН3 | Гектан |
Загальна формула для алканів – CnH2n+2. Як видно із порівняння їх складу (табл. 1.1), два найближчі сусідні гомологи дійсно відрізняються один від одного на гомологічну різницю СН2. Подібним чином органічні сполуки будь-якого класу теж утворюють власні гомологічні ряди, кожний з них має свою загальну формулу. Наприклад, загальна формула для насичених одноатомних спиртів (тобто таких, що містять тільки одну групу ОН) – CnH2n+1OH, для насичених карбонових кислот – CnH2n+1COOH.
1.3.2. Ізомерія
Для органічних сполук характерно явище ізомерії, що значно збільшує загальну кількість органічних сполук.
Ізомерія – це явище, при якому декілька сполук – ізомери – мають однаковий склад і однакову молекулярну масу, але відрізняються одна від одної будовою молекул, а отже, і своїми фізичними та хімічними властивостями.
Існують різні типи ізомерії, серед яких найбільш поширеними є структурна і просторова.
І Структурна ізомерія зумовлюється різним порядком розміщення окремих атомів чи атомних груп у молекулі. Вона поділяється на певні види:
-
ізомерія карбонового ланцюгу, наприклад, для алканів складу С5Н12 існують три ізомери, один з яких має нормальну будову, а решта – розгалужену:
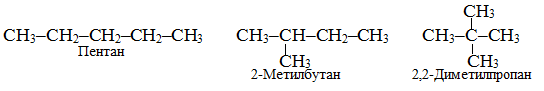
-
ізомерія положення кратного зв’язку, наприклад, ацетиленові вуглеводні складу С5Н8 нормальної будови мають різне розташування потрійного зв’язку в карбоновому ланцюгу:
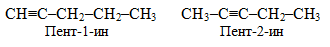
-
ізомерія положення замісника; так, для спиртів складу С3Н7–ОН можливо існування двох ізомерів:

-
міжкласова ізомерія (так звана метамерія). Слід зазначити, що на відміну від інших структурних ізомерів, властивості яких відрізняються не дуже різко, метамери (тобто ізомери, що належать до різних класів органічних сполук або до різних типів вуглеводнів) за своїми властивостями зовсім не походять один на одного. Так, для вуглеводнів складу С5Н10, крім структурної ізомерії, характерне ще й явище метамерії. Як приклад можна навести будову двох вуглеводнів, один з яких належить до алкенів (етиленових вуглеводнів з одним подвійним зв’язком у карбоновому ланцюгу), а інший – до циклоалканів:
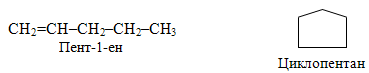
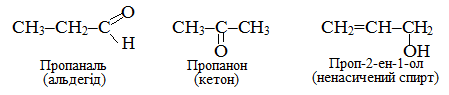
Інший приклад метамерії – ізомери складу С3Н6О, які є представниками різних класів органічних сполук – альдегідів, кетонів і ненасичених спиртів:
Відома міжкласова ізомерія насичених карбонових кислот і естерів, наприклад, метамери складу С3Н6О2:

ІІ Просторова ізомерія, при якій склад і послідовність сполучення атомів в молекулах ізомерів залишаються однаковими, але змінюється просторове розміщення однакових атомів чи атомних груп відносно карбонового ланцюгу. Просторова ізомерія представлена такими видами:
II.1 Геометрична ізомерія (інша назва – π-діастереомерія) зумовлена різним положенням замісників відносно подвійного зв’язку чи малого циклу. Геометричні ізомери, в яких обидва замісники (або продовження карбонового ланцюгу) розташовані по різні боки від подвійного зв’язку чи циклу, називаються транс-ізомерами, а ті, в яких замісники знаходяться з одного боку, – цис-ізомерами. Наприклад, для бут-2-ену СН3–СН=СН–СН3, в якому подвійний зв’язок розміщується після другого атома Карбону, існує два геометричних ізомери (рис. 1.1):
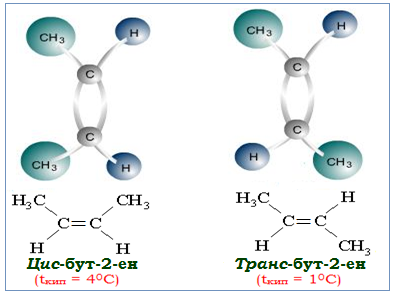
Рисунок 1.1 — Геометричні ізомери бут-2-ену (π-діастереомери)
Геометричні ізомери відрізняються фізичними показниками і реакційною здатністю, що пояснюється різним енергетичним станом цис- і транс-ізомерів. Транс-ізомери є стійкішими, оскільки замісники в їх молекулах більш віддалені один від одного. Перехід геометричних ізомерів з однієї форми в іншу можливий тільки при обертанні навколо подвійного зв'язку, для чого необхідно розірвати π-зв'язок, витративши 263 кДж/моль. Такий великий енергетичний бар'єр обертання навколо подвійного зв'язку С=С можна подолати при температурі вище 3000С. З цієї причини цис- і транс-ізомери існують в індивідуальному вигляді і самочинно не переходять один в одного.
Як приклад геометричної ізомерії можна навести чотири ізомери циклоалканів складу С6Н12, в основі будови яких лежить чотиричленний цикл (тобто такий, що складається з чотирьох атомів Карбону) і містить два бокові ланцюги СН3. Ця ізомерія зумовлена різним розташуванням замісників відносно площини циклу (рис. 1.2).
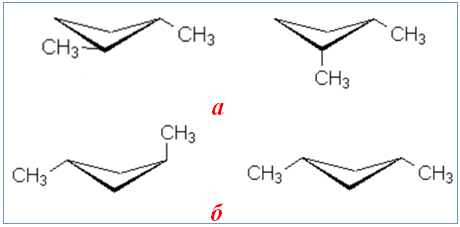
Рисунок 1.2 — Транс- і цис-ізомери (ліворуч і праворуч відповідно): а) 1,2-диметилциклобутан; б) 1,3-диметилциклобутан
Геометрична ізомерія характерна не тільки для вуглеводнів, а і для представників багатьох класів органічних речовин, наприклад, для кислот:
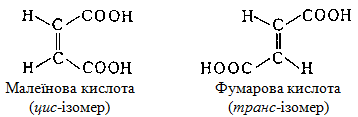
II.2 Оптична ізомерія (або стереоізомерія) у свою чергу поділяється на два види: конформаційну і конфігураційну.
а) Конформаційна стереоізомерія виникає завдяки можливості вільного обертання атомних груп навколо σ-зв’язків С–С в карбоновому ланцюгу, що зумовлює різне просторове розташування атомів і атомних груп у молекулах ізомерів.
Різні геометричні форми молекули, які можуть перетворюватися одна в одну внаслідок обертання окремих атомів і атомних груп навколо σ-зв’язків С–С, називаються конформації ( від лат. сonformatio – форма, розміщення).
При обертанні навколо σ-зв'язків С–С молекула прагне набути найвигіднішої конформації з найменшою внутрішньою енергією. Варіантів таких конформацій дуже багато, але частіше зустрічаються дві:
- загальмована конформація, в якій атоми Н двох сусідніх метильних груп (СН3) віддалені на максимальну відстань; при цьому електронна взаємодія зв'язків С–Н і потенціальна енергія молекули будуть найменшими (рис. 1.3);
-
заслонена конформація, в якій відстань між атомами Гідрогену двох сусідніх метильних груп (СН3) найменша, тому зв'язки С–Н в них взаємно відштовхуються; це приводить до збільшення потенціальної енергії молекули і, отже, до меншої міцності молекули (рис. 1.3).
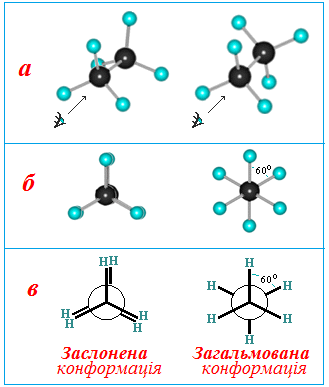
Рисунок 1.3 — Конформації молекули етана: а) кульково-стрижньова модель; б) вигляд вздовж зв’язку С–С; в) проекційні формули
У міру збільшення довжини карбонового ланцюгу зростає кількість конформацій, тому молекули алканів можуть набувати різних форм. Якщо всі атоми Карбону в ланцюгу перебувають в енергетично вигідній загальмованій конформації, то ланцюг має зигзагоподібну будову (рис. 1.4 а). Карбоновий ланцюг може мати і клешневиду структуру (рис. 1.4 б), менш вигідну порівняно із зигзагоподібною. Однак клешневида конформація спрощує замикання ланцюгу в цикл і утворення нових зв'язків, а це в кінцевому підсумку дає виграш в енергії.
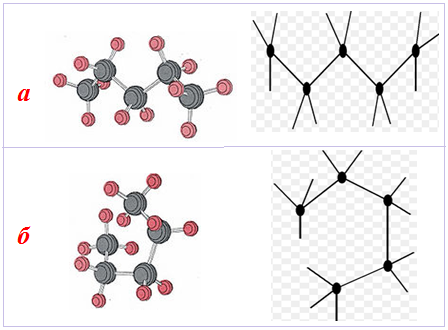
Рисунок 1.4 — Конформації молекули пентану С5Н12: а) зигзагоподібна; б) клешневида
б) Конфігураційна стереоізомерія зумовлюється наявністю в молекулі асиметричних атомів Карбону (в структурних формулах він позначається зірочкою: С*). Конфігураційні стереоізомери на відміну від конформаційних не здатні перетворюватися один в одного без розриву хімічних зв’язків (такий перехід може відбуватися тільки внаслідок хімічної реакції).
Асиметричний атом С* – це sp3-гібридизований атом Карбону, сполучений з чотирма різними за складом і будовою замісниками. Асиметричний атом має й іншу назву – хіральний центр (від грецького χειρ – рука), що наголошує на відсутність симетрії відносно лівого і правого боків (наприклад, хіральним є відображення об’єкту в ідеально плоскому дзеркалі, яке відрізняється від самого об’єкту).
Існує тільки два варіанти тетраедричного розміщення чотирьох замісників навколо sp3-гібридизованого асиметричного атома С*, які складають пару конфігураційних ізомерів – їх звичайно називають оптичні антиподи, або енантіомери. Енантіомери подібно до співвідношення між правою та лівою рукавичками уявляють собою дзеркальні відображення одна одної (рис. 1.5).
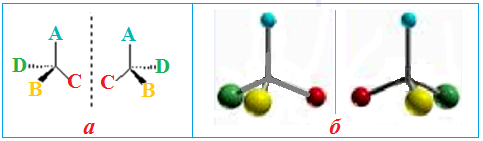
Рисунок 1.5 — Дзеркальні зображення sp3-гібридизованого асиметричного (хірального) атома Карбону з чотирма різними замісниками A, B, C і D: а) графічна формула; б) кульково-стрижньова модель
Для умовного зображення асиметричного атома Карбону на площині використовують проекційні формули Фішера, які одержують шляхом проектування на площину замісників – А, В, С і D, сполучених з асиметричним атомом С* (рис. 1.6 а). При цьому керуються такими правилами:
- карбоновий скелет розміщують вертикально;
- зверху записують старшу функціональну групу А;
- хімічний символ самого асиметричного атома С* не записують, а лише позначають його у вигляді перехрещених ліній;
- тетраедр орієнтують так, щоб хіральний центр знаходився на площині, причому вважається, що лівий (D) і правий (C) замісники розміщуються попереду від площини проекції, а верхній (А) та нижній (В) – по вертикалі за площиною креслення.
Інколи верхній та нижній замісники сполучають пунктирною лінією, щоб підкреслити їх віддаленість від спостерігача (рис. 1.6 б), але частіше цього не роблять (рис. 1.6 в).
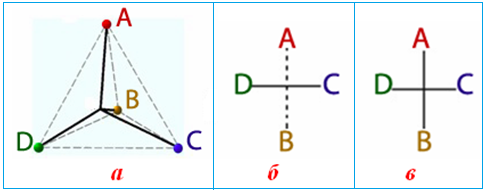
Рисунок 1.6 — Графічне зображення асиметричного атома С*, сполученого з різними замісниками А, В, С і D: а) об’ємне зображення; б) формула Фішера, в якій пунктирною лінією показано розміщення верхнього А і нижнього В замісників за площиною креслення; в) звичайна формула Фішера
Енантіомери за звичайних умов не відрізняються між собою ні за фізичними, ні за хімічними властивостями. Їх головною ознакою вважається оптична активність – здатність обертати площину поляризації світла, яка вперше була знайдена Луї Пастером.
Визначення конфігурації оптичних антиподів проводять експериментально, пропускаючи через розчин оптично активної речовини промінь плоскополяризованого світла і фіксуючи його напрямок і кут відхилення (рис. 1.7). Лівообертальний енантіомер позначають знаком «–», а правообертальній – знаком «+». Наприклад, якщо один з енантіомерів має кут питомого обертання –20о, то його оптичний антипод – +20о.
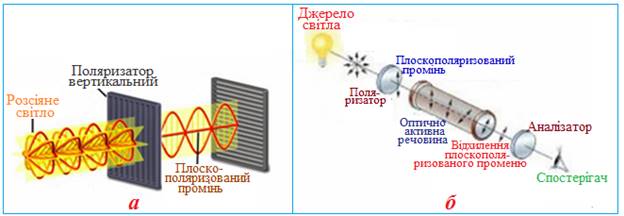
Рисунок 1.7 — Визначення конфігурації оптичних антиподів: а) утворення плоскополяризованого світла; б) змінення напрямку руху плоскополяризованого променю світла при проходженні його через розчин оптично активної речовини
Енантіомери (оптичні антиподи, дзеркальні ізомери) – це пара оптично активних ізомерів, які відрізняються конфігурацією асиметричного атома Карбону і мають протилежні за знаком, але однакові за величиною кути обертання площини поляризації світла (при ідентичності всіх інших фізичних і хімічних властивостей, за винятком реакцій з іншими оптично активними речовинами).
Явище енантіомерії характерне для спіральних конформацій білків, нуклеїнових кислот та інших біополімерів.
Сполуки, до складу яких входять декілька асиметричних атомів Карбону, відрізняються своїми особливостями від вже розглянутих оптично активних речовин – енантіомерів. Такі сполуки правильно називати σ-діастереізомерами, або просто σ-діастереомери (від грецьких diá – через, stereos – об’ємний), однак звичайно символом σ нехтують – його наводять тільки при необхідності розрізнити σ-діастереомери від π-діастереомерів (тобто геометричних ізомерів).
σ-Діастереомери – просторові ізомери, що не належать до оптичних антиподів і містять декілька асиметричних атомів Карбону, для частини з яких конфігурації центрів хіральності співпадають, а для решти асиметричних атомів є протилежними.
σ-Діастереомерними вважаються будь-які комбінації просторових ізомерів, що не складають пару оптичних антиподів – енантіомерів, як це видно при порівнянні проекційних формул Фішера, що зображують будову просторових ізомерів одного складу (рис. 1.8). Ізомери І і ІІ з одного боку та ІІІ і IV – з іншого виглядають як дзеркальне відображення один одного, тому уявляють собою дві пари енантіомерів. І навпаки, в ізомерах І і ІІІ співпадає тільки один центр хіральності, утворений третім атомом Карбона в ланцюгу – отже, вони є діастереомерами один відносно іншого. До аналогічного висновку можна дійти, розглядаючи пари діастереомерів І і IV, ІІ і ІІІ, ІІ і IV.
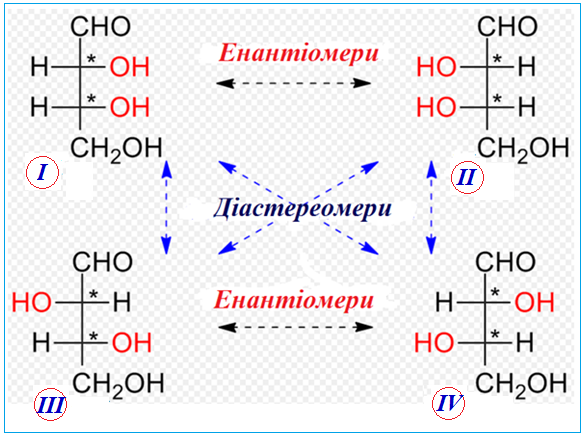
Рисунок 1.8 — Проекційні формули енантіомерів і діастереомерів одного складу
Діастереомери відрізняються один від одного за своїми фізичними і хімічними властивостями. Для прикладу розглянемо будову декількох моносахаридів складу С6Н12О6, зображену за допомогою проекційних формул Фішера:
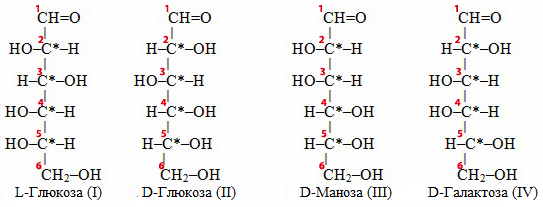
Як видно, стереоізомери L-глюкози (I) і D-глюкози (II) відрізняються конфігураціями чотирьох асиметричних атомів Карбону (С*2, С*3, С*4, С*5), тому L-глюкоза (I) і D-глюкоза (II) – це енантіомери, дзеркальні антиподи. В структурах D-глюкози (II), D-манози (III) і D-галактози (IV) різну конфігурацію мають атоми С*2, С*3, С*4, тому ці сполуки належать до діастеремерів. Якщо порівняти між собою окремо будови сполук D-глюкози (II) і D-манози (III), то видно, що вони відрізняються конфігураціями тільки атомів С*2, а сполуки D-глюкози (II) і D-галактози (IV) у свою чергу – конфігураціями С*4. Вони є епімерами.
Епімери – це діастереомери, які відрізняються один від одного конфігурацією тільки одного асиметричного атома Карбону.
Наявність у складі молекули асиметричного атома ще не є достатньою умовою оптичної активності речовини. У тому випадку, коли асиметричний центр виникає внаслідок реакції (наприклад, заміщення атомів Гідрогену в метиленовій групі СН2 головного ланцюгу чи приєднання до подвійного зв’язку двох різних атомних груп), то імовірність утворення обох антиподних конфігурацій є однаковою, тому продукт реакції виявляється оптично неактивним, незважаючи на асиметрію кожної окремої молекули.
Оптично неактивна модифікація речовини, що містить асиметричні атоми і складається з однакових кількостей обох оптичних антиподів, називається рацемат. Інакше кажучи, рацемат – це суміш однакових кількостей оптичних ізомерів, яка поводить себе як індивідуальна хімічна сполука, що позбавлена оптичної активності і відрізняється за фізичними властивостями від кожного з антиподів.
На відміну від енантіомерів, у яких конфігурація відповідних асиметричних центрів є протилежною (антиподною) і які відрізняються між собою тільки оптичними властивостями при повному збігу всіх інших властивостей, σ-діастереомери відрізняються не тільки величиною кута обертання плоскополяризованого світла, але і фізичними та хімічними особливостями, наприклад, температурами кипіння та плавлення, розчинністю, швидкостями перебігу реакцій тощо. До речі, на відмінності властивостей діастереомерів базується метод розщеплення рацематів на окремі оптичні антиподи.
Конфігураційна стереоізомерія найбільш поширена серед сполук природного походження: амінокислот, вуглеводів, алкалоїдів тощо. Наприклад, для моносахаридів складу С6Н12О6, відомо 16 стереоізомерів. В загальному випадку кількість стереізомерів для сполуки визначається за формулою 2n, де n – число асиметричних центрів. Однак дійсна кількість стереізомерів може зменшуватися завдяки частковій симетрії, коли два асиметричних центри мають формально однакові конфігурації.
Стереоізомерія має велике значення в реакціях біологічно активних речовин. З урахуванням того, що діастереомери відрізняються за своїми властивостями, можна зрозуміти, чому енантіомери однаково реагують з симетричними молекулами, але різним чином поводять себе з хіральними молекулами, до яких, наприклад, належать ферменти. Якщо два енантіомери взаємодіють з одним і тим самим хіральним реагентом, то продукти, що утворюються, вже втрачають ознаки оптичних антиподів, а набувають ознак діастереомерів і, як наслідок, відрізняються між собою за енергетичними характеристиками і властивостями. Так, молочна кислота, вилучена з м'яса, під дією ферменту молочнокислої дегідрогенази дегідрується (втрачає два атоми Н) до піровіноградної кислоти у той час, як для іншого енантіомеру – молочної кислоти, отриманої при бродінні, цей самий фермент не спроможний забезпечити дегідрування.
1.4. Приклади розв'язання задач
Приклад 1.1. Скласти структурні формули ізомерів монохлоралкану складу С4Н9Cl.
Розв’язок. Для галогенопохідних сполук складу С4Н9Cl можливо існування чотирьох структурних ізомерів, які розрізнюються будовою карбонового ланцюгу чи положенням замісника:

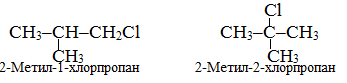
Приклад 1.2. Скласти структурні формули ізомерів амінобутанових (або аміномасляних) кислот С3Н6(NH2)–СООН, які мають однаковий карбоновий ланцюг, але відрізняються положенням замісника.
Розв’язок. Ізомери амінобутанових (або аміномасляних) кислот С3Н6(NH2)–СООН з різним положенням замісника (NH2) мають вигляд:
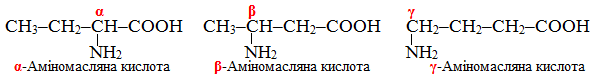
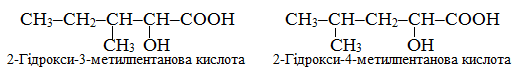
Приклад 1.3. Скласти не менше трьох структурних формул ізомерів α-гідроксокислот С6Н10(ОH)–СООН, які відрізняються будовою карбонового ланцюгу, але мають фіксоване положення замісника (ОН), сполученого з атомом С2.
Розв’язок. Структурні ізомери гідроксокислот, в яких замісник (ОН) сполучений з атомом С2 головного ланцюгу, називаються α-гідроксикислотами. Для складу С6Н10(ОН)СООН можливо існування декількох структурних ізомерів, утворених шляхом зміни будови карбонового ланцюгу при незмінному положенні замісника, наприклад:
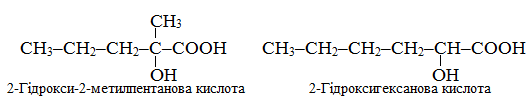
Приклад 1.4. Скласти формули структурних ізомерів циклічних вуглеводнів складу С5Н10.
Розв’язок. Для циклоаканів С5Н10 можливі такі структурні ізомери, в основі яких лежать цикли, що складаються з п’яти, чотирьох чи трьох атомів Карбону:
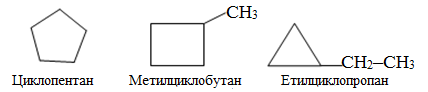

Приклад 1.5. Скласти декілька формул структурних і геометричних ізомерів складу С7Н12, які містять два подвійних зв’язки в головному ланцюгу.
Розв’язок. Вуглеводні з двома подвійними зв’язками в головному ланцюгу належать до гомологічного ряду алкадієнів, які здатні виявляти структурну і геометричну ізомерію. Структурні ізомери можуть відрізнятися різною довжиною ланцюгу та різним положенням як подвійного зв'язку, так і бокових вуглеводневих радикалів, наприклад, для алкадієнів складу С7Н12, що містять шість атомів Карбону в головному ланцюгу:
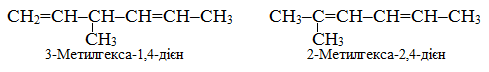
Просторові ізомери зумовлюються різним просторовим розташуванням карбонового ланцюгу відносно кожного подвійного зв’язку, наприклад, для гепта-2,4-дієну можливе існування таких просторових ізомерів:
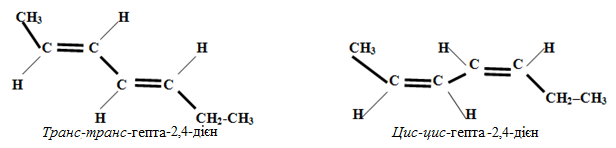
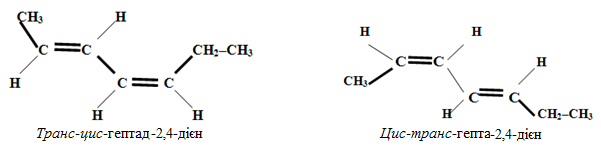
Приклад 1.6. Навести приклади трьох метамерів для вуглеводнів складу С6Н10.
Розв’язок. Метамери – це ізомери, що мають однаковий склад, але належать до різних гомологічних рядів вуглеводнів чи до різних класів органічних сполук. Склад С6Н10 можуть мати представники гомологічних рядів алкадієнів, алкінів, циклоалкенів, наприклад, ізомери складу С6Н10:
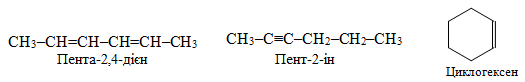
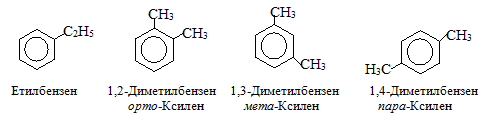
Приклад 1.7. Скласти структурні формули ізомерів С8Н10, які містять бензенове кільце.
Розв’язок. У ди- і багатозаміщених гомологів бензену існує структурна ізомерія, зумовлена різним положенням замісників: