- 3.1 Теорія будови органічних сполук
- 3.2 Сучасні уявлення про будову атома
- 3.3 Стан атома Карбону в органічних сполуках
- 3.4 Гібридизація атомних орбіталей
- Приклади розв'язання задач
Ключові терміни:
валентний кут, валентні електроні, гібридизація, електронна хмара, електронно-графічні схеми, електронні формули, електронні шари, енергетичний підрівень, енергетичні рівні, закон Мозлі, квантова комірка, ковалетність, орбіталь, планетарна модель атома, правило Гунда, принцип Паулі, принцип квантування енергії, принцип корпускулярно-хвильового дуалізму, принцип мінімуму енергії, принцип невизначеності, рівняння Де Бройля, хвильове рівняння Шредінгера, хімічна будова, шкала енергії3.1 Теорія будови органічних сполук
До середини XIX ст. в органічній хімії був накопичений величезний фактичний матеріал, подальше пояснення якого гальмувалося відсутністю систематизуючої основи, спроможної обґрунтувати особливості будови і властивостей органічних сполук. Тому почали з’являтися численні теорії, які зробили певний внесок у вивчення структури органічних сполук, однак не могли узагальнити всі відомості про їх властивості та реакційну здатність. Це вдалося здійснити О.М.Бутлерову (1861 р.).
Сутність теорії будови органічних сполук Бутлерова можна стисло сформулювати за допомогою декількох основних положень.
- Атоми в молекулах сполучені один із одним хімічними зв’язками відповідно до їх валентностей. Карбон практично в усіх органічних сполуках виявляє валентність IV, Гідроген – I, Оксиген – II.
- Атоми розташовуються в молекулах не хаотично, а сполучені між собою в певній послідовності. Порядок розміщення атомів у молекулі та характер хімічних зв’язків між ними називається хімічна будова.
- Властивості органічних сполук залежать не тільки від якісного і кількісного складу, але і від хімічної будови їх молекул.
Це положення найбільш наочно ілюструється при співставленні будови і властивостей ізомерів. Наприклад, відомі дві різні речовини складу С2Н6О з однаковою молекулярною масою (46 а.о.м.), які відрізняються послідовністю сполучення атомів, фізичними і хімічними властивостями: етиловий спирт (рідина, Ткип = 78оС) і диметиловий етер (газ, Ткип = –24оС), різна будова яких відображається різними структурними формулами:
![]()
- В молекулах існує взаємний вплив атомів – як тих, що сполучені хімічними зв’язками безпосередньо один із одним, так і тих, що розділені проміжними атомами чи атомними групами.
Для прикладу розглянемо властивості атома Гідрогену в сполуках: метані СН4, воді Н2О, амоніаку NН3, натрій гідроксиді NaОН. Умовно виділимо один атом гідрогену в кожній сполуці:
![]()
Якщо порівняти відношення виділених атомів Гідрогену до металів, кислот, лугів та представників інших класів, зрозуміло, що вони поводять себе в хімічних реакціях протилежним чином завдяки впливу сполучених з ними різних атомних груп.
- Хімічна будова речовини встановлюється при вивченні її хімічних перетворень і, навпаки, на основі хімічної будови сполуки можна визначити її властивості.
Теорія будови органічних сполук Бутлерова стала логічно завершеною науковою основою органічної хімії. Вона не тільки пояснила вже відомі на той час факти, але і дозволила прогнозувати існування нових органічних речовин.
3.2 Сучасні уявлення про будову атома
Основні положення теорії Бутлерова підкреслюють, що хімічна будова зумовлює властивості органічних сполук, тобто їх здатність вступати в ті чи інші реакції. Отже, для керування перебігом реакцій з метою одержання бажаних продуктів необхідно досконало знати хімічну будову речовин, яка цілком і повністю визначається будовою окремих атомів, що входять до складу сполуки. Тому для розуміння основ органічної хімії необхідно ознайомитися з сучасними концепціями щодо будови атома.
До виникнення сучасної квантово-механічної теорії про будову атома серед науковців панували уявлення, які базувалися на законах класичної фізики. Узагальнювала такі уявлення запропонована Резерфордом (1911 р.) планетарна модель атома, що зводилась до декількох основних стверджень:
- атом – це електронейтральна система, що складається з ядра і електронної оболонки (рис. 3.1 а);
- в центрі атома міститься позитивно заряджене ядро, радіус якого становить мізерну частину радіуса атома (рис. 3.1 б); увесь позитивний заряд і майже вся маса атома зосереджені в його ядрі;
- навколо ядра обертаються негативно заряджені електрони, кількість яких дорівнює позитивному заряду ядра.
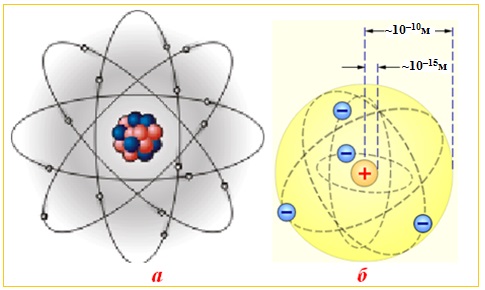
Рисунок 3.1 – Будова атома за Резерфордом: а) планетарна модель;
б) розміри атома і атомного ядра
Теорія Резерфорда стала поштовхом до відкриття фундаментальної залежності, нині відомої як закон Мозлі: Заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі Д.И.Менделєєва.
3.2.1 Квантово-механічна модель атома
Планетарна модель Резерфорда та інші спроби пояснити будову атома довели безпідставність автоматичного поширення законів класичної фізики, справедливих для великих об’єктів макросвіту, на мізерно малі частинки – об’єкти мікросвіту. Тому для опису властивостей і поведінки мікрочастинок поступово сформувалася якісно нова фізична теорія – квантова механіка (або хвильова механіка), що ґрунтується на видатних гіпотезах і законах, справедливість яких блискуче підтвердилася подальшими науковими відкриттями. Перелічимо найважливіші гіпотези, які прийнято називати принципами.
1) Принцип квантування енергії, відкритий Планком. Для пояснення властивостей мікрочастинок на прикладі фотона було введено деякі припущення. По-перше, мікрочастинка є неподільною і існує у вигляді дискретного утворення. По-друге, променева енергія випромінюється і поглинається не безперервно, а дискретно – невеликими порціями (квантами), енергія Е яких залежить від частоти ν згідно з рівнянням Планка:
![]()
де h – стала Планка, яка визначає квант енергії (h = 6,626·10–34 Дж·с).
2) Принцип корпускулярно-хвильового дуалізму, відповідно до якого електрон в атомі виявляє подвійні властивості, зумовлені наявністю одночасно як ознак корпускули (від латинського corpusculum – частинка), що має деяку масу m і швидкість ʋ, так і ознак хвилі з певною довжиною хвилі λ та частотою коливань ν. Вперше гіпотезу щодо корпускулярно-хвильового дуалізму електрона в атомі висловив Де Бройль (1924 р.), стверджуючи, що електрон має властивості стоячої електромагнітної хвилі, подібної до закріпленої з обох боків скрипкової струни, яка здатна коливатися тільки з певними частотами (рис. 3.2). Коливання, при яких амплітуда на обох зафіксованих кінцях струни не дорівнює нулю, просто неможливі.
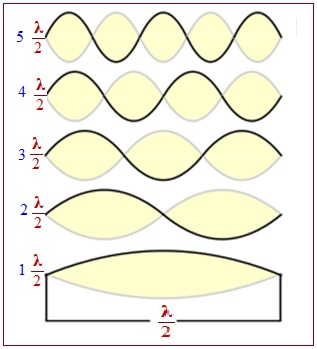
Рисунок 3.2 – Стоячі хвилі, кінці яких закріплені на відстані цілого числа на півхвиль λ/2 один від одного
Однак на відміну від коливання скрипкової струни хвилі Де Бройля уявляють собою хвилі імовірності. Де Бройль вважав, що електрон в атомі рухається так само, як світловий квант, якому відповідає хвиля світла. Такий погляд пояснював квантові умови: з геометричних міркувань хвиля, що рухається навколо ядра, може бути тільки стаціонарною хвилею, а довжина хвилі повинна бути кратною цілому числу напівхвиль – так званих хвиль Де Бройля λБ – і укладатися на орбіті ціле число напівразів (рис. 3.3).
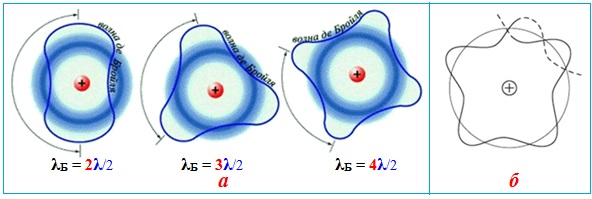
Рисунок 3.3 – Хвилі Де Бройля: а) для електрона з номерами орбіт n = 2, 3 і 4 за умови кількості напівхвиль відповідно 2λ/2, 3λ/2 і 4λ/2; б) якщо довжина орбіти не дорівнює цілому числу напівхвиль, тоді електрон покидає межі атома
Двоїсту корпускулярно-хвильову природу електрона в атомі описує рівняння Де Бройля, що пов’язує довжину хвилі λ електрона з його масою m і швидкістю ʋ:
![]()
Добуток маси m на швидкість ʋ називається кількістю руху, або імпульсом р (р = m · ʋ), тому рівняння Де Бройля може мати і такого вигляду:
![]()
Розрахункові порівняння хвильових (λ) і корпускулярних (m) властивостей електрона (λ : m = 0,332 · 10–9 · 9,1095 · 10–31 ~ 3,7 · 1020) свідчать про значну (~ 20 порядків) перевагу хвильових властивостей електрона над корпускулярними.
3) Принцип невизначеності Гейзенберга (1927 р.), який спрощено формулюється так: неможливо однозначно і точно встановити швидкість електрона і його координати.
Математичний вираз принципу невизначеності має вигляд
![]()
де Δх, Δр, Δʋ – відповідно невизначеності (інакше кажучи – похибки у визначенні) в координаті х, імпульсі р та швидкості ʋ електрона.
Із наведених рівнянь випливає: чим точніше визначена координата електрона (тобто чим менша похибка у визначенні координати Δх), тим менш визначеною стає величина імпульсу (тобто похибка у визначенні імпульсу прямує до нескінченності Δр → ∞). І навпаки: чим точніше визначений імпульс (швидкість), тим більш невизначене місцезнаходження електрона. Так, якщо при радіусі атома приблизно 10–10 м положення електрона визначено з точністю усього до 10–12 м, то невизначеність в швидкості складатиме 5,8 · 107 м/с (при швидкості електрона 2,187 · 106 м/с!).
4) Принцип хвильового характеру руху електрона в атомі, виражений через хвильове рівняння Шредінгера – ще одне важливе положення, на якому базується квантово-механічна модель будови атома. Квантова механіка відмовилася від уточнення місцезнаходження електрона і від уявлення про його рух по чітко окресленій орбіті, замінивши класичне поняття точних координат поняттям статистичної імовірності його знаходження в даному елементі об’єму dV навколо ядра. Це й зрозуміло: за умови невизначеності положення електрона в атомі можна говорити лише про імовірність його перебування в тій чи іншій точці атомного простору.
Хвильове рівняння Шредінгера (1925 р.) пов’язує потенціальну U і повну Е енергії електрона з хвильовою функцією «псі» ψ, яка не має строгого фізичного змісту, а лише порівнюється з тримірною амплітудою коливання, не будучи ідентичною їй. Однак фізичний зміст має добуток ψ2dV, який характеризує імовірність локалізації електрона в елементарному об’ємі навколоядерного простору
Подібно до амплітуди будь-якого іншого процесу хвильова функція y може набувати як додатних, так і від’ємних значень, але величина ψ2завжди додатна. При цьому вона має надзвичайну властивість: чим більше значення ψ2 в якійсь точці простору, тим вища імовірність того, що електрон виявить там свою дію, тобто його існування може бути відкритим у фізичному процесі.
Допустимими розв’язками рівняння Шредінгера є набор функцій ψ1, ψ2, ψ3, …ψn, кожній з яких відповідає своє значення енергії Е1, Е2, Е3,…Еn. Тим самим хвильове рівняння підтверджує квантову природу енергії електрона в атомі і одночасно виводить поняття про квантові рівні, або енергетичні рівні, фізичним втіленням яких є електронні шари в атомі, де розосереджуються електрони.
Найменшу енергію електрон має на найближчому до ядра енергетичному рівні (n = 1); у міру віддалення від ядра (із зростанням номера рівня n), енергія електрона збільшується. При n = ∞ припускають, що електрону надано енергію, достатню для його повного відділення від ядра (іонізація атома).
З математичних позицій хвильова функція ψ, що є розв'язком рівняння Шредінгера, називається орбіталь.
Проте поряд з математичним часто користуються й спрощеним тлумаченням:
Орбіталь – це простір навколо ядра, в якому найімовірніше перебування електрона.
Крім поняття «орбіталь» в квантовій механіці застосовують уявлення про електронну хмару.
Електронна хмара – фізична модель стану електрона в атомі, густина відповідних ділянок якої пропорційна імовірності перебування там електрона.
Форма електронної хмари може бути різною. Це пояснюється тим, що електрон в атомі одночасно зазнає впливу багатьох сил, наприклад, доцентрової сили, зумовленої притяганням до позитивно зарядженого ядра, відцентрової сили, зумовленою інерцією руху електрона навколо ядра, сили відштовхування від інших електронів в атомі тощо. Сукупна дія всіх сил впливає на енергію зв’язку електрона з ядром і, як наслідок, визначає форму орбіталі, яку позначають латинськими буквами s, p, d, f (рис. 3.4 і 3.5).
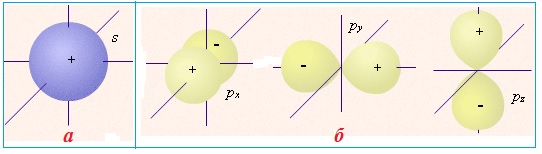
Рисунок 3.4 – Моделі електронних хмар: а) сферична форма s-орбіталі, яка характеризується найменшою енергією на енергетичному рівні та розташовується найближче від ядра порівняно з іншими орбіталями даного енергетичного рівня; б) три р-орбіталі: чим вища енергія електрона, тим швидше він обертається навколо ядра, тим сильніше витягується область його існування, набуваючи гантелеподібної форми. При цьому електронні хмари займають в навколоядерному просторі три положення вздовж осей координат x, y і z, що пояснюється взаємним відштовхуванням негативно заряджених електронних хмар, які намагаються зайняти положення якомога далі одна від одної. Усі разом px-, py- і px-електронні хмари утворюють симетричну геометричну фігуру, у центрі якої розміщується атомне ядро
Рисунок 3.5 – Моделі електронних хмар: а) п’ять d-орбіталей; б) сім f-орбіталей
Орбіталі, що мають однакову форму і знаходяться на одному енергетичному рівні, складають енергетичний підрівень. Кількість підрівнів на будь-якому енергетичному рівні дорівнює номеру цього рівня. Наприклад, на четвертому енергетичному рівні (n = 4) міститься чотири підрівні, кожний з яких має своє позначення: 4s, 4p, 4d, 4f.
3.2.2 Принципи заповнення електронної оболонки атома
Для вичерпного пояснення будови електронних оболонок необхідно знати три фундаментальних положення.
Принцип Паулі, який іноді називають забороною Паулі, формулюється так: В атомі не може бути двох або більше електронів з однаковими властивостями.
З принципу Паулі випливає декілька наслідків, які визначають максимальну ємність енергетичних рівнів, підрівнів і орбіталей.
1) Перший наслідок: одну орбіталь можуть займати не більше, ніж два електрони з антипаралельними спінами.
Якщо на одній орбіталі знаходиться єдиний електрон, його називають неспареним, а якщо два – то це спарені електрони. Спарені електрони відрізняються один від одного так званим «спіном» – власним моментом імпульсу, не пов’язаним з рухом електрона в просторі. На теперішній час думки щодо фізичного змісту спіну електрона діаметрально протилежні. Одні доводять, що спін – це суто квантово-механічна ознака електрона, яка не має класичних аналогів, а тільки відображає наявність у електрона власного моменту кількості руху. Інші впевнені, що спін характеризує обертання електрона навколо власної вісі за годинниковою стрілкою чи проти неї (рис. 3.6).
Рисунок 3.6 – Гіпотетична модель спіну електрона, яка достовірно не доведена, але і доказово не спростована
Для ілюстрації розміщення електронів в атомі використовують електронно-графічні схеми, в яких одна орбіталь позначається за допомогою невеликої клітинки (квантова комірка), а електрон – стрілкою (рис. 3.7).
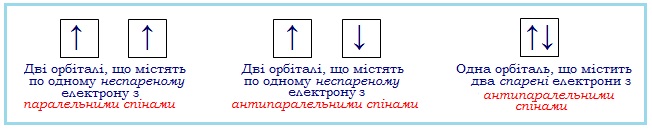
Рисунок 3.7 – Електронно-графічні схеми (пояснення в тексті)
2) Другий наслідок принципу Паулі визначає максимальну кількість електронів на енергетичному підрівні, яка залежіть від кількості орбіталей (табл. 3.1). З урахуванням Першого наслідку на s-підрівні, який складається з однієї орбіталі, може максимально перебувати 1 · 2 = 2 електрони, на трьох орбіталях р-підрівня – 3 · 2 = 6, на п’яти орбіталях d-підрівня – 5 · 2 = 10, на сімох орбіталях f-підрівня – 7 · 2 = 14 електронів.
Таблиця 3.1 – Графічне зображення орбіталей у вигляді квантових комірок
3) Третій наслідок принципу Паулі: максимальна кількість електронів на будь-якому енергетичному рівні дорівнює 2n2, де n – номер рівня. Виходячи з цього, легко розрахувати можливу кількість електронів на будь-якому енергетичному рівні: на першому (n = 1) може знаходитися 2 · 12 = 2 електрони, на другому (n = 2) – 2 · 22 = 8, на третьому (n = 3) – 2 · 32 = 18, на четвертому (n = 4) – 2 · 42 = 32 електрони.
Принцип мінімуму енергії: В атомі електрони заповнюють вільні орбіталі з мінімальними енергіями, що відповідає їх найміцнішому зв’язку з ядром.
За зростанням енергії орбіталей енергетичні підрівні розміщуються в послідовності, яка називається шкала енергії (рис. 3.8):
Рисунок 3.8 – Послідовність заповнення електронами енергетичних підрівнів
На кожному наступному рівні енергія електронів більша, ніж на попередньому, а зв’язок із ядром відповідно менший. У межах певного енергетичного рівня енергія електронів дещо збільшується при переході з s-підрівня на р- і з р- на d-підрівень (рис. 3.9).
Рисунок 3.9 – Зростання енергії енергетичних рівнів і підрівнів
Правило Гунда: Стійкому стану атома відповідає такий розподіл електронів на енергетичному підрівні, при якому електрони певного підрівня займають максимально можливу кількість орбіталей.
З цього випливає, що на суміжних орбіталях одного підрівня спочатку розміщуються електрони з паралельними спінами, а після цього ті самі орбіталі заповнюються електронами з антипаралельними спінами. Наприклад, на d-підрівні п’ять електронів розміщуються за схемою
Правило Гунда не забороняє іншого розподілу електронів у межах підрівня. Воно лише стверджує, що атом має найменшу можливу енергію при максимальній кількості неспарених електронів. При будь-якому іншому розподілі електронів енергія атома буде більшою, отже, атом буде перебувати в нестійкому (збудженому) стані.
Розподіл електронів в атомі виражають не тільки електронно-графічними схемами (квантовими комірками, в яких клітинка символізує орбіталь, а стрілка – електрон), але і за допомогою умовного запису, який називається електронні формули. В електронних формулах цифрами вказують номер енергетичного рівня, латинськими буквами – енергетичні підрівні, а цифрами вгорі справа – кількість електронів на підрівні. Так, запис 5d4 означає, що на d-підрівні п’ятого енергетичного рівня розміщуються чотири електрони.
Складемо для прикладу електронну формулу елемента Мангану. Порядковий номер Мангану, який дорівнює 25, вказує на загальну кількість електронів в атомі, розподілених по чотирьох електронних шарах (оскільки Mn знаходиться в четвертому періоди періодичної системи елементів). Спочатку проходить заповнення електронами першого енергетичного рівня (n = 1), який складається з одного s-підрівня, що має одну s-орбіталь, тому на першому рівні максимально може перебувати два електрони: 1s2. На другому рівні (n = 2) відповідно до Третього наслідку принципу Паулі розміщуються ще вісім електронів (2 · 22 = 8), які розподіляються по двох підрівнях: 2s22р6. На третьому рівні (n = 3) може перебувати вісімнадцять електронів (2 · 32 = 18), але зі шкали енергії (рис. 3.9) випливає, що спочатку заповнюється електронами 4s-підрівень і тільки потім – 3d. З урахуванням цього маємо кінцевий вигляд електронної формули і електронно-графічної схеми атома елемента Мангану:
3.3 Стан атома Карбону в органічних сполуках
Елемент Карбон (порядковий номер 6) розміщується в другому періоді, головній підгрупі IV групи періодичної системи Д.І.Менделєєва. З електронної конфігурації Карбону (1s22s22p2) випливає, що на двох енергетичних рівнях атома С перебуває шість електронів, з яких чотири знаходяться на зовнішньому (другому) рівні:
![]()
Зовнішні електрони атома зумовлюють спінвалентність, або ковалентність Карбону.
Ковалетність – це кількість ковалентних зв’язків, яку атом здатний утворити; ковалентність визначається кількістю неспарених електронів в основному стані атома або кількістю неспарених електронів, що з’являються в атомі при його збудженні.
Оскільки атом Карбону в основному стані має два неспарених електрони, його ковалентність дорівнює двом, тобто він може утворювати два зв’язки. Однак практично в усіх органічних сполуках атом С утворює чотири зв’язки завдяки збудженню внаслідок поглинання певної кількості енергії (405,7 кДж/моль) – при цьому відбувається розпаровування спарених електронів. У збудженому стані, який позначають за допомогою зірочки С*, атом Карбону має вже чотири неспарених електрони, які називаються валентні електроні:
Збудження атома С при переході із стану 2s22p2 в стан 2s12p3 потребує витрати енергії (hν), яка не тільки повністю компенсується при утворенні хімічних зв’язків, але й дає енергетичний виграш. Наприклад, енергія, що виділяється при утворенні кожного зв’язку С–Н у вуглеводнях, становить 415,5 кДж/моль. А при утворенні двох додаткових зв’язків (порівняно з основним станом) виділяється енергії на 415,5·2 – 405,7 = 425,3 кДж/моль більше, ніж її потрібно для збудження атома.
Кожна орбіталь збудженого атома С* характеризується певною формою та енергією (рис. 3.10).
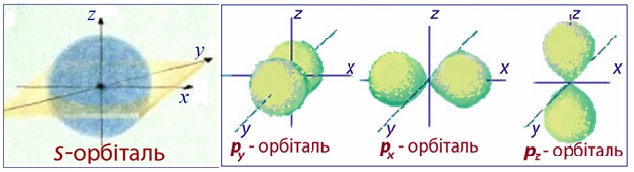
Рисунок 3.10 – Орбіталі атома Карбону в збудженому стані
3.4 Гібридизація атомних орбіталей
Різниця у формі та енергії атомних орбіталей повинна спричиняти утворення хімічних зв’язків С–Н, відмінних за своєю енергією. Однак дослідження доводять, що насправді ці зв’язки є рівноцінними завдяки явищу гібридизації.
Гібридизація – це процес змішування та вирівнювання орбіталей за формою і енергією, при якому відбувається перерозподіл електронних густин близьких за енергією орбіталей, внаслідок чого вони стають рівноцінними.
Для валентних орбіталей збудженого атома Карбону можливі три типи гібридизації.
І. sp-Гібридизація. При комбінації однієї s- i однієї р-орбіталей виникають дві sp-гібридизовані орбіталі у формі неправильної вісімки, що розміщуються симетрично під валентним кутом 1800 (рис. 3.11).
Валентний кут – це кут між осями зв’язку – уявними лініями, які проходять через ядра хімічно сполучених атомів.
Зв’язки, які утворюються за участю електронів валентних орбіталей, також розміщуються під кутом 1800, що зумовлює лінійну форму молекули. Такий тип гібридизації реалізується в молекулах вуглеводнів з потрійними зв’язками, наприклад, в молекулі етину (стара назва ацетилен) НС≡СН та його гомологів.
Рисунок 3.11 – Загальна схема sp-гібридизації
ІІ. sp2-Гібридизація. Комбінація однієї s- і двох р-орбіталей приводить до утворення трьох sp2-гібридизованих зв'язків, розміщених під кутом 1200 (рис. 3.12). Тому фрагмент молекули, в якому зв’язки утворені за рахунок sp2-гібридизованих орбіталей, набуває форми правильного трикутника. Наприклад, збуджений атом Карбону С*(2s12p3) перебуває в стані sp2-гібридизації в молекулі етилену (Н2С=СН2) і в інших органічних сполуках, що містять фрагменти ланцюгу з подвійними зв’язками (>С=С<). Три гібридизовані орбіталі кожного атому Карбону утворюють три зв’язки: два з атомами Гідрогену (С–Н) і один з сусіднім атомом Карбону (С–С), а негібридизовані р-орбіталі утворюють ще один додатковий зв’язок між атомами Карбону.
Рисунок 3.12 – Схема sp2-гібридизації атомних орбіталей і плоска трикутна форма молекули, зумовлена sp2-гібридизацією атомних орбіталей
ІІІ. sp3-Гібридизація. Комбінація чотирьох орбіталей (однієї s- і трьох р-) приводить до sp3-гібридизації, при якій чотири гібридизовані орбіталі симетрично орієнтовані у просторі до чотирьох вершин уявного тетраедра, тобто під валентним кутом 109028` (рис. 3.13). Таке розміщення зв’язків зумовлює тетраедричну форму молекул, що характерно для насичених сполук чотиривалентного Карбону (СН4, СCl4, C2H6).
Рисунок 3.13 – Схема sp3-гібридизації атомних орбіталей і тетраедрична форма молекули, що зумовлена sp3-гібридизацією
Так, в молекулі метану СН4 атом Карбону, який в основному стані мав електронну структуру 2s22p2, а після збудження – 2s12p3, піддається sp3-гібридизації, причому кожна з чотирьох гібридизованих орбіталей містить по одному неспареному електрону (рис. 3.14) і утворює чотири рівноцінні зв’язки при перекриванні з сферичними 1s-орбіталями чотирьох атомів Н. Це сприяє симетричному перекриванню електронних орбіталей у вершинах уявного тетраедру з атомом С* у центрі (рис. 3.15).
Рисунок 3.14 – Схема послідовного переходу атома Карбону в збуджений і гібридизований стан
Рисунок 3.15 – Тетраедрична форма молекули СН4, що утворюється внаслідок перекривання чотирьох sp3-гібридизованих орбіталей атома С* з сферичними s-орбіталями чотирьох атомів Н
Завдяки sp3-гібридизації, яка зумовлює розмір валентного кута (109028`), молекули насичених алканів з довгим ланцюгом часто мають зигзагоподібну форму (рис. 3.16).
Рисунок 3.16 – Просторова форма молекули бутану С4Н10: а) структурна формула; б) модель молекули
Тип гібридизації визначається типом і кількістю вихідних орбіталей і змінює розмір валентного кута (рис. 3.17, табл. 3.2), а також просторову конфігурацію молекул.
Рисунок 3.17 – Форма гібридизованих орбіталей і розмір валентних кутів залежно від типу гібридизації: а) sp-гібридизація; б) sp2-гібридизація; в) sp3-гібридизація
Таблиця 3.2 – Геометрична конфігурація молекул залежно від типу гібридизації центрального атома
Приклади розв'язання задач
Приклад 3.1. Вибрати вірний розподіл двох електронів по квантових комірках р-підрівня. Відповідь мотивувати.
Розв'язок. З правила Гунда випливає, що в межах одного підрівня два електрони повинні розміщуватися на суміжних орбіталях і мати паралельні однонапрямлені спіни, тому вірними є ті електронно-графічні схеми, в яких в сусідніх квантових комірках зображені стрілочки, направлені в один бік. Цьому відповідає два варіанти – а) і д):
Приклад 3.2. Розмістити електрони по квантових комірках для атома деякого елемента з такою конфігурацією зовнішнього електронного шару: 3s23p4.
Розв'язок. Відповідно до правила Гунда на 3s-підрівні розміщуються два спарені електрони, а три орбітали 3р-підрівня заповнюються спочатку по одному електрону і тільки після цього четвертий електрон займає першу з напівзабудованих р-орбіталей:
Приклад 3.3. На основі електронних формул і електронно-графічних схем визначити ковалентність елементів другого періоду періодичної системи Нітрогену і Оксигену.
Розв'язок. Ковалентність зумовлюється кількістю неспарених електронів в атомі, що перебуває в основному чи збудженому стані. Будова атомів 7N і 8O відображається електронними формулами:
Другий енергетичний рівень, який є зовнішнім як для атома N, так і для атома О, містить тільки два підрівня (s- і р-), тому перехід атомів у збуджений стан шляхом розпаровування спарених електронів неможливий. Отже, кавалентність Нітрогену дорівнює трьом, а Оксигену – двом, як це видно з електронно-графічних схем атомів:
Приклад 3.4. Визначити тип гібридизації кожного атома Карбону в молекулах, будова яких відображається структурними формулами:
Розв’язок. Кратність утворених збудженим атомом Карбону хімічних зв’язків залежить від типу гібридизації: одинарні зв’язки утворюються sp3-гібридизованими атомами С*, подвійні – sp2-гібридизованими, потрійні – sp-гібридизованими атомами Карбону. Оскільки на структурних формулах зв’язки позначаються за допомогою рисочок, то легко встановити тип гібридизації кожного атома С в обох сполуках:
Приклад 3.5. Визначити величини валентних кутів в молекулі вінілацетилену:
СН2=СН–С≡СН.
Розв’язок. Величина валентного кута і геометрична форма молекули зумовлюється типом гібридизації атомів Карбону: при sp3-гібридизації розмір валентного кута складає 109о28`, при sp2-гібридизації – 120о, при sp-гібридизації – 180о. Для зручності пронумеруємо атоми Карбону в ланцюгу молекули вінілацетилену, починаючи від подвійного зв’язку і на підставі викладених в попередньому прикладі міркувань проставимо тип гібридизації кожного атома С:
Приймаючи до уваги типи гібридизації, запишемо величини валентних кутів:



