Ключові терміни:
Електронегативність, Побічна підгрупа Б, Спорідненість до електрона, енергія іонізаціТема 5 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ Д.І.МЕНДЕЛЄЄВА
5.1 Періодичний закон
Аналізуючи дані про внутрішній зв’язок між групами подібних за властивостями речовин, Д.І. Менделєєв дійшов до висновку, що хімічні і фізичні властивості повинні зумовлюватися якимись фундаментальними загальними характеристиками хімічного елементу. Такою фундаментальною характеристикою Д.І. Менделєєв обрав атомну масу елементу і вивів стисле формулювання періодичного закону (1869 р.):
властивості простих тіл, а також форми і властивості їх сполук перебувають у періодичній залежності від їх атомної ваги.
У роботі над періодичним законом Д.І.Менделєєв керувався таким підходом:
-
в основу класифікації поклав атомну масу елемента;
-
розташував елементи у порядку збільшення їх атомних мас;
-
надав кожному елементу порядкового номера;
-
порівняв властивості елементів та їх сполук.
Заслуга Менделєєва полягає в тому, що він зрозумів виявлену залежність як об’єктивну закономірність природи, чого не змогли зробити його попередники. Д.І. Менделєєв вважав, що в періодичній залежності від атомної маси перебувають склад сполук, їх хімічні властивості, температури кипіння і плавлення, будова кристалів тощо. Глибоке розуміння суті періодичної залежності дало Менделєєву змогу зробити кілька важливих висновків і передбачень.
По-перше, із відомих на той час 63 елементів Менделєєв змінив атомні маси майже у 20 елементів. Так, Берилій, який вважався на той час тривалентним, Менделєєв відніс до двовалентних елементів і виправив його атомну масу з 13,7 на 9,4. Валентність Індію він, напроти, змінив з двох на три, що дало змогу виправити його атомну масу з 75,4 на 113,1. Сучасні значення атомних мас Берилію (9,01) та Індію (114,8) близькі до запропонованих Менделєєвим величин.
По-друге, Менделєєв передбачив існування близько 11 нових елементів і залишив для них місце в періодичній системі. Три з них, а саме екабор, екаалюміній і екасиліцій були описані досить докладно і з дивовижною точністю. Це тріумфально підтвердилося протягом п’ятнадцяти років, коли були відкриті елементи Галій (екаалюміній), Скандій (екабор) і Германій (екасиліцій).
Як графічне втілення періодичного закону Д.І. Менделєєв запропонував періодичну систему, де розмістив хімічні елементи у порядку зростання їх атомної ваги. Однак у таблиці було виявлено ряд «порушень» у послідовності розміщення хімічних елементів: деякі елементи з більшою атомною вагою розміщувалися перед елементами з меншою атомною вагою (Аргон перед Калієм, Кобалт перед Ніколом, Телур перед Йодом). Такі «порушення» з’язувалися після відкриття явища ізотопії. Наприклад, вміст у природі більш важкого ізотопу Аргону є вищим, ніж вміст у природі менш важкого ізотопу Калію, проте заряд ядра атома Аргону менший, ніж заряд ядра атома Калію, тому в періодичній системі Калій розмішений після Аргону. Стало зрозумілим, що атомна вага елементів не може бути абсолютною характеристикою елемента. Вивчення будови атомів показало, що найважливішою константою будь-якого елемента є заряд його атомного ядра. Беручи до уваги відкриття Мозлі відносно порядкового номера елемента, який дорівнює заряду ядра, сучасне формулювання періодичного закону набуло такого вигляду:
Властивості простих речовин, а також форми і властивості сполук елементів
перебувають у періодичній залежності від величини зарядів їх атомних ядер
або від порядкового номера в періодичній системі.
5.2 Структура періодичної системи і електронні конфігурації атомів
Існує велика кількість варіантів періодичної системи, але найбільш зручними для застосування є коротка та довга її форми. У періодичній системі всі елементи розміщені послідовно у порядку зростання заряду ядра атома. При цьому, кожний елемент займає певну клітинку, в якій зазначено його символ і назву, порядковий номер, відносну атомну масу, а для радіоактивних елементів у квадратних дужках наведено масове число найбільш стабільного або доступного ізотопу.
Основними структурними одиницями періодичної системи є періоди і групи – природні сукупності, на які поділяються хімічні елементи за електронними структурами.
Період – це горизонтальна послідовність елементів, в атомах яких електрони заповнюють однакову кількість енергетичних рівнів.
Номер періоду збігається з номером зовнішнього енергетичного рівня. Наприклад, елемент Калій (4s1) знаходиться у четвертому періоді, тобто його атом має чотири енергетичні рівні, а валентний електрон перебуває на зовнішньому, четвертому рівні.
Перші три періоди називаються малими, а елементи другого і третього періодів – ще й типовими. Усі інші періоди, включаючи і сьомий, незавершений називаються великими.
Усі періоди, крім першого, починаються з лужних металів (Li, Na, K, Rb, Cs, Fr) і закінчуються, за винятком незавершеного сьомого, інертними елементами (He, Ne, Ar, Kr, Xe, Rn). Лужні метали мають однакову зовнішню електронну конфігурацію ns1, де n – номер періоду. Інертні елементи, крім Гелію (1s2), теж мають однакову будову зовнішнього електронного шару: ns2np6.
У перших трьох періодах із збільшенням заряду ядра відбувається заповнення електронами зовнішнього енергетичного рівня, номер якого збігається з номером періоду в періодичній системі.
Перший період складається з двох елементів. У атома Гідрогену один електрон розміщується на єдиній орбіталі s-підрівня першого енергетичного рівня (n=1). Електронна формула водню записується:
![]()
Відповідно до принципу Паулі на s-орбіталі може знаходитись два електрони з антипаралельними спінами, тому електронна формула атома Гелію має такий вигляд:
2Не 1s2
Завдяки такому розміщенню електронів утворюється стійка конфігурація, яка визначає хімічну інертність Гелію. У атома Гелію завершується забудова найближчого до ядра рівня.
У елементів другого періоду відбувається забудова другого рівня (n=2): спочатку заповнюється 2s-орбіталь, а потім послідовно три р-орбіталі. Для спрощення на електронних схемах зазначаються лише неповністю заповнені енергетичні рівні:
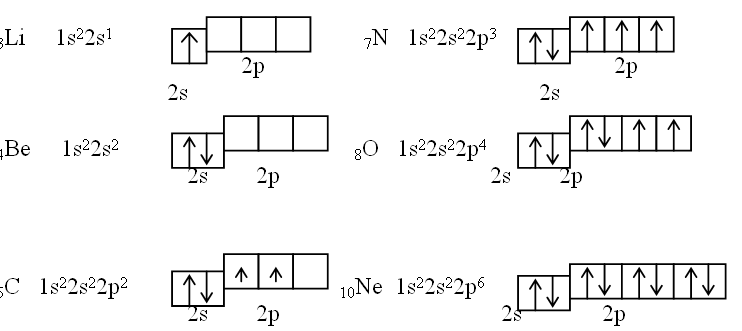
Третій період, в якому проходить забудова третього рівня (n=3), так, як і другий, містить вісім елементів: два s-елементи (Na, Mg) і шість р-елементів (Al, Si, P, S, Cl, Ar), причому конфігурація зовнішнього енергетичного рівня відповідних елементів другого і третього періодів аналогічна. Таким чином, у елементів третього періоду залишається вільним 3d-підрівень.
Четвертий і п’ятий періоди містять по вісімнадцять елементів. В атомів елементів четвертого періоду відбувається забудова четвертого рівня (n=4), починаючи з 4s-орбіталі. Поява електрона в 4s-стані за наявності вільних 3d-орбіталей зумовлюється екрануванням ядра щільним і симетричним електронним шаром 3s23p6. У зв’язку з відштовхуванням від цього шару для 19-го електрона атома Калію і 20-го електрона атома Кальцію найбільш вигідним є 4s-стан:
19К 1s22s22p63s23p64s1 ;
20Ca 1s22s22p63s23p64s2.
А у десяти елементів – від Скандію до Цинку відбувається заповнення 3d-підрівня.
Як показав аналіз, в атомах d-елементів спостерігається самочинне переміщення електронів з ns-підрівня на (n-1)d-підрівень. Таке явище називається проскоком електронів, або їх промотуванням. Воно пов’язане з прагненням атома мати енергетично стійку конфігурацію, якій відповідають повністю або наполовину забудовані електронами енергетичні підрівні. Так, для атома Хрому спостерігається процес, коли електрон з 4s-підрівня переходить на 3d. Це призводить до енергетичної стабілізації Хрому:
24Cr [Ar] 4s13d5
У атома Купруму теж відбувається такий самий проскок електрона, тому на зовнішньому енергетичному рівні залишається тільки один електрон, що зумовлює розміщення Купруму в першій групі періодичної системи:
29Сu [Ar] 4s13d10
30Zn [Ar] 4s23d10.
Отже, четвертий період починається s-елементами (два) і закінчується р-елементами (шість), а між ними розміщуються десять d-елементів, у яких заповнюється другий іззовні d-підрівень.
У п’ятому періоді заповнення енергетичних рівнів і підрівнів відбувається аналогічно четвертому періоду, а саме: в атомів двох перших елементів (37Rb i 38Sr) забудовуються 5s-орбіталі, у атомів наступних десяти (39Y- 48Cd) – 4d-орбіталі, а у шести (49In – 54Xe) – 5p-орбіталі. Треба відзначити, що у п’яти d-елементів п’ятого періоду (41Nb, 42Mo, 44Ru, 45Rh, 47Ag) теж, як і у атома Хрому в четвертому періоді, спостерігається проскок одного, а у 46Pd – двох електронів із зовнішнього 5s-підрівня на попередній 4d-підрівень. Приклади електронних формул елементів п’ятого періоду:
37Rb [Kr] 5s1, 45Rh [Kr] 5s14d8,
39Y [Kr] 5s24d1, 46Pd [Kr] 5s04d10,
42Mo [Kr] 5s14d5, 48Cd [Kr] 5s24d10,
43Tc [Kr] 5s24d5, 54Xe [Kr] 5s24d105p6.
Шостий період, що містить 32 елементи, починається двома s-елементами (55Cs, 56Ba), в атомах яких заповнюється 6s-орбіталь. У наступного елемента, Лантану, останній, п’ятдесят сьомий, електрон надходить на 5d-орбіталь, замість того, щоб згідно з енергетичною шкалою заповнювати 4f-підрівень. Це явище зумовлене більш різким зменшенням енергії 4f-електронів із зростанням заряду ядра порівняно з енергією 5d-елекронів. Тому в 57La енергія 5d-електронів нижча, а у 58Се вища, ніж енергія 4f-електронів. Але у наступних чотирнадцяти елементів від 58Се до 71Lu стан 4f енергетично більш вигідний, ніж стан 5d, тому в них відбувається забудова 4f-орбіталей.
Далі, починаючи з 72Hf, продовжується заповнення 5d-орбіталей у десяти елементів до 80Hg. Період закінчується р-елементами (81Tl – 86Rn), в атомах яких забудовується 6р-підрівень. Проскоки електронів із зовнішнього 6s-підрівня на попередній 5d-підрівень спостерігаються у двох елементів: 78Pt i 79Au. Приклади електронних структур елементів шостого періоду:
55Cs [Xe] 6s1, 75Re [Xe] 6s24f145d5,
57La [Xe] 6s25d1, 78Pt [Xe] 6s14f145d9,
58Ce [Xe] 6s24f2, 80Hg [Xe] 6s24f145d10,
71Lu [Xe] 6s24f145d1, 86Rn [Xe] 6s26p6.
Таким чином, шостий період складається з двох s-елементів, шести р-, десяти d- і чотирнадцяти f-елементів.
Сьомий період ще не завершений. Заповнення енергетичних рівнів і підрівнів відбувається в ньому аналогічно, як і у атомів елементів шостого періоду. Період починається двома s-елементами (87Fr, 88Ra). За ними йдуть d-елементи (89Ас, 90Th), а потім – f-елементи (91Ра – 103Lr). Завершують періодичну систему d-елементи. Приклади електронних конфігурацій елементів сьомого періоду:
87Fr [Rn] 7s1, 103Lr [Rn] 7s25f146d1,
89Ac [Rn] 7s26d1, 104Db [Rn] 7s25f146d2,
90Th [Rn] 7s26d2, 105Je [Rn] 7s25f146d3,
91Pa [Rn] 7s25f26d1, 109Mt [Rn] 7s25f146d7.
У періодичній системі є вісім груп. Групи поділяють на головні та побічні підгрупи, які іноді позначаються літерами А і В відповідно. До складу однієї підгрупи входять елементи з аналогічними електронними структурами зовнішнього енергетичного рівня – так звані елементи-аналоги. Наприклад, елементи-аналоги S, Se, Te, Po мають однакову електронну конфігурацію зовнішнього енергетичного рівня (ns2np4), де n – головне квантове число, яке вказує одночасно і на номер зовнішнього рівня, і на номер періоду, в якому знаходиться даний елемент. IUPAC рекомендує вживати традиційні назви для елементів-аналогів деяких головних підгруп. Наприклад, елементи ІА-підгрупи (крім Гідрогену) називають лужними металами (ns1), елементи ІІА-підгрупи – лужноземельними метами (ns2), елементи ІІІА-підрупи – рідкоземельними металами (ns2np1), елементи VIA-підгрупи – халькогенами (ns2np4), елементи VIIA-підгрупи – галогенами (ns2np5), елементи VIIIA-підгрупи – благородними, або інертними газами (ns2np6).
Головна підгрупа А – це сукупність елементів, що розміщується в періодичній таблиці вертикально і має однакову конфігурацію зовнішнього електронного шару.
Головні підгрупи складаються із s- і p-елементів. Положення елемента в головній підгрупі визначається загальною кількістю s- і р-електронів на зовнішньому енергетичному рівні, яка дорівнює номеру групи. Наприклад, елемент Оксиген (2s22p4), в атомах якого на зовнішньому рівні міститься шість електронів, належить до головної підгрупи шостої групи, Аргон (3s23p6) – до головної підгрупи восьмої групи, а Барій (6s2) – до ІІА-підгрупи.
Побічна підгрупа Б – це сукупність елементів, що розміщуються в періодичній таблиці вертикально і мають однакову кількість електронів на зовнішньому і другому іззовні енергетичних рівнях.
Усі елементи побічних підгруп належать до d- або f-родин. d-елементи іноді називають перехідними металами. Положення перших п’яти d-елементів кожного періоду, що розміщуюються у підгрупах ІІІБ-VІІБ, можна визначити за допомогою суми зовнішніх s-електронів і d-електронів другого іззовні рівня. Так, з електронної формули Скандію (4s23d1) видно, що він розміщується в побічній підгрупі (оскільки є d-елементом) третьої групи (оскільки сума валентних електронів дорівнює трьом); Манган (4s23d5) розміщується в побічній підгрупі сьомої групи.
Положення останніх двох d-елементів кожного великого періоду (у підгрупах ІБ і ІІБ) можна визначити за кількістю електронів на зовнішньому рівні (при повністю завершеному попередньому d-рівні). Так, Ag (5s15d10) розміщується в побічній підгрупі першої групи, Zn (4s23d10) – в побічній підгрупі другої групи.
Сукупності елементів Fe-Co-Ni, Ru-Rh-Pd і Os-Ir-Pt, розміщених у побічній підгрупі восьмої групи, називаються тріадами. Вони утворюють дві родини: перша – родину заліза, а дві останні – родину платиноїдів. Крім зазначених родин, окремо виділяють 4f-родину лантаноїдів (14 елементів від 58Ce до 71Lu) і 5f-родину актиноїдів (14 елементів від 90Th до 103Lr). Ці родини належать до побічної підгрупи третьої групи.
5.3 Періодичність змінювання властивостей хімічних елементів
У типових періодах (І і ІІ) зі збільшенням порядкового номера елемента спостерігається поступове зменшення металічних і зростання неметалічних властивостей, оскільки збільшується кількість валентних електронів на зовнішньому енергетичному рівні. Наприклад, атоми всіх елементів третього періоду мають по три електронних шари. Будова двох внутрішніх шарів однакова для всіх (1s22s22p6), а будова зовнішнього, третього шару різна. При переході від кожного попереднього елемента до кожного наступного заряд ядра атома зростає на одиницю і відповідно збільшується кількість зовнішніх електронів. Внаслідок цього їх притягання до ядра посилюється, а радіус атома зменшується, що й приводить до послаблення металічних властивостей і зростання неметалічних.
Третій період починається дуже активним металом Na (3s1), за яким йде дещо менш активний Mg (3s2). Обидва ці метали належать до 3s-родини. Перший р-елемент третього періоду – Al (3s23p1), металічна активність якого менша, ніж у Магнія, має амфотерні властивості, тобто в хімічних реакціях може поводити себе і як неметал. Далі розміщуються неметали Si (3s23p2), P (3s23p3), S (3s23p4), Cl (3s23p5). Їх неметалічні властивості посилюються від Силіцію до Хлору, який є активним неметалом. Період закінчується інертним елементом Аргоном Ar (3s23p6).
Тенденція зменшення атомного радіуса в періодах повторюється (у кожнім періоді), але на новому якісному рівні. У малих періодах, які складаються тільки з s- і p-елементів, зміна радіуса від елемента до елемента дуже значна, оскільки відбувається забудова електронами зовнішнього електронного шару. У перехідних d-елементів радіус змінюється більш повільно, оскільки електронна структура зовнішнього шару не змінюється, а внутрішні d-орбіталі екранують ядро і послабляють вплив зростаючого заряду на зовнішні електронні шари атомів. У f-елементів змінюється електронна структура ще більш глибоко розташованого шару, тому радіус змінюється ще менш помітно. Уповільнене зменшення розміру атома з ростом заряду ядра за рахунок дії d- і f-орбіталей, що екранують ядро, називається d- і f-стиском (або лантаноїдним стиском).
У межах одного періоду властивості елементів змінюються поступово, а при переході від попереднього періоду до наступного спостерігається різке змінювання властивостей, оскільки починається забудова нового енергетичного рівня. Причому, така закономірность у змінюванні властивостей характерна не лише для простих речовин, а й для складних сполук.
У великих періодах металічні властивості послаблюються більш повільно. Це пов’язано з тим, що починаючи з четвертого періоду, з’являються десять перехідних d-елементів, у яких забудовується електронами не зовнішній, а другий іззовні d-підрівень, а на зовнішньому шарі d-елементів перебувають один чи два s-електрони, які й визначають певною мірою властивості цих елементів. Таким чином, для d-елементів закономірність дещо ускладнюється. Наприклад, у п’ятому періоді металічні властивості поступово зменшуються від лужного Rb, досягають мінімальної сили у металів родини платини (Ru, Rh, Pd). Однак після неактивного срібла розміщується Cd, у якого спостерігається стрибкоподібне зростання металічних властивостей за рахунок повністю заповненного електронами передзовнішнього d-підрівня. Далі після Cd зі зростанням порядкового номера металічні властивості закономірно переходять у типові неметалічні у Йоду. Закінчується цей період, як і усі попередні, благородним газом. Періодична зміна властивостей елементів усередині великих періодів дає підставу розділити їх на два ряди, в яких друга частина великого періоду повторює першу. Отже:
із збільшенням заряду ядра атома в межах періоду
зменшується радіус атома і, як наслідок,
зростає притягання валентних електронів до ядра.
Це приводить до послаблення металічних властивостей і до збільшення неметалічних.
На основі розглянутих закономірностей періодичність змінювання деяких характеристик хімічних елементів можна спрощено представити за допомогою схеми:
У періоді із зростанням порядкового номера (заряду ядра)
-
зменшується атомний радіус;
-
зростає енергія йонізації;
-
зменшується спорідненість до електрона;
-
зростає електронегативність;
-
посилюються неметалічні властивості;
У межах підгруп періодичної системи теж спостерігається певна закономірність. Елементи однієї підгрупи характеризуються подібністю хімічних властивостей. Із зростанням заряду ядра збільшується кількість електронних шарів і радіус атома, але кількість електронів на зовнішньому енергетичному рівні залишається сталою, наприклад: для лужних металів (підгрупа ІА) – один, а для галогенів (підгрупа VІІА) – сім (табл.5.1). Оскільки ж саме зовнішні електрони найбільш суттєво впливають на хімічні властивості, то зрозуміло, що кожна із розглянутих груп елементів-аналогів має подібні властивості.
Таблиця 5.1 – Характеристики елементів-аналогів ІА- і VІІА-пігруп
|
|
Підгрупа IA | Підгруппа VIIА | |||||||
|
Період |
Символ елемента |
Заряд ядра |
Радіус атома, нм |
Зовнішня електронна конфігурація |
Символ елемента |
Заряд ядра |
Радіус атома, нм |
Зовнішня електронна конфігурація |
|
|
II III IV B VI VII |
Li Na K Rb Cs Fr |
+3 +11 +19 +37 +55 +87 |
0,155 0,189 0,236 0,248 0,268 0,280 |
2s1 3s1 4s1 5s1 6s1 7s1 |
F Cl Br I At - |
+9 +17 +35 +53 +85 - |
0,064 0,099 0,114 0,133 0,140 - |
2s22p5 3s23p5 4s24p5 5s25p5 6s26p5 - |
|
В побічних підгрупах властивості змінюються більш повільно, оскільки в атомах d-елементів електрони забудовують другий іззовні енергетичний рівень, а на зовнішньому рівні перебувають майже однакова кількість електронів – лише один або два.
Але у межах однієї підгрупи поряд із подібністю властивостей спостерігається їх деяке змінювання. Так, елементи підгрупи ІА усі, крім Гідрогену, – активні метали. Але із зростанням радіуса атома і кількості внутрішніх електронних шарів, що екранують вплив ядра на валентні електрони, металічні властивості посилюються. Тому Fr більш активний метал, нiж Сs, a Cs – більш активний, ніж Rв і т. д. А в підгрупі VІІІА з тієї ж причини послаблюються неметалічні властивості елементів при зростанні порядкового номера. Тому F – більш активний неметал порівняно із Cl, a Cl – більш активний неметал порівняно з Br.
Приклад 5.1. Порівняти електронні структури валентних електронів для елементів підгрупи VІІА з валентними електронами елемента Мангану. Чим пояснити, що типовий неметал Cl і типовий метал Mn, які не є елементами-аналогами, розміщуються в одній групі періодичної системи елементів? Яку вищу валентність можуть виявляти ці елементи, в яких сполуках?
Розв’язок. При хімічній взаємодії атомів будь-яких елементів найважливішу роль відіграють електрони зовнішніх шарів, найбільш віддалених від ядра і найменш зв'язаних з ним, тобто валентні електрони. В атомах s- і р-елементів валентними є s- і р-електрони тільки зовнішнього шару. У d-елементів валентними є у першу чергу s-електрони зовнішнього шару і d-електрони другого іззовні енергетичного рівня. Електронні формули валентних електронів для елементів VІІА- підгрупи (галогенів) є такими:
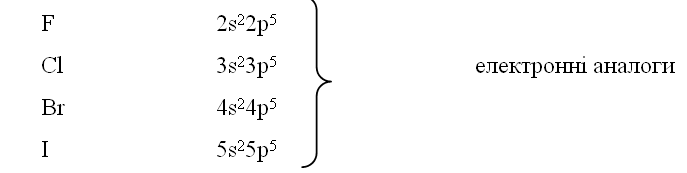
Електронна формула для валентних електронів елемента Мангану Mn: 4s23d5. Загальна електронна формула для елементів підгрупи VІІА має вигляд: ns2np5, а для Мангану – ns2(n-1)nd5,де n – номер періода, що вказує на номер зовнішнього енергетичного рівня. Однакова конфігурація зовнішнього енергетичного рівня у галогенів свідчить про те, що вони є елементами-аналогами. І напроти, відмінна електронна формула атома Мангану, незважаючи на однакову з галогенами кількість валентних електронів (п’ять), доводить, що Mn не є елементом-аналогом для F, Cl, Br і I.
Як випливає з електронних конфігурацій типового неметалу Cl і типового металу Mn, поданих в таблиці, в атомах Cl і Mn міститься однакова кількість валентних електронів, тому Cl і Mn знаходяться в одній групі періодичної системи.
|
Елемент |
Будова зовнішнього та предзовнішнього електронного шару |
Електронна будова йона в найвищому ступені окиснення |
Вищий оксид |
Кислота |
Сіль |
|
Cl |
2s22p63s23p5 |
Cl7+ 2s22p6 |
Cl2O7 |
HClО4 Хлорна |
КClO4 Калій перхлорат |
|
Mn |
3s23p64s23d5 |
Mn7+ 3s23p6 |
Mn2O7 |
HMnО4 Марганцева |
КMnO4 Калій перманганат |
Однак з урахуванням різної природи формуючого електрона в атомах Cl (р-електрон) і Mn (d-електрон), Хлор належить до р-родини і знаходиться в головній підгрупі, а Манган – до d-родини і перебуває в побічній підгрупі VII групи. Отже, обидва елементи виявляють максимальну валентність VII і тому утворюють вищі оксиди і гідроксиди (кислоти) з однаковими загальними формулами (відповідно Е2O7 і HЕО4) і подібними властивостями. Отже
у межах головних підгруп із збільшенням заряду ядра атома
збільшується радіус атома і, як наслідок,
зменшується притягання валентних електронів до ядра.
Це приводить до послаблення неметалічних і збільшення металічних властивостей.
|
У підгрупі із зростанням порядкового номера (заряду ядра) |
|
|
|
|
|
|
5.4 Характер змінювання властивостей оксидів і гідроксидів
Змінювання властивостей хімічних елементів у межах періода зі зростанням порядкового номера впливає і на закономірне змінювання властивостей сполук елементів – вищих оксидів і гідроксидів (у загальному випадку гідроксидами вважаються складні сполуки, утворені елементом з атомами Гідрогену і Оксигену одночасно, тобто основи і оксигенвмісні кислоти). Змінювання властивостей на прикладі оксидів і гідроксидів елементів ІІІ періоду подано в табл.5.1.
Таблиця 5.1 – Деякі властивості елементів ІІІ періоду та їх сполук
|
Електронна родина |
s-елементи |
р-елементи |
||||||||||
|
Символ елемента
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
||||
|
Заряд ядра атома
|
+11 |
+12 |
+13 |
+14 |
+15 |
+16 |
+17 |
+18 |
||||
|
Зовнішня електронна конфігурація |
3s1 |
3s2 |
3s23p1 |
3s23p2 |
3s23p3 |
3s23p4 |
3s23p5 |
3s23p6 |
||||
|
Атомний радіус, нм
|
0,189 |
0,160 |
0,143 |
0,118 |
0,110 |
0,102 |
0,099 |
0,054 |
||||
|
Максимальна валентність |
І
|
ІІ |
ІІІ |
IV |
V |
VI |
VI |
- |
||||
|
Вищі оксиди та їх властивості |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
- |
||||
|
Основні властивості |
Амфотерні власти- вості |
Кислотні властивості |
|
|||||||||
|
Гідрати оксидів (основи чи кислоти) |
NaOH Сильний луг |
Mg(OH)2 Слабка малорозчинна основа |
Al(OH)3 Амфотерна основа |
H2SiO3 Слабка нерозчинна кислота |
H3PO4 Кислота середньої сили |
H2SO4 Сильна кис-лота |
HСlO4 Дуже сильна кислота |
- |
||||
|
Сполуки з Гідрогеном |
NaH |
MgH2 |
AlH3 |
SiH4 |
PH3 |
H2S |
HCl |
- |
||||
|
Тверді солеподобні речовини |
Газуваті речовини |
|
||||||||||
Таким чином, у будь-якому періоді характер вищих оксидів і гідроксидів у міру зростання порядкового номера елемента міняється закономірно: від основного до кислотного через амфотерний.
Періодичність властивостей елементів
Хімічна природа елемента зумовлюється здатністю його атома віддавати або приєднувати електрони, що кількісно характеризується енергією йонізації, спорідненістю до електрона і електронегативністю та залежить від радіуса атома.
Атомні та іонні радіуси
Внаслідок хвильового характеру руху електрона атом не має чітко окреслених границь, тому виміряти абсолютне значення розміру атома неможливо. Останнім часом поширилося поняття про орбітальні радіуси. Орбітальний радіус – це відстань від ядра до найбільш віддаленого від нього максимуму розподілу електронної густини. Тому атом в основному стані може мати тільки один орбітальний радіус, а у збудженому – практично безліч значень rорб. Практично мають справу з радіусами атомів, які сполучені один із одним тим чи іншим типом хімічного зв’язку. Такий радіус розглядають як ефективний радіус атома, тобто такий, що виявляє себе у дії. Ефективні радіуси визначають при вивченні будови молекул і кристалів (рис.3.2).
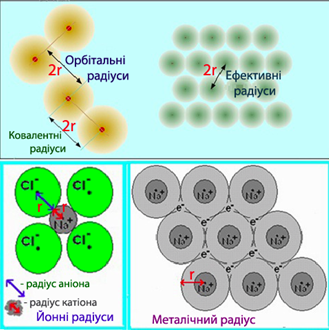
Рисунок 5.2 – Різновиди атомних радіусів
З цієї причини значення атомних радіусів, що наводяться в різних довідникових виданнях, інколи суттєво відрізняються. Однак незважаючи на розбіжності у величинах атомних радіусів для одного і того ж самого елемента, зберігається загальна закономірність, що відображає залежність атомних радіусів від заряду ядра атома Z і має періодичний характер
У межах одного періоду із підвищенням Z спостерігається тенденція до зменшення розмірів атомів. Це пояснюється зростаючим притяганням електронів зовнішнього шару до ядра в міру збільшення його заряду.
При переході від попереднього до наступного періоду атомні радіуси збільшуються, оскільки починається забудова нового енергетичного рівня, більш віддаленого від ядра. У результаті у межах головних підгруп розміри атомів збільшуються із зростанням зарядів ядер. У побічних підгрупах розміри атомів змінюються меншою мірою, особливо для перехідних d-металів п’ятого і шостого періодів, для яких радіуси атомів приблизно однакові. Це пояснюється тим, що збільшення радіусів за рахунок збільшення кількості квантових рівнів при переході від п’ятого до шостого періоду компенсується лантаноїдним стисненням (зменшенням атомних радіусів елементів від 57La до 71Lu ), яке викликане заповненням 4f-підрівня. Завдяки цьому d-елементи-аналоги п’ятого і шостого періодів мають особливо близькі властивості. Так, у IIIB-підгрупі (Ti-Zr-Hf) у останніх двох елементів радіуси однакові (0,145 нм), тому вони дуже подібні між собою за фізичними та хімічними властивостями і значно відрізняються від Титану, радіус якого дорівнює 0,132нм.
Втрата атомом електронів приводить до зменшення його ефективних розмірів, а приєднання надлишкових електронів – до збільшення . Тому радіус позитивно зарядженого йона (катіона) завжди менший, а радіус негативно зарядженого йона (аніона) завжди більший за радіус відповідного електронейтрального атома. Так, радіус атома Калію дорівнює 0,236нм, а радіус йона Калію К+ – 0,133нм, радіуси атома Хлору та йона Хлору Сl– відповідно дорівнюють 0,099 і 0,181нм.
При цьому радіус йона тим сильніше відрізняється від радіуса електронейтрального атома, чим більший заряд йона. Наприклад, радіуси атома хрому і йонів Cr2+ i Cr3+ дорівнюють відповідно 0,127, 0,083 і 0,064нм.
У межах однієї підгрупи радіуси йонів однакового заряду зростають із збільшенням заряду ядра. Така закономірність пояснюється збільшенням кількості електронних шарів і збільшенням віддалення зовнішніх електронів від ядра.
ЕнергІя ІонІзацІЇ
Видалення електрона із незбудженого атома при перетворенні його в позитивно заряджений йон – це процес завжди ендоенергетичний (тобто такий, що проходить при поглинанні енергії), тому для його здійснення необхідно докласти певну енергію.
Мінімальна енергія, що потрібна для відриву електрона від незбудженого атома, називається енергія іонізації І:
Ео + І → E+ + ē.
де символами Е і E+ позначені відповідно нейтральний атом і позитивно заряджений йон (катіон) деякого елемента, I – енергия іонізації, ē – електрон.
Енергія іонізації вимірюється у [кДж/моль] чи [еВ/атом]. 1 еВ (електрон-вольт) – це енергія, яку набуває електрон у прискорюючому електричному полі з різницею потенціалів 1В; (1еВ = 1,6·10–19Дж), у перерахунку на 1моль це відповідає енергії 96,5кДж/моль. Енергію іонізації можна визначити шляхом бомбардування атомів електронами, прискореними в електричному полі.
Від багатоелектронного атома можна відірвати один, два і більше електронів. Відриву кожного електрона відповідає певне значення енергії іонізації І1, І2, … , Іn, при цьому завжди І1 < I2 < … < In, оскільки збільшення кількості відірваних електронів сприяє зростанню позитивного заряду йона, що утворюється. Зовнішні електрони відриваються від атома досить легко, тому що мають більш високу енергію, ніж електрони попереднього рівня, і їхній відрив потребує порівняно незначних витрат енергії. Але при переході до внутрішнього електронного шару енергія іонізації різко зростає. Отже, повністю заповнені енергетичні рівні виявляють підвищену стійкість.
Енергія іонізації залежить від величини заряду ядра, відстані між ядром і зовнішнім електроном, екрануючим ефектом внутрішніх електронних шарів, електронної конфігурації атома. Взагалі можна сказати, що величина енергії іонізації залежить від положення елемента в періодичній системі і змінюється як у межах груп, так і в межах періодів. Енергія відриву першого електрона від атома залежно від порядкового номера елемента змінюється періодично .
У елементів одного й того самого періоду при переході від лужного металу до благородного газу заряд ядра зростає, а радіус атома зменшується. Тому енергія іонізації поступово збільшується, а металічні властивості послаблюються. Але загальна тенденція до зростання енергії іонізації у межах періоду в деяких випадках порушується. Так, енергії іонізації атомів Ве і N вище, ніж у В і О, що розміщені за ними; аналогічне явище спостерігається й у третьому періоді при переході від Мg до Al і від Р до S. При цьому підвищені значення спостерігаються або у атомів з повністю забудованим зовнішнім s-підрівнем (Ве, Мg), або у атомів з рівно наполовину забудованим р-підрівнем (N, P). Це один із доказів положення, згідно з яким підвищену енергетичну стійкість мають електронні конфігурації з повністю (s2, p6, d10) чи рівно наполовину (р3, d5) забудованими підрівнями.
Енергія іонізації в рядах d-елементів змінюється мало. Це пояснюється тим, що збільшення заряду ядра компенсується екранувальною дією електронів, розміщених на внутрішніх енергетичних рівнях.
У межах підгруп періодичної системи збільшення порядкового номера елемента супроводжується збільшенням розміру атома. Збільшення заряду ядра в підгрупах менше впливає на зв’язок зовнішнього електрона з ядром, ніж збільшення розміру атома і числа екранувальних електронів. Тому в межах підгруп s- і р-елементів зв’язок зовнішнього електрона з ядром зменшується, що приводить до зменшення енергії іонізації і посилення металічних властивостей. Виняток становлять підгрупи d-елементів, у межах яких при переході від 3d- до 5d-елементів енергія іонізації збільшується.
Величина енергії іонізації може характеризувати металічні властивості елемента: вони тим вищі, чим менше значення І.
Спорідненість до електрона
Спорідненість до електрона F – це енергетичний ефект процесу приєднання електрона до нейтрального атома з перетворенням його в негативно заряджений йон:
Е + ē → E– ± F.
де символами Е і E– позначені відповідно нейтральний атом і негативно заряджений йон (аніон) деякого елемента, F – спорідненість до електрона, ē – електрон. Вимірюється спорідненість до електрона у [кДж/моль] чи [еВ/атом].
Величина енергії спорідненості до електрона F для атомів елементів має періодичну залежність від заряду ядра атома
Спорідненість до електрона залежить від електронної конфігурації атома та його хімічних властивостей. Найбільшу спорідненість до електрона мають р-елементи сьомої групи (F, Cl, Br, I), а найменші і навіть від’ємні значення – атоми з конфігураціями s2 (Be, Mg), s2p6 (Ne, Ar) або p3 (N, P) .
Спорідненість до електрона атомів металів близька до нуля, тобто приєднання електронів до їх атомів енергетично невигідне. Спорідненість до електрона атомів неметалів має додатне значення, оскільки цей процес енергетично вигідний.
Приєднання одного електрона до атомів О, S, C та деяких інших супроводжується виділенням енергії. Таким чином, для цих елементів сили притягання до ядра додаткового електрона переважають над силами відштовхування між додатковим електроном і електронною оболонкою атома. Приєднання подальших електронів (двох, трьох і більше) до атома згідно з квантово-механічними розрахунками неможливо. Тому одноатомні багатозарядні аніони (О2–, S2–, N3–) у вільному стані існувати не можуть.
Електронегативність
Електронегативність (ЕН або c) – це узагальнена функція, що характеризує здатність атома даного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів тієї самої сполуки.
Термін «електронегативність» був введений американським хіміком Л.Полінгом, який склав першу шкалу електронегативностей (рис. 5.3).
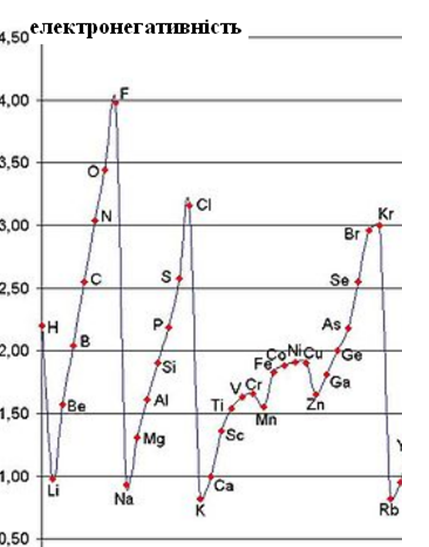
Рисунок 5.3 – Періодичність змінення електронегативності елементів (за шкалою Полінга)
Поняття електронегативності дозволяє оцінити відносну активність елемента і здатність його атомів набувати негативного заряду. Очевидно, ця здатність залежить від енергії іонізації та спорідненості до електрона. Існує декілька способів оцінного розрахунку електронегативності. Відповідно до одного з них електронегативність атома дорівнює напівсумі його першої енергії іонізації та спорідненості до електрона:
Е = ½ (I1 + F).
Слід зазначити, що електронегативність певного елемента не є постійною. На неї впливають різні фактори: валентний стан елемента, тип сполук, до вмісту якої він входить тощо. Але це поняття корисне для якісного пояснення властивостей елементів та їх сполук.
У межах одного періоду із зростанням порядкового номера елемента спостерігається тенденція підвищення електронегативності, а в підгрупах – її зниження. Найменшими значеннями електронегативності характеризуються s-елементи першої групи, а найбільшими – р-елементи сьомої групи.
5.5 Значення періодичного закону
Періодична система справила значний вплив на подальший розвиток хімії. Вона була першою природною класифікацією хімічних елементів, яка показала, що елементи перебувають у зв’язку з один з одним і утворюють єдину систему. Коли Д.І.Менделєєв склав систему елементів, багато елементів були не відомі. Він висловив припущення про існування в природі ще не відкритих елементів. У 1871 році Д.І.Менделєєв описав властивості трьох ще не відкритих елементів, які повинні були зайняти місця в системі: №21 – (Скандій), №31 – (Галій) №32 (Германій). Протягом наступних 1 років були відкриті ці елементи , а їхні властивості виявилися близькими до тих, щ прогнозував Д.І.Менделєєв. Періодичний закон не тільки пояснює властивості вже відомих елементів та їх сполук , а й прогнозує відкриття нових елементів.
Періодичний закон відкрив шлях до пізнання внутрішньої будови атома і його ядра, допомагає відкривати нові елементи, керувати атомною енергією. Періодичний закон є одним із найфундамен-тальніших законів природи. Його вплив на розвиток наукового світогляду можна порівняти лише із законом збереження маси і енергії або квантової теорії.
Слова Менделєєва : «Періодичний закон чекає нових додатків і розвитку» не втрачає своєї актуальності і сьогодні.



