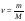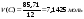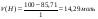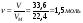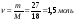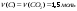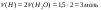- 15.1 Рішення задач на основні закони хімії
- 15.2 Задачі, що пов’язані із розрахунками за рівнянням реакцій.
- 15.3 Рішення задач на тему Розчини
- 15.4 Задачі – обчислення маси продукту реакції за відомою масою вихідної сполуки, що містить певну масову частку домішок
- 15.5 Рішення задач на введення молекулярної формули
15.1 Рішення задач на основні закони хімії
15.1.1 Задачі на визначення характеристик газоподібних речовин: маси, об’єму, кількості речовини, числа молекул, густини та відносної густини газів
Приклад 1.1 Дано: газ SO2, об’ємом 560 мл (н.у.). Розрахувати: а) кількість речовини. б) масу газу в) число молекул; г) відносну густину газу за воднем і за повітрям; д) густину газу за нормальних умов .
|
Дано: |
Розв’язок: |
|
V = 560 мл = 0,56 л; SO2, М (SO2)= 64 г/моль Знайти: -? m-? N-? ρ-? Dпов-? DН2-?ρ-? |
1. Визначимо кількість речовини газу за формулою:
2. Визначимо масу, і число молекул газу за відомою кількістю:
N = ν ⋅ NА = 0,025моль ⋅ 6,02 ⋅ 1023 = 0,15⋅ 1023 молекул. 3. Визначимо відносну густину газу за воднем і за повітрям та густину газу за н.у. DН2(газу)= М газу : М(Н2) = 64г/моль: 2 г/моль= 32 Dповітр.(газу)= М газу : М(повітря) = 64г/моль: 29г/моль= 2,2 (н.у.) = M / VM = 64 г/моль : 22,4 /моль= 2,86 г/л; |
Приклад 1.2 Газ масою 7 г має відносну густину за гелієм DНе = 7. Визначить об’єм (н.у.), кількість речовини, число молекул, густину за н.у., відносну густину цього газу за газом воднем.
|
Дано: |
Розв’язок: |
|
|
DНе = 7; m(газу)= 7 г |
|
|
|
Знайти: -? V-? N-? -? DН2-? |
Кількість речовини:
|
|
|
Об’єм газу: V = ν ⋅ VM , де VM =22,4 л/моль; |
V = 0,25 моль ⋅ 22,4л/моль=5,6 л |
|
|
Число молекул газу N = ν ⋅ NA , де NA = 6,02 ⋅ 1023 |
N = 0,25 ⋅ 6,02 ⋅ 1023 =1,505 ⋅ 1023молекул |
|
|
Густина газу при н.у. = M : VM |
= 28 г/моль : 22,4л/моль = 1,25 г/л |
|
|
DН2(газу)= Мгазу : М(Н2) |
DН2(газу)= 28г/моль : 2 г/моль = 14 |
|
Приклад 1.3 . Дано: газ SO2, об’ємом 112 мл знаходиться при температурі 250С під тиском 740 мм рт.ст. Розрахувати: а) об’єм газу при н.у. б) масу газу; в) кількість речовини.
|
Дано: |
Розв’язок: |
|
|
V = 112 мл Т= 250С; Р= 740 мм рт.ст; SO2, М (SO2)= 64 г/моль |
1. Переведемо об’єм газу, тиск і температуру в міжнародну систему одиниць СІ: V = 112 мл =0,112⋅10-3 м3;
R – універсальна газова стала = 8,31 Дж/мольК; P ,V,T – тиск, об’єм газу, температура, що задані в умові задачі. 3. Визначимо кількість моль газу виходячи з рівняння Менделєєва –Клапйрона:
4. Об’єм (н.у.), і масу газу, визначимо за відповідними формулами: |
|
|
Об’єм газу: V = ν ⋅ VM , де VM =22,4 л/моль; |
V = 0,0045 моль ⋅ 22,4л/моль=0,1 л |
|
|
Масу газу:
|
|
|
15.1.2 Задачі на визначення числа молекул, атомів, кількості речовини по співвідношенню між масами чи об’ємами речовин
Приклад 1.4. В якій масі NH3 міститься стільки молекул, скільки їх в 10 г СаСО3.
|
Дано: |
Розв’язок: |
|
СаСО3, m = 10 г; (СаСО3)=ν(NH3), Знайти: m-NН3-? |
|
15.2 Задачі, що пов’язані із розрахунками за рівнянням реакцій.
Приклад 1.5. Яка маса гідроксиду натрію необхідна для повної нейтралізації 39,2 г сульфатної кислоти?
|
Дано: |
Розв’язок: |
|
H2SO4 m = 39,2 г; Знайти: m-NаОН-? |
х г 39,2 г
Пропорція: 80 г NaOH реагують з 98 г H2SO4 х г NaOH реагують з 39,2 г H2SO4 х = (80 · 39,2) / 98 = 32 г NaOH. Відповідь: 32 г гідроксиду натрію |
2. Обчислення за хімічним рівнянням маси одного з продуктів, якщо одна з вихідних речовин взята в надлишку.
Приклад 1.6. Який об’єм оксиду карбону (І\/) можна одержати, спаливши 12 л оксиду карбону (ІІ) у 9л кисню? Умови нормальні.
|
Дано: |
Розв’язок: |
|
V(O2) = 9 л; V(CO) = 12 л Знайти: V(CO2) -? |
V(СО2) = ν · VМ = 0,54 моль · 22,4 л/моль = 12 л. Відповідь: 12 л оксиду карбону (І\/). |
15.3 Рішення задач на тему Розчини
15.3.1 Задачі на визначення маси розчиненої речовини, маси розчину та масової частки розчиненої речовин
Основні формули для розрахунків:
|
Масова частка розчиненої речовини в розчині (%) |
Маса розчину |
Маса розчиненої речовини |
Маса розчинника |
Об’єм розчину |
|
|
|
|
|
|
Приклад 2.1. Скільки грамів хлориду натрію буде потрібно для приготування 1 л 10%-ного розчину, густина якого дорівнює 1,071(г/мл)? Як практично приготувати такий розчин?
|
Дано: |
Розв’язок: |
|
V = 1 л= 1000 мл; W= 10% = 1,071 г/мл Знайти: mреч (NaCl)- ? |
1. Визначимо масу розчину хлориду натрію, знаючи об’єм V дорівнює 1л, або 1000 мл, а густина ρ =1,071 г/мл:
2. Обчислимо масу речовини - хлориду натрію в розчині, знаючи що масова частка солі ω становить 10%:
Відповідь: для приготування розчину з масовою часткою 10% і об’ємом 1 л необхідно взяти 107,1 г натрій хлориду. 3. Для приготування 1 л 10% розчину хлориду натрію слід розчинити наважку кристалічного NaCl масою 107, 1 г невеликою кількістю дистильованої води в мірній колбі об’ємом 1 л. Після повного розчинення солі об’єм розчину доводять дистильованою водою до мітки на мірній колбі |
Приклад 2.2. До 300 мл розчину NaOH з густиною 1,22 г/мл та масовою часткою 20%, додали 60 г сухого NaOH. Розрахуйте масову частку одержаного розчину.
|
Дано: |
Розв’язок: |
|
Дані про перший розчин: V1 = 300 мл; W1= 20% 1 = 1,22 г/мл Додали: mреч (NaОН)=60 г Знайти: W2 - ? |
1. Визначимо масу першого розчину натрій гідроксиду, знаючи об’єм V дорівнює 300 мл, та густину ρ =1,22 г/мл:
mр-ну 1 = 300мл ⋅ 1,22 г/мл = 366г 2. Обчислимо масу речовини – натрій гідроксиду в першому розчині, за відомою масовою часткою ω, що становить 20%:
mр-ну = 366г + 60 г = 426г 5. Знайдемо остаточну масову частку натрій гідроксиду в розчині:
Відповідь: одержаний розчин буде мати масову частку 26,5 % |
Приклад 2.3.Скільки грамів кристалогідрату мідного купоросу CuSO4· 5Н2О потрібно взяти для приготування 500 г розчину купрум(ІІ) сульфату з масовою часткою 5% ?
|
Дано: |
Розв’язок: |
|
Дані про перший розчин: mрозчину = 500 г; W= 5% Знайти: mкристалогідрату (CuSO4· 5Н2О) - ? |
1. Обчислимо масу речовини – купрум(ІІ) сульфату що має бути в приготовленому розчині, за відомою масовою часткою ω, що становить 5% і масою розчину 500г:
mp.р(CuSO4) = mр-ну · W :100% = 500 г · 5% : 100 г =25г 2. Розрахуємо молярну масу кристалогідрату, звернув увагу на те, яка маса в кристалогідраті припадає на CuSO4· М(CuSO4·5Н2О) = 160 + (18⋅5) = 160 + 90=250 г/моль;
Відповідь: для приготування 5% розчину купрум (ІІ) сульфату масою 500 г необхідно взяти 39 г кристалогідрату – мідного купоросу CuSO4·5Н2О |
15.3.2 Задачі пов’язані із проходженням реакції в розчинах.
Приклад 2.4.Який осад та яка його маса утвориться при змішуванні 100мл 30% розчину натрій гідроксиду (ρ1 = 1,33 г/мл) з 100 г 5% розчину CuSO4·?
|
Дано: |
Розв’язок: |
|
Дані про розчин натрій гідроксиду: Vрозчину = 100 мл; W= 30% = 1,33 г/мл Дані про розчин CuSO4· mрозчину = 500 г; W= 5% Знайти: mосаду - ? |
1. Складемо рівняння реакції: CuSO4 +2NaOHCu(OH)2 + Na2SO4. Отже осад - Cu(OH)2 Для визначення його маси необхідно знайти маси реагуючих речовин: CuSO4 і NaOH.
(Cu(OH)2)=ν(CuSO4)=0,156моль; масу осаду визначимо по формулі: Відповідь: маса осаду Cu(OH)2 15,288г. |
3. Рішення задач пов’язаних із виходом продукту реакції, та речовиною, що містить домішки
Практично при проведенні будь-якого процесу відбувається втрата деякої кількості реагуючих речовин, можливі втрати одержуваних речовин через недоліки апаратури. Ще більші втрати можливі на виробництві. Тому для одержання бажаної маси (чи об’єму) продукту реакції необхідно враховувати виробничих втрати , тобто розраховувати практичний вихід продукту реакції, і навпаки за практичним виходом розраховувати маси (об’єми) реагентів.
Маси (об’єми) продуктів реакції, розраховані за рівнянням реакції називають теоретичним виходом. Теоретичний вихід приймають за 100%, тому що одержати продуктів більше , ніж по рівнянню реакції неможливо.
Маси (об’єми) продуктів реакції, обчислені із урахуванням втрат називають практичним виходом. Практичний вихід завжди менший ніж теоретичний. Формула за якою розраховується вихід продукту реакції :
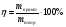
Приклад 3.1. Яку масу сульфатної кислоти можна одержати з 40 г сульфур (VI) оксиду, якщо вихід реакції = 80 %?
|
Дано: |
Розв’язок: |
|
m(SO3) = 40г; = 80% Знайти: m (H2SO4)- ? |
1. Складемо рівняння реакції: SO3 +Н2О H2SO4.
Відповідь: маса сульфатної кислоти =39,2г. |
Другий тип задач, пов'язаний із поняттям «практичний вихід», полягає у знаходженні мас реагентів, необхідних для одержання визначеної маси чи об’єму продукту реакції
Приклад 3.2. Розрахуйте масу цинку, необхідного для одержання 10л водню (н.у.) при реакції із сульфатною кислотою, якщо вихід складає 78%.
|
Дано: |
Розв’язок: |
|
V(H2)практ = 1 л; = 78 % Знайти: m (Zn) - ? |
1. Складемо рівняння реакції: Zn +H2SO4 ZnSO4 + H2.
4. За рівнянням реакції кількість цинку відповідає кількості газу водню, отже кількість цинку = 0,57 моль. 5. Знаходимо масу цинку за формулою
Відповідь: маса цинку =37,05г. |
Ще один варіант задач – обчислення виходу реакції, якщо відома практична маса продукту реакції.
Приклад 3.3. 90 г натрій карбонату повністю розчинилося в сульфатній кислоті, при цьому утворилося 15,2 л газу (н.у.). Визначте вихід продукту реакції?
|
Дано: |
Розв’язок: |
|
m (Na2CO3)= 90 г; V(CO2)практ = 15,2 л; Знайти: - ? |
1. Складемо рівняння реакції: Na2CO3 +H2SO4 Na2SO4 + CO2 +H2O. 2. Визначимо кількість речовини Na2CO3:
5. За практичним об’ємом CO2, та теоретичним його об’ємом визначаємо вихід продукту реакції
Відповідь: η= 79,8% |
15.4 Задачі – обчислення маси продукту реакції за відомою масою вихідної сполуки, що містить певну масову частку домішок
Для розуміння технологічних процесів, що відбуваються реально слід пам’ятати, що вихідні речовини майже завжди містять різні домішки. Домішки як правило не беруть участі в процесі, який розглядають. Тому їх масу слід обов’язково відокремити від загальної маси речовини, що вступає в хімічну реакцію. Масова частка домішок у вихідній сполуці визначається по формулі:
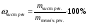
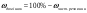
Приклад 3.4. Обчисліть масу негашеного вапна, яке можна добути випалюванням вапняку масою 375 кг, якщо масова частка домішок у ньому становить 20%?
|
Дано: |
Розв’язок: |
|
m (СaCO3)= 375 кг; (домішки)=20% Знайти: m(СаО) - ? |
2. Визначимо кількість речовини СaCO3:
Відповідь: m(CаО) =168 кг |
15.5 Рішення задач на введення молекулярної формули
Виведення молекулярної формули залежно від даних умови задачі може відбуватися різними шляхами. Розглянемо три різні способи розв’язання вказаного типу задач.
4.1. Знаходження молекулярної формули сполуки відомого класу органічних речовин, що має загальну формулу для даного класу органічних сполук.
При розрахунках даного типу задач слід пригадати способи знаходження молярних мас: за відносною густиною газів, за густиною газів при нормальних умовах, за масою речовини і відповідній їй кількості в моль. Крім того необхідно знати загальні формули всіх класів органічних речовин.
Формули необхідні для розрахунків:
|
Визначення молярної маси за відносною густиною за іншим газом |
Визначення молярної маси за відомою масою і кількістю |
Визначення кількості за відомим об’ємом |
Загальні формули вуглеводнів |
Загальні формули інших класів органічних сполук |
|
|
|
|
СnH2n+2 - алкани СnH2n- алкени СnH2n-2- алкіни |
CnH2n +1OH спирти СnH2n+1–CHО альдегіди СnH2n+1–CООH кислоти |
Приклад 4.1. Установіть формулу насиченого вуглеводню, якщо відносна густина (D) його парів за воднем = 22
|
Дано: |
Розв’язок: |
|
DН2(СnH2n+2)=22 Знайти: СnH2n+2 ? |
1. Визначаємо молярну масу вуглеводню по формулі 2. Пригадаємо відносні атомні маси Карбону та Гідрогену: Ar(C)=12, Ar(H)= 1; 3. Підставимо значення відносних атомних мас в загальну формулу насичених вуглеводнів – алканів: СnH2n+2, і складемо рівняння: 12n + 2n+2 = 44, звідси n= 3. Таким чином формула вуглеводню буде: C3H8. Відповідь: молекулярна формула C3H8. |
15.5.1 Знаходження молекулярної формули сполуки невідомого класу органічних речовин, що має масові частки елементів в сполуці.
Для розуміння ходу розв’язання задачі за масовими частками елементів в речовині, слід допустити, що відсоткові співвідношення елементів можна прийняти за їх масові співвідношення , прийнявши масу всієї сполуки за 100г. В такому випадку логічним є знаходження кількостей елементів в формулі як результат відношення маси елемента на його молярну масу
Приклад 4.2. Знайдіть формулу вуглеводню, що має густину 2,5 г/л при н.у., а масова частка елемента С становить 85,71%.
|
Дано: |
Розв’язок: |
|
(С) = 85,71%; = 2,5 г/л Знайти: СxНy - ? |
1. Визначаємо молярну масу вуглеводню: М(СxНy)=2,5 г/л ⋅22,4л/моль= 56 г/моль 2. В умові задачі не вказано, що вуглеводень – алкан, тому ми не маємо можливості розв’язати задачу попереднім способом. Тому спочатку визначаємо кількості елементів С і Н, що складають вуглеводень. Для цього приймаємо відсотки цих елементів в молекулі за їх маси, а далі по формулі
3. Знайдемо співвідношення між кількостями елементів в сполуці: ν(С) : ν(Н)= 7,145: 14,29= 1:2. Таким чином кількості атомів Карбону так відносяться до кількості атомів Гідрогену, як 1:2 отже найпростіша формула буде мати вигляд: СН2 4. Визначимо справжню формулу вуглеводню. Для цього порівняємо молярні маси найпростішої формули з молярною масою, що визначили (56 г/моль). М(СН2)= 12+2 = 14 г/моль. Найпростіша формула має в 4 рази меншу молярну масу ніж справжня, таким чином справжня формула вуглеводню буде мати в 4 рази більшу кількість атомів С і Н, тобто С4Н8. Відповідь: молекулярна формула C4H8 |
15.5.2 Задачи на визначення формули вуглеводню по відомим масам чи об’ємам продуктів його спалювання.
Даний тип задач вимагає знання таких понять як кількість речовини, молярна маса, молярний об’єм. При знаходженні формули спочатку необхідно визначити кількості елементів в продуктах спалювання, проаналізувати їх і зробити висновки про кількості елементів в початковій молекулі. Необхідно знайти найпростішу формулу і порівняти її молярну масу з розрахованою за додатковими даними молярною масою справжньої формули. Знайти в скільки разів ці маси відрізняються і збільшити у відповідну кількість разів найпростішу формулу.
Приклад 4.3. При спалюванні 11,2 л газоподібного вуглеводню утворилось 33,6 л СО2 та 27 г води. 1 л вуглеводню має масу 1,875 г (н.у.). Знайдіть молекулярну формулу вуглеводню.
|
Дано: |
Розв’язок: |
|
V(CхНу) = 11,2 л; V(CО2) = 33,6 л; m (Н2O)= 27 г = 1,875 г/л Знайти: СxНy ? |
1. Визначимо молярну масу вуглеводню: М(СxНy)=1,875 г/л ⋅22,4л/моль= 42 г/моль. 2. Визначаємо кількості елементів С і Н, що складають вуглеводень. Для цього знайдемо кількості моль СО2 : знайдемо кількості моль Н2О :
Співвідношення атомів С і Н в молекулі буде таким: ν(С) : ν(Н)= 1,5: 3= 1:2. Отже найпростіша формула буде мати вигляд: СН2. 3. Визначимо справжню формулу вуглеводню. Для цього порівняємо молярні маси найпростішої формули з молярною масою, що визначили (42 г/моль). М(СН2)= 12+2 = 14 г/моль. Найпростіша формула має в 3 рази меншу молярну масу ніж справжня, таким чином справжня формула вуглеводню буде мати в 3 рази більшу кількість атомів С і Н, тобто С3Н6. Відповідь: С3Н6. |


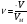 =
=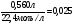 моль
моль ;
;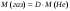 = 7 ⋅ 4 = 28 г/моль.
= 7 ⋅ 4 = 28 г/моль.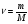
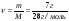 = 0,25 моль
= 0,25 моль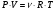 , де
, де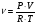 =
=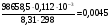 моль,
моль,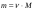 ;
;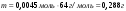 ;
;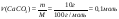
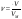 :
: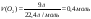
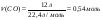
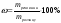
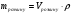
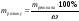
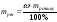
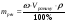
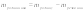
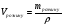
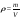 , звідки
, звідки 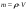 ,
, 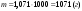
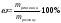 , звідки
, звідки 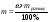
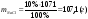
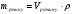 , звідки
, звідки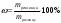 , звідки
, звідки 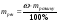
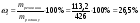
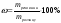 , звідки
, звідки 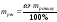
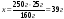
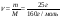 = 0,156моль)
= 0,156моль)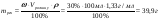 ,
,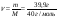 = 1моль)
= 1моль)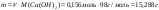
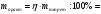 80 ⋅49:100=39,2 г
80 ⋅49:100=39,2 г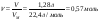

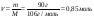
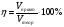 = 15,2л :19,04л ⋅100% =79,8%
= 15,2л :19,04л ⋅100% =79,8%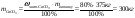
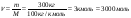
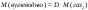
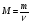
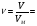
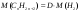 = 22⋅2=44 г/моль.
= 22⋅2=44 г/моль.