- Вуглеводні. Алкани.
- Способи одержання
- Хімічні властивості
- Застосування алканів
- Природні джерела вуглеводнів.
- Ненасичені вуглеводні. Алкени та алкіни
- Етиленові вуглеводні – Алкени
- Способи одержання
- Хімічні властивості
- Застосування.
- Ацетиленові вуглеводні - алкіни
- Способи одержання
- Хімічні властивості
- Застосування.
- Ароматичні вуглеводні. Арени
- Способи одержання
- Хімічні властивості
Вуглеводні. Алкани.
Вуглеводні - це найпростіші за якісним та кількісним складом органічні сполуки, молекули яких складаються з атомів Карбону та Гідрогену. Залежно від природи зв’язків і співвідношення між кількістю атомів Карбону та Гідрогену розрізняють насичені та ненасичені вуглеводні.
Алкани - насичені вуглеводні з незамкнутим ланцюгом, склад яких виражається загальною формулою СnH2n+2
В алканах зв’язки С−С і С−Н одинарні, міцні σ - зв’язки. Атом Карбону в алканах знаходиться в збудженому стані при якому один s–електрон переходить на вільну р - орбіталь. При цьому всі чотири валентні електрони атому Карбону стають непарними і можуть приймати участь в утворенні хімічного зв'язку. Будову електронної оболонки атому Карбону в нормальному і збудженому стані можна зобразити схемою:

Одночасно відбувається зміна форми орбіталей: одна сферична – s і три гантелеподібні – р змінюються і набувають форми неправильних вісімок, що розташовуються в просторі під кутом 109?28′як показано на малюнку:
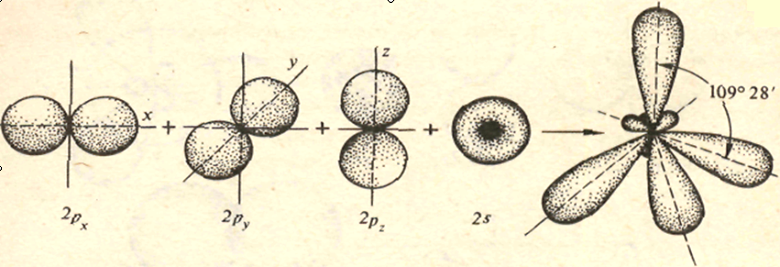
Процес зміни форми електронних хмарин називають гібридизацією. У зв’язку з тим, що в алканах в атомі Карбону форму змінюють одна s і три р – орбіталі, тому такий тип гібридизації називають sp3 – гібридизація. У результаті перекривання чотирьох гібридних орбіталей атома Карбону з s – орбіталями атомів Гідрогену утворюється міцна молекула метану у вигляді тетраедра.
Загальна характеристика насичених вуглеводнів – алканів:
|
Тип гібридизації |
Типи зв’язків |
Загальна формула |
Кут між атомами Карбону |
Довжина зв’язку С – С |
|
sp3 |
π-зв’язок |
СnH2n+2 |
[TEX]\angle [/TEX]109028 |
0,154нм |
Окремі представники гомологічного ряду насичених вуглеводнів (Алканів)
|
Формула алкану |
Назва алкану |
Формула алкану |
Назва алкану |
Радикал |
Назва радикалу |
|
СН4 |
Метан |
С6Н14 |
Гексан |
СН3 – |
Метил |
|
С2Н6 |
Етан |
С7Н16 |
гептан |
С2Н5 – |
Етил |
|
С3Н8 |
Пропан |
С8Н18 |
Октан |
С3Н7 – |
Пропіл |
|
С4Н10 |
Бутан |
С9Н20 |
Нонна |
С4Н9 – |
Бутил |
|
С5Н12 |
Пентан |
С10Н22 |
декан |
Якщо від молекули вуглеводню відщепити атом Гідрогену, то отримають одновалентний радикал – реально існуюча дуже нестабільна частинка. Назви радикалів будуються від назви відповідного вуглеводню шляхом заміни закінчення –ан на закінчення –ил. Наприклад:
СН4 – метан; СН3⋅ - метил;
С2Н6 – етан; С2Н5⋅ - етил
Основи номенклатури ІЮПАК:
- 1. Назви всіх алканів закінчуються суфіксом – ан;
- 2. В основу назви покладено найменування вуглеводню з самим довгим вуглецевим ланцюгом;
- 3. Розміщення бокових відгалужень у вигляді радикалів визначається порядковим номером атомів Карбону вуглецевого ланцюга;
- 4. Нумерацію атомів вуглецю починають з ближнього кінця, де розміщується замісник – радикал.
- 5. Якщо в молекулі вуглеводню є два, три, і більше замісників у вигляді радикалів, то положення кожного з них позначається арабськими цифрами, а кількість однакових замісників – префіксами (два-ди, три- три, чотири- тетра- та ін. );
- 6. При наявності в молекулі алкану декількох радикалів в назві додержуються правила : спочатку найбільш прості, потім складні.
- 7. Цифри, які показують положення радикалів у найбільш довгому ланцюзі, відділяють одну від одної комами, а від назви радикала – дефісами. Наприклад: 2,2-диметил,3-етилпентан.
C2H5 CH3
5 4 3| 2 | 1
CH3 – CH2 – CH – C – CH3
|
CH3
Фізичні властивості насичених вуглеводнів – алканів.
Перші чотири гомологи – гази (СН4 С2Н6 С3Н8 С4Н10), із С5Н12 по С15Н32 – рідини, а з С16Н34 – тверді сполуки. Всі алкани погано розчиняються у воді, газоподібні та тверді не мають запаху, а рідкі мають запах характерний для бензину та нафти. Вуглеводні з розгалуженим ланцюгом киплять при більш низький температурі, ніж з прямим ланцюгом при однаковій кількості атомів Карбону. Температури плавлення, навпаки, часто більш високі в ізомерів з розгалуженою будовою.
Способи одержання
|
1 |
Природні джерела (нафта, газ); |
|
|
2 |
Відновлення галогеноалканів, спиртів (kat Na, Zn) |
СН3-СН2-СН2Cl + H2→ СН3-СН2-СН3 +HCl СН3-СН2-СН2ОН + H2→ СН3-СН2-СН3 +H2О |
|
3 |
Відновлення ненасичених (kat Pt, Pd) |
СН3-СН=СН2 +H2→ СН3-СН2-СН3 |
|
4 |
Лужне сплавлення солей карбонових кислот: |
СН3СООNa + NaOH → CH4 + Na2CO3 |
|
5 |
Збільшення вуглецевого ланцюга (Синтез Вюрца) |
СН3Cl + 2Na + CH3Cl → CH3-CH3 + 2NaCl |
|
6 |
Взаємодія алюміній карбіду з водою |
Al4C3 + H2O → 4Al(OH)3 + 3CH4 |
Хімічні властивості
Алкани при звичайних умовах хімічно інертні. Вони вступають в перетворення при наданні їм досить високої енергії за рахунок нагрівання і УФ- опромінювання. Для насичених вуглеводнів найбільш характерними є реакції заміщення. Вони здатні також окислюватись, піддаватись крекінгу
Галогенування (в присутності світла, температури). Реакція відбувається за радикальним механізмом. Спочатку під впливом світла чи температури утворюються активні радикали СІ •, які далі ініціюють утворення нових радикалів, і реакція відбувається поки не обривається ланцюг внаслідок одержання молекул.
В загальному вигляді на першому етапі можливо утворення таких продуктів:
СІ • • СІ → 2 СІ• - ініціювання ланцюга (в присутності світла)
СН4 + СІ • → СН3 • + НСІ
СН3 • + СІ2→ СН3СІ + СІ•…
CH4 + Cl2→ CH3Cl + HCl
Нітрування (реакція Коновалова):
C2H6 + HO-NO2 (p) → CH3-CH2-NO2 + H2O
Дегідрування (kat Ni):
СН3-СН2-СН3→ CH2=CH-CH3 + H2
Розкладання: без доступу повітря:
(t=2000° C): CH4 → C + 2H2;
(t= 1500°C): 2СН4 → C2H2 + 3H2
Розкладання при нагріванні, в присутності каталізатора (крекінг)
CH3-CH2- CH2-CH3 →C2H4 + C2H6(t)
Конверсія метану з водяною парою (при t)
CH4 + Н2О→ CО + 3H2
СН3 – СН2 – СН3 +O2→ Н – СООН +СН3 – СООН (в присутності МпО2 ; tº)
Застосування алканів
- Як пальне (газ, бензин, керосин);
- Одержання водню, ацетилену, спиртів;
- ССl4 – є добрим розчинником для органічних речовин;
- При окисненні алканів з кількістю атомів С від 20 до 25 одержують синтетичні карбонові кислоти для виробництва мила та миючих засобів.
Природні джерела вуглеводнів.
Природні газ, нафта і кам’яне вугілля – основні джерела вуглеводнів. Природний газ містить 80-90% метану, 2-3% його гомологів (етан, пропан, бутан). Нафта – масляниста темно-бура рідина з характерним запахом, у воді не розчиняється. Нафта – це складна суміш вуглеводнів різної молекулярної маси. Для одержання з нафти технічно цінних продуктів її піддають переробці.
При первинній переробці проводять перегонку внаслідок чого отримують бензин, лігроїн, гас, газойль і мазут (залишок). Мазут також переробляють при пониженому тиску і отримують мастила. Залишок – гудрон, використовують для виготовлення асфальту.
При вторинній переробці нафти відбуваються процеси при яких змінюється структура вуглеводнів. До таких процесів відноситься термічний та каталітичний крекінг. При термічному крекінгу (450-500?C) молекули вуглеводнів розщеплюються на молекули вуглеводнів з меншою кількістю атомів Карбону, як насичених так і ненасичених:
С6Н14 =C3H8 + C3H6
Каталітичний крекінг здійснюється в присутності каталізаторів (алюмосилікати) при температурі 450?C, при цьому відбувається не тільки розщеплення великих молекул, а йдуть процеси ізомеризації – утворюються насичені вуглеводні з розгалуженим ланцюгом, що покращує якість бензину.
Ненасичені вуглеводні. Алкени та алкіни
Ненасичені вуглеводні з незамкнутим ланцюгом – це вуглеводні, в молекулах яких є кратні зв’язки (подвійні чи потрійні), а склад виражається загальною формулою: для алкенів СnH2n, а для алкінів СnH2n-2
Етиленові вуглеводні – Алкени
Етиленові вуглеводні – алкени – сполуки з незамкнутим ланцюгом , що містять один подвійний зв’язок π а всі інші атоми C зв’язані σ- зв’язками , а атоми Карбону біля подвійного зв’язку знаходиться в стані sp2-гібридизації
|
Тип гібридизації |
Типи зв’язків |
Загальна формула |
Кут між вуглецевими атомами біля π- зв’язку |
Довжина зв’язку С=С |
|
sp2 |
π, σ-зв’язок |
СnH2n |
[TEX]\angle [/TEX]120 |
0,134нм |
Атоми Карбону біля подвійного зв’язку в етиленових вуглеводнях – алкенах знаходяться в стані sp2 – гібридизації. Для такого стану характерним є зміна форми електронних хмарин одної s, та двох – р – орбіталей. Утворюються три гібридні орбіталі з формою неправильних вісімок, розташованих в просторі під кутом 1200.
Не гібридизовані р – орбіталі кожного атома Карбону біля подвійного зв’язку, перекриваються в площині, яка перпендикулярна площині молекули, і утворюють π–зв’язок. π-зв’язок має дві області високої електронної густини – над і під площиною молекули, він є менш міцний, ніж σ–зв’язок.
Основи номенклатури алкенів базуються на розглянутій номенклатурі ІЮПАК, але назви всіх алкенів закінчуються суфіксом – ен, з позначенням місця де розташований подвійний зв’язок. Нумерація починається від того кінця, де ближче знаходиться подвійний зв’язок. Наприклад: 2-метилпентен-1
5 4 3 2 1
CH3 – CH2 – CH2 – C = CH2
|
CH3
Перший представник гомологічного ряду алкенів С2Н4 – етен, але частіше його називають тривіальною назвою – етилен. Тому представників алкенів часто називають – етиленові вуглеводні.
Ізомерія етиленових вуглеводнів – алкенів:
- структурна – розгалуження Карбонового ланцюга. Наприклад:
CH3 – CH2 – CН = CH2 – бутен – 1.
CH3 – C = CH2 – 2-метилпропен-1
|
CH3
- положення подвійного зв’язку. Наприклад:
CH3 – CH2 – CН = CH2 – бутен – 1
CH3 – CH = CН – CH3 – бутен – 2
- просторова (геометрична). Наприклад:
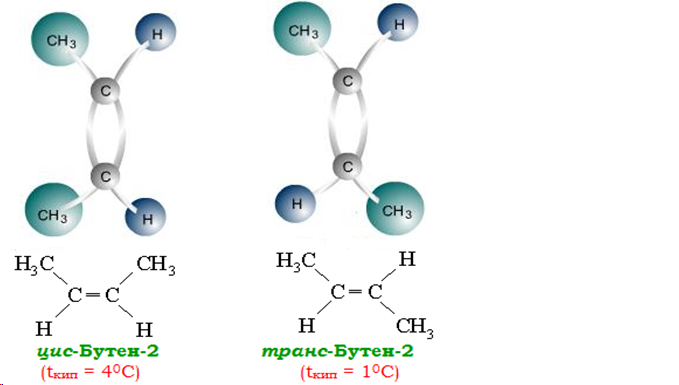
Способи одержання
|
Спосіб |
Приклади реакцій |
|
Промисловий (крекінг нафтопродуктів) |
С18Н38 → С9Н20 + С9Н18 |
|
Лабораторний: |
|
|
Дегідратація спиртів – ( в присутності сульфатної кислоти, при нагріванні) |
С2Н5ОН→ С2Н4 + Н2О |
|
Дегідрогалогенування – (в присутності спиртового розчину лугу NaOH, KOH) |
NaOH(спирт) СН3СН2Cl → C2H4 + HCl |
Правило Зайцева: При дегідрогалогенуванні галогеноалканів атом Гідрогену відщеплюється від атома Карбону, біля якого є менше атомів Гідрогену (менш гідрогенізований).
Хімічні властивості
За хімічними властивостями алкени відрізняються від алканів – насичених вуглеводнів. При хімічних реакціях подвійний зв'язок розривається і переходить в одинарний. По місцю розриву подвійного зв’язку відбуваються реакції приєднання різних молекул : водню, галогенів, галогеноводнів, води.
Правило Марковникова : при взаємодії галогеноводнів з несиметричними молекулами алкенів Гідроген приєднується за місцем подвійного зв’язку переважно до того атома Карбону, біля якого є більше атомів Гідрогену (більш гідрогенізований).
Приєднання водню (гідрування). Утворюються алкани
СН2=СН2 + Н2 à СН3-СН3
Приєднання галогенів – реакція галогенування. Утворюються дигалогенопохідні алканів
СН2=СН-СН3+Cl2àCH2 – CH – CH3
| |
Cl Cl
Приєднання галогеноводнів – гідрогалогенування. Утворюються галогенопохідні алканів
СН2=СН-СН3+HClàCH3-CHCl-CH3
Приєднання води – реакція гідратації (в присутності сульфатної кислоти). Утворюються спирти
СН2=СН-СН3+HОHàCH3-CH-CH3
|
OH
Полімеризація – утворюються полімери
n СН2=СН2 à[-CH2-CH2 -]n
Окиснення розчином KMnO4 (спостерігається знебарвлення розчину). Окисненню підлягають атоми Карбону, з’єднані подвійним зв’язком. Утворюються двохатомні спирт – гліколі.
Більш сильні окисники здатні розщеплювати алкени по місцю подвійного зв’язку з утворенням карбонових кислот, кетонів або СО2
СН2=СН2 +”O”+H2Oà CH2—CH2
| |
OH OH
Застосування.
Етилен застосовують для одержання етилового спирту, дихлоретану, хлористого етилу, поліетилену а інших важливих продуктів. Дихлоретан є розчинником багатьох органічних сполук, поліетилен має цінні властивості – хімічна стійкість, міцність, еластичність, легкість, є добрим електроізолятором, водо-, та газонепроникний матеріал.
Ацетиленові вуглеводні - алкіни
Ненасичені вуглеводні – алкіни - сполуки з незамкнутим ланцюгом , що містять один потрійний зв’язок а всі інші атоми C зв’язані σ- зв’язками , а атоми Карбону біля потрійного зв’язку знаходиться в стані sp- гібридизації .
|
Тип гібридизації |
Типи зв’язків |
Загальна формула |
Кут між вуглецевими атомами біля потрійного (≡) зв’язку |
Довжина зв’язку С≡С |
|
sp |
π, σ-зв’язок |
СnH2n-2 |
[TEX]\angle [/TEX] 180 |
0,120нм |
Атоми Карбону біля потрійного зв’язку в ацетиленових вуглеводнях – алкінах знаходяться в стані sp – гібридизації. Для такого стану характерним є зміна форми електронних хмарин одної s, та одної – р – орбіталей. Утворюються дві гібридні орбіталі з формою неправильних вісімок та розташованих в просторі під кутом 180?.
Не гібридизовані р – орбіталі кожного атома Карбону біля потрійного зв’язку, перекриваються у взаємно перпендикулярних площинах, і утворюють два π–зв’язки.
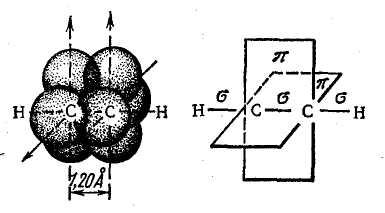
Основи номенклатури алкінів базуються на розглянутій номенклатурі ІЮПАК, але назви всіх алкінів закінчуються суфіксом – ин, з позначенням місця де розташований потрійний зв’язок. Нумерація починається від того кінця, де ближче знаходиться потрійний зв’язок. Наприклад : пентин -1
5 4 3 2 1
CH3- CH2 – CH2 - C ≡ CH
Окремо слід дати назву першому представнику алкінів - C2H2 (CH ≡ CH) – ацетилен (або по міжнародній номенклатурі - етин).
Ізомерія ацетиленових вуглеводнів – алкінів:
- структурна – розгалуження Карбонового ланцюга. Наприклад:
CH3 – CH2– CH2 – C≡CH – пентин – 1.
CH3 – CH – C ≡ CH – 3-метилбутин-1
|
CH3
- положення потрійного зв’язку. Наприклад:
CH3 – CH2 – C ≡ CH – бутин – 1
CH3 – C ≡ C – CH3 – бутин – 2
Способи одержання
|
Кaрбідний (взаємодія карбіду кальцію СаС2 з водою) Розкладання метану (t= 1500 C) |
СаС2 + 2Н2О Ca(OH)2 + C2H2 2СН4 C2H2 + 3H2 |
|
Лабораторний: Дегідратація двохатомних спиртів (в присутності сульфатної кислоти, при нагріванні) |
CH2—CH2 | | CH≡ CH + 2H2O OH OH |
|
Дегідрогалогенування (в присутності спиртового розчину лугу NaOH, KOH) |
NaOH(спирт) СН2Cl-СН2Cl C2H2 + 2HCl |
Хімічні властивості
Реакційна здатність ацетиленових вуглеводнів визначається наявністю потрійного зв’язку, що є сполученням одного σ-зв’язку і двох π зв’язків. Для ацетиленових вуглеводнів типовими є реакції приєднання. Міцність потрійного зв’язку більша ніж подвійного, а довжина менша. Через це реакції приєднання в ацетилені відбувається більш важко, ніж в етилені. Крім того в ацетилені підвищується рухливість атомів Гідрогену (з’являються слабкі кислотні властивості).
|
Приєднання: водню – гідрування, галогенів – галогенування (може відбуватися послідовно - спочатку до утворення подвійного зв’язку, а потім одинарного) при нагріванні в присутності каталізатора -Ni
|
СН≡СН + Н2 СН2=СН2
СН≡СН + 2Н2 СН3-СН3 |
|
Приєднання галогеноводнів – гідрогалогенування, (може відбуватися послідовно - спочатку до утворення подвійного зв’язку, а потім одинарного)
|
|
|
Приєднання води – реакція гідратації – реакція Кучерова – утворюється оцтовий альдегід в присутності солей Hg2+ |
H |
|
Полімеризація залежно від умов буває: - лінійна (каталізатор CuCl); |
СН≡СН+СН≡СН CH2 = CH – C ≡ CH
|
|
- циклічна (тримерізація) (в присутності активованого вугілля Сакт, і температури t) з утворенням бензолу |
3С2Н2
|
|
Реакція заміщення. Відбувається при пропусканні ацетилену крізь розчини солей Ag, Cu(I), або з амідом Na. При цьому заміщується атом Гідрогену біля потрійного зв’язку. Це є свідоцтвом слабких кислотних властивостей. Утворюються ацетиленіди |
СН≡СН+NaNH2 СН≡СNa+NH3 |
Застосування.
Ацетилен є сировиною для одержання поліхлорвінілу, каучуку, оцтової кислоти, розчинників, пластмас.Він широко використовується при зварюванні а різанні металів.
Ароматичні вуглеводні. Арени
Ароматичні вуглеводні або арени – циклічні вуглеводні молекули яких містять один або декілька циклів з шести атомів Карбону- бензольне кільце.
|
Тип гібридизації |
Типи зв’язків |
Загальна формула |
Кут між вуглецевими атомами |
Довжина зв’язку між атомами С |
|
sp2 |
Ароматичний – поєднання π, σ-зв’язків |
СnH2n-6 |
120 |
0,139нм |
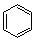
Перший представник ряду ароматичних вуглеводнів – бензол С6Н6 був відкритий в 1835 році Фарадеєм в світильному газі. У 1865 році Кекуле запропонував схему будови молекули бензолу.
В молекулі бензолу 6 атомів Карбону з’єднані між собою в цикл а також з 6 атомами Гідрогену. Структурна формула бензолу має вигляд циклічної молекули, що містить три подвійних зв’язки.
|
Ця формула пояснює реакції приєднання до бензолу і його гомологів – гідрування, галогенування на світлі. Наявність трьох подвійних зв’язків мали би вказувати на більшу ненасиченість бензолу, тобто на більшу схильність до реакцій приєднання. Але, навпаки, для бензолу більш характерні реакції заміщення атомів Гідрогену в бензольному ядрі |
Негібридні р- орбіталі кожного атома Карбону перпендикулярно площині кільця перекриваються, утворюючи замкнуту систему π - зв’язку . Але на відміну від алкенів, де π- зв’язок утворювався двома р- хмаринами, в бензолі π- зв’язок виникає між 6 атомами Карбону. Більш точно будову бензолу відбиває структурна формула у вигляді правильного шестикутника з колом в середні. Коло символізує рівноцінність зв’язків між атомами Карбону. Утворюється єдина π- орбіталь, яку важко зруйнувати. Саме тому для бензолу та його гомологів характерними є реакції заміщення. |
Номенклатура. Згідно номенклатурі ІЮПАК пронумеровані атоми Карбону в ядрі вказують положення замісника. Для ароматичних вуглеводнів ізомерія визначається величиною, кількістю і положенням радикалів. Два радикали можуть займати три різні положення, що називаються : о- орто- (1,2); п- пара – (1,4); м- мета – (1,3).
Х

|

орто орто
мета мета
|
Пара
Наведемо приклади формул ізомерів гомологу бензолу, що мають формулу С8Н10, або С6Н5 – С2Н5
|
СН2 – СН3
|
СН3
|
СН3
_CH3
|
СН3 |
| CH3
|
|
Етилбензол |
1,2 – дим етилбензол онрто-диметилбензол |
1,3 – дим етилбензол мета – диметилбензол |
1,4 –диметилбензол пара-диметилбензол |
Фізичні властивості. Бензол – безбарвна , летка рідина з характерним запахом, у воді не розчиняється, є добрим розчинником багатьох органічних сполук. Бензол горить кіптявим полум’ям, що пов’язано з великим відсотковим вмістом Карбону в молекулі бензолу.
Способи одержання
Бензол у великій кількості одержують з нафти і кам’яновугільної смоли, що утворюється при сухій перегонці кам’яного вугілля. Крім того існують лабораторні способи одержання бензолу. Наприклад:
|
1. Дегидроциклізація гексану (каталізатор – платина, при нагріванні) – ароматизація. |
С6Н14 C6H6 + 4H2 |
|
Тримеризація ацетилену (Сакт, t ) |
3С2Н2 C6H6 |
|
З солей бензойної кислоти |
C6H5COONa + NaOH C6H6 + Na2CO3 |
|
Реакція Вюрца для одержання гомологів бензолу |
C6H5-Cl + 2Na + CH3Cl C6H5 – CH3 + 2NaCl |
|
Алкілування бензолу (реакція Фрідель – Крафтс ) в присутності каталізатору AlCl3 |
C6H6 + C2H5Cl C6H5 – C2H5 + НCl |
Хімічні властивості
|
Реакції заміщення: 1. Галогенування бензолу в присутності AlCl3, FeCl3 |
FeCl3 С6Н6 +Cl2 C6H5Cl + HCl |
|
|
2. Галогенування гомологів бензолу в присутності світла |
C6H5-CH3 + Cl2 C6H5-CH2Cl + HCl
|
|
|
3.Нітрування бензолу концентрованою HNO3 при нагріванні в присутності H2SO4;
|
C6H6 + HO-NO2 C6H5-NO2 + H2O Бензол нітробензол |
|
|
4.Нітрування гомологов бензолу концентрованою HNO3 при нагріванні в присутності H2SO4 (нітруюча суміш); Нітрування гомологів бензолу відбувається значно активніше ніж нітрування бензолу. При цьому на нітрогрупу NO2 заміщуються три атоми Гідрогену бензольного кільця в положеннях 2,4,6.
|
СН3
+ 3HO – NO2 3H2O
Метилбензол (толуол) |
СН3
+
| NO2
(тринітротолуол) |
|
5. Алкілування (в присутності AlBr3, AlCl3) |
C6H6 + CH3Br C6H5-CH3 + HBr |
|
|
6. Реакції приєднання а) водню (нагрів, каталізатор Ni, Pt)
б) хлорування (при УФ - випромінюванні) |
C6H6 + 3H2 C6H12– циклогексан
С6Н6+3Cl2С6H6Cl6 гексахлорциклогексан |
|
|
7. Реакції окиснення характерні для гомологів бензолу. В якості окисників можуть бути : KMnO4, K2Cr2O7, O2.
|
С6Н6 +[O]не підлягає окисненню;
C6H5-CH3+ [О] C6H5-COOH + H2O метилбензол бензойна кислота
C6H5-C2H5+ [О] C6H5-COOH + H2O + СО2 етилбензол бензойна кислота |
|
Орієнтуюча дія замісників, присутніх у молекулі бензолу.
|
Замісники І роду (електронодонорні) орієнтують новий замісник в положення орто – і пара – |
Замісники IІ роду (електроноакцепторні) орієнтують новий замісник в положення мета – |
|
–СН3 , –С2Н5 , –ОН, –NH2, –F, –Cl, –Br. |
–NO2, –COOH, –SO3H, –C=O, –C≡N. | |
Застосування бензолу та його похідних.
Бензол є хімічною сировиною для виробництва ліків, фарб, пластмас, отрутохімікатів та багатьох інших органічних речовин. Бензол та хлорбензол використовують як розчинники. Додавання бензолу покращує якість моторного палива.


 СН≡С-СН3+HClCH2=CCl-CH3
СН≡С-СН3+HClCH2=CCl-CH3 Hg2+O
Hg2+O СН≡СН+H2О CH3-C
СН≡СН+H2О CH3-C (C6H6)
(C6H6)

 або
або |
|
 |
| _ _CH3
_ _CH3 |
|



 |
|
 |
| NO2 NO2
NO2 NO2
