Корозія - це процес самочинного руйнування металів внаслідок їх фізико-хімічної взаємодії з навколишнім середовищем, яка призводить до змінювання властивостей металів.
У природному стані атоми більшості металів мають стабільну електронну конфігурацію, оскільки входять до складу природних руд і мінералів у вигляді позитивно заряджених йонів, тобто перебувають в окисненій формі. А при добуванні металів їх, навпаки, примусово переводять із хімічних сполук у нейтральні атоми – у відновлену форму, яка для металів є термодинамічно нестійким станом.
Основною причиною корозії є термодинамічна нестійкість, для позбавлення від якої атоми прагнуть набути окисненої форми. Корозія - це гетерогенний окисно-відновний процес, що відбувається самочинно на межі поділу двох фаз: метал - газ чи метал - розчин і поєднує, як правило, хімічну взаємодію та електрохімічні явища.
І. Залежно від механізму перебігу процесу розрізнюють: хімічну корозію, електрохімічну корозію.
ІІ. За характером руйнування металу виділяють такі види корозії: суцільна (або загальна), яка виникає при взаємодії всієї поверхні металу з оточуючим середовищем; місцева (або локальна) корозія.
Хімічна корозія - це процес самочинного руйнування металів у атмосфері окиснювальних газів за умов високих температур чи у середовищі рідких неелектролітів.
Хімічній корозії притаманні певні ознаки: безпосереднє передавання електронів атомами металів окиснику, що знаходиться у корозійному середовищі; відсутність у системі електричного струму.
Залежно від умов перебігу хімічна корозія поділяється на типи:
- газова корозія, яка виникає при високих температурах у атмосфері сухих агресивних газів (F2, Cl2, SO2, NO2, H2S тощо), наприклад: корозія двигунів внутрішнього згоряння, деталей турбін, ракетних двигунів;
- корозія у неелектролітах - струмонепровідних рідинах (Br2, нафта і нафтопродукти).
Електрохімічна корозія - це руйнування металів у середовищах з іонною провідністю, при якому відбувається просторове перенесення електронів і виникнення електричного струму.
Залежно від умов перебігу розрізняють такі види електрохімічної корозії: контактна корозія, яка спостерігається при тривалому контакті двох металів, що мають різні значення електродних потенціалів; атмосферна корозія - руйнування металів у вологому повітрі при звичайних температурах; корозія у ґрунті, коли метал контактує з вологим ґрунтом, яка містить розчинений кисень та інші речовини; корозія при нерівномірній аерації відбувається, коли розчинений у воді кисень має неоднаковий доступ до різних ділянок металу; щілиста корозія - підсилене руйнування металів у щілинах, отворах, зазорах та каналах; корозія під напруженням, що спричиняється одночасною дією на метал корозійного середовища і механічного навантаження; фретинг-корозія, яка виникає внаслідок тертя корозійного середовища по поверхні металу; корозійна кавітація - руйнування металів, зумовлене ударною дією корозійного середовища, наприклад, руйнування гребних гвинтів суден або лопатей турбін; біокорозія, що відбувається під впливом продуктів життєдіяльності мікроорганізмів; корозія під дією зовнішнього електричного струму - руйнування підземних металевих комунікацій та споруд блукаючими струмами. Найчастіше цей вид електрохімічної корозії спостерігається при роботі електричного рейкового транспорту за рахунок витоку струму на стиках заглиблених у ґрунт рейок. У цьому випадку можливе розгалужування струму, частина якого піде через вологий ґрунт. Якщо на шляху проходження струму знаходиться підземна металева споруда, то ділянка конструкції, у яку входить блукаючий струм, буде катодом, а місце його виходу - анодом.
Сутність електрохімічної корозії полягає у анодному розчиненні металу на ділянках з меншим значенням електродного потенціалу і катодному відновленні окисника із навколишнього середовища на ділянках з більшим значенням електродного потенціалу, завдяки чому самі катодні ділянки зберігають свою цілісність. Умовно цей процес записується за допомогою напівреакцій:
(-) A: [TEX]Me^0-z\bar{e}\rightarrow Me^{z+}[/TEX], (+) K: [TEX]Ox+z\bar{e}\rightarrow Red[/TEX].
Окисниками при електрохімічній корозії найчастіше виступають О2 і Cl2 у вологому повітрі, йони Н+, Fe3+, NO3- тощо. Взагалі середовищем електрохімічної корозії може бути: електроліт (водні розчини кислот, солей, лугів, морська вода); вологий газ; вологий ґрунт.
Всі окисники, які сприяють перебігу катодної реакції відновлення, називаються деполяризатор, а катодний процес - деполяризація.
Здебільшого на катодних ділянках спостерігається іонізація (відновлення) кисню:
- у нейтральному чи лужному середовищі:
при pH≈7: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX], ε0 = +0,815B;
pH≤7: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX], ε0 = +0,401B;
- у кислому середовищі: [TEX]O_2+4H^++4\bar{e}\rightarrow 2H_2O[/TEX], ε0 = +1,229B,
- а також виділення водню: [TEX]2H^++2\bar{e}\rightarrow H_2[/TEX].
Корозійний процес, що супроводжується поглинанням і відновленням на катоді газоподібного кисню О2, називається корозія з кисневою деполяризацією. Корозійний процес, при якому на катоді відновлюються йони гідрогену Н+ і виділяється газоподібний водень Н2, називається корозія з водневою деполяризацією.
Поряд з електрохімічними процесами під час корозії відбуваються вторинні хімічні реакції, наприклад, взаємодія йонів металу з гідроксильними йонами:
[TEX]Me^{z+}+zOH^-\rightarrow Me(OH)_z[/TEX].
Утворена основа протягом часу може піддаватися поступовій дегідратації (втраті молекул Н2O): [TEX]2Me(OH)_z\rightarrow Me_2O_z\cdot zH_2O[/TEX].
Хімічна схема корозійного гальванічного елемента має простіший вигляд порівняно із звичайним гальванічним елементом, наприклад:
А(-) МеІ | O2, Н2O | МеІІ (+)K,
А(-) МеІ | Н+, Н2O | МеІІ (+)K,
Існує два основних типи корозійних гальванічних елементів:
- макрогальванічний корозійний елемент, який характеризується наявністю розділених катодних і анодних ділянок, досить великих за розмірами;
-
мікрогальванічний корозійний елемент, що складається з багатьох невеликих нерозділених катодних і анодних ділянок, здатних до миттєвої зміни полюсів, наприклад, корозія сталі у вологому повітрі.
Причиною виникнення мікрогальванічних корозійних елементів є електрохімічна гетерогенність (неоднорідність), яка може мати різну природу.
Термодинамічним обґрунтуванням роботи корозійного гальванічного елемента вважається зменшення енергії Гіббса (ΔG<0), яка пов’язана з електрорушійною силою Е залежністю Е = -ΔG/zF. З цього рівняння випливає, що можливість перебігу корозії встановлюється за знаком ЕРС, оскільки умова ΔG<0 виконується тільки при Е>0. ЕРС визначається різницею потенціалів окисника і відновника (E = εок - εвідн), тому корозія можлива (Е>0, ΔG<0), коли потенціал окисника в корозійному середовищі має більше значення, ніж потенціал металу εок > ε0Mem+/Me. Цей вираз дозволяє оцінити можливість перебігу корозійних процесів для будь-яких металів у різних корозійних середовищах.
Якщо потенціал певного металу має більше значення, ніж потенціал кисневого електрода (+1,229В), то такий метал не кородує ні з кисневою, ні, тим більше, з водневою деполяризацією при будь-яких значеннях рН (рис., ділянка 3). Якщо значення потенціалу металу відповідає ділянці 2 (рис.), то метал кородує з кисневою деполяризацією, однак зберігає стійкість до корозії з водневою деполяризацією. Якщо потенціал металу має менше значення, ніж потенціал водневого електрода, то корозія можлива як з кисневою, так і з водневою деполяризаціями (рис., ділянка 1).
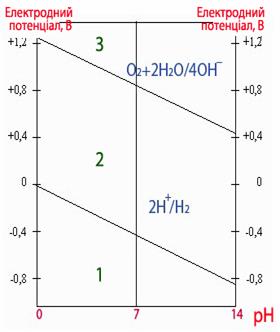
Рисунок - Залежність потенціалів водневого і кисневого електродів від рН середовища
Зменшення енергії Гіббса (ΔG<0) i додатне значення електрорушійної сили (E>0) лише зазначають можливість (імовірність) самочинного перебігу корозійних процесів, але не менш важливою характеристикою є кінетика корозійних процесів, що визначається лімітуючою (найповільнішою) стадією.
Корозійні гальванічні елементи належать до короткозамкнених, тому переміщення електронів у металі відбувається майже миттєво і не може бути лімітуючою стадією. Рух йонів у розчині електроліту теж не лімітує корозійний процес завдяки надзвичайно малій відстані між катодними та анодними ділянками. Отже, лімітуючою стадією можуть бути електрохімічні реакції: окиснення металу (анодний контроль), відновлення корозійного середовища (катодний контроль) чи ті та інші процеси одночасно (змішаний контроль).
Швидкість електрохімічної корозії залежить від різних чинників, які за своїми характерними особливостями поділяються на внутрішні та зовнішні.
І. Внутрішні чинники пов’язані з властивостями корозійно активної речовини. Їх декілька:
-
Природа металів, яка виявляється в їх хімічній активності та схильності до пасивації. Пасивація - це набуття термодинамічно нестійким металом корозійної стійкості внаслідок утворення на його поверхні щільних непоруватих плівок, які захищають метал від руйнування. Пасивність металу – це стан його підвищеної корозійної стійкості, зумовлений гальмуванням анодного процесу.
За схильністю до пасивації найпоширеніші у техніці метали розміщуються у ряд:
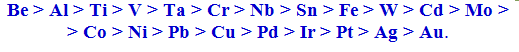
- Структура сплавів, залежно від якої сплави поділяються на гомогенні (тверді розчини) і гетерогенні, що складаються з кількох твердих мікрофаз. Швидкість електрохімічної корозії зростає при переході від гомогенних до гетерогенних сплавів.
- Стан поверхні металу. Корозійна стійкість металу підвищується завдяки тонкій механічній обробці поверхні, що сприяє утворенню досконалих захисних шарів. Термічна обробка, яка полегшує знімання механічного напруження на поверхні та всередині металу, також підвищує його корозійну стійкість.
ІІ. Зовнішні чинники, що впливають на швидкість корозії, пов’язані з природою корозійного середовища і умовами перебігу корозійних процесів. До них належать:
- Кислотність середовища: швидкість корозії зростає зі зменшенням рН середовища, оскільки при цьому підвищується розчинність продуктів корозії.
-
Іонний склад корозійного середовища. Корозійне середовище може містити йони- активатори, які прискорюють корозію, та йони-інгібітори, які її уповільнюють.
Аніони-активатори (Cl-, Br-, I-) виявляють подвійну дію: порушення пасивного стану металів внаслідок руйнування оксидних плівок і утворення розчинних продуктів: полегшення йонізації атомів металу завдяки зв’язуванню їх у розчинні комплекси;
Катіони-активатори - це найчастіше багатозарядні катіони малоактивних металів, які здатні окиснювати більш активні метали; Аніони-інгібітори теж можуть відігравати подвійну роль: утворення з металом важкорозчинної сполуки, що осідає на його поверхні, тим самим гальмуючи подальшу корозію; переведення металів у пасивний стан за допомогою аніонів-окисників;
Катіони-інгібітори - це катіони, які утворюють важкорозчинні сполуки з гідроксильними йонами ОН-, що виникають на катодній ділянці внаслідок кисневої деполяризації.
- Концентрація розчинів. При контакті металів з розчинами солей, йони яких не виявляють властивостей активаторів чи інгібіторів корозії, швидкість корозійних процесів залежно від концентрації підкоряється складним законам.
- Кількість кисню. Кисень є сильним корозійноактивним агентом, однак його вплив на корозійні процеси неоднозначний. Найчастіше збільшення кількості О2 інтенсифікує корозію більшості металів. Але якщо метал легко піддається пасивації, то при підвищенні концентрації кисню корозія такого металу сповільнюється. Швидкість корозії з кисневою деполяризацією зростає при збільшенні дифузії та розчинності кисню, а також при енергійному перемішуванні.
-
Температура і тиск. У випадку корозії з водневою деполяризацією підвищення температури прискорює електродні процеси, тому швидкість корозії зростає. Коли відбувається корозія з кисневою деполяризацією, температура виявляє подвійний вплив, оскільки підвищення температури збільшує швидкість електродних процесів, однак одночасно зменшує розчинність кисню. Максимальної швидкості корозія з кисневою деполяризацією досягає в інтервалі 70-800С. Це зумовлюється оптимальним співвідношенням коефіцієнта дифузії кисню та величиною його розчинності у зазначених межах температур.
Підвищення тиску призводить до зростання швидкості корозії, що пояснюється збільшенням розчинності корозійно-активних газів, а також виникненням внутрішніх напружень у металах.
Захист металів від корозії полягає у комплексі заходів для збільшення працездатності та надійності металів і конструкційних матеріалів за умов їх експлуатації.
Ця група методів досліджується і розвивається у декількох напрямках.
- Легування - одержання сплавів з підвищеною корозійною стійкістю порівняно з основним металом.
- Термообробка металів та сплавів, що підвищує корозійну стійкість конструкції завдяки гомогенізації сплавів і зніманню внутрішніх напружень у металі.
-
Захисні покриття - спеціальні штучні шари на поверхні металевих виробів та споруд для запобігання корозії. Якщо поряд із захисною дією покриття виявляє ще й прикрашувальні функції, його називають захисно-декоративним. Захисні покриття поділяються на металеві та неметалеві, які в свою чергу можуть бути неорганічними або органічними.
3.1. Металеві покриття за механізмом захисної дії поділяються на катодні та анодні.
- Катодні покриття мають більше значення електродного потенціалу, ніж основний метал. При порушенні покриття цього типу виникає корозійний гальванічний елемент, в якому основний метал відіграє роль анода, а покривний - катода, тому основний метал окиснюється і розчиняється, а на покривному металі виділяється водень або поглинається кисень - залежно від виду деполяризації. Катодні покриття захищають метал лише механічно. При утворенні тріщин або пор руйнування основного металу прискорюється.
- Анодні покриття мають менше значення електродного потенціалу порівняно з основним металом. У корозійному гальванічному елементі, що утворюється при порушенні анодного покриття, покривний метал стає анодом, а основний - катодом, тому він не піддається корозії. Таким чином, анодні покриття захищають метал не тільки механічно, але й електрохімічно. Це означає, що при їх порушенні кородує саме покривний метал (анод), а основний метал не руйнується.
3.2. Неметалеві неорганічні покриття виявляють захисну дію в ізоляції металу від оточуючого середовища і можуть мати різну природу: бетонні покриття, неорганічні емалі, оксидні плівки, фосфатні плівки.
3.3. Органічні покриття є засобом захисту металу від низькотемпературної корозії.
Залежно від складу і властивостей органічні захисні шари наносяться різними способами: мастіння, лакування, фарбування, футурування полімерними матеріалами.
Використання цієї групи методів є доцільним у тому випадку, коли мають справу з обмеженим об’ємом корозійного середовища, наприклад, з теплоносієм у системі опалювання. Найбільш поширеними є два методи.
- Усунення агресивного реагенту або зменшення його концентрації у корозійному середовищі. Найчастіше агресивними реагентами є такі деполяризатори: кисень у нейтральному середовищі чи йони гідрогену - у кислому. Вміст деполяризатора у кислому середовищі зменшують шляхом його нейтралізації за допомогою вапна чи каустичної соди. Корозію металів з кисневою деполяризацією послаблюють різними способами: термічною обробкою корозійного середовища гострою парою; продуванням через середовище інертних газів, які захвачують розчинений кисень; хімічним знекисненням при введенні у корозійне середовище відновників для зв’язування кисню.
- Додавання інгібіторів, незначні кількості яких різко уповільнюють швидкість корозійних процесів, не змінюючи при цьому властивостей середовища. Дія інгібіторів полягає в утворенні на поверхні металу захисних плівок, які ізолюють метал від середовища або так змінюють його електродний потенціал, що активність металу помітно зменшується. За інгібітори використовують органічні та неорганічні суміші.
Сутність групи електрохімічних методів захисту від корозії зводиться до зменшення електрохімічної корозії внаслідок поляризації. Це досягається при штучному створенні макрогальванічних елементів, за допомогою яких корозійні процеси спрямовують у необхідному напрямку. Електрохімічні методи застосовують головним чином у тих випадках, коли металева конструкція знаходиться у воді, вологому грунті чи в агресивному середовищі (трубопроводи, кораблі, палі морських нафтопромислів).
Залежно від типу поляризації електрохімічні методи поділяються на такі групи: катодний захист і анодний захист, а залежно від способу складання гальванічного елемента розрізняють протекторний захист і захист зовнішним електричним струмом.
-
Катодний захист полягає у штучному створенні корозійного гальванічного елемента, в якому металева конструкція примусово виконує роль катода.
-
Катодний протекторний захист від корозії реалізується при сполученні конструкції (яка функціонує як катод) з більш активним металом, який відносно основного металу заряджається анодно і тому піддається корозійному руйнуванню.
За протектори найчастіше використовують викидний металевий брухт на основі магнієвих, цинкових та алюмінієвих сплавів. Завдяки роботі корозійного гальванічного елемента сталь не руйнується, оскільки спостерігається розчинення протектора:
A: [TEX]Mg^0-2\bar{e}\rightarrow Mg^{2+}[/TEX],
K: [TEX]O_2^0+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
- Катодний захист зовнішнім електричним струмом відрізняється тим, що металева конструкція під’єднується до негативного полюса джерела постійного струму. Допоміжний електрод - анод – може бути розчинним (сталева рейка, балка чи металевий брухт, які поступово кородують, захищаючи від руйнування основний метал), або інертним (графіт, свинець, феросиліцид).
-
Катодний протекторний захист від корозії реалізується при сполученні конструкції (яка функціонує як катод) з більш активним металом, який відносно основного металу заряджається анодно і тому піддається корозійному руйнуванню.
-
Анодний захист застосовують значно рідше – головним чином у середовищах з достатньо високою провідністю при експлуатації обладнання, виготовленого з металевих матеріалів, що мають підвищену схильність до пасивації – вуглецевих низьколегованих нержавіючих сталей, сплавів на основі титану і алюмінію. При анодному захисту електродний потенціал металу зміщують в бік додатніших значень, завдяки чому відбувається поляризація металу. Внаслідок цього спостерігається суттєве зниження (у тисячі разів) швидкості корозії. Залежно від способу зміщення потенціалу анодний захист може здійснюватися двома способами.
- Анодний протекторний захист. При застосуванні цього методу конструкцію сполучають з малоактивним металом, який має дуже велике додатне значення електродного потенціалу, тому основний метал поляризується анодно.
- Анодний захист зовнішнім електричним струмом, при якому конструкцію під’єднують до позитивного полюсу джерела постійного струму. Цей метод використовують тільки для захисту від корозії металів, схильних до пасивації, наприклад нержавіюча сталь, що перебуває в окислювальному середовищі.



