Ключові терміни:
алкаліметрія, ацидиметрія, крива титрування, лінієя еквівалентності, лінієя нейтральності., показник титрування, стрибок титрування, точка нейтральності, інтервал переходу індикатора5.1. Сутність методу
В основі методу лежить реакція нейтралізації:
Н+ + ОН - = Н2О
Метод застосовується для кількісного визначення кислот (H2SO4, HCL, H3PO4, CH3COOH), гідроксидів (КОН, NaOH, Ba(OH)2 та ін.), солей, здатних гидролизоватися у водних розчинах (Na2CO3, K2CO3), а також сумішей солей і гідроксидів (NH4OH і NaOH).
Кислотно-основне титрування має два основні методи - ацидиметрія (визначення основ) і алкаліметрія (визначення кислот).
В якості робочих розчинів використовують розчини кислот H2SO4 і HCL, розчини гідроксидів NaOH і КОН. Так як ці речовини не можуть бути використані для приготування титрованих розчинів з приготованим титром, то їх титр встановлюють за вихідними речовинами. В якості вихідних для встановлення титрів кислот використовують Na2B4O7 ∙ H2O (бура) або Na2CO3, а для встановлення титру розчинів лугів - щавлеву кислоту Н2С2О4 ∙ 2 H2O або бурштинову кислоту Н2С4О4О4.
5.2. Криві титрування
У процесі титрування змінюються рівноважні концентрації речовини, титранту і продуктів реакції. При цьому пропорційно концентраціям речовин змінюються і властивості розчину.
Графік залежності параметра системи, пов'язаного з концентрацією речовини яка титрується , титранту, або продукту від складу розчину в процесі титрування називають кривою титрування.
Криві титрування допомагають вибрати індикатор, оцінити похибку, наочно простежити за ходом титрування. При побудові кривих по осях можна відкладати різні величини.
Якщо по осі ординат відкласти логарифм концентрації (або відносини концентрацій) або величину, пропорційну цьому логарифму, виходять логарифмічні криві титрування. Якщо ж по осі ординат відкладати концентрацію або фізико-хімічний параметр, пропорційний концентрації, виходять лінійні криві титрування. Найчастіше користуються логарифмічними кривими титрування.
По осі абсцис зазвичай відкладають об’єм доданого титранту Vт або ступінь оттітрованності f - відношення об’єму доданого в даний момент титранту V т до вихідного обєму речовини яка титрується Vо.
В процесі кислотно-основного титрування змінюється рН розчину, тому криві титрування доцільно будувати в координатах f -pH або Vт - рН. Розглянемо на конкретних прикладах побудову кривих титрування.
5.2.1. Крива титрування сильної кислоти сильною основою
Нехай 100.0 мл 0,1 М розчину HCl титрують 0,1 М розчином NaOH. Припустимо, що іонна сила близька до нуля (це, звичайно, не так, але облік іонної сили ускладнить розрахунки). Пренебрежем також і зміною об’єму. Іони Na+ та Сl- не впливають на кислотно-основну рівновагу. Складемо таблицю значень рН і побудуємо криву титрування.
Таблиця 5.1. Титрування 100 мл 0,1 М розчину хлоридної кислоти 0,1 М розчином гідроксиду натрію
|
F= VT/Vo |
Склад розчину |
рН-визначаючий компонент |
Формула розрахунку рН |
Значення рН |
|
0/100=0 |
HCl, H2O |
HCl |
pH=-lgCкисл |
1 |
|
90/100=0.9 |
HCl, H2O |
HCl |
pH=-lgC кисл |
2 |
|
99/100=0.99 |
HCl, H2O |
HCl |
pH=-lgC кисл |
3 |
|
99.9/100=0.999 |
HCl, H2O |
HCl |
pH=-lgC кисл |
4 |
|
100/100=1 |
H2O, NaCl |
H2O |
pH=pOH |
7 |
|
100.1/100=1.001 |
H2O, NaCl, NaOH |
NaOH |
pH= 14+lgCосн |
10 |
|
101/100=1.01 |
H2O, NaCl, NaOH |
NaOH |
pH= 14+lgCосн |
11 |
|
110/100=1.1 |
H2O, NaCl, NaOH |
NaOH |
pH= 14+lgCосн |
12 |
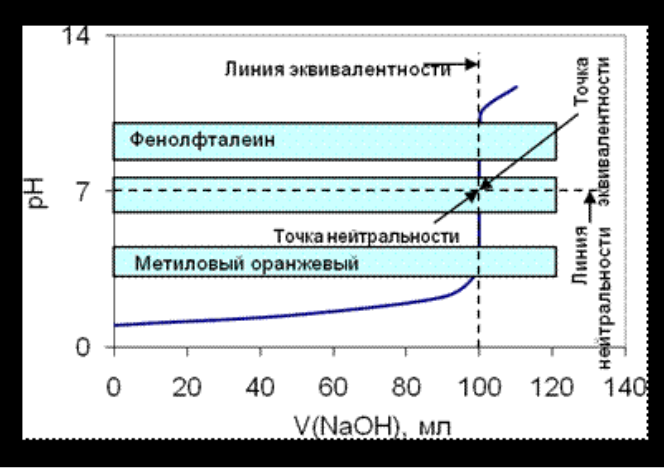
Рисунок 5.1. Крива титрування сильної кислоти сильною основою
-
Пряма, яка паралельна осі абсцис і перетинає вісь ординат при pH 7,0, називають лінією нейтральності.
• Пряма,яка паралельна осі ординат і перетинає вісь абсцис при значенні еквівалентного обсягу лугу (VNaOH = 100,0 мл), називають лінією еквівалентності.
• Точку перетину кривої титрування з лінією еквівалентності, називають точкою еквівалентності, а перетин кривої титрування з лінією нейтральності - точкою нейтральності.
• Різка зміна pH в області точки еквівалентності називають стрибком титрування.
Висновки з кривою титрування
• Крива симетрична щодо точки еквівалентності
• Точка еквівалентності збігається з лінією нейтральності
• Стрибок титрування має великий інтервал
5.2.2. Крива титрування слабкої кислоти сильною основою
Нехай 100.0 мл 0,1 М розчину СН3СООН титрують 0,1 М розчином NaOH. В основі титрування лежить реакція
СН3СООН + NaOH = СН3СООNa + H2O.
На початку титрування в розчині знаходиться тільки слабка кислота. До точки титрування при титруванні виходить спряжена слабка основа СН3СООNa і розчин являє собою буферну суміш. У точці еквівалентності вся кислота відтитровуваєтся і рН розчину визначається наявністю солі СН3СООNa. Після точки еквівалентності основним джерелом гідроксильних іонів буде доданий сильна основа. Складемо таблицю значень рН, зробивши ті ж допущення, що і в п. 5.2.1.
Таблица 5.2. Титрування 100 мл 0,1 н. розчину оцтової кислоти 0,1 н. розчином гідроксиду натрію
|
f = Vт/Vo |
склад розчину |
рН-визначаючий компонент |
формула розрахунку рН |
значення рН |
|
0/100=0 |
СН3СООН,Н2О |
СН3СООН |
pH=1/2pKк-1/2lgCk |
3 |
|
9/100=0,09 |
СН3СООН, Н2О СН3СООNa |
буферна суміш |
pH=pKk – lg Ck/Cc |
3,8 |
|
50/100=0,5 |
СН3СООН, Н2О СН3СООNa |
буферна суміш |
pH=pKk – lg Ck/Cc |
4,8 |
|
91/100=0,91 |
СН3СООН, Н2О СН3СООNa |
буферна суміш |
pH=pKk – lg Ck/Cc |
5,8 |
|
99,9/100=0,999 |
СН3СООН, Н2О СН3СООNa |
буферна суміш |
pH=pKk – lg Ck/Cc |
6,8 |
|
100/100=1 |
СН3СООNa, Н2О |
СН3СООNa |
pH=7-1/2lgKk+1/2lgCo |
8,75 |
|
100,1/100=1,001 |
СН3СООNa, Н2О NaOH |
NaOH |
pH= 14 + lgCo |
9,7 |
|
101/100=1,01 |
СН3СООNa, Н2О NaOH |
NaOH |
pH= 14 + lgCo |
10,7 |
|
110/100=1,1 |
СН3СООNa, Н2О NaOH |
NaOH |
pH= 14 + lgCo |
10,7 |
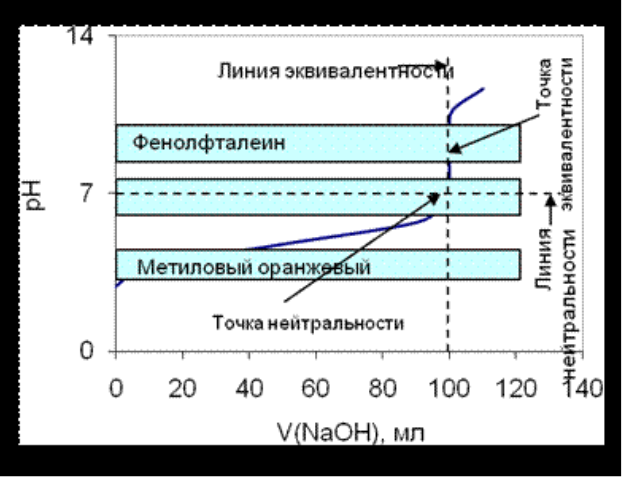
Рисунок 5.2. Крива титрування слабкої кислоти сильною основою
Висновки з кривою титрування
• Розбіжність точки еквівалентності з точкою нейтральності і розташування точки еквівалентності в лужної області.
• Стрибок титрування 0,1 М оцтової кислоти набагато менше, ніж хлоридної або іншої сильної кислоти.
• Крива несиметрична щодо лінії нейтральності
5.2.3. Титрування багатоосновних кислот і основТ
Багатоосновні кислоти зазвичай є слабкими і дисоціюють поступово. При цьому, якщо послідовні константи кислотності відрізняються більш, ніж в 104 разів, то на кривих спостерігаються читки скачки титрування. В іншому випадку скачки зливаються.
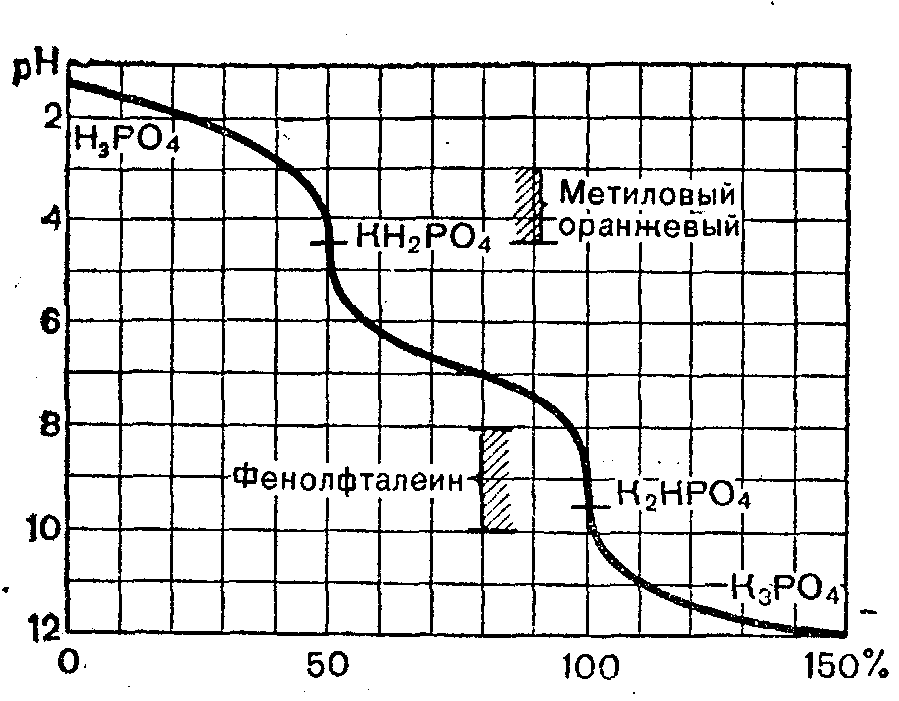
Рисунок 5.3 Крива титрування ортофосфатної кислоти гідроксидом натрію
5.2.4. Фактори, що впливають на величину стрибка титрування
На величину стрибка титрування впливають всі фактори, від яких залежать значення рН: константа дисоціації речовини яка титруєтся, його концентрація, температура і іонна сила.
Чим слабкіше кислота (основа), тим вище рН на початку титрування і в області буферного дії, тобто гілка кривої титрування зміщується в лужну область. У точці еквівалентності утворюється тим більш сильна основа, чим слабкіша вихідна кислота. В результаті цього рН в точці еквівалентності зміщується також в лужну область. У той же час гілка за точкою еквівалентності залишається незмінною. Це призводить до того, що стрибок титрування зменшується. Для кислот і основ Кдісс ≤ 5 ∙ 10-8 точка еквівалентності зливається з початком правій гілки, тобто стрибок титрування відсутен і їх не можна відтитрувати у водних розчинах.
Чим менше концентрація речовини яка титруєтся і титранту, тим менше стрибок титрування. Практично неможливо відтитрувати сильні електроліти з концентрацією менше 1 ∙ 10-4 М, а слабкі з концентрацією менше 1 ∙ 10-2 М.
При зміні температури сильно змінюється константа автопротоліза води, яка входить в багато формул для розрахунку рН. В результаті при збільшенні температури стрибок зменшується і зміщується в більш кислу область. Іонна сипа впливає незначно.
5.3. Індикатори методу нейтралізації
Для фіксування кінця титрування використовують візуальні (титрування з індикатором, кольоровим або флуоресцентним) і інструментальні методи (потенціометричне, амперометричне, фотометричне титрування). Кольорові індикатори в кислотно-основному титруванні - це слабкі органічні кислоти і основи, протоновані і непротонірованние форми яких розрізняються за структурою і забарвленням. Існують одноколірні (наприклад, фенолфталеїн) і двоколірні (наприклад, метиловий оранжевий) індикатори. Зміна забарвлення індикатора пов'язано з таутомерією органічних молекул, що містять хромофор. Такі сполуки мають рухливі p-електрони, і в залежності від розподілу електронної щільності молекулі можна приписати кілька структур; граничні структури називаються таутомерами. На розподіл електронної щільності впливає наявність ауксохромних груп. Ауксохроми пов'язані з ненасиченим вуглецевим скелетом хромофора так, що положення подвійних зв'язків змінюється. Різниця енергій основного і збудженого (під дією світла) станів таких речовин мала, тому молекула поглинає світло у видимій частині спектру, і речовина має певне забарвлення. На рис. 5.4. показані таутомерні переходи метилового оранжевого.
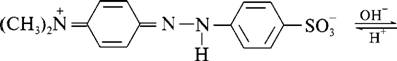

Рис. 5.4. Таутомерні переходи індикатора метилового оранжевого
Однак існують сполуки, які містять хромофори, у яких під впливом середовища структура змінюється так, що з'являються хромофорні групи. Наприклад, фенолфталеїн в кислому середовищі безбарвний. У лужному середовищі в результаті перерозподілу електронної щільності в його молекулі утворюється хіноїдна структура (хромофор), що знаходиться в рівновазі зі своєю таутомерією формою. Речовина набуває червоне забарвлення.
Групу індикаторів, схожу з фталеінамі, складають сул'фофталеіни: бромкрезоловий зелений, феноловий червоний, тимоловий синій та інші сполуки. Наприклад, в розчині фенолового червоного в рівновазі знаходяться червона і жовта форми.
Окрему групу становлять трифенілметанові барвники: кристалічний фіолетовий, метиловий фіолетовий, малахітовий зелений і ін.
За хімічною природою кислотно-основні індикатори є слабкими органічними кислотами або основами, які частково дисоціюють в розчині:
HInd ↔ H + + Ind-,
де HInd – недіссоційована молекула індикатора; Ind- - аніон індикатора. Відповідно до теорії іонних забарвлень Оствальда, HInd і Ind- мають різне забарвлення. Зміна кольору індикатора при зміні pH ця теорія пов'язує зі зміщенням рівноваги дисоціації індикатора. Зі збільшенням концентрації іонів водню ця рівновага зміщується вліво (відповідно до принципу Ле Шательє), і розчин набуває забарвлення HInd; при зменшенні кислотності зростає концентрація Ind-, і забарвлення розчину змінюється. Рівновага дисоціації індикатора характеризується константою дисоціації KHind
KHInd = ( [H+] [Ind-])/ [HInd] (5.1)
Розглянемо один з найбільш поширених індикаторів - метиловий оранжевий. Кисла форма HInd у нього має червоний колір, а основна Ind- - жовтий. З виразу (5.1) можна отримати
KHInd/ [H+] = [Ind-]/ [HInd] (5.2)
Это соотношение показывает, что с увеличением концентрации ионов водорода дробь [Ind-]/[HInd] будет уменьшаться. Если кислотность раствора снижать, то отношение [Ind-]/[HInd] будет расти, и интенсивность желтой окраски увеличится. При логарифмировании (5.2) получаем
pH = pKHInd + lg [Ind- ]/ [HInd] (5.3)
Око людини здатне встановити появу забарвлених частинок, якщо їх зміст буде приблизно в 10 разів або більше перевищувати концентрацію інших забарвлених частинок в розчині. Це означає, що якщо відношення [Ind -] / [HInd] буде близько до значення 10/1 і більше, то колір розчину на око буде сприйматися як колір індикаторній форми Ind-, а якщо відношення [Ind -] / [HInd] буде близько до 1/10 і менше, то колір розчину буде сприйматися як забарвлення індикаторній форми HInd. При виконанні умови 0,1 ≤ [Ind -] / [HInd] ≤ 10 спостерігається проміжне забарвлення індикатора.
Інтервал pH, в якому індикатор змінює своє забарвлення, називається інтервалом переходу індикатора.
Щоб його знайти, підставимо граничні значення відношення [Ind -] / [HInd], рівні 10 і 0,1, в рівняння (5.3)
ΔpH = pKHInd ± 1. (5.4)
Вираз (5.4) показує, що інтервал переходу індикатора становить приблизно дві одиниці pH. Область pH, в якій знаходиться інтервал переходу, визначається величиною pKHInd. Якщо pKHInd <7, інтервал переходу знаходиться в кислої області; якщо pKHInd> 7 - в лужної. Співвідношення (5.4) є наближеним, тому що воно не враховує спектральну чутливість ока і різницю в інтенсивності забарвлення кислотної і лужної форм індикатора. Наприклад, у метилового оранжевого pKHInd = 3,36. З формули (5.4) випливає, що зміна кольору метилового оранжевого відбуватиметься в області pH від 2,36 до 4,36. Експериментально спостережуваний інтервал переходу цього індикатора лежить в області pH 3,1 ... 4,4. У таблиці 5.3 наведені параметри деяких часто використовуваних кислотно-основних індикаторів.
Таблица 5.3. Кислотно-основні індикатори
|
Індикатор |
Інтервал переходу pH |
pKHInd |
Змінення забарвлення |
|
Метиловий оранжевий |
3,1…4,4 |
3,36 |
червона-жовта |
|
Фенолфталеїн |
8,2…9,8 |
9,53 |
Безбарвна - жовта |
|
Лакмус |
5,0 …. 8,0 |
7,00 |
Червона- синя |
Кислотно-основні індикатори змінюють своє забарвлення в області інтервалу переходу, незалежно від того, досягнута або НЕ досягнута точка еквівалентності.
Правильно обраний індикатор змінює забарвлення в області стрибка титрування. Спостережуване при титруванні різка зміна кольору індикатора при додаванні лише однієї краплі титранту пов'язано з різким (в кілька одиниць) зміною pH в області стрибка. У неправильно обраного індикатора зміна забарвлення може відбуватися задовго до настання точки еквівалентності (в недотітрованних розчинах) або після неї (в перетітрованних). При цьому зміна кольору розчину не буде настільки різким, як поблизу точки еквівалентності.
Вибирають індикатор за допомогою кривої титрування. Для цього на графік кривої титрування наносять інтервал переходу індикатора. У правильно підібраного індикатора інтервал переходу повністю або частково перекривається стрибком титрування. Якщо такого перекривання немає, індикатор для даного титрування не підходить. Відмінним індикатором для розглянутого вище титрування сильної кислоти сильною основою є лакмус, інтервал переходу якого знаходиться в середині стрибка титрування (рис. 5.1). Фенолфталеїн також може бути використаний для даного титрування, так як його інтервал переходу (8,2 ... 9,8) захоплює область стрибка титрування. Явно непридатним індикатором для титрування 0,1 М HCl розчином NaOH був би, наприклад, метиловий оранжевий (табл. 5.3).
Величину pH, при якій закінчується титрування з даними індикатором, називають показником титрування і позначають pT. Показник титрування знаходиться близько до середини інтервалу переходу індикатора. У метилового оранжевого pT 4,0, у фенолфталеина 9,0 і т.д. Правило вибору індикатора можна сформулювати також, користуючись поняттям pT. Індикатор придатний для даного титрування, якщо його pT лежить в межах стрибка титрування.
Приклади розв'язання задач
Приклад 1. Визначити вміст хлороводню в розчині, якщо на нейтралізацію 25 см3 розчину НСl, взятого піпеткою з мірної колби ємністю 500,00 см3, витрачається 21,65 см3 0,0962 н. розчину NaOH.
Рішення.
- визначаємо концентрацію розчину НСl:
N НСl ∙ V НСl = N NaOH ∙ V NaOH
N НСl = (0, 0962 ∙ 21.65) / 25.00 = 0.0836 моль/л
- Знаходимо титр НСl:
Т НСl = (N НСl ∙ meкв HCl) /1000 = (0.0836 ∙ 36.5)/1000 = 0.003051 г/см3
3. Обчислюємо масу хлороводню в розчині:
mНСl = TНСl ∙ V = 0.003051 ∙ 500 = 1.5257 г
Приклад 2. Визначити масову частку натрій гідроксиду в зразку, якщо наважка технічного їдкого натру масою 0,1095 г розчинена у воді і на титрування отриманого розчину витрачено 25,50 см3 0,1002 н розчину Н2SO4.
- Знаходимо масу NaOH, що знаходиться в приготованому розчині:
mNaOH = TH2SO4/NaOH ∙ VH2SO4 = (NH2SO4 ∙ meквNaOH ∙ V H2SO4)/ 1000 = (0.1002 ∙40.01 ∙25.50)/1000 = 0.1022 г
2) Знаходимо масову частку гідроксиду натрію в зразку:
W = (mNaOH ∙ 100) / mнаважки = (0,1022 ∙ 100)/0,1095 = 93,36 %.
Приклад 3. Яку наважку технічного NaOH, що містить 40% домішок, необхідно взяти для визначення NaOH, якщо для визначення отриманого розчину витрачено 30.00 см3 0,1000 н розчину HCl.
Рішення.
- Визначаємо масу NaOH, що міститься у наважке, взятої для аналізу:
m NaOH = THCl/ NaOH ∙ VHCl = (NHCl ∙ meквNaOH ∙ V HCl)/1000 = (0.1000 ∙ 40.01∙30.00)/1000 = 0.1200 г
2. Визначаємо масу наважки технічного NaOH:
mнавески = (m NaOH ∙ 100)/W NaOH) = (0.1200 ∙ 100)/40 = 0.3001 г



