- Теплові ефекти хімічних реакцій
- Закон Гесса
- Термохімічні розрахунки
- Залежність теплового ефекту реакції від температури
Ключові терміни:
Ентальпія окиснення сполуки, Ентальпія утворення, Закон Гесса, Тепловим ефектом, рівняння Кірхгофа, стандартний станТермохімією називається розділ хімічної термодинаміки, в якому розглядається застосування першого закону для обчислення теплових ефектів різних фізико-хімічних процесів: хімічних реакцій, фазових переходів, процесів кристалізації, розчинення тощо. У практиці найбільш вимогливими є термохімічні розрахунки теплового ефекту хімічної реакції.
Тепловим ефектом хімічної реакції називається кількість теплоти, яка виділяється (екзотермічні реакції) або поглинається (ендотермічні реакції) при незворотному проходженні реакції, коли єдиною роботою є тільки робота розширення.
Отже, для хімічних реакцій справедливе співвідношення першого закону термодинаміки:
- δQ = dU + PdV, (6.1)
- де Q – тепловий ефект хімічної реакції;
- δA=PdV – робота, яка здійснюється системою в ході реакції.
Тепловий ефект хімічної реакції, яка проходить при постійному об´ємі, називається ізохоричним тепловим ефектом та позначається QV. Оскільки в цьому випадку PdV=0, то
- QV = U2 - U1 = ΔU. (6.2)
Отже, тепловий ефект хімічної реакції, яка проходить при постійному об´ємі, дорівнює зміні внутрішньої енергії системи.
Ізобаричний тепловий ефект реакції (QP) можна отримати проінтегрувавши рівняння (6.1):
- QP = ΔH (6.3)
Ізобаричний тепловий ефект хімічної реакції дорівнює зміні ентальпії системи.
Таким чином, ізохоричний та ізобаричний теплові ефекти дорівнюють змінам функцій стану. Отже, не залежать від шляху процесу, а визначаються тільки початковим та кінцевим станами системи. Незалежність теплових ефектів реакції від їхнього шляху встановлена російським ученим академіком Г.І.Гессом у 1840 році на підставі експериментальних даних.
Закон Гесса доводить, якщо із даних вихідних речовин можна різними шляхами отримати задані кінцеві продукти, то незалежно від шляху одержання, тобто від кількості та виду проміжних реакцій, сумарний тепловий ефект для всіх шляхів буде той самий.
Іншими словами, тепловий ефект хімічної реакції залежить тільки від виду і стану вихідних речовин та продуктів реакції і не залежить від шляху переходу.
Перевіримо зміст закону Гесса на прикладах. Оскільки найчастіше хімічні реакції проходять при постійному тиску, будемо їх тепловий ефект характеризувати зміною ентальпії ΔН. Уявимо процес перетворення вихідних речовин А1, А2, А3… у продукти В1, В2, В3…, причому це перетворення може бути здійснене різними шляхами:
- Прямою реакцією перетворення речовин А в речовини В із тепловим ефектом ΔН1.
- Реакцією, яка складається з двох стадій з тепловими ефектами ΔН2 і ΔН3.
- Сукупністю реакцій із тепловими ефектами ΔН4, ΔН5, ΔН6, ΔН7.
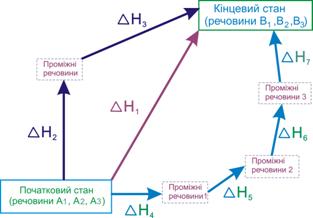
Рисунок 6.1. – Ілюстрація закону Гесса
Закон Гесса стверджує, що ці теплові ефекти зв’язані між собою співвідношенням:
- ΔН1 = ΔН2 + ΔН3 = ΔН4 + ΔН5 + ΔН6 + ΔН7.
Практичне значення закону Гесса полягає в тому, що він дозволяє обчислити теплові ефекти таких реакцій, для яких вони безпосередньо не можуть бути виміряні. Наприклад, тепловий ефект ΔНХ реакції С+1/2О2=СО неможливо обчислити безпосереднім вимірюванням, оскільки одночасно з цією реакцією завжди проходить реакція утворення СО2. Для визначення ΔНХ використовуємо теплові ефекти таких реакцій:
- СО + ½ О2 = СО2, ΔН1 = -282,98 кДж/моль,
- C + О2 = СО2, ΔН2 = -393,51 кДж/моль.
Відповідно до закону Гесса ΔН2=ΔН1+ΔНХ або ΔНХ=ΔН2-ΔН1=-393,51–(-282,98)=-110,53 кДж/моль.
Теплові ефекти хімічних реакції можуть бути виміряні й експериментально спеціальними приладами, які називаються калориметрами. Точні калориметричні вимірювання достатньо трудомісткі та потребують багато часу. Тому їх проводять тільки у випадках неможливості використання закону Гесса.
При написанні термохімічних рівнянь зазначають агрегатний стан реагентів і тепловий ефект реакції:
- С3Н6О(г) + 4О2(г) = 3СО2(г) + 3Н2О(р),
- ΔН = - 1817, 0 кДж/моль.
Такий запис означає, що в результаті реакції 1 моль газоподібного ацетону С3Н6О з 4 моль газоподібного кисню одержують 3 моль газоподібного СО2 і 3 моль рідкої води. При цьому виділяється 1817,0 кДж теплоти на 1 моль ацетону.
Оскільки теплові ефекти залежать від фізичного стану речовин, що реагують, та умов, за якими проходить реакція, то для виконання термохімічних розрахунків теплові ефекти, обчислювані в термохімічних рівняннях, повинні бути одержані за будь-яких однакових умов, у противному разі не можуть бути порівняні. Тобто такими умовами вважаються умови, за яких реакція проходить між речовинами, які перебувають у стандартних станах.
За стандартний стан окремих рідких та твердих речовин беруть їх сталий стан при температурі 298,15 К (250С) і тиску 101325 Па ( 1 атм ), а для газів – такий їх стан, коли при тиску 101325 Па й температурі 298,15 К вони підпорядковуються рівнянню стану ідеального газу. Тому теплові ефекти реакцій за стандартних умов позначають ΔН0298.
Із закону Гесса випливають висновки, які мають велике практичне значення.
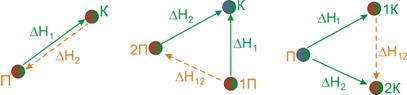
| а | б | в |
Рисунок 6.2. Ілюстрація першого (а), другого (б) та третього (в) висновків із закону Гесса
Розглянемо класичний приклад визначення теплового ефекту перетворення графіту в алмаз за стандартних умов шляхом аналізу реакцій їх горіння:
Наприклад, реакція горіння водню з утворенням одного моля води:
Отже,
- Тепловий ефект прямої реакції ΔН1 дорівнює за величиною та протилежний за знаком тепловому ефекту зворотної реакції ΔН2, тобто ΔН1 = - ΔН2 (рис. 6.2 а).
-
Якщо здійснюються дві реакції з різними початковими станами, результатом яких є однаковий кінцевий стан, то різниця між їх тепловими ефектами являє собою тепловий ефект переходу з одного початкового стану в інший (рис. 6.2 б).
- С(графіт) + О2 = СО2, ΔН1 = - 393,51 кДж/моль,
- С(алмаз) + О2 = СО2, ΔН2 = - 395,34 кДж/моль,
- С(графіт)
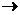 С(алмаз), ΔН12=ΔН1-ΔН2=+1,83 кДж/моль.
С(алмаз), ΔН12=ΔН1-ΔН2=+1,83 кДж/моль.
-
3. Якщо проходять дві реакції, які призводять із одного початкового стану до різних кінцевих станів, то різниця між їх тепловими ефектами є тепловим ефектом переходу із одного кінцевого стану в інший (рис.6.2 в).
- Н2 + 1/2О2 = Н2О(г), ΔН = - 241,83 кДж/моль,
- Н2 + 1/2О2 = Н2О(р), ΔН = - 285,84 кДж/моль,
- Н2 + 1/2О2 = Н2О(т) , ΔН = - 291,67 кДж/моль.
- Н2О(т) → Н2О(р), ΔН = + 5,83 кДж/моль,
- Н2О(р) → Н2О(г), ΔН = + 44,01 кДж/моль,
- Н2О(т) → Н2О(г), ΔН = + 49,84 кДж/моль.
Ми отримуємо значення ентальпій плавлення, випарювання та сублімації води.
Закон Гесса дозволяє обчислити теплові ефекти процесів, для яких відсутні експериментальні дані. Це стосується не тільки хімічних реакцій, але й процесів розчинення, випарювання, сублімації, кристалізації та ін. При термохімічних розрахунках особливо значимі два види теплових ефектів: ентальпія утворення та ентальпія окиснення сполук.
Ентальпія утворення сполуки є тепловим ефектом реакції утворення одного моля даної сполуки із простих речовин за стандартних умов. Наприклад, стандартна ентальпія утворення ΔfН карбонату кальцію – це тепловий ефект реакції
- Са(т) + С(графіт) + 1,5О2(г) = СаСО3(т), ΔfН0298 = - 1206 кДж.
При цьому ентальпія утворення простих речовин (Н2, О2, Са, С та ін.) дорівнює нулю, а ентальпії утворення більшості відомих речовин можна відшукати в довідниках.
За значною кількістю стандартних ентальпій утворення можна обчислити теплові ефекти багатьох хімічних реакцій. При цьому використовують правило, яке випливає із закону Гесса:
тепловий ефект хімічної реакції дорівнює різниці суми ентальпій утворення кінцевих речовин та суми ентальпій утворення вихідних речовин із урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Нехай хімічна реакція проходить відповідно до рівняння
- аА + bВ = сС + dD ΔН - ?
Тут а, b, с, d –коефіцієнти перед речовинами А, В, С, D. Тоді
- ΔН = (сΔfНС + dΔfНD) – ( aΔfНA + bΔfНB). (6.4)
Для наочності розглянемо конкретний приклад. Реакція горіння етану С2Н6 описується рівнянням
- С2Н6(г) + 3,5О2(г) = 2СО2(г)+3Н2О(ж),
- ΔН298 =-1559,87 кДж
Обчислити ентальпію утворення етану, якщо відомі ентальпії утворення вуглекислого газу та води:
- ΔfН298(СО2)=-393,51кДж/моль, ΔfН298(Н2О)=-285,84кДж/моль (табл. 6.1).
Відповідно до закону Гесса маємо:
- ΔН298 = 2ΔfН(СО2) + 3ΔfН(Н2О) - ΔfН(С2Н6).
Звідси ΔfН298(С2Н6) = 2ΔfН298(СО2) + 3ΔfН298(Н2О) - ΔН298 = 2(-393,51) + 3(-285,84) – ( - 1559,87) = -84,67 кДж/моль.
Ентальпія окиснення сполуки - це тепловий ефект реакції окиснення даної сполуки киснем за стандартних умов із утворенням вищих оксидів елементів, що входять до складу цієї сполуки. Наприклад, стандартна ентальпія окиснення ΔСН етилового спирту – це тепловий ефект реакції
- С2Н5ОН(ж) + 3О2 = 2СО2(г) + 3Н2О(ж).
Продуктами згоряння є СО2, Н2О(г) або Н2О(ж), SO3 та інші. Якщо серед продуктів реакції крім оксидів, наявні інші речовини (наприклад, N2, HCl), то це спеціально обумовлюється. Ентальпії згоряння вищих оксидів та інших продуктів згоряння, а також кисню слід брати за нуль. За допомогою ентальпій згоряння можна також розрахувати теплові ефекти хімічних реакцій, використовуючи таке правило:
тепловий ефект хімічної реакції дорівнює різниці суми ентальпій згоряння вихідних речовин та сумі ентальпій згоряння продуктів реакції з урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Для наведеної в даному розділі абстрактної реакції
- ΔН = (аΔСНА + вΔСНВ)-(сΔСНС + dΔСНD) (6.5)
розрахуємо тепловий ефект реакції естерифікації щавлевої кислоти метиловим спиртом, яка проходить за стандартних умов:
- (СООН)2(т) + 2СН3ОН(р) = (СООСН3)2(р) + 2Н2О(р).
У довіднику знаходимо значення стандартних ентальпій згоряння речовин:
- ΔСН[(СООН)2]= -251,8 кДж/моль,
- ΔСН[(СН3ОН)] = -727,6 кДж/моль,
- ΔСН[(СООСН3)2] = -1680,2 кДж/моль,
- ΔСН(Н2О) = 0.
Звідси ΔН298 = -251,8 + 2(-727,6) – (-1680,2) = -26,8 кДж/моль.
Розглянемо хімічну реакцію
- nN + m M = k K + d D.
Тепловий ефект цієї реакції при постійному тиску ΔН дорівнює різниці ентальпій утворення продуктів реакції та вихідних речовин:
- ΔН = [k ΔН(K) + d ΔН(D)] - [n ΔН(N) + m ΔН(M)]. (6.6)
Диференціюючи цю рівність за температурою Т, отримуємо:
-
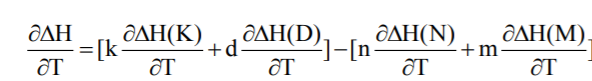
(6.7)
Враховуючи, що
- δН/δТ = СР, (6.8)
маємо:
- (δΔН/δТ)Р =[k CP(K) + d CP(D)] - [n CP(N) + m CP(M)]. (6.9)
Позначаючи ΔСР різницю теплоємностей кінцевих та вихідних речовин, що мають відповідні коефіцієнти, отримуємо:
- (δΔН/δТ)Р = ΔСР. (6.10)
Розглядаючи реакцію, що проходить при постійному об´ємі, можна аналогічним способом отримати:
- (δΔU/δT)V = ΔCV. (6.11)
Знайдені співвідношення являють собою рівняння Кірхгофа у диференціальному вигляді. Розв’яжемо перше з цих рівнянь (розв’язок обох рівнянь однаковий). Розділяємо змінні й інтегруємо за температурою:
-
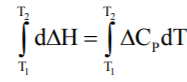
(6.12)
Отримуємо:
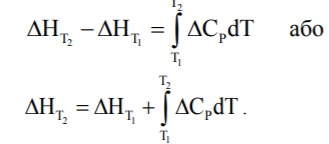
-
(6.13)
Для розрахунку– теплового ефекту при температурі Т2 – треба знати
й мати дані про теплоємності всіх учасників реакції в інтервалі температур від Т1 до Т2.
За температуру Т1 зручно взяти 298К, оскільки для цієї температури є велика кількість довідкових даних. У цьому випадку можна записати
-
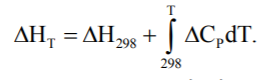
(6.14)
Отримане в інтегральному вигляді рівняння Кірхгофа дозволяє розраховувати теплові ефекти реакцій при різних температурах. Залежно від того, які дані про теплоємності є в довідковій літературі, отримане рівняння застосовують, використовуючи три наближення.
У першому, найгрубішому наближенні, припускають, що ΔСР = 0. У цьому випадку виявляється, що ΔНТ = ΔН298, тобто тепловий ефект від температури не залежить.
У другому, більш точному наближенні, вважають, що різниця теплоємностей є постійна величин - ΔСР = const. Тому отримують:
- ΔНТ = ΔН298 + ΔСp(Т – 298). (6.15)
У третьому, найточнішому наближенні, враховують залежність теплоємностей від температури. Як уже зазначалося у даному курсі найточніше залежність теплоємності від температури можна описати степеневою функцією типу
СР = а + вТ + сТ2 + с´/Т2. Якщо відомі коефіцієнти цього рівняння для всіх учасників реакції, то
- ΔСР = Δа + ΔвТ + ΔсТ2 + Δс’/Т2 , (6.16)
- де
- Δа = [k•a(K)+ d•a(D)] - [n•a(N) + m•a(M)]. (6.17)
Аналогічно розраховуються Δв, Δс та Δс´. Розв’язок рівняння Кірхгофа приводить у цьому випадку до співвідношення:
-
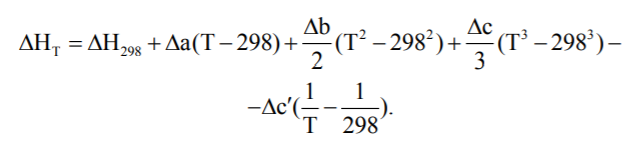 (6.18)
(6.18)
Для термохімічних розрахунків необхідні табличні данні. У табл. 6.1 наведені деякі термодинамічні властивості невеликої кількості хімічних речовин.
Таблиця 6.1 – Термодинамічні властивості речовин
|
Речовина |
ΔfН0298, кДж/моль |
S0298, Дж/мольК |
Cp0298, Дж/мольК |
Cp = f(T), Дж/мольК |
|||
|---|---|---|---|---|---|---|---|
|
а |
b×103 |
c`×10-5 |
c×106 |
||||
|
Br2(р) |
0 |
152,21 |
75,69 |
75,69 |
0 |
0 |
0 |
|
Br2(г) |
30,91 |
245,37 |
36,07 |
37,32 |
0,50 |
-1,26 |
0 |
|
C(алмаз) |
1,83 |
2,37 |
6,11 |
9,12 |
13,22 |
-6,19 |
0 |
|
C(графіт) |
0 |
5,74 |
8,54 |
16,86 |
4,77 |
-8,54 |
0 |
|
Cl2(г) |
0 |
222,98 |
33,93 |
37,03 |
0,67 |
-2,85 |
0 |
|
H2(г) |
0 |
130,52 |
28,83 |
27,28 |
3,26 |
0,50 |
0 |
|
N2(г) |
0 |
191,50 |
29,12 |
27,88 |
4,27 |
0 |
0 |
|
O2(г) |
0 |
205,04 |
29,37 |
31,46 |
3,39 |
-3,77 |
0 |
|
S(монокл) |
0,38 |
32,55 |
23,64 |
23,64 |
0 |
0 |
0 |
|
S(ромбіч) |
0 |
31,92 |
22,68 |
22,68 |
0 |
0 |
0 |
|
S2(г) |
128,37 |
228,03 |
32,51 |
36,11 |
1,09 |
-3,51 |
0 |
|
CO(г) |
-110,53 |
197,55 |
29,14 |
28,41 |
4,10 |
-0,46 |
0 |
|
CO2(г) |
-393,51 |
213,66 |
37,11 |
44,14 |
9,04 |
-8,54 |
0 |
|
COCl2(г) |
-219,50 |
283,64 |
57,76 |
67,15 |
12,03 |
-9,04 |
0 |
|
CaCO3(т) |
-1206,83 |
91,71 |
83,47 |
104,52 |
21,92 |
-25,94 |
0 |
|
CaO(т) |
-635,09 |
38,07 |
42,05 |
49,62 |
4,52 |
-6,95 |
0 |
|
Ca(OH)2(г) |
-985,12 |
83,39 |
87,49 |
105,19 |
12,01 |
-19,00 |
0 |
|
HCl(г) |
-92,31 |
186,79 |
29,14 |
26,53 |
4,60 |
1,09 |
0 |
|
H2O(т) |
-291,85 |
39,33 |
0 |
4,41 |
109,50 |
46,47 |
0 |
|
H2O(р) |
-285,83 |
69,95 |
75,30 |
39,02 |
76,64 |
11,96 |
0 |
|
H2O(г) |
-241,81 |
188,72 |
33,61 |
30,00 |
10,71 |
0,33 |
0 |
|
MgO(т) |
-601,49 |
27,07 |
37,20 |
48,98 |
3,14 |
-11,44 |
0 |
|
Mg(OH)2 (т) |
-924,66 |
63,18 |
76,99 |
46,99 |
102,85 |
0 |
0 |
|
NH3(г) |
–45,94 |
192,66 |
35,16 |
29,80 |
25,48 |
-1,67 |
0 |
|
NH4Cl(т) |
–314,22 |
95,81 |
84,10 |
0 |
0 |
0 |
0 |
|
NO(г) |
91,26 |
210,64 |
29,86 |
29,58 |
3,85 |
–0,59 |
0 |
|
NOCl(г) |
52,59 |
263,50 |
39,37 |
44,89 |
7,70 |
–6,95 |
0 |
|
NO2(г) |
34,19 |
240,06 |
36,66 |
41,16 |
11,33 |
–7,02 |
0 |
|
N2O4(г) |
11,11 |
304,35 |
79,16 |
83,89 |
39,75 |
–14,90 |
0 |
|
SO2(г) |
–296,90 |
248,07 |
39,87 |
46,19 |
7,87 |
–7,70 |
0 |
|
SO2Cl2(г) |
–363,17 |
311,29 |
77,40 |
87,91 |
16,15 |
–14,23 |
0 |
|
SO3(г) |
–395,85 |
256,69 |
50,09 |
64,98 |
11,75 |
–16,37 |
0 |
|
CH4(г) |
–74,85 |
186,27 |
35,71 |
14,32 |
74,66 |
0 |
–17,43 |
|
C2H4(г) |
52,30 |
219,45 |
43,56 |
11,32 |
122,01 |
0 |
–37,90 |
|
C2H6(г) |
–84,67 |
229,49 |
52,64 |
5,75 |
175,11 |
0 |
–57,85 |
|
C6H6(г) |
82,93 |
269,20 |
81,67 |
-21,09 |
400,12 |
0 |
-169,87 |
|
C6H12(г) |
-123,14 |
298,24 |
106,27 |
-51,71 |
598,77 |
0 |
-230,00 |
|
CH3OH(г) |
–201,00 |
239,76 |
44,13 |
15,28 |
105,20 |
0 |
–31,04 |
|
CH3CHO(г) |
–166,00 |
264,20 |
54,64 |
13,00 |
153,50 |
0 |
–53,70 |
|
C2H5OH(г) |
–234,80 |
281,38 |
65,75 |
10,99 |
204,70 |
0 |
–74,20 |
|
C2H5OH(р) |
–276,98 |
160,67 |
111,96 |
0 |
0 |
0 |
0 |
Розрахунки за формулою 6.18 розглянемо на прикладі реакції С6Н6(г) + 3 Н2 = С6Н12(г) для Т=800К.
Спочатку обчислимо ΔНо298. Для проведення розрахунку необхідно взяти в табл. 2.1 ентальпії утворення всіх речовин та підставити їх у формулу 6.4.
- ΔНо298= ΔfHo298(C6H12) – [ΔfHo298(C6H6) + 3ΔfHo298(H2)] = - 123,14–(82,93+3·0) = -206,07 кДж/моль = -206070 Дж/моль.
Інтегральне рівняння Кірхгофа для температури 800 К має вигляд:
- ΔН800 = ΔНо298 + Δа(800 – 298) + Δв/2(8002-2982) + Δс/3(8003-2983) – Δс’(1/800 – 1/298).
Δа, Δв, Δс и Δс’ необхідно розраховувати по закону Гесса, тобто із значення відповідної величини для продукту реакції потрібно відняти значення цієї величини для вихідної речовини. Дані для такого розрахунку необхідно брати в табл.2.1 Наприклад, розрахунок Δа проводять так:
- Δа = а(С6Н12) - [а(С6Н6) + 3 а(Н2)] =-51,71 – [-21,09 + 3·27,28] =-112,46 Дж/мольК.
При розрахунку Δв, Δс, Δс’ зверніть увагу, що в табл.6.1 значення в, с и с’ помножені на величину 10-х (10+х ). Дійсні же значення цих величин повинні бути помножені на 10+х(10-х).
Результати розрахунків:
|
Δа |
Δв |
Δс' |
Δc |
ΔН800, Дж/моль |
|---|---|---|---|---|
|
-112,46 |
188,87•10-3 |
-1,50•105 |
-60,13•10-6 |
-220520 |



