- 9.1 Поняття про адсорбцію
- 9.2 Поверхневі процеси при адсорбції
- Мономолекулярна адсорбція. Ізотерма адсорбції Ленгмюра
- 9.3 Полімолекулярна адсорбція
- 9.4 Енергетичні параметри адсорбції на однорідній поверхні
- 9.5 Взаємодія частинок в адсорбційному шарі та класифікація ізотерм адсорбції
- Адсорбція на межі поділу тверде тіло-розчин
- Значення процесів адсорбції в житті та техниці
Ключові терміни:
адсорбатом, адсорбенто, адсорбція, рівняння Фрейндліха, теорія Ленгмюра, ізотермами адсорбціїБудь-які гетерогенні процеси, наприклад, розкладання або утворення хімічної сполуки, розчинення твердих тіл, газів або рідин, випаровування, сублімація тощо, а також інші процеси відбуваються за наявності поверхонь розподілу фаз (тверде тіло - газ, тверде тіло - рідина, газ - рідина). Стан речовини біля поверхні розподілу фаз, що стикаються, відрізняється від її стану всередині них внаслідок різниці молекулярних взаємодій у різних фазах. Ці відмінності спричиняють особливі поверхневі явища на межі розподілу фаз.
Уявімо собі поверхню твердого тіла на межі з газом. Усередині твердого тіла частинки (атоми, іони або молекули), які утворюють його ґратку, правильно чергуються відповідно до кристалічної структури, причому їх взаємодії урівноважені. Стан частинки, яка перебуває на поверхні, інший - взаємодії таких частинок не урівноважені, тому поверхня твердого тіла притягує молекули речовини з сусідньої газової фази. У результаті концентрація речовини на поверхні стає більшою за концентрацію в об’ємі газу, який адсорбується поверхнею твердого тіла.
Таким чином, адсорбція – це концентрування речовини на поверхні розподілу фаз. Речовина, на поверхні якої відбувається адсорбція, називається адсорбентом, а речовина, що поглинається з об’ємної фази - адсорбатом.
Адсорбент поглинає з об’ємної фази тим більше речовини, чим більше розвинута його поверхня. Поверхню, що припадає на 1 г адсорбенту, називають питомою. Її величина в різних адсорбентів може бути різною. Непористі тіла мають питому поверхню від декількох м2/г до сотен м2/г. Велике збільшення поверхні пов’язане з наявністю у твердому тілі вузьких пор. Прикладами таких високодисперсних пористих тіл із питомою поверхнею до декількох тисяч м2/г є активоване вугілля та силікагель.
Кількісно адсорбція може бути виражена за допомогою декількох величин:
- величиною а, яка є кількістю адсорбату, що міститься в об’ємі адсорбційного шару, який відповідає одиниці маси адсорбенту (моль/г);
- величиною Г, яка є надлишком числа молів адсорбату в об’ємі поверхневого шару площиною 1 см2 у порівнянні до числа його молів у тому самому об’ємі, якщо на міжфазовій межі не відбувається зміна концентрації адсорбату (Г > 0 - адсорбція, Г < 0 - десорбція).
Розрізняють фізичну та хімічну адсорбції. У першому випадку адсорбційні сили мають таку саму природу, що й міжмолекулярні сили. Фізична адсорбція завжди оборотна. За хімічної адсорбції адсорбційні сили мають хімічну природу. Хемосорбція звичайно є необоротною. За хімічної адсорбцієї молекули адсорбату, які пов’язані з адсорбентом міцними хімічними зв’язками, не можуть переміщатися поверхнею адсорбенту. Це випадок локалізованої адсорбції. На відміну від цього за фізичної адсорбції можуть бути як нелокалізована адсорбція, коли молекули адсорбату здатні переміщатися по поверхні адсорбенту, так і локалізована. Локалізована фізична адсорбція пояснюється тим, що поверхня адсорбенту складається з різних атомів, іонів або молекул, які по-різному взаємодіють із молекулами адсорбату. Тобто, для переміщення по поверхні молекулам адсорбату необхідно подолати різні потенціальні бар’єри, що не завжди можливо.
Фізична адсорбція проходить спонтанно з виділенням енергії. Адсорбат прагне зайняти всю поверхню адсорбенту, але цьому заважає процес, протилежний адсорбції, - десорбція, що викликаний прагненням до рівномірного розподілу речовини. Для кожної концентрації адсорбату в навколишньому середовищі існує стан адсорбційної рівноваги, аналогічний до стану рівноваги між випаровуванням та конденсацією. Зрозуміло, що чим вища концентрація адсорбату, тим більша адсорбція, а чим вища температура, тим менша фізична адсорбція. Для кожної температури існує своя адсорбційна рівновага.
Адсорбцію характеризують залежністю кількості адсорбованої речовини a від концентрації (або рівноважного тиску). Графіки а = f(c) або а = f(р) при Т = const називають ізотермами адсорбції. Вигляд звичайної ізотерми наведений на рис.9.1.
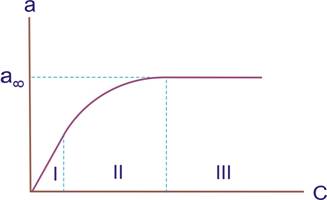
Рис. 9.1. Типовий вигляд ізотерми адсорбції
Вона має три характерні ділянки. Початкова, яка стрімко піднімається вгору майже прямолінійною ділянкою, показує, що за невеликих концентрацій адсорбція пропорційна концентрації. Це область, у якій виконується закон Генрі: а = К × с, де К - константа Генрі, яка не залeжить від концентрації с. В області I поверхня адсорбенту більш вільна.
Майже горизонтальна ділянка III відповідає великим концентраціям і поверхні адсорбенту, яка повністю насичена адсорбатом. За цих умов, якщо на поверхні утворюється лише мономолекулярний шар адсорбату, кількість його практично не залежить від концентрації. Середня ділянка II кривої відповідає проміжним ступеням заповнення поверхні.
Важливою задачею теорії адсорбції є виведення рівняння ізотерми адсорбції. На даний час ця задача ще далека від розв´язання. Для опису ізотерми адсорбції запропонована низка емпіричних формул. Найбільш відомою з яких є формула Фрейндліха:
- а = х/m = β× c1/n, (9.1)
- де х - кількість адсорбованої речовини, моль; m - маса адсорбенту; с - рівноважна концентрація; β і 1/n - константи. Константи β і 1/n рівняння Фрейндліха легко визначити графічним методом за ізотермою, що побудована в логарифмічних координатах:
- ln а = ln β + 1/n ln C. (9.2)
Це рівняння прямої. Тангенс кута нахилу цієї прямої дорівнює 1/n, а відрізок, що відсікається прямою на осі ординат, дорівнює lnβ. Значення константи β звичайно коливаються в широких межах. Фізичний зміст її буде зрозумілим, якщо припустити, що С = 1, тоді β є величиною адсорбції при рівноважній концентрації адсорбату 1 моль/л. Показник 1/n береться постійним, що перебуває у межах 0,2-1,0 для адсорбції з газового середовища і 0,1-0,5 для адсорбції з розчинів. Тому рівняння Фрейндліха придатне лише для концентрацій, менших за 0,5 моль/л.
9.2 Поверхневі процеси при адсорбції
Термодинамічні умови протікання адсорбції. Поверхневий натяг Термодинамічна умова протікання адсорбції DG<0. Процес супроводжується зменшенням поверхневої енергії і протікає до встановлення адсорбційної рівноваги, що має динамічний характер. При цьому швидкість процесу адсорбції стає рівною швидкості процесу десорбції. Адсорбційні процеси мають малу енергію активації і протікають з великою швидкістю. Адсорбція – це процес, що має вибірковий характер. Розглянемо систему «рідина (фаза 1) – газ (фаза 2)», що зображена на рис. 2.
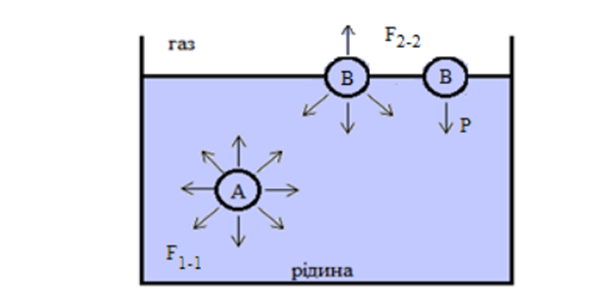
Рисунок 2 Схема механізму винекнення надлишкової енергії
Сили міжмолекулярної взаємодії у рідині F1-1 більше сил взаємодії між молекулами газу F2-2. Молекула А у внутрішньому шарі рідини оточена з усіх боків іншими молекулами. Сили взаємодії при цьому взаємно урівноважуються. На молекулу В, що знаходиться на міжфазній поверхні, з одного боку діють молекули рідини, а з іншого – молекули газу. Оскільки F1-1 > F2-2, виникає результуюча сила Р, що спрямована у глибину рідинного шару, та пропорційна різниці (F1-1 – F2-2). Цю силу називають внутрішнім тиском і це дуже велика величина, наприклад, Р= 1400атм
Таким чином, молекули, що знаходяться у поверхневому шарі, є «особливими» з точки зору енергетичного стану. Доля «особливих» молекул зростає із зменшенням розміру частинок. Надлишок поверхневої енергії, що припадає на 1 м2 міжфазної поверхні, має назву поверхневого натягу (σ). Це одна з найважливіших характеристик поверхні. Одиниці виміру цієї величини: Дж/м2 = Н/м.
Поверхневий натяг дорівнює термодинамічній зворотній ізотермічній роботі, яку необхідно виконати для збільшення площі міжфазної поверхні на одиницю:
- (1.1)
- [TEX]\sigma =\frac{dG}{dS} [/TEX]
Фактори, що впливають на поверхневий натяг. Залежність поверхневого натягу від температури. Поверхневий натяг окремих речовин на границі із газом знижується з підвищенням температури При цьому температурний коефіцієнт має практично постійне від’ємне значення безпосередньо до температури, що наближується до критичної. При критичній температурі зникає відмінність у фазах, що межують, і поверхневий натяг дорівнює нулю. Для більшості неполярних рідин температурна залежність поверхневого натягу лінійна
Самочинні процеси у поверхневому шарі. Згідно з основними законами термодинаміки самочинно протікають лише процеси, що призводять до зменшення вільної енергії системи
dG= dS × ds
Умовами самочинного перебігу ізохорно-ізотермічного або ізобарноізотермічного процесу буде зменшення енергії Гіббса за рахунок зменшення площини міжфазної поверхні або поверхневого натягу. Звідси спостерігаємо такі процеси , що відбуваються самочинно:
– прагнення краплин рідини або бульбашок газу прийняти сферичну форму (сферичні частинки мають найменшу форму);
– злипання твердих частинок дисперсної фази (коагуляція);
– злипання крапель у емульсіях або бульбашок газів у пінах (коалесценція);
– ріст кристалів.
Якщо площа міжфазної поверхні залишається сталою ( S = const ; dS = 0 ), вимога виконується за рахунок зменшення поверхневого натягу ( ds < 0 ), що може бути обумовлено процесом адсорбції.
Змочування
Змочування – це поверхневе явище, що полягає у взаємодії рідини з твердим тілом або іншим рідким тілом при одночасному контакті трьох фаз, що не змішуються, одна з яких є газ (повітря). Явище змочування обумовлене величиною міжфазної вільної енергії і співвідношенням сил когезії та адгезії, діючих між фазами. Когезія – це сила притягання між однаковими молекулами фази. Адгезія – це сила, що діє між молекулами, які знаходяться в різних фазах. Якщо молекули рідини взаємодіють з молекулами твердого тіла сильніше, ніж між собою, то переважає сила адгезії і рідина розтікається по поверхні твердого тіла, тобто змочує його. Якщо ж молекули рідини взаємодіють одна з одною сильніше, ніж з молекулами твердого тіла, то переважає сила когезії і рідина не розтікається по поверхні твердого тіла.
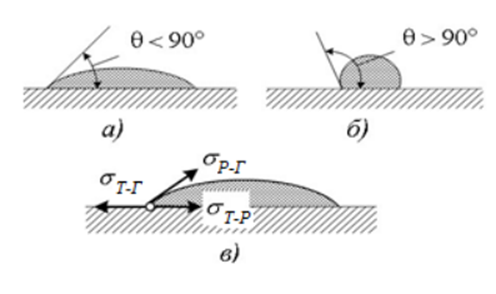
Рисунок 3. Залежність крайового кута змочування від поверхневих сил на межі поділу фаз.
На крайовий кут змочування впливає хімічна природа рідини, природа і структура поверхні твердого тіла, наявність тонких оксидних плівок на його поверхні, домішок, які забруднюють поверхню тощо.
Поверхнево- активні речовини ПАР
При введенні у розчин деяких речовин поверхневий натяг розчину змінюється. Речовини, що знижують поверхневий натяг розчинника, називаються поверхнево-активними речовинами. Вони характеризуються малою розчинністю. Поверхневий натяг у поверхнево-активних речовин менше, ніж поверхневий натяг розчинника. Внаслідок цього взаємодія між молекулами поверхнево-активних речовин і розчинника завжди менша за взаємодію між молекулами розчинника. Через це молекули поверхневоактивних речовин будуть виштовхуватись із об'єму розчину на його поверхню. В результаті накопичення на поверхні розчинника слабко взаємодіючих між собою молекул поверхнево-активних речовин у поверхневому шарі зменшується міжмолекулярна взаємодія і поверхневий натяг рідини також зменшується.
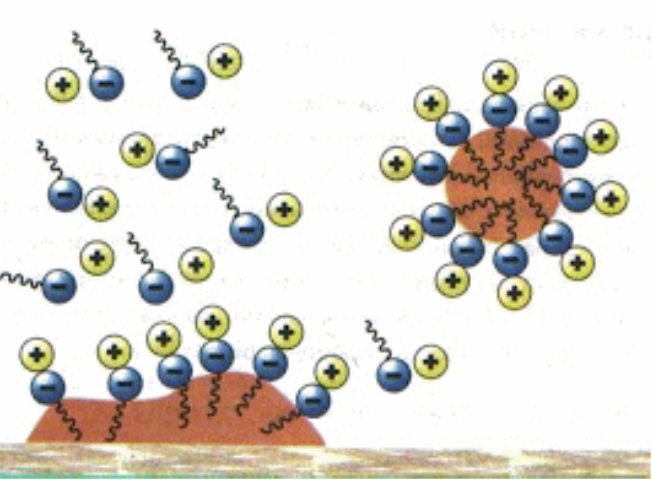
Молекули поверхнево-активних речовин складаються з двох частин:
- – полярної групи ( – СООН, – ОН, – NH2, – SH, – CN, – NCS, – SO3H), яка має великий дипольний момент;
- – неполярного вуглеводневого радикала.
Довжина вуглеводневого радикала значно впливає на поверхневу активність молекул. Дюкло, а пізніше Траубе, вивчаючи поверхневий натяг водних розчинів гомологічного ряду граничних жирних кислот, встановили, що поверхнева активність цих речовин на межі поділу розчин-повітря тим вища, чим більша довжина вуглеводневого радикала. В середньому поверхнева активність кислоти збільшується у 3,2 рази на кожну групу – СН2. Наприклад, поверхнева активність жирної кислоти при збільшенні довжини її вуглеводневого радикалу на групу –СН2–СН2–СН2 зросте у (3,2 )3 = 32,7 раз, оскільки ланцюг збільшується на 3 групи – СН2. Причина залежності, встановленої Дюкло і Траубе, криється в тому, що із збільшенням довжини вуглеводневого радикала зменшується розчинність жирної кислоти. Внаслідок цього молекули кислоти намагаються перейти з об’єму в поверхневий шар. Правило Дюкло-Траубе справедливе для водних розчинів при кімнатній температурі. При високих температурах величина 3,2 зменшується, наближаючись до одиниці. Це пов'язано з десорбцією молекул і зниженням поверхневої активності розчинів.
ПАР – поверхнево активні речовини – мила, пральні порошки – це речовини, що зменшують поверхневий натяг.
Мономолекулярна адсорбція. Ізотерма адсорбції Ленгмюра
Фундаментальним внеском у вчення про адсорбцію є теорія Ленгмюра. Ця теорія дозволяє враховувати найбільші відхилення від закону Генрі, пов’язані з обмеженістю поверхні адсорбенту. Ця обставина приводить до адсорбційного насичення поверхні адсорбенту в міру збільшення концентрації адсорбованої речовини. Це положення є основним у теорії Ленгмюра та уточнюється такими припущеннями:
- адсорбція локалізована на деяких адсорбційних центрах, кожен із яких взаємодіє тільки з однією молекулою адсорбату;
- адсорбційні центри енергетично еквівалентні;
- адсорбовані молекули не взаємодіють одна з одною.
Для виведення ізотерми адсорбції Ленгмюра врахуємо, що із встановленням у системі адсорбційної рівноваги швидкість адсорбції (V¯) повинна дорівнювати швидкості десорбції (V). Для того, щоб молекула адсорбувалася, вона повинна стикнутися з поверхнею і потрапити на незайняте місце. Враховуючи, що кількість ударів пропорційна концентрації С, а ймовірність потрапити на незайняте місце пропорційна їх кількості, маємо
- V↓ = k1 C (1-Θ), (9.3)
- де Θ - частка зайнятих місць; k1 - константа швидкості адсорбції. Швидкість десорбції прямо пропорційна кількості адсорбованих молекул:
- V↑ = k2Θ, (9.4)
- де k2 - константа швидкості десорбції.
- При рівновазі V↑ = V↓ і
- k1с(1-Θ) = k2Θ.
- Звідси
-
, (9.5)
- де K = k1/k2 - константа адсорбційної рівноваги.
Позначимо символом а∞ максимальну адсорбцію або ємність адсорбційного моношару. Тоді
- Θ = а / а∞ . (9.6)
Отже,
-
. (9.7)
Це рівняння має назву ізотерми адсорбції Ленгмюра. Для газів і парів концентрацію можна замінити пропорційним їй значенням тиску та ізотерма адсорбції набуде вигляду
-
. (9.8)

Константи адсорбційної рівноваги К характеризують енергію взаємодії адсорбату з адсорбентом. Чим сильніша ця взаємодія, тим більше значення константи адсорбційної рівноваги.
Важливими є екстраполяційні наслідки рівняння ізотерми Ленгмюра. При С -> 0 маємо а = а∞×К×с і Θ =К×с. Ці вирази відповідають закону Генрі: величина адсорбції лінійно зростає зі збільшенням концентрації. Таким чином, рівняння Ленгмюра є більш загальним співвідношенням, яке вміщує і рівняння Генрі.
При великих концентраціях, коли К•c >> 1,
- а = а∞ і Θ = 1.
Ці співвідношення відповідають насиченню, коли вся поверхня адсорбенту покривається мономолекулярним шаром адсорбату.
Експериментальні результати за визначенням ізотерми адсорбції звичайно обробляють за допомогою рівняння Ленгмюра, яке записане в лінійній формі:
-
. (9.9)
Методика знаходження коефіцієнтів рівняння Ленгмюра наведена на рис. 9.2.
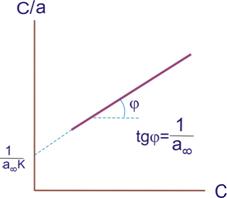
Рисунок 9.2. До знаходження констант рівняння Ленгмюра
9.3 Полімолекулярна адсорбція
Досвід показує, що поряд з ізотермами адсорбції, які описуються рівнянням Ленгмюра та про які ми говорили, часто спостерігаються ізотерми, які не мають ділянки, паралельної осі тисків, та які відповідають насиченню поверхні адсорбенту молекулами адсорбату. Така ізотерма наведена на рис.9.3.
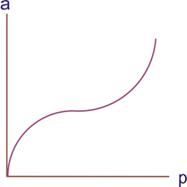
Рисунок 9.3. Ізотерма полімолекулярної адсорбції
Найбільш вдала теорія (із багатьох), що описує подібні процеси, була створена в 1935-1940 рр. Брунауером, Емметом, Теллером стосовно адсорбції парів. Їх теорія отримала назву теорії БЕТ. Її основі положення:
- Адсорбційні шари полімолекулярні, причому їх товщина на різних ділянках поверхні різна.
- Адсорбційні сили тотожні силам, які спричиняють конденсацію.
Останнє положення може бути обґрунтовано так: лише перший шар молекул адсорбату перебуває в безпосередній близькості до поверхні твердого тіла. Другий і особливо останні шари прилягають до молекул, подібних до них, і їх утворення нагадує звичайну конденсацію пари на поверхні рідини.
На основі цих уявлень Брунауер, Еммет і Теллер вивели такі рівняння ізотерми адсорбції парів:
-
, (9.10)
- де Кп - константа рівноваги полімолекулярної адсорбції; p-тиск пари; ps - тиск насиченої пари за даною температурою; a∞ - ємність моношару.
За умови низьких тисків, коли p/ps << 1, ураховуючи, що Кр = Кп×1/ps, отримуємо рівняння Ленгмюра:
-
. (9.11)
Рівняння ізотерми полімолекулярної адсорбції БЕТ легко звести до лінійної форми:
-
. (9.12)
За нахилом цієї прямої та відрізка, що відсікається цією прямою на осі ординат, можна відшукати значення констант а∞ і Кп.
Теорія БЕТ – так само, як і теорія Ленгмюра – вказує шлях для визначення питомої поверхні адсорбенту (будь-якої твердої речовини). Для цього відшукують ємність моношару а∞ для парів простих речовин (N2, Ar, Kr) за умови низьких температур. Потім, знаючи площу S0, яку займає одна молекула простої речовини, обчислюють питому поверхню адсорбенту:
- Sпит = а∞ × Na × S0, (9.13)
- де Na - число Авогадро. Це метод визначення питомої поверхні за БЕТ.
Між енергією Гіббса, ентальпією та ентропією адсорбції існує відоме співвідношення:
- ΔТ = ΔН - ТΔS.
Адсорбція - спонтанний процес, а будь-якому спонтанному процесу при р,Т = const відповідає умова ΔG < 0. Ентропія також зменшується (ΔS < 0), оскільки при адсорбції обмежується свобода руху молекул: в об’ємній фазі рухаються за трьома напрямками, а на поверхні - за двома. З наведеного рівняння випливає, що ентальпія адсорбції повинна мати той самий знак, тобто Δ Н < 0. Таким чином, адсорбція - екзотермічний процес.
Якщо адсорбція підпорядковується рівнянням Генрі та Ленгмюра, тобто константа рівноваги адсорбції в цих рівняннях не залежить від ступеня заповнення поверхні, то стандартна енергія Гіббса адсорбції може бути розрахована за рівнянням, справедливим для хімічних реакцій:
- ΔG0 = - RT lnK.
Ентальпію адсорбції визначають із експериментальної залежності константи рівноваги адсорбції від температури відповідно до рівняння ізобари Вант-Гоффа
-
.
Беручи до уваги слабку залежність змінення ентальпії від температури, відшукуємо
Тангенс кута нахилу прямої lnK - 1/T дорівнює -ΔH0/R, звідки легко визначити ΔH0.
Ентропію адсорбції, яка підпорядковується закону Генрі або рівнянню Ленгмюра, легко визначити, якщо відомі ΔН0 та ΔG0 , за рівнянням
-
.
Наведені співвідношення для розрахунку енергетичних параметрів адсорбції отримані, виходячи з припущення, що поверхня адсорбенту однорідна (еквіпотенціальна) і на ній утворюється мономолекулярний шар адсорбату.
Якщо адсорбція відбувається на неоднорідній поверхні, то найбільш реакційноздатні адсорбційні центри будуть зайняті вже при малих рівноважних концентраціях. Таким чином, енергетичні параметри адсорбції залежать від ступеня заповнення поверхні адсорбатом. Наприклад, диференціальна теплота адсорбції буде зменшуватися в міру заповнення поверхні.
Одним із опорних пунктів теорії Ленгмюра є констатація відсутності взаємодії частинок адсорбату в адсорбційному шарі. Однак ленгмюровська адсорбція є лише окремим випадком у різноманітному світі адсорбційних процесів. На рис. 9.4 наведені різні форми ізотерм адсорбції з розбавлених розчинів.
Виходячи з форми початкової ділянки, були виділені чотири характерних класи ізотерм (S, L, H, C). Розподіл ізотерм на окремі типи в кожному класі пов’язаний із подальшою зміною їх форми при більш високих концентраціях. Клас L (клас Ленгмюра) є найбільш загальним. Ізотерми типу L2 досягають насичення, подальша адсорбція, вища за цей рівень, дає ізотерму типу L3. Якщо досягається друге плато – то маємо справу з ізотермою L4. Для ізотерм типу L5 характерна наявність максимуму. Максимум відображає змінення стану речовини в розчині - наприклад, асоціацію молекул при визначеній концентрації. Подібний, хоча й не такий повний, набір типів ізотерм отриманий і для інших класів.
Початкова ділянка ізотерм S-класу вигнута відносно осі концентрацій, однак надалі часто іде точка перегину, що і надає ізотермі характерну S-подібну форму.
Ізотерми класу Н (висока спорідненість - high) спостерігається за найсильнішої адсорбції при дуже низьких концентраціях; вони перетинаються з віссю ординат. Ізотерми класу С (constant) мають початкову лінійну ділянку, що вказує на сталий розподіл розчиненої речовини між розчином і адсорбентом (стала швидкість адсорбції).
Теоретичний аналіз різних типів ізотерм адсорбції дозволяє отримати багато корисної інформації про механізм адсорбції. При цьому слід брати до уваги величину енергії активації процесу видалення молекул адсорбату з поверхні адсорбенту. Якщо взаємодія між адсорбованими молекулами дуже мала, енергія активації не залежить від ступеня заповнення поверхні, а це призведе до ізотерми типу L або Н.
Якщо сила взаємодії між адсорбованими молекулами більша від сили взаємодії між розчиненою речовиною й адсорбентом, енергія активації підвищується й адсорбція описується ізотермою типу S. У цьому випадку молекули розчиненої речовини прагнуть розміститися на поверхні у вигляді ланцюгів.
Ізотерми типу Н спостерігаються в тих випадках, коли проходить хемосорбція.
Ізотерма типу С є характерною для адсорбції на мікропористих адсорбентах і відповідає таким умовам, за яких кількість адсорбційних центрів залишається постійною в широкій області концентрацій. У міру заповнення одних центрів з'являються нові, і доступна для адсорбції поверхня збільшується пропорційно кількості адсорбованої речовини.
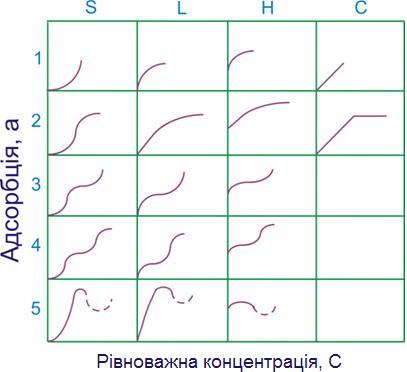
Рисунок 9.4. Форми ізотерм адсорбції
Адсорбція на межі поділу тверде тіло-розчин
Адсорбція на межі поділу тверде тіло-розчин має багато загального з адсорбцією на межі поділу тверде тіло-газ. Одночасно вона значно ускладнюється наявністю розчинника, молекули якого можуть адсорбуватись на поверхні адсорбенту, а також взаємодією молекул адсорбтиву з молекулами розчинника. У системі тверде тіло-розчин може відбуватись молекулярна і іонна адсорбція.
Молекулярна адсорбція з розчинів
Якщо розчинена речовина не є електролітом, то на поверхні твердого тіла адсорбуються її молекули. Одночасно з розчиненою речовиною на межі поділу адсорбуються молекули розчинника. Його адсорбція залежить від поверхневого натягу рідини. Чим більше поверхневий натяг рідини, тим менше адсорбуються її молекули і легше йде адсорбція розчиненої речовини. На адсорбцію з розчинів впливають властивості твердого адсорбенту, зокрема пористість і полярність. Вплив пористості адсорбенту на величину адсорбції залежить від співвідношення розмірів пор адсорбенту і розмірів молекул адсорбтиву. При збільшенні пористості адсорбенту адсорбція малих молекул адсорбтиву з розчину зростає. Дрібнопористі адсорбенти характеризуються вибірковою адсорбцією. Із збільшенням розмірів молекул адсорбтиву адсорбція на дрібнопористих адсорбентах зменшується. Вивчаючи взаємний вплив полярності адсорбенту, адсорбтиву і розчинника, Ребіндер сформулював правило вирівнювання полярностей.
Із полярних розчинників на полярному адсорбенті легше всього адсорбується речовина, яка зрівнює полярності двох фаз, що дотичні між собою. На полярних адсорбентах легше адсорбуються полярні речовини. Неполярні адсорбенти краще адсорбують неполярні адсорбтиви. Якщо дисперсна фаза і дисперсійне середовище значно різняться за полярністю, то взаємодія між ними незначна, а поверхнева енергія – велика. Це створює сприятливі умови для адсорбції саме розчиненої речовини. Чим більша вільна поверхнева енергія на межі поділу, тим більша вірогідність її зниження за рахунок адсорбції розчиненої речовини, яка має проміжну полярність.
Залежність молекулярної адсорбції з розчинів від концентрації адсорбтиву характеризується звичайними ізотермами адсорбції. У випадку розбавлених розчинів адсорбція добре описується рівнянням Ленгмюра. Кількість речовини, адсорбованої з розчину 1г адсорбенту, можна розрахувати за рівнянням Ленгмюра-Фрейндліха
- (1.1)
- де х - невідоме
- (1.1)[TEX]Г=\frac{(С_{0}-С)\cdot V}{1000\cdot m} [/TEX]
де С0 і С – відповідно початкова концентрація розчину і концентрація розчину після встановлення адсорбційної рівноваги, моль/л; V – об'єм розчину, з якого відбувається адсорбція, мл; m – маса адсорбенту, г.
На величину молекулярної адсорбції з розчинів впливає також температура. Із збільшенням температури адсорбція з розчинів зменшується, але в меншій мірі, ніж адсорбція газів. Якщо розчинена речовина відноситься до важкорозчинних, то при збільшенні температури розчинність речовини зростає. Як наслідок цього, буде збільшуватись концентрація розчину і відповідно зростатиме величина адсорбції.
Іонна адсорбція з розчинів
Якщо розчинена речовина є електролітом, то на поверхні твердого тіла адсорбуються іони, тобто відбувається іонна адсорбція, яку ще називають полярною. На адсорбцію іонів суттєво впливає природа адсорбенту. Іони, здатні поляризуватись, адсорбуються тільки на поверхні, яка складається з полярних молекул або іонів. Мікрочастинки поверхні, які несуть певний заряд, адсорбують протилежно заряджені іони. Адсорбція іонів має чітко виражений вибірковий характер. Тверда поверхня переважно адсорбує ті з іонів, які мають з поверхнею загальне атомне угрупування. Адсорбція іонів залежить від їх радіусу. При однаковому заряді максимальну адсорбційну спроможність мають іони найбільшого радіусу. Причина цього явища криється в тому, що такі іони в більшій мірі поляризуються, в меншій мірі протікає гідратація іонів. Гідратація іонів перешкоджає їх адсорбції, так як наявність гідратних оболонок зменшує електростатичну взаємодію. Іони розташуються по збільшенню до здатності адсорбуватись по монотропним рядам, або по рядам Гофмейстера:
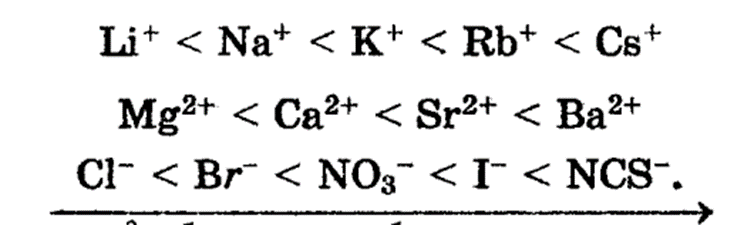
Значення процесів адсорбції в житті та техниці
Адсорбційні процеси широко використовуються з метою розподілу сумішей різних речовин. Вони лежать в основі хроматографічного методу аналізу (М. С. Цвєт, 1903р). Хроматографія – це фізико-хімічний метод розподілу суміші речовин, заснований на різному розподілі компонентів між двома фазами, одна з яких нерухома, а інша являє собою рухливий потік, що фільтрується через нерухому фазу. Як нерухома фаза можуть використовуватися адсорбенти, поміщені в адсорбційні колони або нанесені у вигляді тонкого шару на скляні пластинки, а також спеціальний хроматографічний папір. Відповідно розрізняють колоночну, тонкошарову й паперову хроматографію. Розподіл компонентів може відбуватися за різними ознаками: здатності вибірково адсорбуватися на даному адсорбенті, здатності до іонного обміну, різному розподілі між двома рідинами, які не змішуються. Ці різновиди хроматографічного методу називають адсорбційною, іонообмінною і розподільною хроматографією.
При адсорбційній хроматографії в процесі пропускання суміші через адсорбент речовини розташовуються в послідовності, обумовленою їхньою здатністю до адсорбції. У верхньому шарі розташовується найбільше легко адсорбуюча речовина й далі по зменшенню здатності до адсорбції. Пропускаючи через адсорбент розчинник, можна послідовно вимивати компоненти суміші.
При іонообмінній хроматографії адсорбентами служать іонообмінні смоли. У верхній частині обмінюються найбільше адсорбуємі іони, потім менш інтенсивно адсорбуємі і т.д., в результаті чого відбувається поступове виділення іонів з розчину.
У методі розподільної хроматографії використовується різний розподіл речовин між рідинами, що не змішуються. Наприклад, якщо суміш речовин, що значно відрізняються між собою за розчинністю у воді й бензолі, неодноразово обробляти сумішшю цих рідин, то можна практично повно розділити речовини. Одним з варіантів розподільної хроматографії є газорідинна хроматографія. У цьому випадку твердий адсорбент (активоване вугілля, целіт і ін.) пропитують нелетучою рідиною (гліцерин, поліетиленгліколь, ланолін) настільки, щоб він залишався на дотик сухим і легко продувався газом. Адсорбент поміщують у колону і через неї продувають який-небудь газ (азот, аргон і ін.), до якого додана розподіляєма суміш речовин також у вигляді газу або пари. Розподіл речовин відбувається внаслідок різної адсорбційної здатності компонентів. Для проведення хроматографічного аналізу широко використовуються прилади-хроматографи, які дозволяють автоматизувати процес і забезпечують швидкий і чіткий розподіл компонентів. Хроматографічний аналіз разом з іншими фізичними й хімічними методами зараз дуже широко застосовується в біології та медицині. Він дозволяє розділяти складні суміші амінокислот, нуклеїнових основ, вуглеводів і ін. Хроматографічний аналіз також використовується для встановлення первинної структури білків, нуклеінових кислот, полісахаридів, кількісного визначення вітамінів, гормонів та інших біологічно активних сполук. Адсорбція газів на твердих поверхнях використовується в деяких галузях харчової промисловості, а саме масложирової (наприклад, у виробництві маргарину) і в бродильної (наприклад, у виробництві дріжджів) для очищення технологічних газових потоків з метою запобігання викидів шкідливих речовин в атмосферу. Поглинання парів води відбувається на пористих речовинах, які виконують роль твердого адсорбенту. Подібні процеси спостерігаються щодо цукру, солі і сухарів.
Адсорбційний спосіб регулювання газового складу сховищ швидкопсувних продуктів дозволяє в кілька разів скоротити втрати і збільшити терміни зберігання.
Адсорбція різних харчових кислот, лимонної зокрема, знижує в порівнянні з водою поверхневий натяг більшості прохолодних напоїв.
Адсорбція речовин на поверхні розділу рідина - газ сприяє стійкості пін. Подібний процес має місце в бродильної промисловості при виробництві дріжджів і деяких інших напівпродуктів.
Посилення змочування водою різних поверхонь широко використовується в промисловості як супутнього процесу при митті обладнання, підготовці сировини, обробці напівфабрикатів тощо.



