- Загальні уявлення про дисперсні системи
- Отримання і очишення колоїдних розчинів
- 10.3 Оптичні властивості колоїдних систем
- 10.4 Міцелярна теорія будови колоїдної системи
- 10.5 Стійкіть і коагуляція колоїдних систем
- 10.6 Коагуляція дисперсних систем
- 10.7 Захист колоїдних частинок
Загальні уявлення про дисперсні системи
Хімічна взаємодія в гомогенних реакцій відбувається при ефективних зіткненнях активних частинок, а в гетерогенних - на поверхні розділу фаз при контакті реагуючих речовин, причому, швидкість і механізм реакції залежать від площі поверхні, яка тим більше, чим сильніше розвинена поверхня. З цієї точки зору особливий інтерес представляють дисперсні системи, що володіють високою питомою поверхнею.
Дисперсна система - це суміш, що складається як мінімум з двох речовин, які не реагують один з одним хімічно і мають практично повну взаємну нерозчинність.
Дисперсна система, це система в якій дуже подрібнені частинки однієї речовини рівномірно розподілені в об'ємі іншої.
Розглядаючи дисперсні системи, розрізняють два поняття: дисперсна фаза і дисперсійне середовище (рис. 10.1).
Дисперсна фаза - це сукупність часток диспергованої до дрібних розмірів речовини, рівномірно розподілених в об'ємі іншої речовини. Ознаками дисперсної фази є роздробленість і уривчастість.
Дисперсійне середовище - це речовина, в якому рівномірно розподілені частки дисперсної фази. Ознакою дисперсійного середовища є її безперервність.
Дисперсну фазу можна відокремити від дисперсійного середовища фізичним способом (центрифугуванням, сепаруванням, відстоюванням і т.п.).
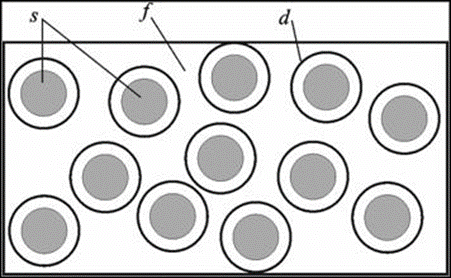
Малюнок 10.1 - Дисперсна система: частинки дисперсної фази s (у вигляді дрібних твердих частинок, кристалів, крапель рідини, бульбашок газу, ассоциатов молекул або іонів), що володіють адсорбційним шаром d, розподілені в однорідної безперервної дисперсійному середовищі f
Дисперсні системи класифікують за різними відмітних ознак: дисперсності, агрегатному стані дисперсної фази і дисперсійного середовища, інтенсивності взаємодії між ними, відсутності або утворення структур в дисперсних системах.
-
Класифікація за ступенем дисперсності. Залежно від розмірів частинок дисперсної фази все дисперсні системи умовно діляться на три групи (рис. 10.2).
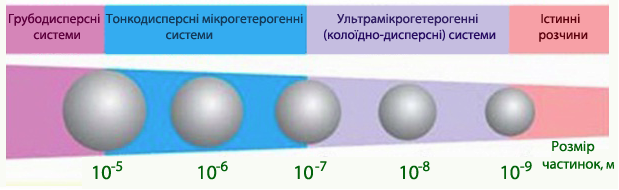
Малюнок 10.2 – Класифікація дисперсних систем по розміру частиток
1. Грубодисперсні системи, в яких розмір часток більш 1 мкм (10-5м). Для цієї групи дисперсних систем характерні такі ознаки: частинки дисперсної фази осідають (або спливають) в полі гравітаційних сил, не проходять крізь паперові фільтри; їх можна роздивитися в звичайному мікроскопі. До грубодисперсних систем відносяться суспензії, емульсії, пил, піна, аерозолі і т.п.
Суспензія - це дисперсна система, в якій дисперсною фазою є тверда речовина, а дисперсійним середовищем - рідина.
Прикладом суспензії може бути система, що утворюється при збовтуванні глини або крейди у воді, фарби, пасти.
Емульсія - це дисперсна система, в якій рідка дисперсна фаза рівномірно розподілена в об'ємі рідкого дисперсійного середовища, тобто емульсія складається з двох взаємно нерозчинних рідин.
Як приклад емульсій можна назвати молоко (в ньому дисперсною фазою виступають краплі рідкого жиру, а дисперсійним середовищем - вода), вершки, майонез, маргарин, морозиво. (Рис. 10.3)
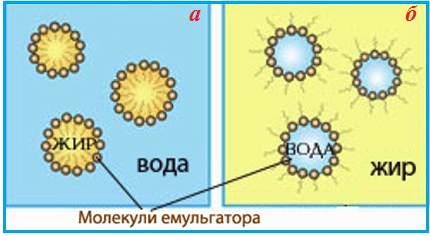
Малюнок10.3 – Структура емульсій: а) дисперсна система, що містить рідку дисперсну фазу (жир) і рідке дисперсійне середовище (вода); б) дисперсна система, в якій дисперсною фазою є вода, а дисперсійним середовищем – рідкий жир (олія)
При відстоюванні суспензії і емульсії поділяються (розшаровуються) на складові частини: дисперсну фазу і дисперсійне середовище. Так, якщо енергійно збовтати бензол з водою, то утворюється емульсія, яка через деякий час розділяється на два шари: верхній бензоловий і нижній водний (Рис.10.4). Для запобігання розшаровування емульсій до них додають емульгатори - речовини, що додають емульсій агрегатну стабільність.

Малюнок 10.4 – Емульсії: а) дисперсна система, що складається з рідкої дисперсної фази (олія) і рідкого дисперсійного середовища (вода); б) розшаровування емульсії на складові частини після відстоювання
Піна – комірчаста дисперсна система, в якій дисперсною фазою є сукупність бульбашок газу (або пари), а дисперсійним середовищем – рідина чи тверде тіло.
У пінах загальний об'єм газу, що міститься в бульбашках, може у сотні разів перебільшувати об’єм рідкого чи твердого дисперсійного середовища, який знаходиться в прошарках між бульбашками газу (рис. 10.5).

Малюнок 10.5 – Піни: а) з рідким дисперсійним середовищем; б) з твердим дисперсійним середовищем Аерозоль – дисперсна система, що складається з дрібних твердих або рідких частинок дисперсної фази, рівномірно розподілених по газовому дисперсійному середовищу (найчастіше по повітрю).
Аерозолі часто зустрічаються в оточуючому середовищі. Серед природних аерозолів доречно згадати такі різновиди:
- Туман – аерозольна дисперсна система, що складається з рідкої дисперсної фази (краплі рідини діаметром 10 мкм) і газового дисперсійного середовища (рис. 10.6а).
- Дим – аерозольна дисперсна система, що складається з твердої дисперсної фази (частинки розміром 0,1-5 мкм) і газового дисперсійного середовища (рис. 10.6б).
- Смог – аерозольна дисперсна система, що складається з суміші твердої і рідкої дисперсних фаз (частинки діаметром 0,1-50 мкм) і газового дисперсійного середовища (рис. 10.6в).
- Пил – аерозольна дисперсна система, що складається з твердої дисперсної фази (частинки діаметром 10-100 мкм) і газового дисперсійного середовища (рис. 10.6г).

Малюнок 10.6 – Приклади аерозольних дисперсних систем: а) туман; б) дим; в) смог; г) пил
2. Мікрогетерогенні (або тонкодисперсні) системи, в яких розмір часток коливається в межах 10-5-10-7м. До них відносяться тонкі суспензії, дими, пористі тверді тіла.
3. Ультрамікрогетерогенні (або колоїдно-дисперсні) системи, в яких частинки розміром 1-100нм (10-9-10-7м) складаються з 103_109 атомів і відокремлені від розчинника поверхнею поділу. Колоїдні розчини характеризуються гранично-високодисперсним станом, їх зазвичай називають золі, або часто ліозолі, щоб підкреслити, що дисперсійним середовищем є рідина. Якщо в якості дисперсійним середовищем взята вода, то такі золі називають гідрозолі, а якщо органічна рідина - органозолі.
Для більшості тонкодисперсних систем притаманні певні особливості:
• невисока швидкість дифузії;
• частки дисперсної фази (тобто колоїдні частинки) можна розглянути лише за допомогою ультрамікроскопа або електронного мікроскопа;
• розсіювання світла колоїдними частинками, внаслідок чого в ультрамікроскопі вони набувають вигляду світлових плям - ефект Тиндаля (рис. 10.7);
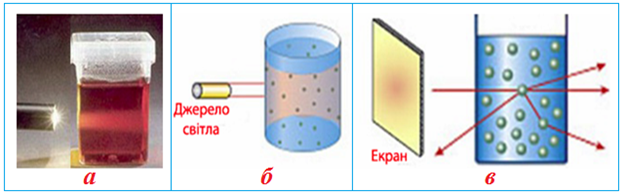
Малюнок 10.7 - Ультрамікрогетерогенна (тонкодисперсна) система: а) колоїдний розчин; б) розсіювання світла колоїдним розчином (ефект Тіндаля); в) схема відхилення тонкого променю світла при проходженні через колоїдний розчин
• на поверхні розділу фаз в присутності стабілізаторів (іонів електролітів) утворюється іонний шар або сольватна оболонка, що сприяють існуванню частинок в суспендованому вигляді;
• дисперсна фаза є або зовсім нерозчинною, або незначно розчинною в дисперсійному середовищі.
Як приклади колоїдних частинок можна привести крохмаль, білки, полімери, каучук, мила, Алюміній і Ферум (III) гідроксид.
II. Класифікація дисперсних систем по співвідношенню агрегатних станів дисперсної фази і дисперсійного середовища, запропонована Оставльдом (табл. 10.1). При схематичному записі агрегатного стану дисперсних систем першим вказують буквами Г (газ), Ж (рідина) або Т (тверде) агрегатний стан дисперсної фази, а потім ставлять тире (або знак дробу) і записують агрегатний стан дисперсійного середовища.
Позначення дисперсної системи Назва дисперсної системи і приклади
Г/Г Дисперсна система не утворюється
Р/Г Аерозолі:

Т/Г Аерозолі, порошки:

Г/Р Газові емульсії, піни:

Р/Р Емульсії:

Т/Р Суспензії та золі:

Г/Т Поруваті тіла:


Р/Т Капілярні системи:


Т/Т Тверді гетерогенні системи:


III. Класифікація дисперсних систем за інтенсивністю молекулярного взаємодії, запропонована Г.Фрейндліхом і застосовується виключно для систем з рідким дисперсійним середовищем.
-
Ліофільні системи, в яких дисперсна фаза взаємодіє з дисперсійним середовищем і при певних умовах здатна в ній розчинятися - це розчини колоїдних поверхнево-активних речовин (ПАР), розчини високомолекулярних сполук (ВМС). Серед різноманітних ліофільних систем найбільш важливі в практичному відношенні ПАР, які можуть перебувати як в молекулярно-розчиненому стані, так і у вигляді агрегатів (міцел), що складаються з десятків, сотень і більш молекул.
|
|
|
|
а |
б |
Малюнок 10.8 – Ліофільні системи: а) розчин прального порошку (ПАР); б) міцела ПАР з гідрофобною часткою в середені та дія ПАР по видаленню бруду з поверхні у водному середовищі.
2. Ліофобні системи, в яких дисперсна фаза не здатна взаємодіяти з дисперсійним середовищем і розчинятися в ній. В ліофобних системах взаємодія між молекулами різних фаз значно слабкіше, ніж в разі ліофільних систем; міжфазне поверхневий натяг велике, внаслідок чого система виявляє тенденцію до мимовільного укрупнення частинок дисперсної фази. Прикладом таких систем можуть бути наночастинки металів у водному середовищі (Рис.10.9), наночастинки нерозчинних речовин (солей, оксидів, гідроксидів) у воді.

Малюнок 10.9 – Ліофобні системи: колоїдні розчини золота у воді, що мають різне забарвлення, залежно від розміру частинок золота.
IV. Класифікація дисперсних систем за фізичним станом, запропонована П.Ребіндером. Згідно з цією класифікацією дисперсна система позначається дробом, в якій дисперсна фаза ставиться в чисельнику, а дисперсійна середу - в знаменнику. Наприклад: Т1 / Ж2 позначає дисперсних систем з твердою фазою (індекс 1) і рідким дисперсійним середовищем (індекс 2). Класифікація за Ребіндера ділить дисперсні системи на два класи:
1. вільнодисперсні системи - золі, в яких дисперсна фаза не утворює суцільних жорстких структур (сіток або каркасів), а частинки дисперсної фази не контактують один з одним, а беруть участь в хаотичному тепловому русі і вільно переміщуються під дією сили тяжіння. До них відносяться аерозолі, ліозолі, розбавлені суспензії і емульсії.
Приклади вільнодисперсні систем:
• Дисперсні системи в газах з колоїдною дисперсністю (Т1 / Г2- пил у верхніх шарах атмосфери, аерозолі), з грубою дисперсністю (Т1 / Г2 - дими і Ж1 / Г2 - тумани);
• Дисперсні системи в рідинах з колоїдною дисперсністю (Т1 / Ж2 - ліозолі, дисперсні барвники у воді, латекси синтетичних полімерів), з грубою дисперсністю (Т1 / Ж2 - суспензії; Ж1 / Ж2 - рідкі емульсії; Г1 / Ж2 - газові емульсії);
• Дисперсні системи в твердих тілах: Т1 / Т2 - тверді золи, наприклад, золь жовтого металу в склі, пігментовані волокна, наповнені полімери.
2. Связнодісперсние (або суцільні) системи. У суцільних (связнодісперсних) системах частинки дисперсної фази утворюють жорсткі просторові структури. Такі системи чинять опір деформації зсуву. Связнодісперсні системи тверді, вони виникають при контакті частинок дисперсної фази, що приводить до утворення структури у вигляді каркаса або сітки, яка обмежує плинність дисперсної системи і надає їй здатність зберігати форму. Подібні структуровані колоїдні системи називають гелями.
Приклади связнодісперсних систем:
• Дисперсні системи з рідкою поверхнею поділу фаз (Г1 / Ж2 - піни; Ж1 / Ж2 - піноподібні емульсії);
• Дисперсні системи з твердою поверхнею поділу фаз (Г1 / Т2 - пористі тіла, натуральні волокна, пемза, губка, деревне вугілля; Ж1 / Т2 - волога в граніті; Т1 / Т2 - взаємопроникні сітки полімерів).
Отримання і очишення колоїдних розчинів
Колоїдні розчини можуть бути отримані дисертаційними або конденсаційними методами.
1 Диспергаційні методи - це способи отримання ліофобних золів шляхом подрібнення великих шматків до агрегатів колоїдних розмірів.
Механічне подрібнення грубодисперсних систем здійснюється шляхом: подрібнення, удару, стирання, розщеплення. Подрібнення частинок до розмірів в кілька десятків мікрон здійснюється за допомогою кульових млинів. Дуже тонке подрібнення (до 0,1-1 мікрона) досягається на спеціальних колоїдних млинах з вузьким зазором між швидко обертовим ротором (10-20 тис.об / хв) і нерухомим корпусом, притому частинки розриваються або стираються в зазорі (Рис. 10.10).

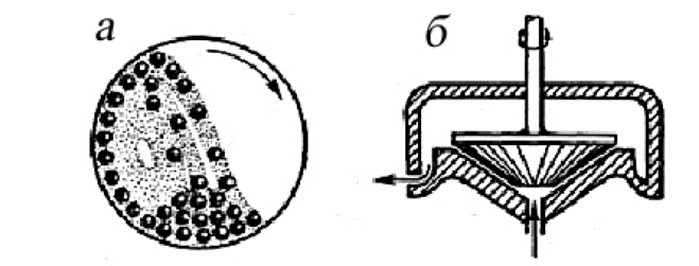
Малюнок 10.10 – Колоїдні та шарові млини для диспергування твердих речовин
Роботами П. А. Ребіндера встановлено явище зниження опору твердих тіл пружним і пластичним деформаціям, а також механічному руйнуванню під впливом адсорбції поверхнево-активних речовин. Поверхнево-активні речовини полегшують диспергування і сприяють значному підвищенню ступеня дисперсності.
2 Конденсаційні методи - це способи отримання колоїдних розчинів шляхом об'єднання (конденсації) молекул і іонів в агрегати колоїдних розмірів. Система з гомогенної перетворюється в гетерогенну, виникає нова фаза (дисперсна фаза). Обов'язковою умовою є пересиченість вихідної системи.
Конденсаційні методи класифікують за природою сил, що викликають конденсацію, на фізичну конденсацію і хімічну конденсацію (Рис. 10.11).
Фізична конденсація може здійснюватися з парів або шляхом заміни розчинника. Конденсація з парів. Вихідна речовина знаходиться в парі. При зниженні температури пар стає пересиченим і частково конденсується, утворюючи дисперсну фазу. Так, якщо до спиртового розчину сірки або каніфолі додати води,, то утворюється водно-спиртовий золь. Виникнення золю викликане тим, що вода не розчиняє сірку чи каніфоль і під час її додавання відбувається висадження твердої фази. Таким методом очищують полісахариди.
Метод заміни розчинника. Метод заснований на зміні складу і властивостей дисперсійного середовища. Наприклад, спиртовий розчин сірки, фосфору або каніфолі влити в воду, внаслідок зниження розчинності речовини в новому розчиннику розчин стає пересиченим і частина речовини конденсується, утворюючи частинки дисперсної фази.

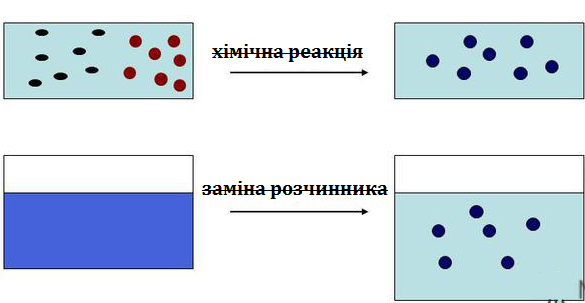
Малюнок 10.11 – Конденсаційні методи одержання колоїдних систем: – фізична конденсація з парів та фізична конденсація пов’язана із заміною розчинника; хімічна конденсація
Хімічна конденсація полягає в тому, що речовину, яка утворює дисперсну фазу, одержують в результаті хімічної реакції. Щоб в ході реакції утворився колоїдний розчин, а не істинний розчин або осад, необхідне дотримання трьох умов:
- щоб речовина дисперсної фази була нерозчинна в дисперсійному середовищі;
- щоб швидкість утворення зародків кристалів дисперсної фази була набагато більше, ніж швидкість росту кристалів; ця умова виконується зазвичай тоді, коли концентрований розчин одного компонента вливається в сильно розбавлений розчин іншого компонента при інтенсивному перемішуванні;
- щоб одна з вихідних речовин було взята в надлишку, саме вона є стабілізатором.
10.2.1 Методи очищення колоїдних розчинів
Отримані тим або іншим способом колоїдні розчини звичайно очищують від низькомолекулярних домішок (молекул і іонів). Видалення цих домішок здійснюється методами діалізу, (електродіаліз), ультрафільтрації.
Діаліз - метод очищення за допомогою напівпроникної мембрани, яка відділяє колоїдний розчин від чистого дисперсійного середовища. В якості напівпроникної (тобто проникною для молекул і іонів, але непроникною для частинок дисперсної фази) мембрани застосовують пергамент, целофан, колодій, керамічні фільтри і інші тонкопористі матеріали. В результаті дифузії низькомолекулярні домішки переходять у зовнішній розчин.
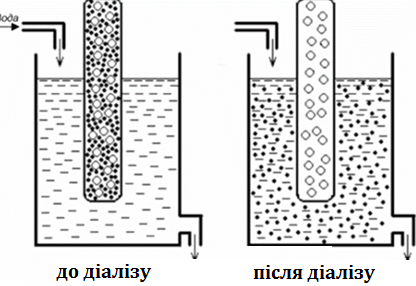
Ультрафільтрацією називається діаліз, що проводиться під тиском у внутрішній камері. По суті, ультрафільтрація є не методом очищення золів, а лише методом їх концентрування.
10.3 Оптичні властивості колоїдних систем
Дослідження оптичних властивостей колоїдних систем дало дослідникам цілу низку методів для спостереження за поведінкою цих систем, а також для визначення розмірів та форми частинок. З оптичних властивостей найхарактернішим для колоїдних систем є розсіювання та поглинання світла. Усі дисперсні системи розсіюють світло, але механізм розсіювання в суспензіях, колоїдних розчинах та істинних відрізняється. В грубодисперсних системах розмір частинок більший за довжину хвилі світла, що падає і світлорозсіювання зумовлене хаотичним відбиванням та заломленням променів. При цьому довжина хвиль, що падає і що розсіюється – однакові.
В колоїдних системах розміри частинок менші за довжину хвилі світла, що падає. Світлові хвилі не відбиваються, а світлорозсіювання викликано тим, що хвилі світла спонукають електрони в частинці випромінювати світло у всіх напрямках. Частота такого випромінювання = частоті хвилі, що падає. Розсіювання світла колоїдними системами детально описав Тіндаль (1868 р.). Він встановив, що світлорозсіювання зручно спостерігати на темному фоні, при освітленні збоку.(Рис.10.12)

Малюнок 10.12 – Світлорозсіювання колоїдними розчинами (ефект Тіндаля)
При падінні світла на дисперсну систему можуть спостерігатися такі явища:
• проходження світла через систему;
• заломлення світла частинками дисперсної фази (якщо ці частинки прозорі);
• відображення світла частинками дисперсної фази (якщо частки непрозорі);
• розсіювання світла;
• абсорбція (поглинання) світла дисперсною фазою.
Світлорозсіювання.
Теорію світлорозсіювання створив Релей. Він вивів рівняння, яке пов'язує інтенсивність розсіяного світла I з інтенсивністю падаючого світла I0. справедливе за умови, що:
• частки мають сферичну форму;
• частки не проводять електричний струм (тобто є неметалічними);
• частки не поглинають світло, є безбарвними;
• колоїдний розчин є розведеним в такій мірі, що відстань між частинками більше довжини хвилі падаючого світла.
Рівняння Релея:
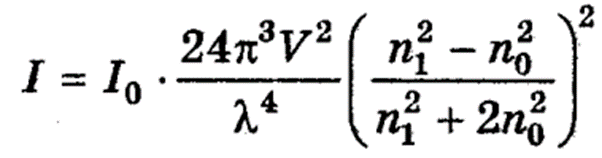 (10.1)
(10.1)
де V - об'єм однієї частинки,,
λ - довжина хвилі;
n1 - показник заломлення частинки;
nо - показник заломлення середовища.
Об’єднуючи сталі величини рівняння Релея записують так:
![]() (10.2)
(10.2)
Де ν - концентрація частинок золю.
З рівняння Релея випливають такі висновки:
1. Інтенсивність розсіювання світла тим більше, чим більше часткова концентрація v. Масова концентрація С, г / дм3, яка зазвичай використовується при приготуванні розчинів, пов'язана з частковою концентрацією виразом:
c = v⋅V⋅ρ (10.3)
де ρ - густина частинки
Слід зазначити, що ця залежність зберігається тільки в області малих розмірів частинок, розмір яких не перевищує 0,1 довжини світлової хвилі (розмір частинок не більших 40-70 нм). Якщо радіус частинок менший , то показник степені в рівнянні Релея відрізняється від 4.
Геллер встановив залежність показника степені в рівнянні:
D= Kλ-n (10.4)
де n- показник степені в рівнянні Релея;
D – оптична густина золю
К - константа
2. Розсіювання пропорційне до квадрата об’єму або шостого степені лінійного розміру. Частинок дисперсної фази. Зменшення розміру частинок приводить до збільшення розсіювання за тієї самої масової концентрації
3. Інтенсивність розсіяного світла обернено пропорційна довжині хвилі в четвертому ступені. Тобто сильніше розсіюються хвилі меншої довжини.
Це означає, що при проходженні через колоїдний розчин пучка білого світла переважно розсіюються короткі хвилі - синьою і фіолетовою частин спектру. Це пояснює голубе забарвлення розсіяного світла та жовтувате забарвлення світла, що пройшло крізь систему. Блакитний колір неба також обумовлений розсіюванням світла дрібними крапельками води в атмосфері. Почервоніння біля горизонту з'являється через те, що світлу доводиться пробиватися крізь величезний об’єм повітря. Це підвищує ефект релєєвського розсіювання і прибирає весь синій колір зі шляху спостереження. Той світловий потік що залишився володіє більш довгими хвилями, тому здається червонуватим.

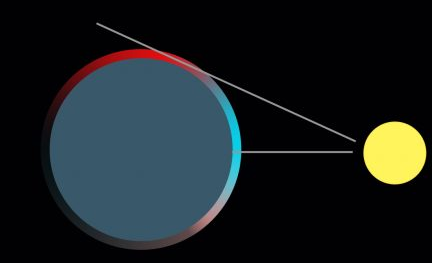
Малюнок 10.12 – Розсіювання світла атмосферою
Поглинання світла.
Поглинання світла залежить від фізичних та хімічних властивостей речовини. Для розчинів у прозорих розчинниках, зв'язок між інтенсивністю світла та концентрацією встановлює закон Бугера-Ламберта-Бера
Рівняння Релея виведено для нефарбованих золів, що не поглинають світло. Однак, багато колоїдних розчинів мають певне забарвлення, тобто поглинають світло у відповідній області спектра - золь завжди забарвлений в колір, протилежний до поглиненого. Так, поглинаючи синю частину спектру (435-480 нм), золь виявляється жовтим; при поглинанні синювато-зеленої частини (490-500 нм) він приймає червоне забарвлення.
Якщо промені всього видимого спектру проходять через прозоре тіло, або відбиваються від непрозорого, то прозоре тіло здається безбарвним, а непрозоре - білим. Якщо тіло поглинає випромінювання всього видимого спектру, воно здається чорним.
Оптичні властивості колоїдних розчинів, здатних до поглинання світла, можна характеризувати по зміні інтенсивності світла при проходженні через систему. Для цього використовують закон Бугера-Ламберта-Бера:
I= I0e-kcl (10.5)
де I0 - інтенсивність падаючого світла;
І – інтенсивність, що пройшов крізь систему;
k - коефіцієнт поглинання;
l - товщина шару золю;
с - концентрація золю.
Якщо концентрація виражена у моль/л, а товщина розчину в см, k=ε (молярний показник поглинання), тоді
I= I0e-εcl (10.6)
Для білих золів (частинки не поглинають світла ε=0)
Якщо прологаріфмувати вираз, отримаємо:
lnI0/I=-ε ·c· l (10.7)
Величину lnI0/I називають оптичною густиною розчину. При роботі з монохроматичним світлом завжди вказують, при якій довжині хвилі була визначена оптична густина, позначаючи її D.
10.4 Міцелярна теорія будови колоїдної системи
З погляду міцелярної теорії, стосовно будови золів, на колоїдних частинках виникає певний заряд, який обумовлений вибірковою адсорбцією на поверхні дисперсних частинок певних іонів. Це підтвердили досліди, які показали, що електрокінетичні явища не спостерігаються в розчинах неелектролітів.
Розглянемо будову гідрофобної колоїдної частинки на прикладі утворення золю AgI обмінної реакцією:
АgNO3 + KI → AgI ↓ + KNO3.
Якщо вихідні речовини (аргентум нітрат та калій йодид) беруться в еквівалентних кількостях, то випадає кристалічний осад AgI. Але, якщо одна з вихідних речовин буде в надлишку, наприклад КI, процес кристалізації AgI веде до утворення колоїдного розчину AgI. Внаслідок вибіркової адсорбції іонів на поверхні твердих нерозчинних молекул AgI відбувається утворення міцел. Розглянемо будову даної міцели (Рис.10.13)
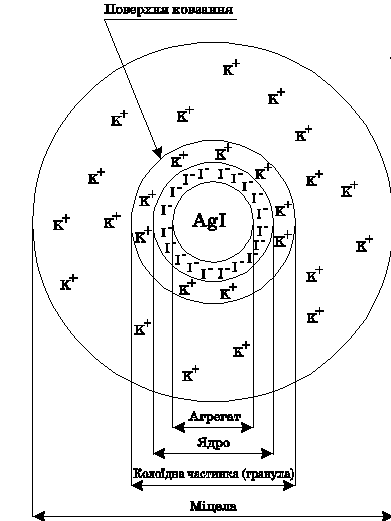
Малюнок 10.13 – Схема будови міцели гідрозолю AgI
Агрегат молекул [mAgI] кількістю 100-1000 молекул це- ядро, є зародком нової фази, на поверхні якого відбувається адсорбція іонів електроліту, що знаходяться в дисперсійному середовищі. Згідно з правилом Панета - Фаянса краще адсорбуються іони, однакові з іонами, які входять в кристалічну решітку агрегату і добудовують цю решітку. Іони, які адсорбуються безпосередньо на ядрі, називаються потенціалвизначальні, так як вони визначають величину потенціалу і знак заряду поверхні, а також і знак заряду всієї частинки. Потенціалвизначальні іони в даній системі є іони I-, які знаходяться в надлишку, і входять до складу кристалічної решітки ядра AgI. Дані іони виконують роль стабілізаторів і складають внутрішню оболонку в жорсткій частині подвійного електричного шару (ПЕШ) міцели. Агрегат з адсорбованими на ньому іонами I− утворює ядро міцели.
До негативно зарядженої поверхні частинок AgI на відстані, близькому до радіусу гідратованого іона, з розчину притягуються іони протилежного знаку (протиіони) і тієї речовини, що в надлишку - позитивно заряджені іони К +. Шар противоіонів - зовнішня оболонка подвійного електричного шару (ПЕШ), утримується як електростатичними силами, так і силами адсорбційного притяжіння. Агрегат молекул разом з потенціалвизначальними іонами, та шаром противоіонів називається - гранула.
Частина протиіонів внаслідок теплового руху розміщується дифузно навколо гранули, і пов'язані з нею тільки за рахунок електростатичних сил. Гранула разом з дифузним шаром, що оточує її називається міцела. Міцела електронейтральна, так як заряд ядра дорівнює заряду всіх противоионов, а гранула зазвичай має заряд, який визначається зарядом потенціалвизначального іона. В скороченому вигляді схему будови міцели для даного прикладу можна записати в такому вигляді:
![]()
Електрокінетичні властивості колоїдних систем
Одним з основних положень теорії будови колоїдних частинок є уявлення про будову подвійного електричного шару (ПЕШ).
Відповідно до сучасних уявлень, ПЕШ складається з адсорбційного і дифузійного шарів. Адсорбційний шар складається:
а) з зарядженої поверхні ядра міцели в результаті адсорбції на ній потенціалвизначальних іонів, які визначають величину потенціалу поверхні і його знак;
б) з шару іонів протилежного знаку - противоіонів, які притягуються з розчину до зарядженої поверхні ядра. Адсорбційний шар протиіонів знаходиться на відстані молекулярного радіуса від зарядженої поверхні. Між цією поверхнею і противоіонами адсорбційного шару існують як електростатичні, так і адсорбційні сили, і тому ці противоіони пов'язані особливо міцно з ядром. Адсорбційний шар дуже щільний, товщина його постійна і не залежить від зміни зовнішніх умов (концентрації електроліту, температури).
в) Внаслідок теплового руху частина протиіонів відходить від гранули і переміщується вглиб дисперсійного середовища. Їх притяжіння до зарядженої поверхні гранули здійснюється тільки за рахунок електростатичних сил. Ці противоіони становлять дифузний шар, який менш міцно пов'язаний з поверхнею. Дифузний шар має змінну товщину, яка залежить від концентрації електролітів в дисперсійному середовищі.
Існують декілька теорій, що описують електрокінетичні явища за участю заряджених поверхонь. Сучасна теорія , що запропонована Штерном об’єднує різні моделі, враховує як адсорбцію протиіонів, так і їх тепловий рух. Згідно цієї теорії частина протиіонів розміщені на відстанях близьких до діаметра іона від поверхні ядра, і утворюють так званий адсорбційний шар δ. Іони тут утримуються не лише за рахунок електростатичних сил, а й за рахунок специфічної адсорбції. Потенціал, що виникає при цьому називається термодинамічним і позначається ϕ.
Інша частина протиіонів розташована за межами твердої поверхні гранули в дисперсійному середовищі і утворює дифузійний шар. При переміщенні твердої і рідкої фаз одна відносно одної на межі поділу фаз виникає стрибок потенціалу, який називають електрокінетичний або ζ - потенціалом (дзета - потенціал). Його величина визначає агрегатну стійкість золю. Падіння міжфразного потенціалу при віддаленні від твердої фази вглиб дисперсійного середовища показано на ріс.10.14.
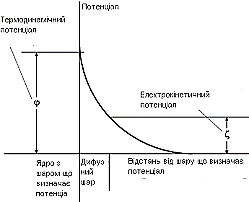
Малюнок 10. 14 Будова ПЕШ колоїдної міцели.
Наявність різниці потенціалів навколо частинок гідрофобного золю перешкоджає їх злипанню при зіткненні, тобто є фактором агрегатної стійкості золю. Якщо кількість дифузних іонів зменшується або прагне до нуля, то гранула стає електронейтральною (Ізо електричної стан) і така система стає нестійкою.
Таким чином, величина електрокінетичного потенціалу визначає сили відштовхування, а отже і агрегатну стійкість колоїдного розчину.
Достатня стійкість колоїдного розчину забезпечується при величині електрокінетичного потенціалу ζ = 0,07В, при значеннях менших ζ = 0,03В сили відштовхування надто слабкі, щоб протистояти агрегації, а тому відбувається коагуляція, яка неминуче закінчується седиментацією.
Величину електрокінетичного потенціалу можна визначити за допомогою приладу для електрофорезу за формулою:
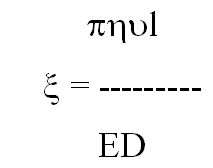 (10.8)
(10.8)
де η - в'язкість; υ - швидкість переміщення частинок; l - відстань між електродами уздовж розчину; Е - електрорушійна сила, D - діелектрична постійна.
Фактори, що впливають на ζ - потенціал.
1. Наявність в розчині індиферентного електроліту - електроліту, який не містить потенціалвизначального іона.
- Індиферентний електроліт містить противоіон. В такому випадку відбувається стиснення дифузійного шару і падіння ζ і як наслідок - коагуляція.
- Індиферентний електроліт містить іон однознаковий з протиіоном, але не сам протиіон. В цьому випадку відбувається іонний обмін: протиіон заміщується на іони індиферентного електроліту. Спостерігається падіння ζ, але ступінь падіння буде залежати від природи іона - заступника, його валентності, ступеня гідратованості.
Ліотропні ряди катіонів та аніонів - ряди, в яких іони розташовуються по збільшенні їх здатності стискати дифузний шар і викликати падіння ζ - потенціалу.
Li+ - Na+- NH4+ - K+- Rb+ - Cs+ - Mg2+ - Ca2+ - Ba2+…
CH3COO– - F– - NO3– - Cl– - I–- Br– - SCN– - OH– - SO42–
2. Додавання розчину електроліту-стабілізатора - електроліту, що містить потенціалвизначальний іон, викликає збільшення ζ - потенціалу, а значить сприяє стійкості колоїдної системи, але до певної межі.
10.5 Стійкіть і коагуляція колоїдних систем
Сучасну теорію стійкості і коагуляції колоїдних систем створювали кілька відомих вчених: Дерягин, Ландау, Фервей, Овербек, і тому її скорочено називають теорія ДЛФО. Відповідно до цієї теорії стійкість дисперсної системи визначається балансом сил тяжіння і відштовхування, що виникають між частинками при їх зближенні в результаті броунівського руху. Розрізняють кінетичну і агрегатну стійкість колоїдних систем.
1 Кінетична (седиментаційна) стійкість - здатність дисперсних частинок перебувати в підвішеному стані і не осідати. У дисперсних системах, як і в природних розчинах, існує броунівський рух. Броунівський рух залежить від розмірів частинок, в'язкості дисперсної середовища, температури і ті.
Тонкодисперсні системи (золи), частки яких практично не осідають під дією сили тяжіння, відносяться до кінетично (седиментаційно) стійких. До них також відносяться гідрофільні золі - розчини полімерів, білків і ті. Гідрофобні золі, грубодисперсні системи (суспензії, емульсії) кінетично нестійкі. У них досить швидко проходить поділ фази і середовища.
2 Агрегатна стійкість - здатність частинок дисперсної фази зберігати певну ступінь дисперсності незмінною. У агрегатностійких системах частинки дисперсної фази при зіткнення не злипаються і не утворюють агрегатів. Але при порушенні агрегатної стійкості колоїдні частинки утворюють великі агрегати з подальшим випаданням дисперсної фази в осад. Такий процес називається коагуляцією, і протікає він самовільно, так як при цьому зменшується вільна енергія системи (Δ G <0).
До факторів, які впливають на стабільність колоїдних систем, відносяться:
1. Наявність електричного заряду дисперсних частинок. Дисперсні частинки ліофобних золів мають однаковий заряд, і тому при зіткненні вони будуть відштовхуватися одна від одної тим сильніше, чим вище дзета - потенціал. Однак електричний фактор не завжди є визначальним.
2. Здатність до сольватації (гідратації) стабілізуючих іонів. Чим більше гідратованих (сольватованих) протиіонів в дифузному шарі, тим більше загальна гідратна (сольватна) оболонка навколо гранул і тим стабільніше дисперсна система.
Відповідно до теорії стійкості (Дерягин, Ландау, Фервей, Овербек) при броунівському русі колоїдні частинки вільно зближуються на відстань до 10-5 см. Характер зміни Ван - дер Ваальсових сил тяжіння (1) і електростатичних сил відштовхування (2) між колоїдними частинками показаний на рис. 10.15. Результуюча крива (3) отримана шляхом геометричного складання відповідних ординат. При мінімальних і великих відстанях, між частинками переважає енергія тяжіння (I і II енергетичні мінімуми). У II-ому енергетичному мінімумі енергія зчеплення частинок недостатня для утримання їх в агрегатованому стані. На середніх відстанях, що відповідають товщині подвійного електричного шару, переважає енергія відштовхування з потенційним бар'єром AB, що перешкоджає злипанню частинок. Практика показує, що при дзета-потенціал ζ = 70 мВ колоїдні системи характеризуються високим потенційним бар'єром і великою агрегативною стійкістю. Для дестабілізації колоїдної системи, тобто здійснення процесу коагуляції, необхідно знизити ζ-потенціал до значень 0 - 3 мВ.
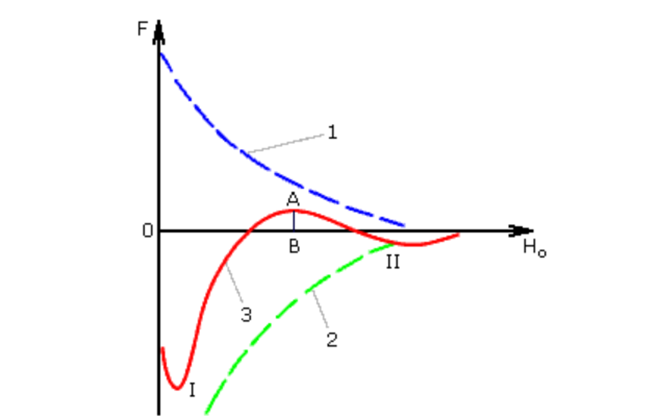
Малюнок 10.15. Потенційні криві взаємодії колоїдних частинок
10.6 Коагуляція дисперсних систем
Коагуляція - процес злипання колоїдних частинок. Даний процес протікає порівняно легко під дією різних факторів: введення електролітів, неелектролітів, заморожування, кип'ятіння, перемішування, дії сонячного світла і ті. В процесі електролітичної коагуляції (під впливом електролітів) часто спостерігається іонообмінна адсорбція: іони коагулянту з більшою валентністю або великим адсорбційним потенціалом витісняють протиіони спочатку дифузного шару, а потім і адсорбційного шару. Обмін проходить в еквівалентній кількості, але заміна протиіонів призводить до того, що при достатній концентрації електролітів в дисперсному середовищі частинки втрачають стійкість і при зіткненні злипаються.
Для електролітичної коагуляції встановлений ряд експериментальних загальних правил:
-
Коагуляцію ліофобних золів викликають будь-які електроліти, але з помітною швидкістю вона спостерігається при досягненні певної концентрації електроліту. Поріг коагуляції (Ск) - це мінімальна концентрація електроліту необхідна для початку коагуляції золю. При цьому спостерігаються зовнішні зміни, такі як помутніння розчину, зміна забарвлення і ін.
![]() (10.9)
(10.9)
де Сел - молярна концентрація електроліту, ммоль / л;
Vел – об’єм розчину електроліту, л;
Vз – об’єм золю, л.
Величина, зворотна порогу коагуляції, називається коагуляційна здатність (γ) електроліту:
γ= 1/Ск (10.7)
де Ск - поріг коагуляції.
2. Відповідно до правила Шульца - Гарді, коагулююча дія зазвичай проявляє той іон, заряд якого за знаком протилежний заряду поверхні колоїдних частинок (заряду гранули), причому ця дія зростає зі збільшенням валентності іона;
коагулюючий вплив іонів багаторазово збільшується зі збільшенням валентності іонів. Для одне - двох-і тривалентного іонів коагулююча дія їх приблизно відносяться як 1: 50: 500. (Рис.10.16)

Малюнок - 10.16. Коагуляція негативно зарядженого золю іонами: а) Fe3+ ;б) Ca2+; в) Na+.
Це пояснюється тим, що високозарядні іони коагулянтів значно сильніше притягуються зарядженою поверхнею колоїдної частинки, ніж одновалентні, і значно легше витісняють протиіони з дифузного і навіть адсорбційного шару.
- Коагулююча дія органічних іонів значно вище, ніж неорганічних. Це пов'язано з їх високою адсорбційною здатністю, можливістю адсорбуватися в надеквівалентній кількості, а також викликати перезарядку поверхні колоїдних частинок.
- У ряді неорганічних іонів з однаковими зарядами коагуляційна здатність залежить від радіуса іона - коагулянту: чим більше радіус, тим більше коагуляційна здатність (див. Ліотропні ряди). Це пояснюється тим, що ступінь гідратації іонів зменшується, наприклад, від Lі+ до Cs+, а це полегшує його впровадження в подвійний іонний шар.
- З найбільшою швидкістю коагулюють електронейтральні частки ліофобних колоїдних золів.
- Явище звикання золю. Якщо до золю швидко додати коагулянт, то відбувається коагуляція, якщо ж повільно - коагуляція відсутня. Це можна пояснити тим, що між електролітом і золем відбувається реакція, в результаті якої, утворюються пептизатори, які стабілізують дисперсну систему:
Fe (OH)3 + HCl → FeOCl + 2H2O ,
FeOCl → FeO + + Cl –
де FeO + - пептизатор для золю Fe (OH) 3.
Коагулююча дія суміші електролітів проявляється по-різному в залежності від природи іона - коагулятора. В суміші електролітів дія може підсилюватися коагулуючою дією кожного електроліту. Це явище називається адитивність іонів (NaCl, KCl). Якщо коагулююча дія іонів електроліту зменшується при введенні іонів іншого електроліту спостерігається антагонізм іонів (LiCl, MgCl2). У разі, коли коагулююча дія іонів електроліту збільшується при введенні іонів іншого електроліту таке явище називається синергізм іонів.
Введення наприклад 10 мл 10% розчину NaCl в 10 мл золю Fe (OH) 3 призводить до коагуляції цього золю. Але цього можна уникнути, якщо додатково ввести в розчин золю одне із захисних речовин: 5 мл желатину, 15 мл яєчного альбуміну, 20 мл декстрину.
10.7 Захист колоїдних частинок
Колоїдний захист - підвищення агрегатної стійкості золю шляхом введення в нього високомолекулярної сполуки (ВМС).
Для гідрофобних золів як ВМС зазвичай використовуються білки, вуглеводи, пектини; для неводних золів - каучуки.
Захисна дія ВМС пов'язана з утворенням на поверхні колоїдних частинок певного адсорбційного шару (Рис. 10.17). Явище протилежне коагуляції називають пептизація.
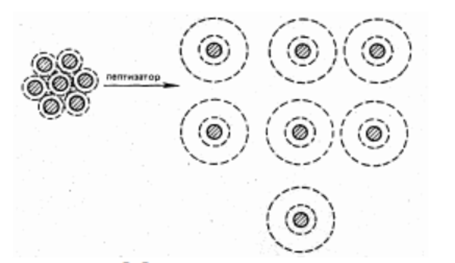
Малюнок 10.17 Механізм пептизації
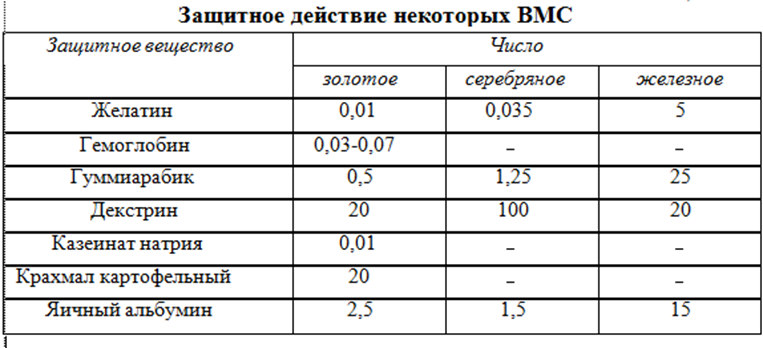
Для характеристики захисної дії різних ВМС Зігмонді запропонував використовувати золоте число. Золоте число - це кількість міліграмів ВМС, яке треба додати до 10 см3 0,0006% - го червоного золю золота, щоб запобігти його посинінню (синіє золь внаслідок укрупнення частинок при коагуляції) при додаванні до нього 1см3 10% розчину NaCl. Іноді для характеристики захисної дії ВМС замість золю золота використовуються колоїдні розчини срібла (срібне число), гідроксиду заліза (залізне число) і ін.
У таблиці 10.2 наведені значення цих чисел для деяких ВМС.
Велике значення колоїдний захист має для живих організмів. Захисну дію в організмі проявляють білки, полісахариди, пектини. Вони адсорбуються на частинках карбонатів та фосфатів кальцію, переводячи їх у стійкий колоїдний стан. Прикладом захищених колоїдних систем в організмі є кров та сеча.





