Лабораторна робота 4
ТЕМА. Вимірювання адсорбції оцтової кислоти на поверхні вугілля
МЕТА – ознайомитися з адсорбцією на межі рідкої та твердої фаз. Побудувати ізотерму адсорбції і визначити константи в рівнянні Фрейндліха.
Матеріали і реактиви: активоване вугілля, фільтрувальний папір, лійки для фільтрування, колби об′ємом 50 см3, бюретки, конічні колби, піпетки, мірна колба місткістю 1000 см3, 0,1 н розчин їдкого натру, спиртовий розчин фенолфталеїну, 2 н розчин СН3СООН.
Хід визначення
-
В чотири пронумеровані колби вносять по 50 см3 дистильованої води. В першу колбу доливають 50 см3 2 н розчину СН3СООН, перемішують. Потім відбирають з неї 50 см3 розчину і переносять в другу колбу, перемішують. Із другої колби відбирають 50 см3 розчину і переносять в третю, перемішують, а потім із третьої знову відбирають 50 см3 розчину і переносять в четверту, перемішують, відбирають 50 см3 розчину і виливають. Отримали серію розчинів, концентрації яких вдвічі менші, ніж концентрації попередніх розчинів.
-
Визначають точну концентрацію оцтової кислоти в кожній із колб. Для цього відбирають піпеткою 2 см3 розчину оцтової кислоти і титрують 0,1 н розчином NaOH за фенолфталеїном. Концентрацію оцтової кислоти (С0) розраховують за формулою
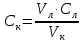 (1)
(1)
де Vл – об’єм лугу NaOH, що пішов на титрування, Vк – об’єм кислоти взятий для титрування (2 мл), Сл – нормальна концентрація лугу NaOH, (0,1 н)
-
Результати заносять до таблиці 4.1 в графу С0.
Таблиця 4.1 Данні для розрахунку коефіцієнтів у рівняння Фрейндліха та побудові ізотерми адсорбції в звичайному та логарифмічному вигляді.
|
Номер колби |
С0, моль/л |
Сі, моль/л |
Х, моль |
Х/m, моль/кг |
lgCi |
X lg----- m |
|
1 |
||||||
|
2 |
||||||
|
3 |
||||||
|
4 |
-
До всіх чотирьох колб додають по 1г активованого вугілля і залишають на 40 хв, періодично струшуючи.
-
Готують чотири чисті колби з лійками та сухими фільтрами. Через 40 хв від початку адсорбції фільтрують усі 4 розчини. Перші мл фільтрату відкидають.
-
Визначають рівноважні концентрації оцтової кислоти. Для цього відбирають по 2 мл фільтрату із кожної колби і титрують окремо 0,1 н NaOH за фенолфталеїном. Розраховують концентрацію оцтової кислоти по формулі (1) і результати заносять до таблиці 4.1 в графу Сі.
-
Число молей поглинутої кислоти (Х) визначають за формулою
Х = (С0 – Сі) V.
де V – об’єм кислоти 50 мл.
-
Показник адсорбції (X/m) визначають як кількість (моль) кислоти адсорбованих 1 кг вугілля (моль/кг)
-
На основі одержаних даних будують ізотерми адсорбції Фрейндліха в координатах (Х/m – Сі) та логарифмічному вигляді (lgХ/m – lgСі).
|
Х\m lgX/m
Сі lgCi |
Рис.4.1 Залежність показника адсорбції (Х/m або lgX/m) від рівноважної концентрації кислоти в розчині адсорбату (Сі або LgСі)
-
Визначають коефіцієнти в рівнянні Фрейндліха.
-
Записують рівняння Фрейндліха для адсорбції оцтової кислоти на активованому вугіллі.
-
На основі визначення констант в рівнянні Фрейндліха прогнозувати величину адсорбції при рівноважній концентрації кислоти в розчині 0,75 моль/л
Питання для самоперевірки
-
Адсорбційні процеси на межі поділу фаз рідина – газ. Рівняння Гібса. Вплив чинників на адсорбцію.
-
Адсорбційні процеси на межі поділу фаз рідина - тверде тіло.
-
Залежність адсорбції від концентрації (ізотерма адсорбції, рівняння Фрейндліха, рівняння Ленгмюра).
-
Адсорбція із розчинів слабких електролітів.
-
Обмінна адсорбція.
-
Визначення адсорбції оцтової кислоти на активованому вугіллі.
-
Практичне використання процесу адсорбції.
-
50 мл розчину оцтової кислоти з концентрацією 0,1 моль/л збовтували з 5 г активованого вугілля. Адсорбент відфільтрували. На титрування 10 мл фільтрату витратилося 15 мл NaOH з концентрацією 0,05 моль/л. Визначити величину адсорбції.







