Лабораторна робота 4
ТЕМА. Вимірювання адсорбції оцтової кислоти на поверхні вугілля
МЕТА – ознайомитися з адсорбцією на межі рідкої та твердої фаз. Побудувати ізотерму адсорбції і визначити константи в рівнянні Фрейндліха.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Тіла з великою поверхнею при стисканні з газовою або рідкою фазою здатні поглинати частинну добавку її речовини, причому поглинання може відбуватися в усьому об’ємі або тільки на поверхні тіла. Явище поглинання однією речовиною інших речовин називається сорбцією. Сорбція, що відбувається на поверхні тіла, називається адсорбцією, а в товщі поглинача – абсорбцією. Речовину, яка адсорбується, називають адсорбатом, а тверде тіло, на якому вона адсорбується - адсорбентом. Відповідно для абсорбції – абсорбат і абсорбент.
Адсорбція залежить від природи поглинача і речовини, яка поглинається, температури та концентрації розчину (тиску газу). Як адсорбенти застосовуються силікагель, глини (гідрофільні), вугілля, парафін, тальк (гідрофобні). Чим більша різниця в полярності між адсорбованою речовиною і адсорбентом, тим вища адсорбція.
Адсорбція може відбуватися за рахунок молекулярних сил (фізична) і хімічного зв’язку в результаті обміну електронів, які передаються від адсорбату адсорбенту (хемосорбція).
Залежність адсорбції від концентрації розчину (тиску газу) виражається у вигляді рівняння ізотерми адсорбції Ленгмюра
[TEX]a=a_{\infty }\frac{K}{1+KC} [/TEX] (1)
е a, a∞ – адсорбція, гранична адсорбція, г/моль; С – молярна концентрація розчину в момент адсорбційної рівноваги, моль/л; К – стала.
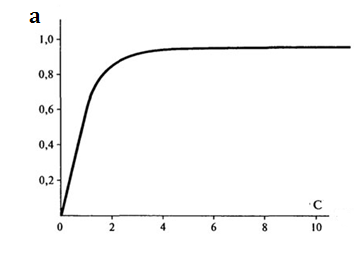
Рисунок 1. Графік ізотерми адсорбції Ленгмюра
При адсорбції з газового середовища величина С замінюється пропорційною їй величиною тиску
Р = k ⋅ С,
де k – константа, що залежить від хімічної природи та фізичного стану адсорбенту та адсорбованої речовини.
Часто залежність адсорбції від концентрації виражають емпіричним рівнянням Фрейндліха
[TEX]\frac{x}{m} =a=\beta \cdot C^{1/n} [/TEX](2)
де X – кількість розчиненої речовини, адсорбована масою (m) адсорбенту, яка перебуває в адсорбційній рівновазі; β, n – константи, причому
n<1.
Для зручності користування рівняння Фрейндліха логарифмують:
Одержане рівняння є рівнянням прямої лінії (рис.2). На осі ординат відкладають величину lg a, а на осі абсцис – lg C. Тоді відрізок, що відсікає пряма на осі ординат, дає величину lg β, а тангенс кута нахилу до осі абсцис дає величину 1/n.
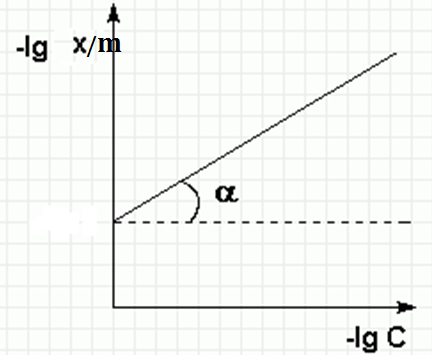
Рисунок 2. Ізотерма адсорбції Фрейндліха в логаріфмічних координатах
Адсорбція широко застосовується для очистки повітря від шкідливих газів, в протигазах; для очистки рідин від сторонніх домішок.
Експериментальна частина
Матеріали і реактиви: активоване вугілля, фільтрувальний папір, лійки для фільтрування, колби об′ємом 50 см3, бюретки, конічні колби, піпетки, мірна колба місткістю 1000 см3, 0,1 н розчин їдкого натру, спиртовий розчин фенолфталеїну, 2 н розчин СН3СООН.
Хід визначення
1. Приготування розчинів різної концентрацїї.
В чотири пронумеровані колби вносять по 50 см3 дистильованої води. В першу колбу доливають 50 см3 2 н розчину СН3СООН, перемішують. Потім відбирають з неї 50 см3 розчину і переносять в другу колбу, перемішують. Із другої колби відбирають 50 см3 розчину і переносять в третю, перемішують, а потім із третьої знову відбирають 50 см3 розчину і переносять в четверту, перемішують, відбирають 50 см3 розчину і виливають. Отримали серію розчинів, концентрації яких вдвічі менші, ніж концентрації попередніх розчинів.



2. Уточнення концентрації приготовлених розчинів методом титрування
Визначають точну концентрацію оцтової кислоти в кожній із колб. Для цього відбирають піпеткою 2 см3 розчину оцтової кислоти і титрують 0,1 н розчином NaOH за фенолфталеїном. Концентрацію оцтової кислоти Ск розраховують за формулою
[TEX]С_{к} =\frac{V_{л} С_{л} }{V_{к} } [/TEX](4)
де Vл Сл - об'єм і концентрація лугу, що пішов на титрування , Vк - об'єм кислоти = 2 мл. Значення Ск - записують в таблицю 1 в графу С0
3. Адсорбція оцтової кислоти на активованому вугіллі
До всіх чотирьох колб додають по одному граму активованого вугілля і залишають на 40 хв, періодично струшуючи.



1 2 3 4
Готують чотири чисті колби з лійками та сухими фільтрами. Через 40 хв від початку адсорбції фільтрують усі 4 розчини. Перші мілілітри фільтрату відкидають. А решту фільтрату аналізують на вміст кислоти Сі.
4. Визначення концентрації кислоти після адсорбції титруванням
Визначають рівноважні концентрації оцтової кислоти. Для цього відбирають по 2 мл фільтрату із кожної колби і титрують окремо 0,1 н NaOH за фенолфталеїном. Розраховують концентрації оцтової кислоти (Сі) за формулою (4) і результати заносять до таблиці 1.
Число молей поглинутої кислоти (Х) визначають за формулою
Х = (С0 – Сі) V.
5. Показник адсорбції, ізотерми адсорбції, константи Фрейндліха
На основі одержаних даних будують ізотерми адсорбції Фрейндліха в звичайному (рис.1) вигляді.
Для ізотерми адсорбції в логаріфмічномку вигляді знаходять логаріфм показник адсорбції х/m, та логаріфм рівноважної концентрації кислоти в розчині після адсорбції (рис.2). Будують графік і знаходять і записують рівняння лінії тренда то графіку lgx/m= f(lgCi). По ній визначають константи в рівнянні Фрейндліха.
Записують рівняння Фрейндліха для адсорбції оцтової кислоти на активованому вугіллі з використанням знайдених констант К і 1/n .
Результати заносять до таблиці 1.
Запис даних дослідів
Таблиця 1 Данні для розрахунку коефіцієнтів у рівняння Фрейндліха та побудові ізотерми адсорбції в звичайному та логарифмічному вигляді.
|
Номер колби |
С0, моль/л |
Сі, моль/л |
Х, моль |
Х/m, моль/кг |
lgCi |
X lg----- m |
|
1 |
||||||
|
2 |
||||||
|
3 |
||||||
|
4 |
Приклад оформлення графіків
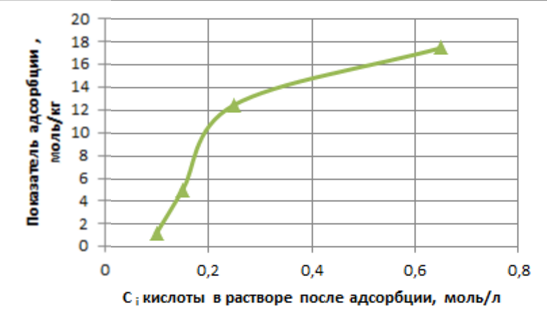
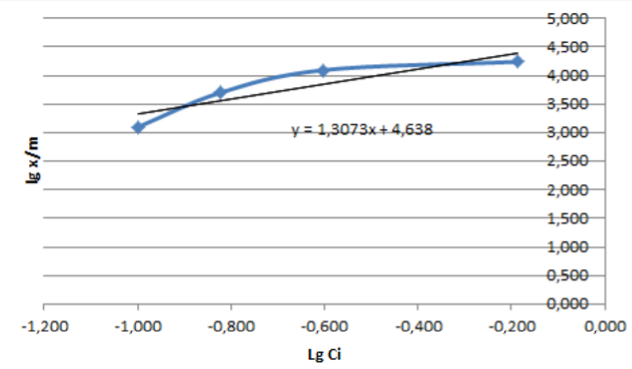
Рисунок 3. Графіки ізотерм адсорбции в звичайних координатах, і в логарифміческих координатах: (на графіку показано рівняння лінії тренда)
Результати. Висновки
З рівняння лінії тренда визначаємо коефіцієнти в уравнении Фрейндлиха (см. Рис 3):
Коэффициент lgβ =__________
Коэффициент 1/n = _____________
Питання для самоперевірки
-
Адсорбційні процеси на межі поділу фаз рідина – газ. Рівняння Гібса. Вплив чинників на адсорбцію.
-
Адсорбційні процеси на межі поділу фаз рідина - тверде тіло.
-
Залежність адсорбції від концентрації (ізотерма адсорбції, рівняння Фрейндліха, рівняння Ленгмюра).
-
Адсорбція із розчинів слабких електролітів.
-
Обмінна адсорбція.
-
Визначення адсорбції оцтової кислоти на активованому вугіллі.
-
Практичне використання процесу адсорбції.
-
50 мл розчину оцтової кислоти з концентрацією 0,1 моль/л збовтували з 5 г активованого вугілля. Адсорбент відфільтрували. На титрування 10 мл фільтрату витратилося 15 мл NaOH з концентрацією 0,05 моль/л. Визначити величину адсорбції.
-
Обчислити величину адсорбції поверхнево-активованої речовини, якщо при зміні об’ємної концентрації в розчині від 0,028 моль/л до 0,056 моль/л поверхневий натяг розчину змінився від 4,33⋅10-2 Н/м до 2,16 ⋅ 10-2 Н/м. Т = 293 К.



