- 4.1 Загальні поняття хімічної кінетики
- 4.2 Швидкість хімічної реакції
- 4.3 Каталіз
- 4.4 Швидкість гетерогенних реакцій
- 4.5 Необоротні та оборотні хімічні реакції. Умова хімічної рівноваги
- 4.6 Константа хімічної рівноваги
- 4.7 Вплив зовнішніх чинників на хімічну рівновагу
Ключові терміни:
активні молекули, активований комплекс, гетерогенні реакції, гомогенні реакції, дифузійний контроль, дифузійний шар, елементарні стадії, енергія активації, ефективні зіткнення, загальний порядок реакції, закон Гульдберга-Вааге, закон діючих мас, закон діючих мас для стану рівноваги, змішаний контроль, зміщення хімічної рівноваги, зсув хімічної рівноваги, каталіз, каталізатор, каталітичні отрути, константа рівноваги, константа швидкості, кінетичне рівняння, кінетичний контроль, лімітуюча стадія, математичний вираз закону діючих мас, механізм реакції, молекулярність реакції, наслідки принципу Ле-Шательє, необоротні реакції, оборотні реакції, порядок реакції за реагентом, правило Вант-Гоффа, принцип Ле-Шательє, промотор, рівноважні концентрації, рівняння Арреніуса, селективність каталізаторів, середня швидкість реакції, стеричний фактор, сучасне формулювання закону діючих мас, температурний коефіцієнт, хімічна кінетика, хімічна рівновага, швидкість гетерогенної реакції, швидкість реакції, інгібітор, істинна швидкість реакції
4.1 Загальні поняття хімічної кінетики
Хімічна термодинаміка дозволяє передбачити принципову можливість чи неможливість самочинного перебігу реакції, а також розрахувати рівноважні концентрації реагуючих речовин. Однак визначенням швидкості і механізму реакції та керування процесом займається хімічна кінетика – розділ хімії, який вивчає швидкість і механізми перебігу хімічних реакцій та їх залежність від окремих чинників.
Хімічна кінетика вирішує дві конкретні задачі, першою з яких є визначення механізму реакції. Механізм реакції – це сукупність і послідовність елементарних стадій, через які проходить хімічна реакція від вихідних речовин до кінцевих продуктів.
Звичайне рівняння реакції містить інформацію тільки про склад і кількість речовин, що вступають у реакцію та утворюються внаслідок неї, але не відображає реальних процесів, які відбуваються в дійсності, тобто не описує елементарних стадій. Елементарні стадії – це проміжні одиничні процеси протягом хімічної реакції, які не можуть бути розділені на простіші акти хімічної взаємодії і які включають зіткнення реагуючих частинок, розрив зв'язків у вихідних сполуках, утворення проміжних сполук і взаємодію між ними, виникнення нових зв'язків і одержання продуктів реакції.
Встановлення механізму пов'язано з класифікацією реакцій за молекулярністю.
Молекулярність реакції – це характеристика, яка визначається кількістю молекул, що беруть участь в елементарній стадії при взаємодії чи перетворенні частинок.
За молекулярністю розрізнюють такі реакції: мономолекулярні, в яких елементарним актом є перетворення однієї молекули (ізомерізація, дисоціація тощо); бімолекулярні – такі реакції, елементарний акт в яких здійснюється при зміненні двох частинок (молекул, іонів, радикалів, атомів); тримолекулярні – в таких реакціях елементарний акт взаємодії відбувається при одночасному зіткненні трьох молекул. Доведено, що одночасне зіткнення більше трьох молекул практично неможливе.
Другою задачею хімічної кінетика вважається кількісний опис хімічної реакції за допомогою кінетичного рівняння. Кінетичне рівняння – це математичний вираз, який описує залежність швидкості реакції від концентрації вихідних речовин і дає можливість визначати змінення кількостей реагентів і продуктів реакції протягом її перебігу.
4.2 Швидкість хімічної реакції
Взаємодія між частинками може відбуватися тільки при їх безпосередньому контакті, який певним чином визначається особливостями реакційного середовища, або реакційного простору.
За ознакою фазового складу реакційного простору в хімічній кінетиці розрізняють: гомогенні реакції, які перебігають в одній фазі одночасно по всьому реакційному простору, причому, між окремими речовинами в реакційній системі відсутня межа поділу; гетерогенні реакції, в яких речовини в реакційній системі відокремлюються одна від одної поверхнею поділу фаз.
Швидкість реакції ϑ – це фізична величина, яка визначається кількістю речовини, що вступає в реакцію чи утворюється внаслідок реакції за одиницю часу в одиниці реакційного простору, тобто в одиниці об’єму для гомогенних реакцій чи на одиниці площі реакційної поверхні – для гетерогенних.
Однак відношення кількості речовини [TEX]\nu[/TEX] до одиниці об’єму [TEX]V[/TEX] – це молярна концентрація [TEX]C[/TEX] ([TEX]C=\nu/V[/TEX]). Тому швидкість гомогенної реакції дорівнює зміненню концентрації вихідної сполуки чи продукту реакції протягом часу. Завдяки стехіометричному співвідношенню речовин у хімічній реакції, контроль за зміненням концентрації звичайно здійснюється тільки для однієї сполуки, яку вибирають з практичних міркувань.
Розрізняють середню та істинну (або миттєву) швидкості реакції.
Середня швидкість реакції ϑсер визначається різницею концентрацій ΔС речовини протягом певного часу Δ[TEX]\tau[/TEX]:
- (4.1)[TEX]ϑ_{сер} = (C_2 – C_1)/(\tau_2 – \tau_1) = ± ΔC/ Δ\tau[/TEX],
- де С2 і С1 – концентрації речовини у кінцевий [TEX]\tau_2[/TEX] і початковий [TEX]\tau_1[/TEX] моменти часу.
Знак «±» у рівнянні (4.1) має такий зміст. Оскільки швидкість реакції завжди є додатною, то при використанні величини ΔС для вихідної речовини, концентрація якої протягом часу зменшується (С2,вих. < С1,вих, С2,вих. – С1,вих. = ΔCвих < 0), беруть знак мінус. Якщо швидкість визначають за зміненням концентрації одного з продуктів реакції, кількість якого поступово зростає (С2,прод > C1,прод, С2,прод – С1,прод = ΔCпрод > 0), то відношення ΔС/Δ[TEX]\tau[/TEX] треба брати із знаком плюс (рис. 4.3).
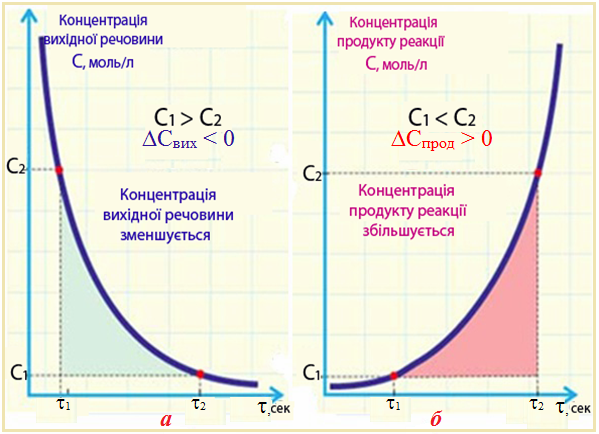
Рисунок 4.3 – Змінення концентрації протягом реакції:
а) вихідного реагенту; б) продукту реакції
У ході реакції змінюються концентрації реагуючих речовин і відповідно змінюється швидкість реакції. Чим коротший проміжок часу [TEX]\Delta \tau[/TEX], тим менше змінення концентрацій [TEX]\Delta C[/TEX] і тим ближче відношення [TEX]\Delta C/\Delta\tau[/TEX] до істинної (або миттєвої) швидкості реакції. Однак концентрації речовин у хімічному процесі змінюються безперервно, тому правильніше говорити не про середню, а про істинну швидкість реакції, яка є похідною від концентрації за часом:
- (4.2)[TEX]\vartheta_{іст}=\dfrac{\text{d}C}{\text{d}\tau}[/TEX].
Як істинну, так і середню швидкості реакції можна визначити графічно – (рис. 4.4) – через тангенс кута нахилу дотичної (ϑіст) до кривої залежності концентрацій від часу чи через тангенс кута нахилу січної (ϑсер):
ϑіст = tg α,
ϑсер = tg β.
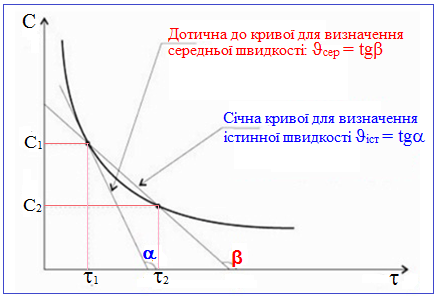
Рисунок 4.4 – Графічне визначення середньої швидкості (ϑсер = ±C / [TEX]\Delta \tau[/TEX] чи ϑсер = tgβ) та істинної швидкості реакції (ϑіст = tgα)
Залежність швидкості реакції від концентрації реагентів
Будь-яка реакція може здійснюватися тільки за умов зіткнення молекул реагуючих речовин, тому швидкість реакції насамперед залежить від числа зіткнень, яке пропорційне концентрації реагентів. Ця закономірність була встановлена Гульдбергом і Вааге і одержала назву закон діючих мас, або закон Гульдберга-Вааге: швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у ступенях, які дорівнюють стехіометричним коефіцієнтам, що стоять перед формулами відповідних речовин у рівнянні реакції.
Для реакції між умовними речовинами A і B з утворенням продуктів L і M, (буквами [TEX]a,\;b,\;l[/TEX] і [TEX]m[/TEX] позначені коефіцієнти)
[TEX]aA+bB\rightarrow lL+mM[/TEX]
математичний вираз закону діючих мас має вигляд:
- (4.3)[TEX]\vartheta=k\cdot C_A^a\cdot C_B^b[/TEX],
де CА і CВ – позначення концентрацій вихідних реагентів А і В, k – константа швидкості, яка не залежить від концентрації реагентів, але залежить від їх природи і температури.
Із рівняння (4.3) випливає фізичний зміст константи швидкості: при концентраціях вихідних реагентів СА = СВ = 1 моль/л (або за умови СА ⋅ СВ = 1) константа швидкості чисельно дорівнює швидкості реакції. При постійній температурі константа швидкості реакції між певними сполуками має сталу величину і характеризує природу реагуючих речовин.
Як довів досвід, закон Гульдберга-Вааге виявився справедливим тільки для обмеженого кола реакцій з невеликими стехіометричними коефіцієнтами, сума яких не перевищує 3, а для складніших процесів розрахунки за рівнянням (4.3) дають значну похибку. Це пов’язано з тим, що для більшості взаємодій сумарне рівняння реакції не відображає дійсного механізму процесу з безліччю проміжних стадій, а є загальним виразом для вихідних речовин і продуктів. Тому показники ступенів у рівнянні (4.3) не завжди повинні збігатися з стехіометричними коефіцієнтами. Насправді показники ступенів мають формальний характер і визначаються експериментально.
При цьому кінетичне рівняння відповідно до закону діючих мас набуває точнішого математичного вигляду:
- (4.4)[TEX]\vartheta=k\cdot C_A^{n_A}\cdot C_B^{n_B}[/TEX],
де nA i nB – порядки реакції за відповідними реагентами, вони визначаються на практиці для кожної окремої реакції, а їх сума nА + nВ = n – це загальний порядок реакції, який і характеризує механізм процесу.
Порядок реакції за реагентом – це експериментально визначена величина, що дорівнює показнику ступеня, до якого необхідно піднести концентрацію даного реагенту, щоб теоретично розрахована швидкість реакції дорівнювала встановленій практично.
Поняття порядок реакції було введене в сучасне формулювання закону діючих мас: швидкість реакції пропорційна добутку концентрацій реагентів у ступенях, що дорівнюють порядкам реакцій за відповідними реагентами.
Реакції можуть мати різні порядки, у тому числі й дробові. Залежно від порядку реакції розглядають такі типи реакцій:
-
Реакції нульового порядку, що проходять з постійною швидкістю протягом часу (ϑ = const), яка не залежить від концентрацій реагуючих речовин. Нульовий порядок характерний для гетерогенних реакцій, для яких швидкість дифузії реагентів до поверхні поділу фаз менша, ніж швидкість їх безпосереднього хімічного перетворення.
-
Реакції першого порядку залежать від концентрації тільки одного реагенту, тому описується кінетичним рівнянням
- (4.5)[TEX]ϑ = k·С[/TEX].
-
Реакції другого порядку. Швидкість реакції другого порядку для умовних реагентів А і В підкоряється кінетичному рівнянню
ϑ = k CA·CB,
яке при однакових концентраціях вихідних реагентів (СА = СВ = С) набуває простішого вигляду:
- (4.11)[TEX]ϑ = k·C^2[/TEX].
-
Реакції дробового порядку зустрічаються надзвичайно рідко.
4.2.2 Енергія активації
Загальною умовою елементарного акту хімічної взаємодії є зіткнення частинок. Однак не кожне зіткнення реакційноздатних молекул завершується хімічною взаємодією між ними. Для того, щоб реакція дійсно відбулася, необхідна геометрична відповідність між активними центрами частинок, яка називається стеричний фактор.
Під час хімічної реакції руйнуються одні хімічні зв’язки та утворюються інші, а це завжди супроводжується перерозподілом електронної густини, внаслідок чого частина молекул – так звані активні молекули – завжди має певний надлишок енергії порівняно з середньою енергією реакційної системи.
Активні молекули – це такі молекули, які внаслідок невпорядкованих зіткнень і перерозподілу енергії в системі набувають певного надлишку енергії та стають здатними до хімічної взаємодії.
Як доводить молекулярно-кінетична теорія газів і рідин, кількість зіткнень настільки велика, що всі реакції повинні відбуватися миттєво. Але цього не спостерігається і лише окремі зіткнення завершуються хімічною взаємодією, оскільки не всі частинки мають достатню енергію для подолання енергетичного бар’єру. Виникнення енергетичного бар’єру зумовлюється необхідністю енергетичних витрат для розриву зв’язків у молекулах реагентів і відштовхуванням між їх електронними оболонками. Отже, не кожне зіткнення є ефективним. Ефективні зіткнення – це такі, при яких енергія молекул є не тільки достатньою для розриву старих зв’язків у молекулах вихідних реагентів, але і перевищує енергію відштовхування (тобто енергетичний бар’єр) між електронними оболонками реагуючих частинок.
Під час ефективних зіткнень реакційна система проходить через проміжний стан, який називають активований комплекс – перехідний стан системи при хімічній реакції, коли старі зв’язки в молекулах вихідних реагентів ще не розірвані, але вже послаблені, а нові намітилися, але ще не утворилися.
Час існування активованого комплексу дуже невеликий (приблизно 10–13 с). При його руйнуванні утворюються або продукти реакції, або знов вихідні речовини. Енергія переходу речовини в стан активованого комплексу, яка дорівнює різниці між середньою енергією молекул реакційної системи і енергією, необхідною для перебігу хімічної реакції, називається енергія активації.
Під час хімічного процесу перехід системи від вихідних речовин з енергетичним станом Евих до продуктів реакції з енергетичним станом Епрод здійснюється через енергетичний бар’єр, який визначається енергією активації реакції Еакт. При цьому різниця енергій у вихідному і кінцевому станах дорівнює тепловому ефекту реакції: ΔН = Епрод – Евих.
Графічно хід реакції зображується за допомогою енергетичної діаграми (рис. 4.11), в якій вісь ординат відображує енергію реакційної системи, а вісь абсцис – координату реакції, якою може бути будь-який контрольований параметр, що змінюється протягом реакції, наприклад: концентрація вихідної речовини чи продукту реакції, густина, об’єм газу, маса осаду тощо.
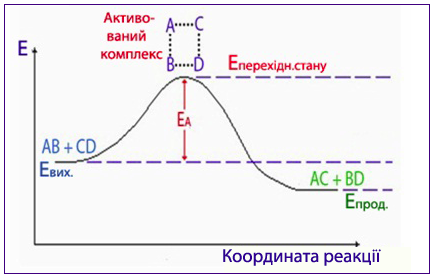
Рисунок 4.11 – Енергетична діаграма умовної реакції АВ + СD → АС + ВD, де ЕА – енергія активація, Евих. і Епрод. – середня енергія вихідних реагентів і продуктів реакції відповідно
Слід звернути увагу, що енергія системи у перехідному стані активованого комплексу завжди має більшу величину, ніж у вихідному і кінцевому станах. Причому перебіг екзотермічних реакцій потребує меншої енергії активації, ніж ендотермічних.
4.2.3 Вплив температури на швидкість реакції
Вплив температури на швидкість реакції оцінюється за допомогою емпірично встановленої закономірності, яка називається правило Вант-Гоффа: підвищення температури на кожні 10 градусів збільшує швидкість реакції приблизно у 2-4 рази:
- (4.15)[TEX]\vartheta_2 =\vartheta_1 \cdot \gamma^{(T_2-T_1)/10} [/TEX],
де (Т2 – Т1) = ΔТ – різниця температур між початковю Т1 і кінцевою Т2, ϑ1 і ϑ2 – початкова і кінцева швидкість реакції, [TEX]\gamma[/TEX] – температурний коефіцієнт швидкості, який показує, у скільки разів зростає швидкість реакції при підвищенні температури на десять градусів. Значення температурного коефіцієнта для ендотермічних реакцій вище, ніж для екзотермічних [TEX](\gamma_{енд}>\gamma_{екз})[/TEX]. Для більшості реакцій γ змінюється у межах 2-4.
Якщо перетворити рівняння Вант-Гоффа (4.15), поділивши ліву і праву його частини на ϑ1, одержимо рівняння вигляду
[TEX]\vartheta_2/\vartheta_1=\gamma^{(T_2-T_1)/10}[/TEX],
за допомогою якого легко обчислювати, у скільки разів швидкість реакції ϑ2 при кінцевій температурі Т2 більше (чи менше) початкової швидкості ϑ1 при температурі Т1.
Рівняння (4.15) зручно використовувати лише для приблизних розрахунків, тому що воно є справедливим за умови помірних температур і невеликого їх інтервалу. Точніше вплив температури на швидкість реакції відображає рівняння Арреніуса:
- (4.16)[TEX]k=k_0\cdot \text{e}^{-E_A/RT}[/TEX],
де k – константа швидкості реакції, k0 – передекспоненційний множник Арреніуса, пропорційний кількості зіткнень між молекулами, ЕА – енергія активації (для більшості хімічних реакцій ЕА = 40-400 кДж/моль).
4.3 Каталіз
Каталізатор – це речовина, що збільшує швидкість реакції, кількісно і якісно при цьому не змінюючись. Явище змінювання швидкості реакції під впливом каталізатора називається каталіз.
Речовина, яка уповільнює швидкість хімічних процесів, а сама при цьому не змінюється, називається інгібітор.
Однак надалі зосередимося тільки на прискорюючому впливі каталізаторів.
Каталізаторам притаманні деякі специфічні особливості. Не піддаючись якісним і кількісним зміненням внаслідок реакції, каталізатори зменшують енергію активації, але не впливають при цьому на термодинамічні показники реакції (ΔН, ΔG, ΔS) і на константу хімічної рівноваги, рівною мірою збільшуючи швидкість як прямої, так і зворотної реакцій.
Механізм дії каталізаторів дуже складний і не до кінця вивчений. Однак достовірно доведено, що вони зменшують енергію активації процесу, напрямляючи його перебіг іншим шляхом, через інші проміжні стани. Активований комплекс у присутності каталізатора має меншу енергію, ніж комплекс без каталізатора, тому енергія активації каталітичної реакції ЕА,к нижча за енергію активації некаталітичної реакції ЕА, тобто молекулам реагентів для взаємодії необхідно подолати значно нижчий енергетичний бар’єр.
За своїм агрегатним станом каталізатори бувають твердими, рідкими і газоподібними, тому каталітичні процеси поділяються на гомогенні і гетерогенні.
При гомогенному каталізі всі реагуючі речовини утворюють з каталізатором одну фазу (газоподібну або рідку). Механізм гомогенного каталізу пояснюється на основі проміжних сполук, які каталізатор утворює з реагентами і сприяє зменшенню енергії активації. Наприклад, реакція між умовними реагентами А і В, яка проходить через активований комплекс AB* за схемою
А + В → AB* → AB,
за наявності каталізатора перебігає через два (чи більше) проміжні стани:
А + Кat → AKat* → AKat,
AKat + B → AKatB* → AB + Kat.
До гомогенних каталітичних процесів належать численні природні процеси, що прискорюються ферментами – біологічними каталізаторами (звичайно це білкові молекули), завдяки яким швидкість реакцій у клітинах зростає в десятки тисяч разів.
При гетерогенному каталізі реагенти і каталізатори перебувають у різних фазах і відокремлюються один від одного межею поділу. Як правило, гетерогенними є тверді каталізатори, на поверхні яких реагують газоподібні речовини. Сумарна швидкість перетворення на гетерогенному каталізаторі залежить від площі його поверхні, тому звичайно використовують каталізатори з розвиненою поверхнею або наносять їх тонким шаром на пористий носій (активоване вугілля, силікагель тощо).
Існує декілька теорій гетерогенного каталізу. Згідно з найбільш вичерпною теорією Баландіна для здійснення каталізу необхідна геометрична відповідність між параметрами кристалічної решітки каталізатора і довжинами хімічних зв’язків у молекулах реагентів та продуктів реакції. У більшості теорій припускається, що реакція перебігає не на всій поверхні каталізатора, а лише на активних центрах – ділянках, де забезпечуються оптимальні умови процесу. Кількість активних центрів визначається складом поверхневого шару, способом приготування каталізатора і обробки його поверхні.
Важливою властивістю є селективність каталізаторів (вибірність) – здатність спрямовувати взаємодію одних і тих же самих речовин у різних напрямках для одержання бажаних продуктів.
Каталітична активність багатьох каталізаторів зростає при додаванні невеликих кількостей промоторів. Промотор – каталітично неактивна речовина, присутність якої посилює дію каталізаторів. У той же час існують речовини, які погіршують каталітичну активність каталізаторів – каталітичні отрути.
Каталізатори мають важливе значення, оскільки забезпечують економію енергії та сировини і допомагають вирішувати екологічні проблеми (очищення стічних вод, промислових та автомобільних викидів). Застосування каталізаторів стає необхідним і при створенні екологічно чистих маловідходних технологій.
4.4 Швидкість гетерогенних реакцій
Гетерогенні реакції відбуваються на поверхні поділу фаз, яка і вважається реакційним простором.
Швидкість гетерогенної реакції – це величина, яка визначається зміненням кількості речовини, що вступає в реакцію чи утворюється внаслідок неї за одиницю часу на одиниці площі поверхні фаз.
[TEX]\vartheta_{гетерог}=\pm \dfrac{\Delta \nu}{S\Delta \tau}[/TEX],
де [TEX]\Delta\nu[/TEX] – різниця між кількістю речовини [TEX](\Delta \nu=\nu_2-\nu_1)[/TEX] в кінцевий [TEX]\tau_2[/TEX] і початковий [TEX]\tau_1[/TEX] моменти часу, S – площа поверхні.
Особливістю кінетики гетерогенних реакцій є вплив площі реакційної поверхні на швидкість реакції. Залежність швидкості реакції від площі поверхні контакту фаз має дуже складний характер, але її якісне оцінювання є очевидним: при збільшенні площі дотику реагуючих речовин швидкість гетерогенної реакції зростає.
Слід пам’ятати важливе правило: якщо в гетерогенній реакції безпосередньо бере участь тверда речовина, то в кінетичне рівняння не входить його концентрація, яка вважається постійною протягом реакції.
Більшість гетерогенних реакцій складається з трьох основних стадій: підведення однієї реагуючої речовини до поверхні іншої; хімічна взаємодія на поверхні поділу фаз; відведення продукту від поверхні.
Найповільніша стадія, яка практично визначає швидкість реакції в цілому, називається лімітуюча стадія.
Другою особливістю швидкості гетерогенної реакції є її залежність від швидкості подачі реагенту в реакційну зону.
Найбільше змінення концентрації спостерігається у тонкому шарі реагенту поблизу реакційної поверхні, який називається дифузійний шар. Перенесення речовини в ньому здійснюється за рахунок дифузії. При перемішуванні товщина дифузійного шару зменшується і відповідно зростає швидкість підведення реагентів. Якщо швидкість дифузії нижча, ніж швидкість хімічної взаємодії, то лімітуючою стадією є дифузія. В такому випадку говорять, що має місце дифузійний контроль. Коли швидкість дифузії достатньо висока, то спостерігається кінетичний контроль, при якому процес лімітується власне хімічною реакцією. А якщо швидкості дифузії і хімічної реакції порівнянні, то має місце змішаний контроль.
Гетерогенні процеси мають важливе значення у техніці; до них належать корозія металів і сплавів, горіння твердого палива, випалювання сульфідних руд тощо.
4.5 Необоротні та оборотні хімічні реакції. Умова хімічної рівноваги
Необоротні реакції – це такі хімічні реакції, які перебігають лише у прямому напрямі і тривають до повного витрачання реагентів.
Для необоротних реакцій притаманні такі ознаки: а) виділення осаду чи газу; b) утворення малодисоційованих сполук – слабких електролітів: води, слабкої кислоти чи слабкої основи; с) виділення великої кількості теплоти (горіння, вибух).
З точки зору термодинаміки, відповідно до рівняння Гіббса (ΔG = ΔH – TΔS) необоротні процеси супроводжуються зменшенням ентальпії (ΔН < 0) і збільшенням ентропії (ΔS > 0) – за таких умов енергія Гіббса завжди матиме від’ємне значення (ΔG < 0), а це свідчить про можливість самочинного протікання необоротних реакцій.
Оборотні реакції – це такі хімічні реакції, які можуть відбуватися як у прямому, так і в зворотному напрямах.
Отже, головною відмінністю оборотних реакцій є можливість перебігу прямої (→) і зворотної (←) реакцій. У рівняннях оборотних реакцій замість знаку рівності (=) або стрілки (→) використовують подвійну стрілку, напрямлену в протилежні боки (↔ чи ⇔).
Оборотні реакції найчастіше супроводжуються зменшенням ентальпії (ΔН < 0) і ентропії (ΔS < 0) системи, причому ΔG може мати від’ємне значення (якщо переважає ентальпійний фактор ΔН) або додатне (при високих температурах, коли переважає ентропійний фактор Т·ΔS). Для таких процесів за певних умов можливий перебіг як прямої, так і зворотної реакцій.
При деякій температурі ентальпійний (ΔН) і ентропійний (Т·ΔS) фактори можуть зрівнятися, дві протилежних тенденції будуть зрівноважувати одна одну, тобто ΔН = Т · ΔS і ΔG = 0. Це є термодинамічною умовою хімічної рівноваги. Хімічна рівновага – це такий стан системи, при якому концентрації всіх речовин залишаються незмінними, а швидкості прямої та зворотної реакцій є однаковими.
Хімічна рівновага має динамічний характер. Це означає, що незмінність концентрації кожної речовини, що входить до складу реакційної системи, забезпечується не припиненням взаємодії, а тим, що швидкість прямої реакції дорівнює швидкості зворотної. З цієї причини кількість будь-якої речовини, що витрачається внаслідок перебігу однієї реакції, компенсується за рахунок утворення такої ж кількості цієї речовини у результаті реакції в протилежному напрямку.
4.6 Константа хімічної рівноваги
У стані хімічної рівноваги концентрації (або парціальні тиски газів у випадку газофазних взаємодій) вихідних речовин і продуктів реакції, називаються рівноважні концентрації (або рівноважними парціальними тисками).
Для реакції загального вигляду
[TEX]aA+bB\leftrightarrow lL+mM[/TEX]
швидкості прямої (ϑ1) і зворотної (ϑ2) реакцій відповідно до закону діючих мас виражаються кінетичними рівняннями:
[TEX]\vartheta_1=k_1[A]^a\cdot [B]^b[/TEX], [TEX]\vartheta_2=k_2[L]^l\cdot [M]^m[/TEX],
де за допомогою квадратних дужок ([A], [B], [L], [M]) позначені рівноважні концентрації умовних речовин A, B, L і M, а буквами [TEX]a,\;b,\;l[/TEX] і [TEX]m[/TEX] – коефіцієнти перед формулами відповідних речовин. Нагадаємо, що при більш точних розрахунках замість коефіцієнтів використовують величини експериментально визначених порядків реакції за відповідними реагентами.
Але у стані хімічної рівноваги швидкості прямої та зворотної реакцій однакові (ϑ1 = ϑ2), тому можна прирівняти і праві частини кінетичних рівнянь:
[TEX]k_1[A]^a\cdot [B]^b=k_2[L]^l\cdot [M]^m[/TEX].
Якщо спочатку поділити ліву і праву частини одержаної рівності на константу швидкості зворотної реакції k2, а потім – на добуток концентрацій вихідних речовин [A]a·[B]b, то після необхідних скорочень одержимо вираз
-
(4.20)
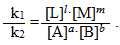
При даній температурі константи швидкості прямої k1 і зворотної k2 реакцій є величинами сталими, тому їх відношення k1/k2 теж стала величина, яка позначається великою літерою К і називається константа рівноваги:
-
(4.21)
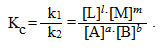
Аналогічний вигляд матиме константа рівноваги для газофазних реакцій, однак замість концентрації речовин використовують парціальні тиски газів (Р′):
-
(4.22)
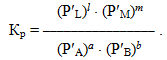
Рівняння (4.21) і (4.22) є варіантами математичного виразу закону діючих мас для стану рівноваги: При постійній температурі відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у ступенях, що дорівнюють стехіометричним коефіцієнтам (або точніше, порядкам реакції за відповідними реагентами), являє собою сталу величину і називається константа рівноваги.
Оскільки константа рівноваги пов’язана з енергією Гіббса рівнянням ізотерми Вант-Гоффа
- (4.23)[TEX]\Delta G^0=-RT\ln{K_p}[/TEX],
то за відомим значенням ΔG можна розрахувати константу хімічної рівноваги:
- (4.24)[TEX]K_p=\exp(\Delta G^0/RT)[/TEX].
4.7 Вплив зовнішніх чинників на хімічну рівновагу
Стан хімічної рівноваги за постійних умов може зберігатися будь-який час. Проте при зміненні умов стан рівноваги порушується. Процес змінювання концентрацій речовин, викликаний порушенням стану рівноваги, називається зміщення хімічної рівноваги, або зсув хімічної рівноваги.
Характер зміщення рівноваги залежно від дії зовнішніх чинників визначає принцип Ле-Шательє (1882 р.): якщо на систему, що перебуває в стані хімічної рівноваги, подіяти зовнішнім чинником, то рівновага зміщується у напрямі процесу, який послаблює цю дію.
З принципу Ле-Шательє випливає ряд загальних положень.
- при збільшенні концентрації деякої речовини в рівноважній системі рівновага зміщується в бік витрачання цієї речовини; при зменшенні концентрації – у бік її утворення;
- при підвищенні температури рівновага системи, що перебуває у стані рівноваги, зміщується у напрямку ендотермічної реакції, а при зниженні – у бік екзотермічної;
- підвищення тиску приводить до зміщення рівноваги у бік утворення меншої кількості молекул газу (тобто речовин, які займають менший об′єм), а при зниженні тиску – у бік утворення більшої кількості молекул газу;
- якщо об′єм системи під час реакції не змінюється, то змінення тиску не впливає на стан рівноваги;
- каталізатор, однаково прискорюючи і пряму і зворотну реакції, не зміщує рівновагу, але сприяє її скорішому встановленню.
Принцип Ле-Шательє має велике практичне значення, особливо для хімічної промисловості. Однак він справедливий не тільки для хімічних реакцій, а поширюється на всі системи, що перебувають у стані динамічної рівноваги.



