- 5.1 Електронні ефекти
- 5.2 Вплив електронних ефектів на реакційну здатність речовин
- 5.3 Розрив хімічних зв'язків при взаємодії органічних сполук
5.1 Електронні ефекти
Відповідно до сучасних теорій щодо будови органічних сполук їх реакційна здатність великою мірою залежить від взаємного впливу атомів у молекулі, який зумовлюється характером розподілу електронної густини і особливостями хімічних зв’язків (див. § 4.1). Це явище пов’язане з електронними ефектами, що діють в молекулах субстрату і реагенту.
Електронний ефект – зміщення електронної густини в молекулі під впливом замісників чи кратних зв’язків.
Виникнення в молекулі електронних ефектів, які впливають на реакційну активність окремих ділянок молекули, зумовлює специфічні особливості взаємодії між органічними речовинами.
Електронні ефекти поділяються на два типи: індуктивний і мезомерний.
5.1.1 Індуктивний ефект
Індуктивний ефект І – це зміщення електронної густини по ланцюжку σ-зв'язків, що зумовлюється різницею електронегативності хімічно сполучених атомів.
Напрямок індуктивного ефекту І позначають стрілкою, яка співпадає із σ-зв’язком. Наявність в молекулі полярного ковалентного σ-зв’язку спричиняє поляризацію найближчих двох-трьох σ-зв’язків, внаслідок чого виникають часткові заряди на сусідніх атомах, які позначаються грецькою буквою дельта з відповідним знаком: δ+ і δ–. Індуктивний ефект передається по системі σ-зв'язків із затуханням, а напрямок зміщення електронної густини σ-зв’язків залежить від природи замісників Х і Y:
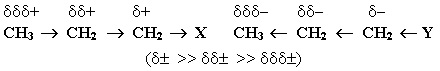
Атом більш електронегативного елемента – електроноакцептор – відтягує електронну густину на себе і набуває часткового негативного заряду (δ–). Його партнер по σ-зв'язку має рівний за величиною дефіцит електронної густини, тобто частковий позитивний заряд (δ+), і називається електронодонор.
Залежно від напрямку зміщення електронної густини σ-зв'язку індуктивний ефект може бути позитивним (+І) і негативним (–І).
Негативний індуктивний ефект (–І) приписують тим атомам і групам, які зміщують електронну густину σ-зв’язку у свій бік, а позитивний індуктивний ефект (+І) – тим, від яких електронна густина σ-зв’язку зміщується.
Негативний індуктивний ефект (–І) виявляють електроноакцептори – атоми і атомні групи, що здатні притягувати електронну густину зв'язку сильніше, ніж атоми Н. До них належать: галогени (Hal: F, Cl, Br, I), =O, –OH, –NO2, –NH2 (або заміщені аміногрупи: –NHR, –NR2), –COOH, –CH=O, –COOR, –CN, –CH=CH2, –C≡CH, –CF3 тощо. Сила негативного індуктивного ефекту –І зменшується у ряді:
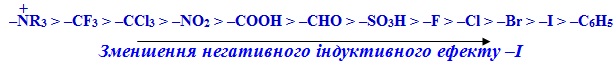
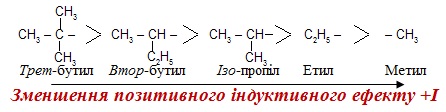
Позитивний індуктивний ефект (+І) виявляють електронодонори – атоми і атомні групи, що притягують електронні пари зв'язку слабше, ніж атоми Н; +І-ефект характерний для атомів металів Ме і насичених алкільних радикалів –CnH2n+1; причому, чим більш розгалужену будову має радикал, тим більший за величиною його позитивний індуктивний ефект:
Загальний висновок щодо індуктивного ефекту: виявляється тільки при наявності в молекулі полярних σ-зв’язків і атомів з різною електронегативністю; розповсюджується лише в одному напрямку через σ-зв’язки; швидко затухає по ланцюгу σ-зв’язків; максимальна відстань впливу індуктивного ефекту – чотири σ-зв’язки.
5.1.2 Спряжені системи
Якщо спільна електронна пара, що утримає разом два атоми, перебуває в полі ядер сполучених атомів, то утворюється локалізований зв’язок. На відміну від нього, делокалізований зв’язок – це зв’язок, електронна пара якого розосереджена між декількома (трьома чи більше) ядрами атомів. Подібна делокалізація (розосередження) електронів характерна для спряжених π-зв’язків, тобто кратних зв'язків, що чергуються з одинарними.
Спряження – розосередження по молекулі (або по її окремому фрагменту) електронної густини π-зв'язків чи замісників, які мають надлишок або, навпаки, дефіцит електронної густини.
Надлишок електронної густини в заміснику забезпечується за рахунок неподілених електронних пар гетероатомів (О, S, N), а дефіцит електронної густини – за рахунок вакантних орбіталей. Завдяки спряженню відбувається перерозподіл і вирівнювання (делокалізація) π-електронної густини і утворення єдиної спільної π-електронної системи.
Спряжені системи називаються ще кон’югованими, а явище спряження – кон’югація (від лат. сonjugate – перекривання, накладення), оскільки відбувається додаткове перекривання π- і р-атомних орбіталей, які мають паралельні осі симетрії, – так звані компланарні орбіталі. В загальному випадку обов’язковою умовою спряження є компланарність – розташування в одній площині всіх атомів, що беруть участь в цьому процесі. Спряження сприяє перерозподілу і вирівнюванню (тобто делокалізації) π-електронної густини і утворенню єдиної спільної π-електронної системи.
Як випливає з визначення, до спряжених систем належать молекули, в яких спостерігається чергування простих і кратних зв'язків, або молекули, в яких поруч з атомом Карбону при кратному зв'язку знаходиться гетероатом, що має вакантну орбіталь чи, навпаки, неподілену пару електронів. Спряжені системи можуть мати відкритий чи замкнутий ланцюг.
Делокалізація π-електронів у спряженій системі приводить до того, що кратність зв'язків набуває дробових значень, тобто зв’язки вже не можна віднести ні до подвійних (або потрійних), ні до одинарних. Тому для графічного зображення спряжених систем при необхідності звертаються до запропонованих Л.Полінгом форм запису, які відображають резонансні структури – уявний набір проміжних станів, через які спряжена система миттєво переходить в обидва боки з однієї пограничної структури в іншу. Наприклад, для нітробензену С6Н5–NО2 резонансні структури можуть мати такий вигляд:
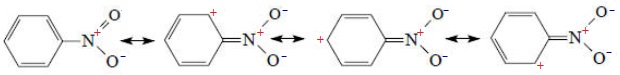
Залежно від вигляду орбіталей, що перекриваються, розрізняють декілька видів спряження.
І. π,π-Спряження виникає, коли прості і кратні (подвійні чи потрійні) зв’язки розміщуються в молекулі почергово, наприклад:
![]()
Найпростішим прикладом π,π-спряження є будова бута-1,3-дієну: в ньому всі чотири атоми Карбону перебувають у sp2-гібридизованому стані, утворюючи по три гібридизовані орбіталі, вісі яких розміщуються на одній площині під кутом 120о(рис. 5.1). Кожна з цих орбіталей при перекривання з sp2-гібридизованою орбіталлю сусіднього атома С чи з s-орбіталлю атома Н утворює σ-зв’язок, а разом вони складають σ-скелет молекули. Вісі sp2-гібридизованих орбіталей кожного атома Карбону знаходяться на одній площині, а вісі негібридизованих рz-орбіталей розміщуються компланарно – перпендикулярно до площини σ-скелету і паралельно одна відносно одної. Це створює умови їх взаємного перекривання над і під площиною σ-скелету молекули не тільки між атомами С1–С2 і С3–С4, але й частково – між С2–С3. Завдяки такому боковому перекриванню чотирьох рz-орбіталей утворюється єдина π-електронна хмара – π,π-спряження зв'язків, при якому π-електрони вже не належать окремим зв'язкам, а делокалізуються по спряженій системі в цілому.
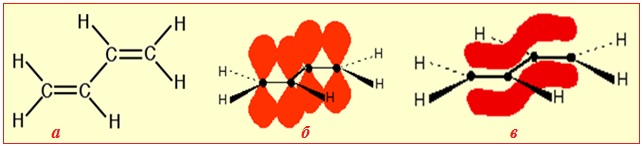
Рисунок 5.1 – Будова бута-1,3-дієну: а) структура, що відображає плоский σ-скелет молекули; б) компланарне розташування pz-електронних негібридизованих орбіталей чотирьох атомів С; в) утворення спряженої системи – єдиной π-електронної хмари над і під площиною σ-скелету молекули
Спряжені системи характеризуються підвищеною термодинамічною стійкістю, оскільки спряження є енергетично вигідним процесом. Делокалізація π-електронної густини (тобто її більш менш рівномірний розподіл по всій спряженій системі, по всіх зв'язках і атомах) супроводжується виділенням енергії. Енергія, що вивільняється за рахунок спряження, називається енергія делокалізації, або енергія спряження.
Типовим прикладом делокалізації зв’язків в замкнутому ланцюгу є молекула бензену, в якій відбувається колове π,π-спряження. Причому, найбільша електронна густина в цій спряженій системі розміщується над і під площиною σ-скелету молекули і однаковою мірою охоплює всі шість атомів С у циклі (рис. 5.2).
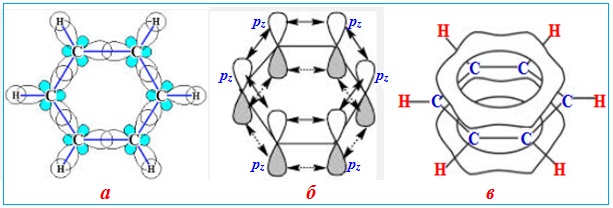
Рисунок 5.2 – Будова молекули бензену С6Н6: а) σ-скелет молекули, утворений σ-зв‘язками (шість зв’язків С–С при взаємному перекриванні sp2-гібридизованих орбіталей сусідніх атомів Карбону і шість зв’язків С–Н при перекриванні sp2-гібридизованих орбіталей атомів Карбону з s-орбіталями атомів Н; б) розташування шести компланарних негібридизованих pz-орбіталей перпендикулярно площині σ-скелету; в) утворення колового спряження делокалізованої π-електронної хмари над і під площиною σ-скелету молекули
Колове спряження в молекулі бензену зумовлює велику енергією спряження (або енергію делокалізації, яка дорівнює 150,7 кДж/моль) і вирівнювання зв'язків між атомами Карбону: їх довжина стає проміжною між довжинами подвійного і одинарного зв'язків, а кратність зв'язків С–С в молекулі С6Н6 становить 1,67.
ІІ. р,π-Спряження виникає в системі з таким чергуванням фрагментів: подвійний зв’язок – одинарний σ-зв’язок – р-орбіталь. Причому, р-орбіталь може містити неподілену електронну пару, один неспарений електрон чи бути вакантною (0 електронів). Відповідними до такої кількості електронів прикладами р,π-спряження можуть бути системи типу СН2=СН–Х, в яких замісником Х виступає або атом галогену (:F, :Cl, :Br, :I), або sp3-гібридизований атом Карбону ·CH2, в якому на орбіталі міститься один неспарений електрон (його позначають точкою), або sp3-гібридизований атом Карбону з вакантною орбіталлю □C+H2 (у формулі вакантна орбіталь позначається за допомогою квадратика квантової комірки), за рахунок чого на ньому скупчується позитивний заряд, – так званий карбоній-катіон.
5.1.3 Мезомерний ефект
Мезомерний ефект М, або ефект спряження – це зміщення електронної густини в спряженій системі від замісників, які мають неподілені електронні пари чи вакантні орбіталі.
Мезомерний ефект М у порівнянні з індуктивним І викликає сильніший зсув електронної густини і практично не затухає по ланцюгу.
За направляючою дією замісника мезомерний ефект поділяється на позитивний (+М) і негативний (–М). Позитивний мезомерний ефект (+М-ефект) характерний для електронодонорних замісників, які зміщують π-електронну густину від себе за рахунок атомів з неподіленою електронною парою або з повним негативним зарядом. Замісники з позитивним мезомерним ефектом:
![]()
![]()
![]()
Негативний мезомерний ефект (–М-ефект) характерний для електроноакцепторних замісників, які знижують електронну густину в спряженій системі, відтягуючи спільну електронну густину у свій бік. До замісників з негативним мезомерним ефектом належать такі атомні групи:
![]()
![]()
На відміну від індуктивного ефекту мезомерний ефект передається на значно більшу відстань, причому і сам замісник входить до складу спряженої системи.
Графічно зміщення електронної густини у спряженій системі позначається за допомогою вигнутих стрілок, початок яких показує, від яких р- чи π-електронів відбувається зміщення, а кінець – вказує на атом чи зв’язок, у напрямку яких вона зміщується. Найчастіше вплив мезомерного ефекту набагато перебільшує дію індуктивного. Одна і та сама група атомів може виявляти одночасно два електронних ефекти: мезомерний та індуктивний, які можуть або збігатися за напрямком свого впливу, або діяти в протилежні боки, наприклад:
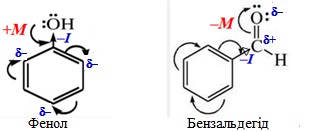
5.2 Вплив електронних ефектів на реакційну здатність речовин
Дію електронних ефектів на реакційну здатність речовин і швидкість реакції можна спостерігати на прикладі багатьох хімічних процесів.
Розглянемо, як впливає індуктивний ефект на перебіг реакцій на прикладі процесів галогенування. Встановлено, що в ряді сполук СН4, СН3Cl, СН2Cl2, CHCl3 найскладніше відбувається монохлорування метану СН4, а галогенопохідні метану взаємодіють з хлором дуже легко.
![]()
![]()
Різниця в швидкості перебігу наведених реакцій пояснюється дією індуктивного ефекту. В метані СН4 зв'язки С–Н є мало полярними і не викликають індуктивних ефектів, а в хлорметані СН3Cl за рахунок негативного індуктивного ефекту атома Хлору відбувається поляризація σ-зв'язків С–Н, що значно полегшує їх розрив і заміщення атомів Гідрогену атомами Хлору.
Алкани з більшою довжиною ланцюгу теж вступають в реакції галогенування, які проходять значно легше, ніж з метаном, оскільки метильні радикали –CН3, виявляючи позитивний індуктивний ефект +І, спричиняють поляризацію (і послаблення) зв’язків С–Н у сусіднього атома Карбону. Саме тому реакція відбувається селективно (вибірним чином) – переважно біля третинного атома Карбону.
Мезомерний ефект в реакціях за участю спряжених систем виявляє ще помітнішу дію. Наявність в спряженій системі замісника з певним мезомерним ефектом змінює як реакційну здатність речовини, так і напрямок перебігу реакції порівняно з тими, що є характерними для вихідної системи, в якій замісник відсутній. Яскравими прикладами таких змін можуть бути похідні бензену з електронодонорними чи електроноакцепторними замісниками. Молекула бензену – це спряжена система з рівномірним і симетричним розподілом шестиелектронної π-електронної хмари. Однак наявність у бензеновому кільці замісника призводить до певного перерозподілу електронної густини і, як наслідок, до змінення реакційної здатності сполуки. Тобто замісник виявляє орієнтуючу дію при введенні у кільце ще одного, нового, замісника, який внаслідок реакції заміщення може займати мета-, орто- і пара-положення, утворюючи відповідні ізомерні продукти (рис. 5.3).
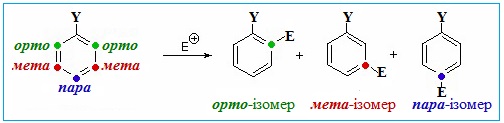
Рисунок 5.3 – Можливе розташування другого замісника Е в похідному бензену С6Н5–Y внаслідок реакції заміщення одного з атомів Гідрогену в бензеновому кільці
За характером орієнтуючої дії при реакціях заміщення атомів Н в бензеновому кільці замісники поділяються на два типи.
Електронодонорні замісники (замісники І роду), які за рахунок позитивного мезомерного (+М) чи індуктивного (+І) ефекту підвищують електронну густину бензенового кільця (особливо в о- і n-положеннях). Завдяки загальному збільшенню електронної густини спряженої системи, утвореної π-електронною хмарою бензенового кільця і неподіленою електронною парою замісника, виявляється прискорюючий ефект на швидкість реакцій заміщення. Такі замісники називаються активуючими.
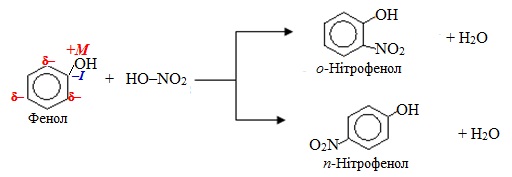
Оскільки електронодонорний замісник утворює з кільцем загальну спряжену систему, то перерозподіл електронної густини відбувається таким чином, що найбільша її частина зосереджується в о- і n-положеннях на атомах С. З цієї причини електронодорні замісники часто називають орто-орієнтанти і пара-орієнтанти. За рахунок виникнення часткових негативних зарядів (δ–) полярність зв'язків С–Н в о- і n-положеннях збільшується, тому зростає рухливість атомів Н, що полегшує їх заміщення. До електронодонорних замісників належать атоми і атомні групи з позитивним мезомерним (+М) чи індуктивним (+І) ефектом.
Подвійний (о- і n-) орієнтуючий вплив електронодонорних замісників приводить до утворення внаслідок реакцій суміші ізомерів, серед яких у переважній кількості знаходяться о- і n-продукти, наприклад:
Електроноакцепторні замісники (замісники ІІ роду) – це мета-орієнтанти, які знижують електронну густину бензенового кільця і зменшують швидкість реакцій електрофільного заміщення. Їх називають дезактивуючими замісниками, тому що вони відтягують у свій бік π-електронну хмару з бензенового кільця завдяки негативному мезомерному (–М) чи негативному індуктивному (–І) ефекту. Електронна густина на бензеновому кільці зменшується і внаслідок її перерозподілу лишається дуже незначний за величиною частковий негативний заряд (δ–) на атомах Карбону в мета-положеннях.
Замісники ІІ роду зменшують реакційну здатність кільця в реакціях заміщення, однак направляють нові групи у мета-положення, при цьому реакції протікають дуже повільно. Наприклад, швидкість реакції нітрування нітробензену, який містить замісник ІІ роду, в 10000 разів менша, ніж швидкість нітрування самого бензену:
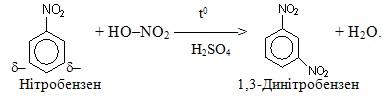
Правила орієнтації дозволяють передбачити переважний напрямок перебігу реакції, однак вони рідко виконуються з абсолютною точністю. У продуктах реакції можуть одночасно міститися о-, n- і м-ізомери, але їх відносна кількість буде різною.
5.3 Розрив хімічних зв'язків при взаємодії органічних сполук
Залежно від особливостей розриву хімічних зв’язків органічні реакції поділяються на радикальні, іонні та узгоджені.
1. Радикальні реакції – це процеси, що проходять за участю вільних радикалів. Поняття «вільний радикал» характеризує нейтральний атом чи частинку, що має неспарений електрон, за рахунок якого виявляє підвищену реакційну здатність.
Вільні радикали утворюються внаслідок гомолізу.
Гомоліз – гомолітичний розрив зв’язків, при якому внаслідок руйнування спільної електронної пари хімічного зв’язку кожна одержана частинка набуває по одному неспареному електрону, утворюючи вільні радикали. Формули радикалів записують з крапкою, яка символізує неспарений електрон:
![]()
2. Іонні реакціі – це взаємодія між іонами або між частинками, що утворюються внаслідок гетеролізу.
Гетероліз – це гетеролітичний розрив ковалентного зв’язку з утворенням двох частинок, на одній з яких залишається спільна електронна пара, а на іншій виникає дефіцит електронної густини. Такі частинки називаються нуклеофілом і електрофілом:
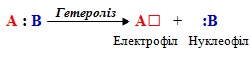
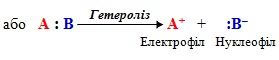
Нуклеофіл – це частинка, що має вільну електронну пару на зовнішньому рівні, яку може надавати для утворення нового ковалентного зв’язку при взаємодії з тією ділянкою іншої молекули, де зосереджений частковий позитивний заряд.
Нуклеофілом (:Nuc) можуть виступати:
- негативно заряджені аніони, наприклад:
![]()
- електронейтральні молекули з неподіленими p- чи π-електронами:
![]()
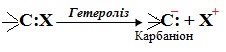
- карбаніони – частинки, в яких неподілена електронна пара знаходиться на атомі Карбону. Карбаніони утворюються при гетеролітичному розриві полярних зв’язків за схемою:
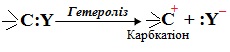
Електрофіл – це частинка з дефіцитом електронної густини (за рахунок неповністю забудованих електронами валентних енергетичних рівнів), яка може надавати для утворення ковалентного зв’язку вільну орбіталь чи центр зі зниженою електронною густиною.
Електрофілом (Е+) можуть бути:
- позитивно заряджені катіони, наприклад:
![]()
- електронейтральні молекули з вільними валентними орбіталями:
![]()
- карбкатіони – частинки з позитивним зарядом на атомі Карбону, який має вільну р-орбіталь, наприклад, R3C+. Карбкатіони, як і карбаніони, утворюються внаслідок гетеролізу:
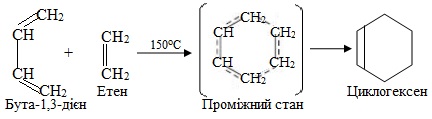
3. Узгоджені реакції (інколи їх називають ще молекулярні реакції чи синхронні реакції) – це процеси, при яких руйнування старих зв’язків і утворення нових відбувається одночасно без участі радикалів чи іонів. Наприклад, дієновий синтез Дільса-Альдера, що проходить при нагріванні чи опромінюванні вихідних речовин – суміші алкену і спряженого алкадієну: