- 11.1 Загальні відомості про корозію
- 11.2 Хімічна корозія
- 11.3 Електрохімічна корозія
- 11.4 11.4. Захист металів від корозії
- 11.5 Приклади розв'язування типових задач
Ключові терміни:
Анодний захист зовнішнім електричним струмом, Анодні покриття, Захисні покриття, Захист металів від корозії, Катодний захист зовнішнім електричним струмом, Катодний протекторний захист від корозії, Катодні покриття, Корозія, Легування, Металеві покриття, Неметалеві неорганічні покриття, Органічні покриття, Пасивація, Термообробка, Хімічна корозія, анодний контроль, анодний протекторний захист від корозіїї, анодування, атмосферна корозія, біокорозія, види електрохімічної корозії, воронування, газова корозія, деполяризатор, деполяризація, електрохімічна корозія, змішаний контроль, катодний контроль, контактна корозія, корозійна кавітація, корозія з водневою деполяризацією, корозія з кисневою деполяризацією, корозія при нерівномірній аерації, корозія під дією зовнішнього електричного струму, корозія під напруженням, корозія у неелектролітах, корозія у ґрунті, макрогальванічний корозійний елемент, мікрогальванічний корозійний елемент, оксидування, пари диференціальної аерації, пасивність металу, фретинг-корозія, щілиста корозія11.1 Загальні відомості про корозію
Термін корозія (від латинського corrodere - роз’їдати) традиційно пов’язують з руйнуванням металів, що складають одну з основ цивілізації. Серед них як конструкційний матеріал виділяється залізо, обсяг промислового виробництва якого приблизно у 20 разів перебільшує обсяги всіх інших металів, узятих разом. Тому людство несе величезні збитки внаслідок корозії численних конструкцій та виробів, виготовлених зі сталі та інших сплавів: трубопроводів, деталей машин, судів, мостів, морських споруд, технологічного обладнання, кріплень, опор і т. і., які через корозію втрачають не тільки товарний вигляд (рис. 11.1), але і - що значно важніше - функціональні якості, необхідні для ефективного і безпечного їх використання.

Рисунок 11.1 – Корозія металевих виробів
Корозія - це процес самочинного руйнування металів внаслідок їх фізико-хімічної взаємодії з навколишнім середовищем, яка призводить до змінювання властивостей металів.
Корозія завдає надзвичайно великої шкоди світовому господарству. Це виявляється, по-перше, у безпосередній втраті самих металів при корозійному руйнуванні, яка щорічно досягає близько 15% від кількості усього виплавленого металу та оцінюється у декілька мільярдів доларів. Спеціалісти підрахували, що в розвинених країнах збитки від корозії складають 3-4% валового національного доходу. По-друге, корозія є причиною непрямих збитків, зумовлених необхідністю дострокового ремонту чи навіть заміни зруйнованого обладнання, а також вартістю втрачених продуктів, наприклад, масла, газу, води із системи з прокородованими трубами або антифризу через зіпсований радіатор. Вихід природного газу та інших шкідливих чи агресивних речовин через отвори, утворені у результаті корозії, може призвести до пожеж, потужних вибухів з величезними матеріальними втратами і навіть до людських жертв.
Хоч корозію частіше пов'язують з металами, необхідно знати, що їй піддаються також камені, пластмаси, полімерні матеріали і деревина. Однак при цьому до корозії не відносять процеси фізичного руйнування матеріалів – їх звичайно називають стиранням, зносом, спрацюванням чи ерозією.
Корозія сталі та інших сплавів на основі заліза привертає особливу увагу. Продуктом корозії заліза є іржа – складна суміш змінного складу, що утворюється при взаємодії заліза з вологим повітрям (рис.11.2а). Для порівняння на рис.11.2б показаний первинний продукт взаємодії Fe з О2 і Н2О – білий осад Fe(OH)2 (на дні пробірки), який на повітрі майже миттєво окиснюється до рудого Fe(OH)3 (у верхній частині пробірки). Проміжним продуктом окиснення є брудно-зелений осад змішаного складу, що містить гідроксиди Fe (II) і Fe (III).

Рисунок 11.2 – Продукти корозії заліза: а) іржа; б) первинний продукт корозії
Цікавою властивістю іржі є її здатність займати набагато більший об’єм, ніж вихідний об’єм самого заліза. Це може призвести до катастрофічних наслідків, оскільки при утворенні іржі розвиваються великі зусилля. Наприклад, коли у Лондоні (1675-1710р.р.) будували собор Святого Павла, кам’яні блоки дзвіниці для міцності сполучали залізними скобами. За сотні років скоби прокородували, значно збільшилися в об’ємі і почали піднімати кам’яну кладку, від чого дзвіницю перекосило. Інженери обчислили, що тиск, який чинить іржа, настільки великий, що спроможний підняти двохметровий кам’яний шар. Цей факт примусив реставраторів розібрати стару кладку і вставити нові скоби, виготовлені з нержавіючої сталі.
Для успішної боротьби з корозією необхідно досконало знати її механізм та вміти визначати стійкість різних металів і конструкційних матеріалів до корозійного руйнування за умов їхньої експлуатації.
У природному стані атоми більшості металів мають стабільну електронну конфігурацію, оскільки входять до складу природних руд і мінералів у вигляді позитивно заряджених йонів, тобто перебувають в окисненій формі. А при добуванні металів їх, навпаки, примусово переводять із хімічних сполук у нейтральні атоми – у відновлену форму, яка для металів є термодинамічно нестійким станом.
Отже, основною причиною корозії є термодинамічна нестійкість, для позбавлення від якої атоми прагнуть набути окисненої форми.
Корозія - це гетерогенний окисно-відновний процес, що відбувається самочинно на межі поділу двох фаз: метал - газ чи метал - розчин і поєднує, як правило, хімічну взаємодію та електрохімічні явища.
Корозію класифікують за різними ознаками. По-перше, за механізмом її перебігу, пов'язаного з особливостями, що супроводжують корозійне руйнування металів. По-друге, – за характером руйнування, тобто за тими зміненнями, що відбуваються з поверхнею і структурою матеріалу внаслідок протікання корозійних процесів.
І. Залежно від механізму перебігу процесу розрізнюють:
- хімічну корозію,
- електрохімічну корозію.
ІІ. За характером руйнування металу виділяють такі види корозії:
-
суцільна (або загальна), яка виникає при взаємодії всієї поверхні металу з оточуючим середовищем (рис.11.3а).
Розрізнюють два види суцільної корозії: рівномірну, при якій вся поверхня металу роз'їдається однаковою мірою без змінення її топографії, і нерівномірну корозію, коли поверхня металу під шаром продуктів корозії має «зритий» характер, тобто містить ділянки більш глибоких пошкоджень – корозійні каверни. До нерівномірної корозії відноситься і структурно-вибірна (або селективна) корозія (рис.11.3ж), при якій одна із структурних складових сплаву розчиняється з більшою швидкістю, ніж решта, наприклад, процес знецинкування латуней (сплавів Cu і Zn);
- місцева (або локальна) корозія. Характерною ознакою корозії цього виду є руйнування окремих ділянок поверхні металу. Місцеву корозію звичайно поділяють на декілька дрібніших груп (рис.11.3б – 11.3е).
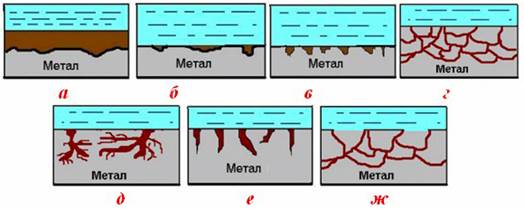
Рисунок 11.3 – Види корозії за характером руйнування металу: а) суцільна, б) місцева плямиста; в) місцева виразкова;
г) місцева міжкристалітна; д) місцева розтріскувальна; е) місцева пітинг; ж) суцільна селективна (вибірна)
11.2 Хімічна корозія
Хімічна корозія спостерігається при взаємодії металу з корозійним середовищем, при якій електрони, що вивільняються внаслідок окиснення металу, передаються безпосередньо атомам окиснювального компонента, що міститься у корозійному середовищі, а продукти корозії утворюються саме на тих ділянках, що кородують.
Причиною хімічної корозії є термодинамічна нестійкість металів за даних зовнішніх умов, внаслідок чого за рахунок зменшення термодинамічного потенціалу (енергії Гіббса) відбувається самочинний перехід металу в стійкіший (окиснений) стан при перебігу реакції загального вигляду:
метал + окиснювальний компонент середовища → продукт корозії.
Очевидно, що при хімічній корозії окисник, що міститься у середовищі, вступає з металом у взаємодію, утворюючи з ним хімічну сполуку, яка у більшості випадків розташовується на поверхні у вигляді плівки. Якщо плівка достатньо щільна, вона сповільнює подальше транспортування окисника до поверхні металу, тобто спричиняє ефект самогальмування процесу корозії.
Хімічна корозія - це процес самочинного руйнування металів у атмосфері окиснювальних газів за умов високих температур чи у середовищі рідких неелектролітів.
Хімічній корозії притаманні певні ознаки:
- безпосереднє передавання електронів атомами металів окиснику, що знаходиться у корозійному середовищі;
- відсутність у системі електричного струму.
Залежно від умов перебігу хімічна корозія поділяється на типи:
- газова корозія, яка виникає при високих температурах у атмосфері сухих агресивних газів (F2, Cl2, SO2, NO2, H2S тощо), наприклад: корозія двигунів внутрішнього згоряння, деталей турбін, ракетних двигунів;
- корозія у неелектролітах - струмонепровідних рідинах (Br2, нафта і нафтопродукти).
Для прикладу розглянемо схему корозії металу в атмосфері кисню:
[TEX]nMe+0,5mO_2\rightarrow Me_nO_m[/TEX].
Згідно із законами хімічної термодинаміки цей процес може самочинно відбуватися лише за умов зменшення енергії Гіббса (ΔG<0). Для більшості металів при їх взаємодії з оточуючим середовищем змінення енергії Гіббса має від’ємне значення (ΔG<0), що свідчить про можливість самочинного протікання корозійних реакцій при атмосферному тиску. А умова ΔG>0, за якою корозія самочинно не відбувається, виявляється тільки за дуже низьких тисків. Наприклад, при 298К хімічна корозія срібла у кисні термодинамічно неможлива (ΔG>0 ) і припиняється, лише якщо Р ~ 10Па.
Таким чином, більшість металів можуть піддаватися хімічній корозії за наявності сухого О2. Однак термодинаміка, вказуючи на можливість самочинного перебігу корозійних процесів, не дає остаточної відповіді на питання, чи відбуваються вони насправді. Для цього необхідно розглянути ще і кінетичні закономірності.
На швидкість корозії впливають такі чинники:
- характер продуктів корозії: утворення суцільних хімічно стійких поверхневих плівок на металі значно сповільнює, а іноді й зовсім припиняє хімічну корозію, але крихкі, малопластичні чи розчинні плівки сприяють швидкому руйнуванню металу;
- температура: з підвищенням температури інтенсивність корозії зростає, що зумовлюється прискорюванням дифузії газів через поверхневу плівку та утворенням тріщин, через які газ проникає у метал і окиснює його;
- природа навколишнього середовища: швидкість корозії збільшується, якщо у повітрі міститься значна кількість агресивних домішок, які при взаємодії з металом утворюють на його поверхні розчинні сполуки;
- властивості металу: чим активнішим є метал, тим швидше і легше він кородує.
11.3 Електрохімічна корозія
Електрохімічна корозія полягає у взаємодії металу з корозійним середовищем і має специфічну особливість: окиснення атомів металу і відновлення окиснювального компоненту корозійного середовища локалізуються на різних ділянках, де відповідно перебігають окремо анодна і катодна напівреакції окисно-відновного процесу.
Електрохімічна корозія - це руйнування металів у середовищах з іонною провідністю, при якому відбувається просторове перенесення електронів і виникнення електричного струму.
Залежно від умов перебігу розрізняють такі види електрохімічної корозії:
- контактна корозія, яка спостерігається при тривалому контакті двох металів, що мають різні значення електродних потенціалів;
- атмосферна корозія - руйнування металів у вологому повітрі при звичайних температурах;
- корозія у ґрунті, коли метал контактує з вологим ґрунтом, який містить розчинений кисень та інші речовини;
- корозія при нерівномірній аерації відбувається, коли розчинений у воді кисень має неоднаковий доступ до різних ділянок металу;
- щілиста корозія - підсилене руйнування металів у щілинах, отворах, зазорах та каналах;
- корозія під напруженням, що спричиняється одночасною дією на метал корозійного середовища і механічного навантаження;
- фретинг-корозія, яка виникає внаслідок тертя корозійного середовища по поверхні металу;
- корозійна кавітація - руйнування металів, зумовлене ударною дією корозійного середовища, наприклад, руйнування гребних гвинтів суден або лопатей турбін;
- біокорозія, що відбувається під впливом продуктів життєдіяльності мікроорганізмів;
- корозія під дією зовнішнього електричного струму - руйнування підземних металевих комунікацій та споруд блукаючими струмами. Найчастіше цей вид електрохімічної корозії спостерігається при роботі електричного рейкового транспорту за рахунок витоку струму на стиках заглиблених у ґрунт рейок. У цьому випадку можливе розгалужування струму, частина якого піде через вологий ґрунт. Якщо на шляху проходження струму знаходиться підземна металева споруда, то ділянка конструкції, у яку входить блукаючий струм, буде катодом, а місце його виходу - анодом.
Технічні метали обов'язково забруднені різними домішками, а сплави містять ще більшу кількість сторонніх включень (у тому числі й атомів легуючих елементів), що пояснює структурну і термодинамічну неоднорідність поверхні. З іншого боку, корозійне середовище з різних причин теж має певну гетерогенність. Тому електродні потенціали, що виникають на окремих ділянках поверхні металу у струмопровідному середовищі, можуть суттєво відрізнятися між собою. Це створює передумови для роздільного перебігу процесу окиснення (на ділянках з меншим значенням електродного потенціалу) і процесу відновлення (на тих ділянках поверхні, які мають більш додатне значення електродного потенціалу). З урахуванням іонної провідності корозійного середовища зрозуміло, що при електрохімічній корозії утворюється корозійний гальванічний елемент (рис. 11.4).
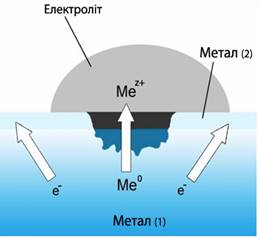
Рисунок 11.4 – Корозійний гальванічний елемент
Як випливає із визначення, процеси іонізації атомів металу і відновлення окиснювального компонента із корозійного середовища відбуваються хоч і одночасно, однак не в єдиному акті (на різних ділянках), а їх швидкості залежать від величин електродних потенціалів металу.
Сутність електрохімічної корозії полягає в анодному розчиненні металу на ділянках з меншим значенням електродного потенціалу і катодному відновленні окисника із навколишнього середовища на ділянках з більшим значенням електродного потенціалу, завдяки чому самі катодні ділянки зберігають свою цілісність. Умовно цей процес записується за допомогою напівреакцій:
(-) A: [TEX]Me^0-z\bar{e}\rightarrow Me^{z+}[/TEX],
(+) K: [TEX]Ox+z\bar{e}\rightarrow Red[/TEX].
Окисниками при електрохімічній корозії найчастіше виступають О2 і Cl2 у вологому повітрі, йони Н+, Fe3+, NO3- тощо. Взагалі середовищем електрохімічної корозії може бути:
- електроліт (водні розчини кислот, солей, лугів, морська вода);
- вологий газ;
- вологий ґрунт.
Всі окисники, які сприяють перебігу катодної реакції відновлення, називаються деполяризатор, а катодний процес - деполяризація.
Здебільшого на катодних ділянках спостерігається іонізація (відновлення) кисню:
- у нейтральному чи лужному середовищі:
при pH≈7: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX], ε0=+0,815B;
pH≤7: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX], ε0=+0,401B;
- у кислому середовищі:
[TEX]O_2+4H^++4\bar{e}\rightarrow 2H_2O[/TEX], ε0=+1,229B,
- а також виділення водню:
[TEX]2H^++2\bar{e}\rightarrow H_2[/TEX].
Корозійний процес, що супроводжується поглинанням і відновленням на катоді газоподібного кисню О2, називається корозія з кисневою деполяризацією.
Корозійний процес, при якому на катоді відновлюються йони гідрогену Н+ і виділяється газоподібний водень Н2, називається корозія з водневою деполяризацією.
Схематично обидва види корозійної деполяризації показані на рис.11.5.
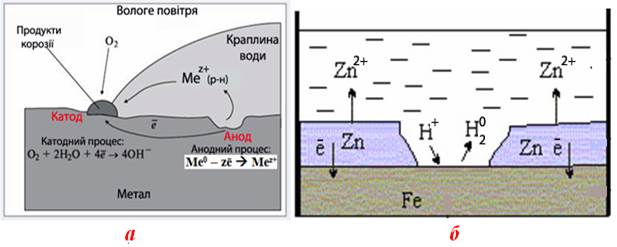
Рисунок 11.5 – Схема корозії металу: а) з кисневою деполяризацією; б) з водневою деполяризацією
Поряд з електрохімічними процесами під час корозії відбуваються вторинні хімічні реакції, наприклад, взаємодія йонів металу з гідроксильними йонами:
[TEX]Me^{z+}+zOH^-\rightarrow Me(OH)_z[/TEX].
Утворена основа протягом часу може піддаватися поступовій дегідратації (втраті молекул Н2O):
[TEX]2Me(OH)_z\rightarrow Me_2O_z\cdot zH_2O[/TEX].
Корозійні електрохімічні процеси подібні до тих, що відбуваються у гальванічних елементах. Однак на відміну від звичайних у корозійних гальванічних елементах відсутній зовнішній ланцюг, а електрони переходять безпосередньо з анода на катод без участі з'єднувального електронного провідника. З цієї причини хімічна схема корозійного гальванічного елемента має простіший вигляд порівняно із звичайним гальванічним елементом, наприклад:
А(-) МеІ | O2, Н2O | МеІІ (+)K,
А(-) МеІ | Н+, Н2O | МеІІ (+)K.
Існує два основних типи корозійних гальванічних елементів:
- макрогальванічний корозійний елемент, який характеризується наявністю розділених катодних і анодних ділянок, досить великих за розмірами, наприклад, алюмінієвий лист з латунними гвинтами. У ньому алюміній, що має менше значення електродного потенціалу (ε0Al3+/Al = -1,66B), відіграє роль анода, а мідь, яка є основним компонентом латуні (ε0Cu2+/Cu = -0,34B), - катода;
- мікрогальванічний корозійний елемент, що складається з багатьох невеликих нерозділених катодних і анодних ділянок, здатних до миттєвої зміни полюсів, наприклад, корозія сталі у вологому повітрі.
Причиною виникнення мікрогальванічних корозійних елементів є електрохімічна гетерогенність (неоднорідність), яка може мати різну природу:
- неоднорідність сплаву за хімічним чи фазовим складом;
- наявність домішок у металі;
- захисні плівки змінного складу;
- наявність на окремих ділянках каталізуючих речовин;
- флуктуація концентрації електроліту в приповерхневому шарі;
- нерівномірна аерація металу;
- різниця фізичних умов (температура, тертя тощо) на окремих ділянках поверхні.
Термодинамічним обґрунтуванням роботи корозійного гальванічного елемента вважається зменшення енергії Гіббса (ΔG<0), яка пов’язана з електрорушійною силою Е залежністю
- [TEX]E=-\Delta G/zF[/TEX].(11.1)
З рівняння (11.1) випливає, що можливість перебігу корозії встановлюється за знаком ЕРС, оскільки умова ΔG<0 виконується тільки при Е>0. ЕРС визначається різницею потенціалів окисника і відновника
- E = εок - εвідн ,
тому корозія можлива (Е>0, ΔG<0), коли потенціал окисника в корозійному середовищі має більше значення, ніж потенціал металу
- (11.2)
εок > ε0Mem+/Me .
Вираз (11.2) дозволяє оцінити можливість перебігу корозійних процесів для будь-яких металів у різних корозійних середовищах. Якщо потенціал певного металу має більше значення, ніж потенціал кисневого електрода (+1,229В), то такий метал не кородує ні з кисневою, ні, тим більше, з водневою деполяризацією при будь-яких значеннях рН (рис.11.6, ділянка 3). Якщо значення потенціалу металу відповідає ділянці 2 (рис.11.6), то метал кородує з кисневою деполяризацією, однак зберігає стійкість до корозії з водневою деполяризацією. Якщо потенціал металу має менше значення, ніж потенціал водневого електрода, то корозія можлива як з кисневою, так і з водневою деполяризаціями (рис.11.6, ділянка 1).
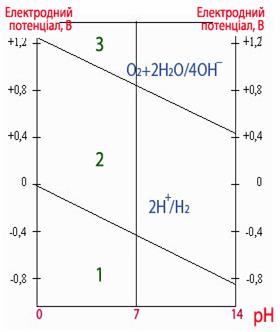
Рисунок 11.6 - Залежність потенціалів водневого і кисневого електродів від рН середовища
Зменшення енергії Гіббса (ΔG<0) i додатне значення електрорушійної сили (E>0) лише зазначають можливість (імовірність) самочинного перебігу корозійних процесів, але не менш важливою характеристикою є кінетика корозійних процесів, що визначається лімітуючою (найповільнішою) стадією.
Корозійні гальванічні елементи належать до короткозамкнених, тому переміщення електронів у металі відбувається майже миттєво і не може бути лімітуючою стадією. Рух йонів у розчині електроліту теж не лімітує корозійний процес завдяки надзвичайно малій відстані між катодними та анодними ділянками. Отже, лімітуючою стадією можуть бути електрохімічні реакції: окиснення металу (анодний контроль), відновлення корозійного середовища (катодний контроль) чи ті та інші процеси одночасно (змішаний контроль).
11.3.1 Чинники, що впливають на швидкість корозії
Швидкість електрохімічної корозії залежить від різних чинників, які за своїми характерними особливостями поділяються на внутрішні та зовнішні.
І. Внутрішні чинники пов’язані з властивостями корозійно активної речовини. Їх декілька:
-
Природа металів, яка виявляється в їх хімічній активності та схильності до пасивації.
Пасивація - це набуття термодинамічно нестійким металом корозійної стійкості внаслідок утворення на його поверхні щільних непоруватих плівок, які захищають метал від руйнування.
Пасивність металу – це стан його підвищеної корозійної стійкості, зумовлений гальмуванням анодного процесу.
За схильністю до пасивації найпоширеніші у техніці метали розміщуються у ряд:
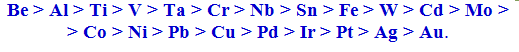
Розташування металів у цьому ряді не завжди збігається з їх розміщенням в електрохімічному ряді напруг (табл.10.1 і 11.1), що пояснюється особливостями кристалічної структури і властивостей окремих металів.
Таблиця 11.1 – Стандартні електродні потенціали металів
Електрод ε0 Електрод ε0 Електрод ε0 Li/Li+ -3,045 Zn/Zn2+ -0,76 Cu/Cu2+ +0,34 K/K+ -2,92 Cr/Cr3+ -0,74 Ag/Ag+ +0,97 Ca/Ca2+ -2,90 Fe/Fe2+ -0,44 Hg/Hg2+ +0,85 Na/Na+ -2,71 Cd/Cd2+ -0,40 Pt/Pt2+ +1,19 Mg/Mg2+ -2,36 Ni/Ni2+ -0,25 Au/Au3+ +1,50 Al/Al3+ -1,66 Pb/Pb2+ -0,126 Mn/Mn2+ -1,18 ½H2/H+ 0,00 Як випливає із аналізу корозійних процесів з кисневою та водневою деполяризаціями, корозійна активність металу буває різною залежно від природи середовища, з яким він контактує.
а) У нейтральному середовищі та за наявності кислот-неокисників (HCl, розв. H2SO4, СН3СООН та інші слабкі кислоти) усі метали за своєю корозійною активністю поділяються на чотири групи:
-
Метали з невеликими електродними потенціалами ε0Mem+/Me < -0,41B (табл.11.1). Ця група металів піддається корозії з водневою деполяризацією, при якій спостерігається катодний контроль: лімітуючою стадією є реакція відновлення йонів гідрогену на катодних ділянках та сполучення їх у молекули
[TEX]H^++\bar{e}\rightarrow H_{адс}^0 [/TEX],
[TEX]2H_{адс}\rightarrow H_2[/TEX],
тому швидкість корозії зростає при збільшенні концентрації Н+ і температури.
Крім цього, швидкість залежить від природи катодних ділянок. Якщо вони містять метали, що каталізують виділення водню (Pt, Pd, Ni), то корозія прискорюється, а у випадку некаталізуючих катодних металів (Hg, Pb) - сповільнюється завдяки зменшенню площі поверхні, яку займає основний метал.
Взагалі при одному і тому самому катоді вплив природи основного металу на швидкість корозії з водневою деполяризацією можна оцінити за величиною перенапруги виділення водню: чим вона більша, тим повільніше відбувається корозія.
- Метали з електродними потенціалами у межах -0,41< ε0Mem+/Me <0 (табл.11.1) у кислих середовищах кородують з водневою, а у нейтральних - з кисневою деполяризацією. Винятком є свинець, який не піддається корозії у кислому середовищі, оскільки його поверхня пасивується утвореними нерозчинними солями (PbSO4, PbCl2 тощо).
- Метали з електродними потенціалами у межах 0< ε0Mem+/Me <1,229B (табл.11.1) кородують лише з кисневою деполяризацією.
- Метали з електродним потенціалом ε0Mem+/Me>+1,229B (табл.11.1) виявляють корозійну стійкість у нейтральному середовищі та за наявності кислот-неокисників.
б) За наявності кислот-окисників (HNO3, конц. H2SO4 та ін.) корозії піддаються всі метали від початку ряду напруг до Ag включно, за винятком тих, що пасивуються сильними окисниками. Склад кінцевих продуктів корозії зумовлюється як активністю самого металу, так і природою та концентрацією кислоти. Наприклад, при контакті металу з концентрованою сульфатною кислотою відбувається анодне розчинення металу:
(A) [TEX]Me^0-z\bar{e}\rightarrow Me^{z+}[/TEX],
а на катодних ділянках може спостерігатися один з таких процесів чи їх сукупність:
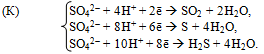
При цьому відома залежність: чи меншим є значення електродного потенціалу металу на анодній ділянці, тим глибше відновлюється йон SO42- із корозійного середовища на катоді. Вторинні продукти корозії утворюються при взаємодії окисненого металу із сульфатною кислотою.
У середовищі концентрованої нітратної кислоти на відповідних ділянках корозійного гальванічного елемента відбуваються процеси:
(A) [TEX]Me^0-z\bar{e}\rightarrow Me^{z+}[/TEX],
(K) [TEX]NO_{3}^-+2H^++\bar{e}\rightarrow NO_2+H_2O[/TEX].
У розведеній нітратній кислоті характер катодних процесів зумовлюється активністю металу і концентрацією кислоти: чим активніший метал і чим більше розведена HNO3, тим глибше відновлюється нітроген (+5).
в) У лужному середовищі кородують амфотерні метали (Al, Zn, Pb, Sn, Ga, In) незалежно від їх положення в електрохімічному ряді напруг. Внаслідок корозії утворюються комплексні солі та виділяється водень.
г) У розчинах солей корозія металів спостерігається лише у тих випадках, коли метал контактує із сіллю, утвореною менш активним металом. У протилежному випадку корозія відсутня.
-
Метали з невеликими електродними потенціалами ε0Mem+/Me < -0,41B (табл.11.1). Ця група металів піддається корозії з водневою деполяризацією, при якій спостерігається катодний контроль: лімітуючою стадією є реакція відновлення йонів гідрогену на катодних ділянках та сполучення їх у молекули
- Структура сплавів, залежно від якої сплави поділяються на гомогенні (тверді розчини) і гетерогенні, що складаються з кількох твердих мікрофаз. Швидкість електрохімічної корозії зростає при переході від гомогенних до гетерогенних сплавів. Особливо несприятливою є наявність у сплаві включень менш активного металу в основний активніший метал, наприклад, катодних включень Cu чи Ni у залізо. Анодні структурні включення або не змінюють швидкості корозії, або призводять до розвитку локальних корозійних процесів.
- Стан поверхні металу. Корозійна стійкість металу підвищується завдяки тонкій механічній обробці поверхні, що сприяє утворенню досконалих захисних шарів. Термічна обробка, яка полегшує знімання механічного напруження на поверхні та всередині металу, також підвищує його корозійну стійкість.
ІІ. Зовнішні чинники, що впливають на швидкість корозії, пов’язані з природою корозійного середовища і умовами перебігу корозійних процесів. До них належать рН та іонний склад корозійного середовища, кількість у ньому кисню, температура, тиск, швидкість руху середовища, дифузія тощо.
-
Кислотність середовища. Здебільшого швидкість корозії зростає зі зменшенням рН середовища, оскільки при цьому підвищується розчинність продуктів корозії.
За корозійною стійкістю залежно від рН середовища усі метали поділяються на п’ять груп:
- благородні метали (Au, Pt, Ag), швидкість корозії яких є надзвичайно малою і фактично не залежить від рН (рис.11.7а);
- метали, що є нестійкими у кислому та нейтральному середовищах, але виявляють корозійну стійкість при рН>7. Наприклад, Mg (рис.11.7б);
- метали, малостійкі у кислому середовищі, однак досить стійкі у нейтральному і лужному середовищах, наприклад, Со, Ni, Cd (рис.11.7в);
- метали, стійкі у кислому та нейтральному середовищах і нестійкі при рН>7, наприклад, Nb, Zr, Mo, W, Ta (рис.11.7г);
- метали, стійкі тільки у нейтральному середовищі, але нестійкі у кислому та лужному середовищах - амфотерні метали Al, Zn, Sn, Pb, Be (рис.11.7д).
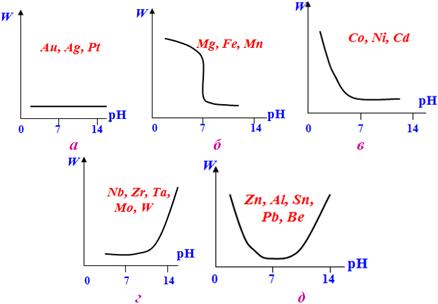
Рисунок 11.7 – Залежність швидкості корозії W для окремих груп металів від рН корозійного середовища (пояснення в тексті)
-
Іонний склад корозійного середовища. Корозійне середовище може містити йони- активатори, які прискорюють корозію, та йони-інгібітори, які її уповільнюють.
-
Аніони-активатори (Cl-, Br-, I-) виявляють подвійну дію:
- порушення пасивного стану металів внаслідок руйнування оксидних плівок і утворення розчинних продуктів (FeCl2, AlCl3, LnCl2) - цим пояснюється посилення корозії металів у морській воді;
- полегшення іонізації атомів металу завдяки зв’язуванню їх у розчинні комплекси, наприклад, [Fe(CN)6]3-, [Co(NO2)6]3-.
- Катіони-активатори - це найчастіше багатозарядні катіони малоактивних металів, які здатні окиснювати більш активні метали, наприклад:
[TEX]Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu[/TEX],
[TEX]3Cd+2Bi^{3+}\rightarrow 3Cd^{2+}+2Bi[/TEX].
-
Аніони-інгібітори теж можуть відігравати подвійну роль:
- утворення з металом важкорозчинної сполуки, що осідає на його поверхні, тим самим гальмуючи подальшу корозію, наприклад:
для Fe: OH-, CO32-, PO43-, SiO32-;
для Al: S2-, SiO32-, HPO42-;
для Pb: F-, SO42-, Cl-;
- переведення металів у пасивний стан за допомогою аніонів-окисників (CrO42-, Cr2O72-, MnO4-, NO3-).
- утворення з металом важкорозчинної сполуки, що осідає на його поверхні, тим самим гальмуючи подальшу корозію, наприклад:
- Катіони-інгібітори - це катіони (Fe2+, Mg2+, Cu2+, Co2+, Sn2+, Zn2+ та ін.), які утворюють важкорозчинні сполуки з гідроксильними йонами ОН-, що виникають на катодній ділянці внаслідок кисневої деполяризації.
-
Аніони-активатори (Cl-, Br-, I-) виявляють подвійну дію:
- Концентрація розчинів. При контакті металів з розчинами солей, йони яких не виявляють властивостей активаторів чи інгібіторів корозії, швидкість корозійних процесів залежно від концентрації підкоряється складним законам. Наприклад, якщо Fe перебуває у розчині Na2SO4, то при збільшенні концентрації солі швидкість корозії спочатку зростає, оскільки підвищується електрична провідність середовища, а після досягнення певної концентрації - поступово сповільнюється, оскільки зменшуються електролітична дисоціація солі та розчинність кисню у середовищі.
-
Кількість кисню. Кисень є сильним корозійно активним агентом, однак його вплив на корозійні процеси неоднозначний. Найчастіше збільшення кількості О2 інтенсифікує корозію більшості металів. Але якщо метал легко піддається пасивації, то при підвищенні концентрації кисню корозія такого металу сповільнюється. Швидкість корозії з кисневою деполяризацією зростає при збільшенні дифузії та розчинності кисню, а також при енергійному перемішуванні.
За умов нерівномірного доступу кисню до всіх частин поверхні металу утворюються корозійні гальванічні елементи - так звані пари диференціальної аерації, в яких ділянки з недостатньою кількістю кисню (пори, щілини, отвори) відіграють роль анода і окиснюються. Електрони, що при цьому вивільняються, переходять на катодні ділянки на поверхні металу (де знаходиться більша кількість О2) і беруть участь у відновленні атмосферного кисню. Наприклад, якщо стальний гвіздок вбити у вологу деревину (рис.11.8), то його внутрішня частина, до якої доступ кисню обмежений, відіграє роль анода і окиснюється:
(-) A: [TEX]Fe^0-2\bar{e}\rightarrow Fe^{2+}[/TEX],
а зовнішня частина стає катодом, на якому відбувається відновлення О2 з вологого повітря:
(+) K: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
Первинні продукти електрохімічної корозії (Fe2+ і ОН-) спочатку хімічно доокиснюються:
[TEX]4Fe(OH)_2+O_2+2H_2O\rightarrow 4Fe(OH)_3[/TEX],
а потім поступово дегідратуються
[TEX]2nFe(OH)_3\rightarrow Fe_2O_3\cdot nH_2O+2nH_2O[/TEX].
Кінцевим продуктом корозії є руда іржа, яка має невизначений склад і виражається формулою FeOOH, або частіше – [TEX]nFe_2O_3\cdot mH_2O[/TEX].
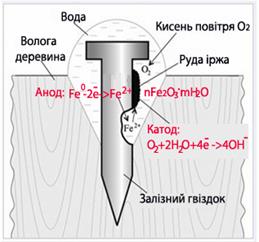
Рисунок 11.8 – Схема утворення пари диференціальної аерації при корозії стального гвіздка, вбитого у вологу деревину
-
Температура і тиск. У випадку корозії з водневою деполяризацією підвищення температури прискорює електродні процеси, тому швидкість корозії зростає. Коли відбувається корозія з кисневою деполяризацією, температура виявляє подвійний вплив. Так, підвищення температури збільшує швидкість електродних процесів, однак одночасно зменшує розчинність кисню. Максимальної швидкості корозія з кисневою деполяризацією досягає в інтервалі 70-800С. Це зумовлюється оптимальним співвідношенням коефіцієнта дифузії кисню та величиною його розчинності у зазначених межах температур.
Підвищення тиску призводить до зростання швидкості корозії, що пояснюється збільшенням розчинності корозійно-активних газів, а також виникненням внутрішніх напружень у металах.
11.4 11.4. Захист металів від корозії
Сучасна техніка потребує використання металевих виробів у широкому діапазоні температур і тисків, а іноді ще й в агресивних середовищах. Для запобігання чи повного усунення корозії застосовуються численні методи захисту металів.
Захист металів від корозії полягає у комплексі заходів для збільшення працездатності та надійності металів і конструкційних матеріалів за умов їх експлуатації.
Боротьба з корозією починається ще на першому етапі створення будь-яких об'єктів і споруд, складовими частинами яких є металеві вузли. Тобто захист від корозії необхідно забезпечувати не тільки на стадіях виготовлення та експлуатації металевих виробів, але і в процесі їх проектування. Раціональне обрання певних матеріалів та їх сполучень для виготовлення тієї чи іншої деталі диктується у першу чергу технічною і економічною доцільністю, але одночасно й урахуванням корозійної стійкості виробу. З цієї причини при проектуванні слід дотримуватися певних правил:
- без відповідної ізоляції не допускати сполучення металів, які істотно відрізняються значеннями електродних потенціалів;
- при застосуванні неметалевих поруватих покривних матеріалів, здатних адсорбувати вологу, їх необхідно просочувати дьогтем чи бітумом;
- у металевих конструкціях слід уникати зазорів, щоб запобігти виникненню осередків корозії внаслідок роботи пар диференціальної аерації;
- при сполученні конструкційних елементів перевагу слід віддавати зварним з’єднанням;
- на тих виробах, що підлягають нанесенню лакофарбових покриттів, необхідно уникати гострих кутів, які містять внутрішні напруження.
Під час експлуатації металевих виробів вибір конкретного методу захисту зумовлюється його ефективністю та економічною доцільністю. Залежно від специфіки всі методи поділяються на три великі групи: дія на метал, дія на корозійне середовище та електрохімічні методи.
11.4.1 Методи дії на метал
Ця група методів досліджується і розвивається у декількох напрямках.
-
Легування - одержання сплавів з підвищеною корозійною стійкістю порівняно з основним металом. З цією метою до складу сплаву вводять певні інгредієнти:
- компоненти, що здатні утворювати захисні плівки на поверхні металу чи переводити її у пасивний стан;
- благородні метали, які збільшують корозійну стійкість металевих виробів у цілому.
- Термообробка металів та сплавів, що підвищує корозійну стійкість конструкції завдяки гомогенізації сплавів і зніманню внутрішніх напружень у металі.
-
Захисні покриття - спеціальні штучні шари на поверхні металевих виробів та споруд для запобігання корозії. Якщо поряд із захисною дією покриття виявляє ще й прикрашувальні функції, його називають захисно-декоративним.
Захисні покриття поділяються на металеві та неметалеві, які в свою чергу можуть бути неорганічними або органічними.
3.1. Металеві покриття за механізмом захисної дії поділяються на катодні та анодні.
- Катодні покриття мають більше значення електродного потенціалу, ніж основний метал (табл.11.1). Наприклад, для сталі катодними покриттями можуть бути тонкі шари малоактивних металів (Cu, Ni, Ag, Sn). При порушенні покриття цього типу виникає корозійний гальванічний елемент, в якому основний метал відіграє роль анода, а покривний - катода, тому основний метал окиснюється і розчиняється, а на покривному металі виділяється водень або поглинається кисень - залежно від виду деполяризації. Катодні покриття захищають метал лише механічно. При утворенні тріщин або пор руйнування основного металу прискорюється.
- Анодні покриття мають менше значення електродного потенціалу порівняно з основним металом (табл.11.1). У корозійному гальванічному елементі, що утворюється при порушенні анодного покриття, покривний метал стає анодом, а основний - катодом, тому він не піддається корозії. Таким чином, анодні покриття захищають метал не тільки механічно, але й електрохімічно. Це означає, що при їх порушенні кородує саме покривний метал (анод), а основний метал не руйнується.
Щоб правильно підібрати покривний метал, необхідно врахувати його механічні та фізико-хімічні властивості. Для прикладу розглянемо оцинковане та луджене (покрите оловом) залізо. Із порівняння електродних потенціалів
ε0Fe2+/Fe = -0,44B, ε0Zn2+/Zn = -0,76B, ε0Sn2+/Sn = -0,13B
випливає, що відносно заліза покриття із цинку буде анодом, а із олова - катодом. У першому випадку (рис.11.9а) при пошкодженні покриття у вологому повітрі утворюється корозійний гальванічний елемент
А(-) Zn | O2, Н2O | Fe (+)K,
при роботі якого перебігають електродні процеси:
(-) A: [TEX]Zn^0-2\bar{e}\rightarrow Zn^{2+}[/TEX],
(+) K: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
Отже, руйнується сам покривний метал – цинк і тим самим захищає від корозії основний метал – залізо. Напроти, олово, що має більше значення електродного потенціалу порівняно з залізом, є катодним покриттям (рис.11.9б). При його пошкодженні утворюється корозійний гальванічний елемент
А(-) Fe | O2, Н2O | Sn (+)K,
в якому перебігають такі електродні процеси:
(-) A: [TEX]Fe^0-2\bar{e}\rightarrow Fe^{2+}[/TEX],
(+) K: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
Видно, що порушення покриття з олова викликає посилену корозію заліза.
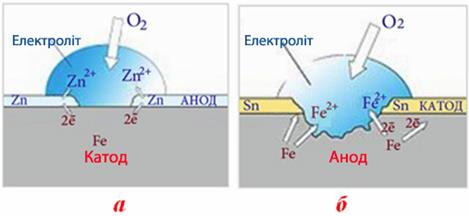
Рисунок 11.9 – Корозія з кисневою деполяризацією при руйнуванні: а) анодного покриття (оцинковане залізо);
б) катодного покриття (луджене залізо)Однак, не завжди цинкове покриття краще, ніж олов’яне, оскільки вони мають різні механічні властивості. Під час цинкування між залізом і цинком утворюються крихкі прошарки інтерметалідів змінного складу (FeZn7, FeZn3), які розтріскуються при перегинанні сталевого листа, що призводить до відшаровування і руйнування покриття. А шар олова на залізі за складом належить до твердих розчинів і не містить інтерметалідів, тому на відміну від цинкового олов’яне покриття є пластичним, міцно зціпленим із залізом, і може витримувати численні перегинання без порушення захисного шару. Отже, залежно від умов подальшого використання сталевого виробу для його захисту вибирають цинкове чи олов’яне покриття.
3.2. Неметалеві неорганічні покриття виявляють захисну дію в ізоляції металу від оточуючого середовища і можуть мати різну природу
- Бетонні покриття використовують для захисту громіздких металевих споруд та підземних комунікацій.
- Неорганічні емалі за своїм складом належать до силікатних матеріалів. Емалюванню піддають чорні та кольорові метали, які застосовуються при виробництві апаратури у фармацевтичній, хімічній чи харчовій промисловостях та при виготовленні речей побутового вжитку. Основною вадою силікатних емалей є крихкість та розтріскування під дією теплових і механічних напружень.
-
Оксидні плівки (рис.11.10) нарощують на металах, схильних до пасивації (Al, Ti, Fe, Cr).
Рисунок 11.10 – Вигляд під мікроскопом: оксидна плівка на поверхні металу
Оксидні плівки одержують двома способами: хімічним, який полягає в обробці металу розчином, що містить аніони-окисники (NO3-, S2O82-, ClO4-, CrO42-, Cr2O72-), та електрохімічним, при якому метал відіграє роль анода під час електролізу у відповідному електроліті. Утворення на поверхні металу штучних оксидних плівок називається оксидування, причому деякі процеси мають ще й спеціальні назви, наприклад, оксидування сталі називається воронування, а алюмінію - анодування;
-
Фосфатні плівки, за допомогою яких найчастіше захищають сталь. Процес передбачає обробку стальних деталей у гарячому розчині гідрогенортофосфатних солей (MnHPO4, ZnHPO4, FeHPO4). При контакті з деталлю кисла сіль розкладається з утворенням важкорозчинних фосфатів, що осідають на поверхні металу у вигляді поруватих плівок:
[TEX]3MnHPO_4\rightarrow Mn_3(PO_4)_2\downarrow +H_3PO_4[/TEX].
Одночасно з цим утворюється ортофосфатна кислота, яка дифундує через порувату плівку і взаємодіє з поверхнею деталі:
[TEX]2H_3PO_4+3Fe\rightarrow Fe_3(PO_4)_2\downarrow +3H_2[/TEX].
Нерозчинні фосфати досить міцно зчіплюються зі сталлю, однак фосфатна плівка через свою поруватість не може забезпечити достатнього захисту від корозії, тому її використовують як основу під фарби.
3.3. Органічні покриття є засобом захисту металу від низькотемпературної корозії.
Залежно від складу і властивостей органічні захисні шари наносяться різними способами:
- Мастіння – нанесення мастил, стійких до окиснення у випадку необхідності консервації металевих виробів.
- Лакування - нанесення на поверхню металу високомолекулярних сполук, розчинених у леткому розчиннику. Після випаровування розчинника на металі залишається полімерний шар, який не пропускає окисників з оточуючого середовища і має електроізоляційні властивості.
- Фарбування – утворення полімеру безпосередньо на поверхні металу. Фарбування належить до найпоширеніших методів захисту металів від корозії, завдяки низькій вартості, простоті застосування, легкості реставрації та можливості сполучення з іншими методами захисту. Однак цей метод має свої недоліки: недостатню термостійкість і невисоку механічну міцність. Лакофарбові покриття не можуть бути абсолютним бар’єром для корозійного середовища, оскільки вони здатні тільки гальмувати розвиток корозійного процесу, але не зупиняти його.
- Футерування полімерними матеріалами – утворення на металі захисного шару з ізолювальними та декоративними властивостями. Наприклад, нанесення гумового покриття на поверхню сталі при виробництві хімічної апаратури.
11.4.2 11.4.2. Методи дії на корозійне середовище
Використання цієї групи методів є доцільним у тому випадку, коли мають справу з обмеженим об’ємом корозійного середовища, наприклад, з теплоносієм у системі опалювання.
Найбільш поширеними є два методи.
-
Усунення агресивного реагенту або зменшення його концентрації у корозійному середовищі. Найчастіше агресивними реагентами є такі деполяризатори: кисень у нейтральному середовищі чи йони гідрогену - у кислому.
Вміст деполяризатора у кислому середовищі зменшують шляхом його нейтралізації за допомогою вапна чи каустичної соди:
[TEX]2H^++CaO\rightarrow Ca^{2+}+H_2O[/TEX],
[TEX]H^++NaOH\rightarrow Na^++H_2O[/TEX].
Корозію металів з кисневою деполяризацією послаблюють різними способами:
- термічною обробкою корозійного середовища гострою парою (оскільки з підвищенням температури розчинність газів зменшується);
- продуванням через середовище інертних газів, які захвачують розчинений кисень;
-
хімічним знекисненням при введенні у корозійне середовище відновників для зв’язування кисню:
[TEX]2Na_2SO_3+O_2\rightarrow 2Na_2SO_4[/TEX],
[TEX]N_2H_4+O_2\rightarrow N_2+2H_2O[/TEX].
-
Додавання інгібіторів, незначні кількості яких різко уповільнюють швидкість корозійних процесів, не змінюючи при цьому властивостей середовища.
Дія інгібіторів полягає в утворенні на поверхні металу захисних плівок, які ізолюють метал від середовища або так змінюють його електродний потенціал, що активність металу помітно зменшується. У випадку корозії з водневою деполяризацією інгібітори мають особливо велике значення, оскільки більшість хімічних реакторів працює в агресивному кислотному середовищі.
За інгібітори використовують органічні та неорганічні суміші.
- Органічні інгібітори – це тіосечовина (C(NH2)2S), диетиламін (NH2–СН2–СН2–NH2), уротропін (CH2)6N4) та інші похідні амінів, наприклад, циклогексиламонію хромат (С6Н11NH3)2CrО4, додавання якого у кількості 0,5% від маси нейтрального розчину запобігає корозії сталі, латуні, бронзи і навіть алюмінію протягом 420 діб. У кислому середовищі застосовують каталізатор змінного складу – катапін, який уповільнює корозію сталі практично у будь-якій кислоті приблизно у 7000 разів.
- Неорганічні інгібітори – силікати, нітрити, дихромати лужних металів тощо.
11.4.3 Електрохімічні методи захисту
Сутність групи цих методів зводиться до зменшення електрохімічної корозії внаслідок поляризації. Це досягається при штучному створенні макрогальванічних елементів, за допомогою яких корозійні процеси спрямовують у необхідному напрямку.
Електрохімічні методи застосовують головним чином у тих випадках, коли металева конструкція знаходиться у воді, вологому грунті чи в агресивному середовищі (трубопроводи, кораблі, палі морських нафтопромислів).
Залежно від типу поляризації електрохімічні методи поділяються на такі групи:
- катодний захист,
- анодний захист,
а залежно від способу складання гальванічного елемента розрізняють
- протекторний захист,
- захист зовнішнім електричним струмом.
-
Катодний захист полягає у штучному створенні корозійного гальванічного елемента, в якому металева конструкція примусово виконує роль катода.
-
Катодний протекторний захист від корозії (рис.11.11а) реалізується при сполученні конструкції (яка функціонує як катод) з більш активним металом, який відносно основного металу заряджається анодно і тому піддається корозійному руйнуванню.
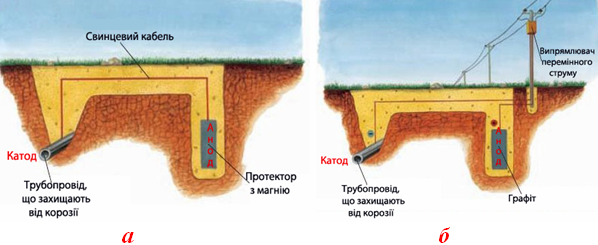
Рисунок 11.11 – Катодний захист металевих конструкцій: а) протекторний захист; б) захист зовнішнім струмом
За протектори найчастіше використовують викидний металевий брухт на основі магнієвих, цинкових та алюмінієвих сплавів. Наприклад, якщо до корпусу корабля приєднати магнієву пластину-протектор, то виникає макрогальванічний корозійний елемент, в якому магній є анодом, а сталевий корпус - катодом, що випливає з порівняння значень електродних потенціалів:
ε0Mg2+/Mg = -2,34B, ε0Fe2+/Fe = -0,44B.
Завдяки роботі корозійного гальванічного елемента сталь не руйнується, оскільки спостерігається розчинення протектора:
A: [TEX]Mg^0-2\bar{e}\rightarrow Mg^{2+}[/TEX],
K: [TEX]O_2^0 +2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
-
Катодний захист зовнішнім електричним струмом (рис.11.11б) відрізняється тим, що металева конструкція під’єднується до негативного полюса джерела постійного струму. Допоміжний електрод - анод – може бути розчинним (сталева рейка, балка чи металевий брухт, які поступово кородують, захищаючи від руйнування основний метал), або інертним (графіт, свинець, феросиліцид).
Катодний захист з застосуванням поляризації від зовнішнього джерела струму використовують для захисту обладнання, виготовленого з вуглецевих сталей, низько- і високолегованих і хромістих сталей, олова, свинцю, цинку, мідних і міднонікелевих сплавів, алюмінію і титану та їх сплавів. Як правило, захищають підземні та морські споруди (трубопроводи і кабелі різного призначення, фундаменти, бурове обладнання, корпуса судів), внутрішні поверхні апаратів і резервуарів хімічної промисловості.
-
Катодний протекторний захист від корозії (рис.11.11а) реалізується при сполученні конструкції (яка функціонує як катод) з більш активним металом, який відносно основного металу заряджається анодно і тому піддається корозійному руйнуванню.
-
Анодний захист застосовують значно рідше – головним чином у середовищах з достатньо високою провідністю при експлуатації обладнання, виготовленого з металевих матеріалів, що мають підвищену схильність до пасивації – вуглецевих низьколегованих нержавіючих сталей, сплавів на основі титану і алюмінію. При анодному захисту електродний потенціал металу зміщують в бік додатніших значень, завдяки чому відбувається поляризація металу. Внаслідок цього спостерігається суттєве зниження (у тисячі разів) швидкості корозії. Залежно від способу зміщення потенціалу анодний захист може здійснюватися двома способами.
- Анодний протекторний захист. При застосуванні цього методу конструкцію сполучають з малоактивним металом, який має дуже велике додатне значення електродного потенціалу, тому основний метал поляризується анодно.
- Анодний захист зовнішнім електричним струмом, при якому конструкцію під’єднують до позитивного полюсу джерела постійного струму. Цей метод використовують тільки для захисту від корозії металів, схильних до пасивації, наприклад нержавіюча сталь, що перебуває в окислювальному середовищі.
11.5 Приклади розв'язування типових задач
Приклад 11.1. Які процеси відбуваються при нещільному контакті цинкової та нікелевої пластини а) у вологому повітрі; б) у кислому середовищі?
Розв’язок. При контакті зазначених металів кородує більш активний цинк, що має менше значення електродного потенціалу:
ε0Zn2+/Zn = -0,76B, ε0Ni2+/Ni = -0,25B
а) У вологому повітрі утворюється корозійний гальванічний елемент, в якому цинк відіграє роль анода, а менш активний нікель – катода (рис.11.12):
А(-) Zn | O2, Н2O | Ni (+)K.
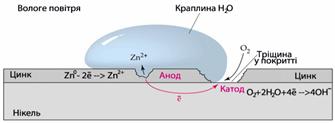
Рисунок 11.12 – Корозійні процеси при нещільному контакті цинкової та нікелевої пластин
Анод окиснюється, а на катоді спостерігається киснева деполяризація – це описується електронними рівняннями анодного і катодного процесів:
(-) A: [TEX]Zn^0-2\bar{e}\rightarrow Zn^{2+}[/TEX],
(+) K: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
б) У кислому середовищі корозія проходить з водневою деполяризацією, тому цинк піддається анодному окисненню, а на нікелевому катоді відновлюються йони гідрогену і виділяється вільний водень. Схема корозійного гальванічного елемента і електронні рівняння електродних процесів мають вигляд:
А(-) Zn | Н+, Н2O | Ni (+)K.
(-) A: [TEX]Zn^0-2\bar{e}\rightarrow Zn^{2+}[/TEX],
(+) K: [TEX]2H^++2\bar{e}\rightarrow H_2[/TEX].
Приклад 11.2. На стальний виріб нанесли краплину води. Чим пояснити, що після її висихання виникає пляма іржі?
Розв’язок. В даному випадку утворюється корозійна гальванопара нерівномірної аерації, що сприяє прискоренню корозійних процесів. При цьому ділянка поверхні металу під краплиною, куди доступ кисню дуже обмежений, є анодом – там проходить окиснення
(-) A: [TEX]Fe^0-2\bar{e}\rightarrow Fe^{2+}[/TEX].
Електрони прямують до ділянок Fe, які знаходяться на периферії краплини, куди кисень поступає без перешкод – це катодні ділянки, там проходить відновлення:
(+) K: [TEX]O_2+2H_2O+4\bar{e}\rightarrow 4OH^-[/TEX].
Туди ж від анода дифундують і катіони Fe2+, які беруть участь в утворенні іржи:
[TEX]4Fe^{2+}+3O_2+nH_2O+8\bar{e}\rightarrow 2Fe_2O_3\cdot nH_2O[/TEX].



