- 13.1 Вступ
- 13.2 Класифікація металів
- 13.3 Особливості будови металів
- 13.4 Фізичні властивості металів
- 13.5 Хімічні властивості металів
- 13.6 Взаємодія різних металів. Сплави
- 13.7 Добування металів
Ключові терміни:
d-метали, f-метали, p-метали, s-метали, Інтерметаліди, Густина, Електрична провідність, Збагачення руди, Магнітна сприйнятливість, Металевий блиск, Метали , Механічні суміші, Непрозорість, Питома теплоємність, Пластичність, Поліморфізм , Тверді розчини, Твердість, Теплопровідність, актиноїди, багатоелектронність, багатоцентровість, благородні метали, бориди, важкі метали, гідриди, делокалізованість, діамагнітні метали, евтектика, карбіди, кольорові метали, конгруентний сплав, лантаноїди, легкоплавкі метали, легкі метали, лужноземельні метали, лужні метали, ліквідус, металовмісні мінерали, металотермія, металічний зв’язок, надпероксиди, напівметали, ненапрямленість, ненасиченість, нітриди, область гомогенності, оксиди, парамагнітні метали, перехідні метали, пероксиди, платинові метали, поширені метали, природні метали, прості метали, пуста порода, радіоактивні метали, родина заліза, розсіяні метали, рідкоземельні метали, рідкі метали, силіциди, сингулярна точка, солідус, сплави, тверді розчини впровадження, тверді розчини заміщення, тугоплавкі метали, фазові діаграми стану, феромагнітні метали, флюси, чорні метали, шлаки, штучні метали, щільність пакування кристалу, інконгруентний сплав13.1 Вступ
Слово «метали» походить від грецького metallon – шахта, копалина. Однак з часом наповнення терміна змінилося і тепер в нього вкладають інший зміст.
Метали – це речовини, які мають певні особливості у будові атомів і кристалів та за звичайних умов виявлять специфічні характерні властивості: високу електропровідність, теплопровідність, від’ємний температурний коефіцієнт електричної провідності, здатність добре відбивати світлові хвилі (блиск), пластичність.
З хімічної точки зору металами називаються прості речовини, атоми яких на зовнішній оболонці містять невелику кількість електронів (1–3), мають великі ефективні радіуси, низькі значення потенціалів іонізації та високі відновлювальні властивості.
До класу металів належать як власно метали (прості речовини), так й їх сплави. Іноді металами називаються всі речовини, яким притаманні ті чи інші металічні властивості, наприклад, так звані «синтетичні» метали – інтеркаллати, органічні метали. Серед 118 вивчених елементів 95 вважаються металами, хоч межа між металами й неметалами в періодичній системі є досить умовною – від В до At (рис.13.1).
Однак слід зауважити, що існує група елементів, що виявляють проміжні властивості, – напівметали, які займають проміжну позицію між власно металами і напівпровідниками. До них відносять Sb, Bі, Ро, інколи –At і Te, які за хімічними властивостями більше походять на неметали, але за типом електричної провідності – на провідники. Важливою ознакою напівметалів є достатньо висока електропровідність при абсолютному нулі, яка на відміну від звичайних металів, зростає з підвищенням температури. Крім металів, напівметалів й неметалів, є ще одна група елементів – напівпровідники, що відрізняються особливим типом електричної провідності. Це Si, Ge, As, а також алотропні модифікації C (графіт) і Sn.
При віднесенні елемента до якоїсь групи необхідно брати до уваги явище поліморфізму.
Поліморфізм – це здатність однієї речовини у твердому стані утворювати різні кристалічні структури, що відрізняються одна від одної не тільки будовою кристалічних rраток, а й властивостями.
Наприклад, олово може існувати як у металічній (β-Sn), так і в напівпровідниковій модифікаціях (α-Sn), для однієї поліморфної модифікації хімічного елемента арсену As – сірого миш’яку – характерні електропровідність і металевий блиск, у той час як інша поліморфна модифікація – жовтий миш’як – є типовим неметалом. З іншого боку, у Ge, Si і навіть P за умов високого тиску знайдені модифікації з металічною електро- і теплопровідністю.
Поліморфні модифікації металів у міру зростання їх температур плавлення позначають буквами грецького алфавіту: найбільш низькотемпературній модифікації надають символ α, потім β і т.д.
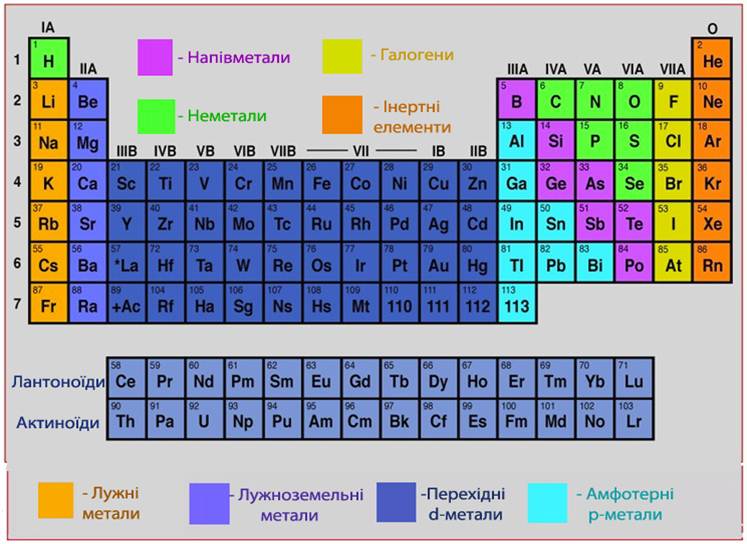
Рисунок 13.1 – Розташування металів та неметалів у Періодичній системі елементів
13.2 Класифікація металів
Існує багато класифікацій металів – залежно від характерної ознаки, яка розглядається. При цьому один і той самий метал може одночасно належати до різних класифікаційних груп. З точки зору хімії найважливішою є класифікація на підставі електронної будови атомів. Однак для інженера-фахівця корисно мати уявлення і про інші класифікації металів: за поширенням у природі, за фізичними властивостями тощо.
-
Геохімічна класифікація, яка склалася історично, поділяє метали на чорні та кольорові. Слід зазначити, що геохімічна класифікація дещо не співпадає з тією, що прийнята в металургії, згідно з якою до чорних металів відносять тільки залізо та сплави на його основі, а до кольорових – решту металів. А згідно з геохімічною класифікацією до групи чорних металів входить достатньо велика їх кількість.
- чорні метали, серед яких найтиповішими є залізо Fe, марганець Mn, хром Cr тощо (рис.13.2). Ці метали мають темно-сіре забарвлення, високу температуру плавлення, велику твердість. Для деяких з них характерне явище поліморфізму (Fe, Co, Mn, Ti, Zr, U);
- кольорові метали, що мають біле, жовте чи червоне забарвлення, низьку температуру плавлення, невелику твердість (рис.13.3). Найтиповіший представник – мідь.

Рисунок 13.2 – Чорні метали

Рисунок 13.3 – Деякі кольорові метали
-
За електронною конфігурацією валентних орбіталей метали поділяються на електронні родини:
- s-метали – лужні та лужноземельні метали, а також магній Mg і берилій Be;
- p-метали – алюміній Al, галій Ga, індій In, талій Tl (головна підгрупа III групи), германій Ge, олово Sn, свинець Pb (головна підгрупа IV групи), бісмут Bi (головна підгрупа V групи), полоній Po (головна підгрупа VІ групи);
- d-метали – елементи I-VIIIВ-підгруп періодичної системи;
- f-метали – лантаноїди і актиноїди.
Перші дві групи (s- і p-метали) іноді називають прості метали, а дві останні (d- і f-метали) – перехідні метали, оскільки вони виконують функцію неначе сполучальної ланки між s- і p-металами і виявляють вторинну періодичність у змінюванні потенціалів іонізації, атомних радіусів, фізичних і хімічних властивостей.
-
За природним походженням (тобто за сумісним знаходженням в одних і тих мінералах, гірських породах чи рудних копалинах) метали поділяють на такі групи:
- лужні метали (літій Li, натрій Na, калій K, рубідій Rb, цезій Cs, францій Fr);
- лужноземельні метали (кальцій Ca, стронцій Sr, барій Ba, радій Ra);
- родина заліза – залізо Fe, кобальт Co, нікель Ni;
- платинові метали – рутеній Ru, осмій Os, паладій Pd, родій Rh, іридій Ir, платина Pt;
- лантаноїди – 14 металів, що стоять у періодичній системі елементів після лантану 57La – від церію 58Ce до лютецію 71Lu; інколи до цієї групи відносять і сам лантан; серед лантаноїдів є один радіоактивний метал – прометій 61Pm;
- актиноїди – 14 металів після актинію 89Ac, починаючи від торію 90Th і закінчуючи лоуренсієм 103Lr; як і у випадку лантаноїдів, до родини актиноїдів часто приєднують і актиній; і всі актиноїди належать до радіоактивних елементів, причому у природі знайдені тільки Th, Pa, U, Np, Pu і Ac, а решта, від америцію 95Am до лоуренсію 103Lr, одержані штучно;
- рідкоземельні метали – скандій Sc, ітрій Y, лантан La і лантаноїди.
-
За конструкційними властивостями з урахуванням механічних, фізичних, хімічних та інших особливостей метали поділяються на численні групи, наприклад:
- важкі метали, густина яких перевищує 5г/см3, наприклад: мідь Cu, цинк Zn, свинець Pb, ртуть Hg, найважчим металом є осмій Os, густина якого дорівнює 22,6г/см3 (рис.13.4);
- легкі метали, що мають густину менше 5г/см3, наприклад: калій K, натрій Na, магній Mg, алюміній Al, найлегший метал – літій Li з густиною 0,53г/см3 (рис.13.4);
- легкоплавкі метали, температури плавлення яких не перевищують 1500оС; до них належать францій Fr (Тпл=18-21оС), цезій Cs (Тпл=28,5оС), галій Ga (Тпл=29,1оС), калій K (Тпл=62,3оС), натрій Na (Тпл=97,8оС), олово Sn (Тпл=231,85оС), свинець Pb (Тпл=327,4оС), а найлегкоплавкішою є ртуть Hg, температура плавлення якої дорівнює Тпл= –38,9оС (рис.13.4);
- тугоплавкі метали, температури плавлення яких вище 1500оС: залізо Fe (Тпл=1539оС), молібден Mo (Тпл=2620оС), осмій Os (Тпл=3030оС); найтугоплавкіший метал – вольфрам W, температура плавлення якого складає Тпл=3420оС (рис.13.4);
- благородні метали, які виявляють підвищену хімічну стійкість до окиснювальних і агресивних реагентів; благородними металами є золото Au, срібло Ag, платина Pt, паладій Pd, родій Rh, іридій Ir, рутеній Ru, осмій Os;
- радіоактивні метали – це метали, усі ізотопи яких мають радіоактивні властивості: технецій 43Tc, прометій 61Pm, полоній 84Po і всі метали з більшими, ніж у полонію, атомними номерами.

Рисунок 13.4 – Деякі фізичні властивості металів
-
За походженням виділяють такі групи елементів:
- природні метали, які входять до складу природних сполук. Це метали від Літію Li до Плутонію (94Рu);
- штучні метали, що утворюються внаслідок ядерних реакцій. Окрему групу складають радіоактивні елементи, яких відомо 27: Технецій 43Тс, Прометій 61Рm, Полоній 84Ро та всі елементи, що розміщуються в періодичній системі за Полонієм.
-
За розповсюдженням у природі всі метали можна поділити на три умовні групи:
- поширені метали – це, по-перше, Al, Fe, Ca, Na, K, Mg, які разом з О і Si становлять 98,53% від маси земної кори, а також Zn, Cu, Mn, Cl, N, P, S, Ba, Sr та Cr. На всі інші елементи припадає лише 0,85%;
- рідкі метали – малопоширені у природі або маловивчені метали, вміст яких у земній корі надто низький, наприклад: Літій Li, Рубідій Rb, Цезій Cs, Молібден Mo, Вольфрам W, Берилій Be, Цирконій Zr, Гафній Hf, Ванадій V, Ніобій Nb, Тантал Ta;
- розсіяні метали - метали, що не утворюють власних родовищ і самостійних мінералів, а знаходяться з іншими металами як домішки, наприклад, Германій Ga, Цезій Cs.
13.3 Особливості будови металів
У атомів металів на зовнішньому енергетичному рівні міститься невелика кількість валентних електронів (1, 2 чи – дуже рідко – 3), слабко сполучених із ядром завдяки великим атомним радіусам та екранувальній дії внутрішніх електронних шарів. Це зумовлює особливості хімічного зв’язку, який називається металічний зв’язок. Атоми, що знаходяться у вузлах металічної кристалічної гратки, неспроможні утримати свої зовнішні електрони, тому перетворюються у позитивно заряджені йони. У свою чергу, валентні електрони, відриваючись від атомів, достатньо вільно переміщуються по всьому кристалу і утворюють електронний газ. Загальна сума зарядів електронів відповідає загальній сумі позитивних зарядів вузлових частинок.
Електронна конфігурація атомів металів є причиною таких найважливіших властивостей металічного зв’язку:
- багатоцентровість – одночасне виникнення зв’язку між величезною кількістю вузлових частинок у кристалі; саме багатоцентровість забезпечує високу теплопровідність металів;
- багатоелектронність – здійснення зв’язку за рахунок усуспільнення всіх валентних електронів, що знаходяться у кристалі металу; багатоелектронність зумовлює електропровідність металів;
- ненапрямленість (або делокалізованість) – рівномірний розподіл електронної густини за всіма напрямками; при цьому валентні електрони жорстко не закріплюються між двома атомами, як при ковалентному зв’язку, а переходять у стан провідності, внаслідок чого повністю делокалізуються і належать не одному конкретному атому, а однаковою мірою всім атомам у вузлах кристалічної решітки;
- ненасиченість – можливість утворення хімічних зв’язків між невизначеною кількістю атомів, яка обмежується лише геометричними параметрами (розмірами атомів) і взаємним відштовхуванням однойменно заряджених вузлових частинок; ненасиченістю пояснюються великі координаційні числа (як правило, 8 чи 12), які показують кількість найближчих вузлів кристалічної решітки, що оточують даний вузол.
Металічний зв’язок у чистому вигляді реалізується тільки у лужних і лужноземельних металів, а у решти металів поряд із металічним здійснюється і ковалентний зв’язок. У р-металах і особливо у перехідних d-металах тільки невелика частина електронів перебуває у стані усуспільнення. Наприклад, у типовому перехідному металі ніобії Nb на один атом припадає всього 1,2 узагальнених делокалізованих електрони. Інші валентні електрони утворюють напрямлений ковалентний зв’язок між сусідніми атомами. Саме цим пояснюються високі температури плавлення та велика механічна міцність d-металів.
Великі координаційні числа металів зумовлюють значну щільність пакування кристалу – частку об’єму елементарної кристалічної комірки, безпосередньо зайняту йонами металу, при якій йони укладаються у просторі як кульки однакового розміру. Структура металічних кристалів визначається у першу чергу просторово-геометричними чинниками – намаганням атомів скоординуватися якомога щільніше.
Для металів найбільш характерними є три типи кристалічної rратки:
- кубічна об’ємноцентрована з координаційним числом 8 і щільністю пакування 68% (рис.13.5а); таку rратку мають метали Li, Na, K, V, W, Cr, Pb, а також поліморфні модифікації Fe до температури 911оС та від 1392оС до точки плавлення;
- кубічна гранецентрована з координаційним числом 12 і щільністю пакування 74% (рис.13.5б), така rратка утворюється при кристалізації металів: Al, Ca, Mi,Cu, Ag, Au, а також поліморфної модифікації Fe в інтервалі температур 911-1392оС;
- гексагональна з координаційним числом 12 і щільністю пакування 74% (рис.13.5в), в якій кристалізуються метали Be, Mg, Cd, Ti, Co, Zn.
Тільки незначна кількість металів має кристалічні структури, відмінні від розглянутих простіших типів, наприклад: Hg, In, окремі поліморфні модифікації U, Mn, Np.
Рисунок 13.5 – Кристалічні гратки металів: а) кубічна об’ємноцентрована (Li, Na, Ba, Mo, W, V); б) кубічна гранецентрована (Cu, Au, Ag, Al); в) гексагональна (Mg, Zn, Ti, Cd, Cr)
Під час кристалізації металів (наприклад, у процесі охолоджування розплавів) одночасно утворюється величезна кількість дрібних кристаликів, які заважають один одному вирости і набути правильної форми. Тому будь-який металевий виріб має полікристалічну структуру, що складається із великої кількості дрібних кристаликів – так званих кристалітів, або зерен, які на відміну від чітко огранених монокристалів інших неорганічних речовин мають неправильну форму і різну просторову орієнтацію. З цієї причини у кристалічній структурі металів виникають дефекти, які суттєво впливають на фізичні властивості металів.
13.4 Фізичні властивості металів
Особливості будови атомів металів та їх кристалічної структури зумовлюють певні оптичні, механічні, теплові, електромагнітні та інші ознаки, сукупність яких складає фізичні властивості металів.
І. Оптичні властивості металів.
- Металевий блиск зумовлюється здатністю металів майже повністю відбивати світлові промені будь-якої довжини спектру. Цим пояснюється білий чи сірий колір більшості металів. Частка світла, що поглинається, визначає інтенсивність блиску. Найяскравіше блищать паладій, іридій та срібло (рис.13.6). Однак деякі метали (золото, мідь, цезій) сильніше поглинають світло з певними довжинами хвиль, тому вони забарвлені у жовті чи червоні кольори. У порошкоподібному стані більшість металів набуває чорного чи темно-сірого кольору.

Рисунок 13.6 – Метали з найсильнішим блиском
- Непрозорість металів пов’язана із наявністю в кристалічній rратці вільних рухливих електронів, які гасять світлові коливання, перетворюючи їх у теплоту чи, в деяких випадках, використовуючи їх енергію для вивільнення електронів зі своєї поверхні (явище фотоефекту).
ІІ. Механічні властивості металів.
- Пластичність – здатність без руйнування піддаватися деформаціям за умов звичайних чи підвищених температур, завдяки чому метали можна кувати, прокатувати, штампувати, витягувати у дріт тощо. Найбільш пластичний метал – золото. Пластичність металів забезпечується специфічними особливостями металічного зв’язку: завдяки багатоцентровості та багатоелектронності він не розривається при дії механічних навантажень, які викликають тільки зміщення (ковзання) окремих шарів кристалічної rратки один відносно одного і перерозподіл електронного газу, що зв’язує атоми металу.
- Густина – інша характеристика механічних властивостей, залежно від якої метали поділяються на легкі та важкі. Як вже зазначалося, до легких металів, густина яких не перебільшує 5г/см3, належать всі s-метали, алюміній, титан і скандій, а до важких – в основному d-метали V-VII періодів. Найлегший метал – літій (0,53г/см3), найважчий – осмій (22,6г/см3).
- Твердість – опір проникненню у метал іншого твердого тіла. Найтвердішими металами є хром, молібден і вольфрам, а найменш твердими – індій та лужні метали.
ІІІ. Теплові властивості.
- Теплопровідність металів пояснюється тим, що вільні електрони обмінюються енергією з йонами, які знаходяться у вузлах кристалічної решітки. При нагріванні металу коливання йонів на його поверхні зростають, а енергія коливань через електронний газ миттєво передається сусіднім йонам, тому відбувається швидке вирівнювання температури по всій масі металу.
- Питома теплоємність для більшості металів має невисокі значення (менше 0,84Дж/г.К), але все ж таки може коливатися у достатньо широкому діапазоні від 3,55Дж/г·К у літію до 0,115Дж/г·К в урану.
IV. Електромагнітні властивості.
- Електрична провідність зумовлюється наявністю зони провідності (див. тему 5.4.5), на яку здатні легко переходити валентні електрони, що і забезпечує електропровідність металу. Максимальна електропровідність притаманна для металів, в атомах яких на зовнішньому s-підрівні міститься по одному електрону, це – хром, молібден і особливо мідь, срібло, золото.
- Магнітна сприйнятливість – це міра магнітних властивостей металів, які визначають їх поведінку у магнітному полі. Метали з негативною магнітною сприйнятливістю, які виявляють опір магнітним силовим полям, називаються діамагнітні метали. До них належать берилій, цинк, кадмій, ртуть, галій, германій. Метали з позитивною магнітною сприйнятливістю, які добре проводять магнітні силові поля, називають парамагнітні метали, а метали з особливо високою магнітною сприйнятливістю – феромагнітні метали(рис.13.7). Парамагнітними є лужні, лужноземельні метали і метали побічних підгруп, а феромагнітними – тільки залізо, кобальт, нікель, гадоліній и диспрозій. Феромагнетизм зберігається лише до певної критичної температури – так званої точки Кюрі, – вище якої залишаються звичайні парамагнітні властивості.

Рисунок 13.7 – Феромагнітні метали
13.5 Хімічні властивості металів
Хімічні властивості металів залежать від електронної будови їх атомів, а саме від структури валентних енергетичних підрівнів і великих розмірів атомних радіусів (порівняно із атомними радіусами неметалів). Зовнішні електрони в атомах металів суттєво віддалені від ядра і слабко сполучені з ним, завдяки чому метали мають невисокі значення потенціалів іонізації, які характеризують їх відновлювальні властивості. Метали достатньо легко віддають свої валентні електрони, перетворюючись у позитивно заряджені йони.
Однак різним металам відновлювальна здатність притаманна неоднаковою мірою. Висновок про можливість взаємодії конкретного металу з тим чи іншим окисником можна зробити, виходячи зі знака енергії Гіббса (ΔG<0) чи із порівняння стандартних електродних потенціалів відповідних окисно-відновних систем: εоок/відн>εоМеn+/Mе. У загальному випадку відновлювальні властивості металів посилюються у межах підгруп із зростанням порядкового номера, збільшенням атомних радіусів і зменшенням величин енергії іонізації. Деякі метали (наприклад, лужні та лужноземельні) настільки активні, що їх необхідно зберігати у запаяному посуді під шаром гасу, вазеліну чи парафіну.
13.5.1 Взаємодія з неметалами
Практичне значення має відношення металів до дії галогенів, кисню, сірки та інших простих речовин неметалів з окиснювальними властивостями.
1. Галогени. Серед галогенів окиснювальна здатність зменшується при переході від фтору до йоду, тому F2 і Cl2 окиснюють всі метали, Br2 – більшість, а I2 – тільки найактивніші. При цьому активні метали швидко згоряють в атмосфері F2 і Cl2, з бромом реакція відбувається повільніше, а з йодом – при підпалюванні реакційної суміші (рис.13.8). Внаслідок взаємодії утворюються солі – галогеніди металів:
- [TEX]2Ag+F_2\rightarrow{2AgF}[/TEX]
- [TEX]2Fe+3Cl_2\rightarrow2FeCl_3[/TEX]
- [TEX]2Al+3I_2\rightarrow2AlI_3[/TEX]

Рисунок 13.8 – Згоряння металів в атмосфері галогенів: а) магнію у хлорі; б) магнію у йоді; в) заліза у хлорі
2. Кисень. З киснем за тих чи інших умов взаємодіють майже всі метали, але менш енергійно. Як продукти, як правило, утворюються оксиди, причому не обов’язково вищі:
- [TEX]2Mg+O_2\rightarrow{2MgO}[/TEX],
- [TEX]2Cu+O_2\rightarrow{2CuO}[/TEX],
- [TEX]4Al+3O_2\rightarrow{2Al_2O_3}[/TEX].
Лужні метали (за винятком літію, який окиснюється до оксиду Li2O) утворюють пероксиди, де оксиген має ступінь окиснення –1, чи надпероксиди, в яких оксиген виявляє дробовий ступінь окиснення –1/2:
- [TEX]2Na+O_2\rightarrow{Na_2O_2}[/TEX],
- [TEX]2K+2O_2\rightarrow{K_2O_4}[/TEX].
3. Сірка. Із сіркою, особливо при нагріванні чи у розплавленому стані, реагує більшість металів з утворенням сульфідів (рис.13.9), наприклад:
- [TEX]Zn+S\rightarrow{ZnS}[/TEX],
- [TEX]Ca+S\rightarrow{CaS}[/TEX].

Рисунок 13.9 – Поетапний перебіг реакції, що відбувається при взаємодії магнію з сіркою за схемою Mg + S → MgS
4. Водень. З воднем взаємодіють переважно активні метали. Продуктами взаємодії є бінарні сполуки – гідриди, які бувають такими:
-
солеподібні (гідриди лужних і лужноземельних металів з високою відновлювальною здатністю; ця група гідридів містить атоми гідроген у ступеню окиснення – 1):
- [TEX]2Na+H_2\rightarrow{2NaH}[/TEX];
-
металоподібні, які за характером хімічного зв’язку близькі до металів і не мають фіксованого стехіометричного складу:
- [TEX]Ti+H_2\rightarrow{TiH_{1,5-2}}[/TEX],
- [TEX]U+H_2\rightarrow{UH_{2-3}}[/TEX];
- ковалентні, яким притаманна полімерна природа, – це гідриди таких металів, як Be, Mg, Al, Cu, Zn та ін.:
- [TEX]2Al+3H_2\rightarrow{2AlH_3}[/TEX].
5. Азот є слабким окисником завдяки надзвичайно міцному хімічному зв’язку, тому на більшу частину металів він не діє. Лише деякі метали здатні згоряти в атмосфері азоту з утворенням бінарних сполук, які називаються нітриди, а за кімнатної температури у реакцію з ним може вступати тільки літій:
- [TEX]6Li+N_2\rightarrow{2Li_3N}[/TEX],
- [TEX]2Al+N_2\rightarrow{2AlN}[/TEX],
- [TEX]3Mg+N_2\rightarrow{Mg_3N_2}[/TEX].
6. Інші слабкі окисники (вуглець, кремній, бор) при високій температурі утворюють з металами бінарні сполуки – карбіди, силіциди, бориди відповідно. Для багатьох із них характерні висока твердість (наприклад, WC, TiC, CrB2), жаростійкість (ZrC, MoB5, TiNx ), хімічна стійкість (TiNx, ZrN), тому вони застосовуються як абразиви, вогнетриви, матеріали різальних інструментів, жароміцні та хімічно стійкі покриття.
13.5.2 Відношення до води
Більшість металів не розчиняються у воді, однак майже всі s-елементи, крім берилію Be, вступають з нею у хімічну реакцію з утворенням відповідної основи і водню. При цьому рубідій Rb і цезій Cs реагують із вибухом, калій K – із самозайманням водню, який при цьому виділяється, натрій Na і літій Li – достатньо бурхливо, а метали IIА-підгрупи – без згоряння:
- [TEX]2Na+2H_2O\rightarrow{2NaOH+H_2\uparrow}[/TEX],
- [TEX]Ba+2H_2O\rightarrow{Ba(OH)_2+H_2\uparrow}[/TEX].
p-Елементи, незважаючи на те, що стоять у ряді напруг до водню (рис.13.10), не можуть розкласти воду, оскільки їх поверхня покрита хімічно стійкою оксидною плівкою, щільно з’єднаною з металом.

Рисунок 13.10 – Електрохімічний ряд напруг металів
Однак якщо видалити захисну плівку чи перевести метал у тонкодисперсний стан (у вигляді порошку), то деякі з них здатні розчинятися у воді, наприклад, алюміній може взаємодіяти з рідкою водою при кімнатній температурі, а галій – при підвищеній температурі з парами води:
- [TEX]2Al+6H_2O\rightarrow{2Al(OH)_3+3H_2\uparrow}[/TEX],
- [TEX]4Ga+3H_2O\rightarrow{2Ga_2O_3+3H_2\uparrow}[/TEX].
Позбавлений захисної оксидної плівки алюміній взаємодіє з рідкою водою при кімнатній температурі
Серед d-елементів тільки лантан вступає у реакцію з водою
- [TEX]2La+6H_2O\rightarrow{2La(OH)_3+3H_2\uparrow}[/TEX].
Дія води на метали посилюється за наявності розчиненого в ній кисню. При цьому деякі малоактивні метали, які за звичайних умов не взаємодіють з Н2О, окиснюються аерованою водою за схемою
- [TEX]2Me+nH_2O+0.5nO_2\rightarrow{2Me(OH)_n}[/TEX].
13.5.3 Відношення до кислот
Оскільки метали згідно із їх природою та призначенням (конструкційні чи інструментальні матеріали) можуть використовуватися у різному оточенні, то необхідно мати повну інформацію про їх поведінку у середовищах, які містять йони гідрогену, тобто у водних розчинах кислот чи тих солей, що утворені сильними кислотами і внаслідок гідролізу дають кислу реакцію середовища. Однак щоб прогнозувати можливість взаємодії кожного металу з тією чи іншою кислотою, слід аналізувати відомості про властивості як самого металу (активний, малоактивний, схильний до пасивації тощо), так і кислоти. За характером дії, в тому числі по відношенню до металів, кислоти умовно поділяють на дві групи:
- неокиснювальні, в яких окисником виступає йон гідрогену Н+;
- окиснювальні, в яких окисником є кислотний залишок за рахунок центрального атома, що перебуває у максимальному чи достатньо високому ступені окиснення.
Крім того, залежно від кількісного вмісту кислоти у розчині вони можуть бути концентрованими і розведеними, що також впливає на шлях перебігу реакції та склад продуктів, які при цьому утворюються.
І. Неокиснювальні кислоти (розведена сульфатна H2SO4, галогеноводневі HF, HCl, HBr, HI, ортофосфатна H3PO4, оцтова CH3COOH та інші слабкі кислоти) діють тільки на метали, що стоять у ряді напруг до водню і мають помітно від’ємне значення стандартного електродного потенціалу (рис.13.10). У результаті таких реакцій виділяється вільний водень і утворюються солі.
Слід взяти до уваги декілька важливих моментів. По-перше, якщо метал здатен виявляти у сполуках декілька ступенів окиснення, то неокиснювальні кислоти окиснюють його мінімально. Наприклад, Fe, неокиснювальними кислотами окиснюється до +2:
- [TEX]Fe+2HCl\rightarrow{FeCl_2+H_2\uparrow}[/TEX],
- [TEX]Cr+H_2SO_{4(розв.)}\rightarrow{CrSO_4+H_2\uparrow}[/TEX].
По-друге, деякі метали, стандартний електродний потенціал яких близький до нуля, майже не взаємодіють з неокиснювальними кислотами. Це пов’язано із значною перенапругою виділення водню на таких металах. Наприклад, стійкими до дії розведеної сульфатної, хлоридної та слабких кислот є метали:
галій (εо= –0,53В), вольфрам (εо= –0,09В), індій (εо= –0,34В).
По-третє, якщо продуктом реакції металу з неокиснювальною кислотою є малорозчинна сіль, то вона покриває поверхню металу плівкою і тим захищає його від подальшої взаємодії, наприклад:
- [TEX]2Al+2H_3PO_4\rightarrow{2AlPO_4\downarrow+3H_2\uparrow}[/TEX],
- [TEX]Pb+H_2SO_{4(розв.)}\rightarrow{PbSO_4\downarrow+H_2\uparrow}[/TEX].
Взаємодія цинку з сульфатною кислотою, внаслідок якої утворюється сіль цинк сульфат і виділяється вільний водень згідно з рівнянням
Zn + H2SO4(розв) → ZnSO4 + H2↑.
ІІ. Окиснювальні кислоти (нітратна HNO3, концентрована сульфатна H2SO4 та ін.), окиснювальна здатність яких зумовлюється не наявністю йона Н+, а властивостями недисоційованих молекул самих кислот чи їх аніонів, взаємодіють із усіма металами від початку ряду напруг до срібла включно (рис.13.10).
Особливість дії цих кислот полягає в тому, що вони окиснюють метал без виділення водню. Однак у випадку реакції найактивніших металів (Li, Na, K, Mg) з дуже розведеними розчинами окиснювальних кислот, яка відбувається надзвичайно бурхливо, водень все ж таки може виділятися, але це є результатом взаємодії металу не з кислотою, а з водою, наявною у розчині кислоти.
Другою особливістю концентрованих розчинів окиснювальних кислот, яку слід завжди пам’ятати, є їх пасивуюча дія, внаслідок якої на поверхні металу, схильного до пасивації (Al, Cr, Fe, Ti та ін.), з’являється захисна плівка із малорозчинних сполук, що зберігає метал від подальшого розчинення у кислоті, тому при кімнатній температурі реакція миттєво припиняється. Проте при сильному нагріванні захисна плівка на поверхні металу розчиняється і тоді починається взаємодія металу з кислотою (рис.13.11).

Рисунок 13.11 – При сильному нагріванні Fe (а) і Al (б) з концентрованою нітратною кислотою захисна плівка на поверхні металу розчиняється і відбувається взаємодія металу з HNO3, внаслідок якої виділяється бурий газ NO2
Необхідно знати ще один важливий момент. З міркувань техніки безпеки не проводять реакцію лужних і більшості лужноземельних металів з концентрованими сульфатною і нітратною кислотами, оскільки така взаємодія супроводжується сильним вибухом (рис.13.12).
Взаємодія лужного металу натрію Na з концентрованою сульфатною кислотою H2SO4(конц) супроводжується самозайманням продуктів реакції або навіть вибухом – у випадку достатньої кількості вихідних речовин

Рисунок 13.12 – Взаємодія натрію Na з концентрованою сульфатною кислотою проходить з вибухом: а) концентрована H2SO4, в яку опускають шматочок Nа; б) перебіг реакції Nа з H2SO4(конц.)
ІІ.1 Концентрована сульфатна кислота, окиснювальна здатність якої виявляється за рахунок Сульфуру (+6), при взаємодії з металами залежно від їх активності, температури середовища, ступеня концентрування кислоти може відновлюватися по-різному. Малоактивні метали відновлюють сульфатну кислоту H2SO4(конц.) до SO2, наприклад:
- [TEX]2Ag+2H_2SO_{4(конц.)}\rightarrow{Ag_2SO_4+SO_2\uparrow{+2H_2O}}[/TEX],
метали середньої активності – до вільної сірки S(0):
- [TEX]3Ni+4H_2SO_{4(конц.)}\rightarrow{3NiSO_4+S+4H_2O}[/TEX],
активні метали – переважно до H2S:
- [TEX]4Mg+5H_2SO_{4(конц.)}\rightarrow{4MgSO_4+H_2S\uparrow{+4H_2O}}[/TEX].
Але на практиці достатньо активні метали звичайно реагують із концентрованою сульфатною кислотою з утворенням суміші сірчистого газу SO2, сірководню Н2S і вільної сірки S, тобто паралельно відбуваються всі три імовірні реакції. Наприклад, при взаємодії H2SO4(конц.) з цинком одночасно можуть відбуватися такі процеси:
- [TEX]Zn+2H_2SO_{4(конц.)}\rightarrow{ZnSO_4+SO_2\uparrow{+2H_2O}}[/TEX],
- [TEX]Zn+4H_2SO_{4(конц.)}\rightarrow{3ZnSO_4+S\downarrow{+4H_2O}}[/TEX],
- [TEX]4Zn+5H_2SO_{4(конц.)}\rightarrow{4ZnSO_4+H_2S\uparrow{+4H_2O}}[/TEX].
ІІ.2 Концентрована нітратна кислота при взаємодії з металами відновлюється, як правило, до бурого газу – нітроген (IV) оксиду, а метал при цьому окиснюється найчастіше до максимального (чи достатньо високого) ступеня окиснення (рис.13.13 і 13.14а), наприклад:
- [TEX]Cu+4HNO_{3(конц.)}\rightarrow{Cu(NO_3)_2+2NO_2\uparrow{+2H_2O}}[/TEX],
- [TEX]Sn+4HNO_{3(конц.)}\rightarrow{H_2SnO_3\downarrow+4NO_2\uparrow{+H_2O}}[/TEX].
Взаємодія активного металу магнію з концентрованою нітратною кислотою відповідно до рівняння реакції
Mg + 4HNO3(конц) → Mg(NO3)2 + 2NO2↑ + 2H2O
Взаємодія малоактивного металу олова Sn з концентрованою нітратною кислотою відповідно до рівняння реакції
Sn + 4HNO3(конц)→ H2SnO3↓ + 4NO2↑ + H2O

Рисунок 13.13 – Поетапна взаємодія олова Sn з концентрованою нітратною кислотою HNO3, внаслідок якої виділяється бурий газ NO2
ІІ.3 Розведена нітратна кислота у реакціях із малоактивними металами (Cu, Ag, Hg, Pb) виділяє нітроген (ІІ) оксид (рис.13.14б):
- [TEX]3Cu+8HNO_{3(розв.)}\rightarrow{3Cu(NO_3)_2+2NO\uparrow{+4H_2O}}[/TEX],
- [TEX]3Hg+4HNO_{3(розв.)}\rightarrow{3Hg(NO_3)_2+2NO\uparrow{+4H_2O}}[/TEX],
- [TEX]3Ag+4HNO_{3(розв.)}\rightarrow{3AgNO_3+NO\uparrow{+2H_2O}}[/TEX].

Рисунок 13.14 – Взаємодія ртуті: а) з концентрованою нітратною кислотою; б) з розведеною HNO3
Інколи деякі метали, що стоять усередині ряду напруг (Fe, Cd, Ga), можуть відновити розведену нітратну кислоту до N2O чи до вільного азоту N2:
- [TEX]10Fe+36HNO_{3(розв.)}\rightarrow{10Fe(NO_3)_3+3N_2\uparrow{+18H_2O}}[/TEX],
- [TEX]4Cd+10HNO_{3(розв.)}\rightarrow{4Cd(NO_3)_2+N_2O\uparrow{+5H_2O}}[/TEX].
ІІ.4 Дуже розведена нітратна кислота взаємодіє з активними металами (Mg, Al, Zn, V, Nb) з утворенням амоніаку NH3 (чи йона амонію NH4+, який реагує з надлишком кислоти і дає нітрат амонію), наприклад:
- [TEX]4Mg+9HNO_{3(розв.)}\rightarrow{4Mg(NO_3)_2+NH_3\uparrow{+3H_2O}}[/TEX],
- [TEX]8Al+30HNO_{3(розв.)}\rightarrow{8Al(NO_3)_3+3NH_4NO_3+9H_2O}[/TEX],
Отже, у загальному випадку особливості взаємодії металів з HNO3 і характер продуктів, що утворюються, залежать від активності металу, концентрації та кількості кислоти і умов проведення реакції (рис.13.15).
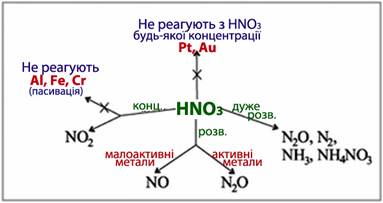
Рисунок 13.15 – Найімовірніші продукти відновлення нітратної кислоти при її взаємодії з металами
13.5.4 Відношення до лугів
У реакцію з лугами вступають лише амфотерні метали: берилій Be (s-елемент), алюміній Al, олово Sn, свинець Pb, германій Ge (p-елементи), цинк Zn (d-елемент). Якщо взаємодія відбувається у водних розчинах (рис.13.16), то утворюються комплексні гідроксосолі, комплексоутворювачем в яких є катіон амфотерного металу, наприклад:
- [TEX]Be+2KOH+2H_2O\rightarrow{K_2[Be(OH)_4]+H_2\uparrow}[/TEX],
- [TEX]Pb+4KOH+2H_2O\rightarrow{K_4[Pb(OH)_6]+H_2\uparrow}[/TEX],
- [TEX]2Al+2KOH+6H_2O\rightarrow{2K[Al(OH)_4]+3H_2\uparrow}[/TEX],
- [TEX]2Al+6KOH+6H_2O\rightarrow{2K_3[Be(Al)_6]+H_2\uparrow}[/TEX].
Взаємодія амфотерного металу алюмінію Al з лугом КОН, внаслідок чого утворюється комплексна сіль і виділяється водень:
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑,

Рисунок 13.16 – Поетапний перебіг взаємодії алюмінію з лугом і згоряння водню, що виділився внаслідок реакції
У деяких випадках взаємодія амфотерного металу відбувається по-різному залежно від концентрації розчину лугу, як це видно із наведених вище рівнянь, що відбивають реакції алюмінію з лужними розчинами. Можна навести інший приклад: при розчиненні олова у концентрованому лузі утворюються солі дуже слабкої станітної кислоти – станіти:
- [TEX]Sn+2KOH_{(конц.)}\rightarrow{K_2SnO_2+H_2\uparrow}[/TEX],
а у розведеному розчині лугу – комплексні гідроксостаніти:
- [TEX]Sn+2KOH_{(розв.)}+2H_2O\rightarrow{K_2[Sn(OH)_4]+H_2\uparrow}[/TEX].
При сплавленні амфотерних металів з твердими лугами отримують звичайні середні солі – берилати, алюмінати, цинкати і т.ін.:
- [TEX]Be+2KOH\rightarrow{K_2BeO_2+H_2\uparrow}[/TEX],
- [TEX]2Al+6KOH\rightarrow{2KAlO_2+2K_2O+3H_2\uparrow}[/TEX],
- [TEX]Zn+2KOH\rightarrow{K_2ZnO_2+H_2\uparrow}[/TEX].
Деякі метали хоч фактично і не належать до амфотерних, можуть взаємодіяти з лугами за наявності сильних окисників. Наприклад, якщо через розчин лугу пропускати під тиском струмінь кисню, то такі метали, як ванадій V, ніобій Nb і тантал Ta (d-елементи) вступають у реакцію з утворенням солей – ванадатів, ніобатів і танталатів відповідно, набуваючи максимального ступеня окиснення +5, згідно із загальною схемою
- [TEX]4Me+5O_2+12KOH\rightarrow{4K_3MeO_4+6H_2O}[/TEX],
Аналогічно поводять себе із лугами за наявності окисників і d-метали рутеній Ru та осмій Os. При сплавленні із сумішшю лугу і окисника вони дають середні солі – рутенати і осмати, в яких ступінь окиснення металу дорівнює +6:
- [TEX]Me+3KClO+2KOH\rightarrow{K_2MeO_4+3KCl+H_2O}[/TEX].
13.5.5 Взаємодія із солями інших металів
Метали у вільному стані виявляють відновлювальні властивості, які послаблюються із зростанням значення стандартного електродного потенціалу від початку ряду напруг до його кінця (рис.13.10), а у стані позитивно заряджених йонів – окиснювальні, які у зазначеному напрямку, навпаки, посилюються. Це є передумовою для витіснення малоактивних металів із розчинів їх солей більш активними металами (рис.13.17), наприклад:
- [TEX]Fe+CuSO_4\rightarrow{FeSO_4+Cu}[/TEX],
- [TEX]Zn+SnCl_2\rightarrow{ZnCl_2+Sn}[/TEX].

Рисунок 13.17 – Кінець мідної пластинки, занурений у безбарвний розчин аргентум нітрату (а), через деякий час вкривається нальотом чистого срібла (б), а розчин набуває синьо-зеленого забарвлення внаслідок перебігу реакції [TEX]Cu+2AgNO_3\rightarrow{Cu(NO_3)_2+2Ag\downarrow}[/TEX]
Необхідно пам’ятати, що найбільш активні метали, які розміщуються на самому початку ряду напруг, при внесенні їх у водні розчини солей малоактивних металів вступають у взаємодію не з сіллю, а з водою, що міститься у розчині. Так, якщо шматочок калію занурити у розчин солі малоактивного металу (наприклад CuSO4 чи Pb(NO3)2), то реакція відбувається за схемою:
- [TEX]2K+2H_2O\rightarrow{2KOH+H_2}[/TEX].
Реакції між металами і простими нерозчинними солями менш активних металів (галогенідами загального складу MeHalx, халькогенідами MexSy) звичайно відбуваються тільки при сильному нагріванні, хоч і супроводжуються екзотермічними ефектами:
- [TEX]Mg+SnCl_2\rightarrow{MgCl_2+Sn}[/TEX],
- [TEX]Be+Ag_2S\rightarrow{BeS+2Ag}[/TEX].
13.6 Взаємодія різних металів. Сплави
У твердому стані метали майже не взаємодіють один із одним, але у розплавленому вигляді у більшості випадків вони змішуються між собою, утворюючи однорідні системи – сплави.
Металічні сплави – це речовини, що мають типові металічні властивості та складаються із двох чи більше елементів, із яких меншою мірою хоч одним є метал.
Властивості сплавів значно відрізняються від властивостей тих компонентів, що входять до складу сплаву. Наприклад, міцність на розрив у латуні (сплаву міді з цинком) у три рази вища, ніж у чистої міді, і у шість разів, ніж у чистого цинку. За певними ознаками розрізняють такі сплави: жароміцні, жаростійкі, антифрикційні, корозійностійкі, легкі, надлегкі, стійкі до зношування, а також ті, що мають особливі властивості, а саме: теплові, електричні, магнітні тощо.
Одержання сплавів. Для одержання сплавів розроблені численні способи. Найчастіше використовують такі:
- кристалізація при охоложденні розплавлених компонентів;
- сумісне електроосадження твердої фази із розчину чи з газової фази;
- дифузійне насичення одного компонента іншим.
Природа сплавів буває різною залежно від індивідуальних характеристик, будови і властивостей металів, з яких складається сплав, а також від можливості хімічної взаємодії між ними та взаємної розчинності. Слід уточнити, що немає металів, абсолютно нерозчинних один в одному у твердому стані, однак якщо їх взаємна розчинність не перевищує сотої частки відсотку, то такі метали прийнято вважати нерозчинними. Деякі метали (лужні, магній, берилій) є поганими розчинниками і самі погано розчиняються в інших металах. Для систем за їх участю найчастіше спостерігається розшарування в рідкій фазі (наприклад, Na-Al, К-Fe, Li-Cs та ін.). У таких системах компоненти кристалізуються (і плавляться) незалежно один від одного при будь-яких кількісних співвідношеннях.
Для фізико-хімічного аналізу сплавів використовують фазові діаграми стану (їх інколи називають ще діаграмами плавкості, або діаграмами кристалізації), які відображають залежність певного параметра (наприклад, температури кристалізації) від складу сплаву. Типовий вид діаграми стану для механічних сумішей наведений на рис.13.18, де на осі Х відкладають склад компонентів А і В (мас. %), а на осі Y – температури. Діаграми стану, або фазові діаграми, що показують, які фази можуть співіснувати за даної температури, одержують експериментальним шляхом. Для цього готують велику кількість зразків, що містять суміші різного складу із металів А і Б, розплавляють їх, а потім повільно охолоджують і відмічають температуру кристалізації кожного зразку. За умови великого набору сплавів, що містять метали А і В у різному масовому співвідношенні, та відповідних їм температур кристалізації будують діаграми складу.
З урахуванням природи сплавів розглядають три основних випадки.
I Механічні суміші, що складаються із сукупності окремих кристалітів кожного компонента (тобто зерен невеликих монокристаликів). Механічні суміші можуть утворюватися металами, які мають високу взаємну розчинність у розплавленому стані і утворюють гомогенні розчини, але у твердому стані не розчиняються і не взаємодіють один із одним.
Механічні суміші отримують при сумісній кристалізації металів, які суттєво відрізняються за типом кристалічної гратки, наприклад, Pb-Sn, Pb-Sb, Cd-Bi, Sn-Zn. Температура кристалізації (або плавлення) такого сплаву залежить від співвідношення компонентів.
Склад мікрогетерогенної механічної суміші кристалічних твердих фаз, якому відповідає мінімальна температура плавлення, називається евтектика.
Наприклад, для суміші 87% Pb та 13% Sb евтектика має температуру плавлення і кристалізації 246оС, в той час як температури плавлення окремих компонентів становлять відповідно для Pb 327оС, а для Sb 631оС.
Сплав, для якого температура плавлення збігається з температурою кристалізації, називається конгруентний сплав.
На фазовій діаграмі механічних сумішей можна виділити п’ять областей (рис.13.18). Перша – рідкий стан, тобто гомогенний розплав металів А і В. Точки кривих кристалізації Тпл.А і Тпл.В, що лежать на осях ординат, відповідають температурам плавлення (і одночасно – кристалізації) чистих металів А і В. Згідно з другим законом Рауля розчин кристалізується при нижчий температурі порівняно з температурою кристалізації чистого розчинника. Тому у міру додавання до чистого металу А домішок металу В і при додаванні до чистого металу В домішок А буде спостерігатися зниження температури кристалізації суміші. Евтектична точка Е належить обом кривим і відповідає кристалізації евтектичного складу суміші, що кристалізується при найнижчий температурі.
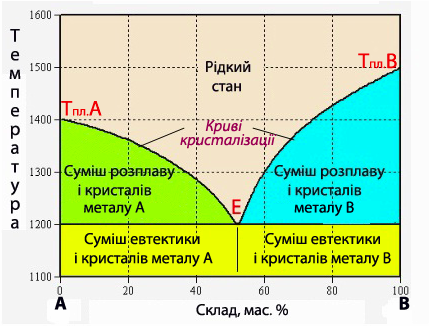
Рисунок 13.18 – Діаграма стану для сплаву металів А і В, нерозчинних один в одному у твердому стані: Е – евтектична точка (рівновага рідкої фази і евтектичної суміші дрібних кристалів)
Як приклад фазової діаграми сплаву, що належить до механічних сумішей, можна навести систему кадмій–вісмут (рис.13.19).
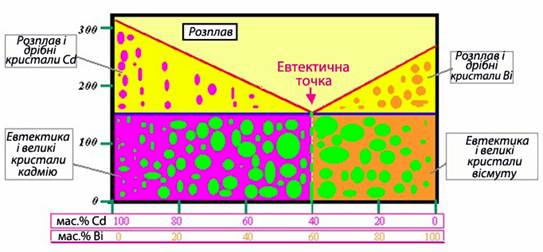
Рисунок 13.19 – Діаграма фазового стану для сплаву металів кадмію та вісмуту
Для евтектичних сплавів характерні однорідність складу, дуже невеликі розміри кристалічних зерен, висока твердіть і механічна міцність. Цими властивостями зумовлюється їх практичне застосування. Наприклад, із евтектичних сплавів Pb-Sb і Pb-Sn виготовляються решітки акумуляторів і друкарські шрифти.
II Тверді розчини – це гомогенні системи, у вузлах кристалічних граток яких розміщуються почергово атоми металів, що входять до складу сплаву і мають необмежену взаємну розчинність як у розплавленому, так і у твердому стані. Тверді розчини подібно до рідких являють собою фази змінного складу, які перебувають у стані термодинамічної рівноваги. Однак, на відміну від рідких, для твердих розчинів притаманні такі ознаки: наявність дальнього порядку, більш сильна взаємодія між частинками і триваліший час досягнення стану рівноваги.
У діаграмі стану для твердого розчину з необмеженою взаємною розчинністю металів на прикладі системи Cu-Ni (рис.13.20) верхня крива лінія, яка називається ліквідус, показує залежність температури початку кристалізації (чи повного розплавлення) від складу системи, а нижня – солідус – залежність температури повного твердіння (чи початку плавлення) від складу системи. Усі точки ліквідуса і солідуса знаходяться між температурами плавлення чистих металів.
Сплав, для якого температури кристалізації та плавлення не збігаються, називається інконгруентний сплав.
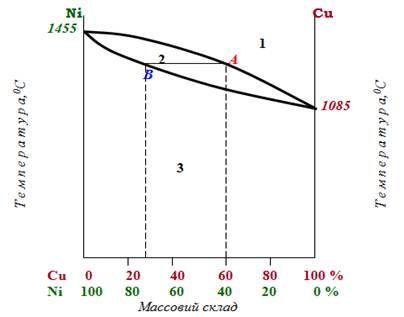
Рисунок 13.20 – Фазова діаграма для системи нікель–мідь як приклад твердого розчину двох металів з необмеженою розчинністю: 1 – рідкий розплав; 2 – система, що кристалізується (чи, навпаки, розплавлюється); 3 – твердий розчин
У складі розплаву в той час, коли він кристалізується, вміст тугоплавкішого металу завжди більше, ніж металу з нижчою температурою плавлення. Наприклад, точка А на кривій ліквідуса відповідає початку кристалізації розплаву, що містить 60% Cu і 40% Ni. У процесі твердіння, поки розплав співіснує з твердим розчином, що утворюється (на діаграмі цьому стану відповідає область між кривими солідуса і ліквідуса), температура залишається незмінною. Однак склад системи поступово змінюється, оскільки рідка фаза збіднюється, а тверда фаза, навпаки, збагачується тугоплавкішим компонентом – нікелем. Після досягнення повної кристалізації (точка В на кривій солідуса) твердий сплав вже містить 30% Cu і 70% Ni.
Якщо розчинність металів обмежена, то залежно від їх кількісного співвідношення можуть утворюватися як механічні суміші з евтектикою включно, так і тверді розчини, які звичайно позначають буквами α і β, як показано на рис.13.21 для системи Cu-Ag.
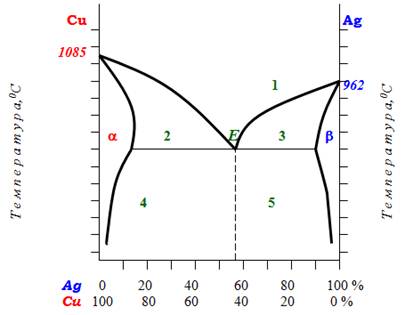
Рисунок 13.21 – Діаграма стану системи Cu-Ag з утворенням твердих розчинів: α – твердий розчин срібла Ag у міді Cu; β – твердий розчин міді Cu у сріблі Ag; Е – евтектична точка; 1 – рідкий розчин; 2 – суміш рідкого розчину і дрібних кристалів Cu; 3 – суміш рідкого розчину і дрібних кристалів Ag; 4 – суміш крупних кристалів Cu і евтектики; 5 – суміш крупних кристалів Ag і евтектики
У твердих розчинах атоми різних металів утворюють єдину спільну кристалічну решітку. Залежно від її особливостей тверді розчини поділяються на такі типи:
- тверді розчини заміщення, в яких атоми металу, що розчиняється у металі-розчиннику, займають вузли кристалічної rратки (рис.13.22а); тверді розчини заміщення утворюються металами, які мають схожу електронну конфігурацію і близькі за розмірами атомних радіусів, наприклад, системи, складені з металів Ag–Au, Ni–Co, Cu–Ni, Mo–W;
- тверді розчини впровадження (або укорінення), в яких компонент, що розчиняється, проникає у пустоти кристалічної гратки металу-розчинника (рис.13.22б); тверді розчини впровадження найчастіше утворюються при розчиненні легких неметалів (C, P, H, O, S, B, N і т.п.) у розплавлених перехідних металах з дефектними d- і f-електронними оболонками.
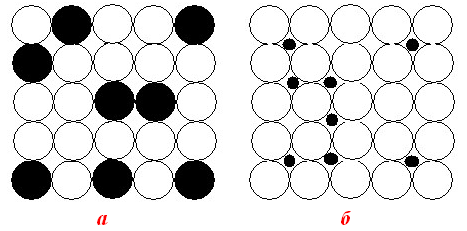
Рисунок 13.22 – Структура твердих розчинів: а) заміщення; б) впровадження
III Інтерметаліди – хімічні сполуки, утворені внаслідок взаємодії між декількома металами. Склад і структура інтерметалідів зумовлені положенням металів-компонентів у періодичній системі, співвідношеннями їх електронегативностей, потенціалів іонізації та атомних радіусів. Найбільш схильні до хімічної взаємодії з іншими металами лужні, лужноземельні, рідкоземельні метали, а також берилій та магній. Вдалося одержати подвійні та потрійні інтерметаліди. Їх склад може бути як сталим, так і змінним, однак він не відповідає класичним уявленням про валентність, наприклад: Na12Ba, Mg17Al12, TiBe12, CaZn10, LaAl4, MgNi2, MgCu2, Mg3Sb2, NixAly, LaxNiy. При цьому деякі метали здатні утворювати декілька інтерметалідів різного складу: AuZn, Au3Zn5, AuZn3.
Кристалічна структура і властивості інтерметаліду суттєво відрізняються від структур і властивостей вихідних металів, із яких він утворений. У спільній кристалічній гратці інтерметалідів атоми кожного із металів займають чітко визначене положення, утворюючи неначе декілька вставлених одна в одну підrраток. При цьому в підrратках може залишатися помітна кількість незайнятих вузлів (вакансій) чи вузлів, в яких знаходяться атоми стороннього елемента. Тому інтерметаліди існують тільки в певній області концентрацій, яка називається область гомогенності. Саме її наявністю пояснюється існування нестехіометричних інтерметалідів – бертолідів.
На діаграмах стану (рис.13.23) крива кристалізації інтерметалідів проходить через дві евтектичні точки, кожна з яких відповідає самому низькоплавкому складу суміші інтерметаліду з одним із металів, а також через максимум, який розташовується в області гомогенності між двома евтектиками и зазначає склад хімічної сполуки, що утворюється. Плавний характер максимуму свідчить про те, що інтерметалід належить до бертолідів (рис.13.23а) і найімовірніше буде розкладатися при плавленні. Якщо інтерметалід має стале, найчастіше цілочислове, співвідношення кількостей атомів компонентів (дальтоніди, рис.13.23б), то на діаграмі склад–властивість з’являється різкий злам – так звана сингулярна точка. Як правило, інтерметаліди цього типу настільки міцні, що продовжують існувати і після розплавлення, у рідкому стані. У тих випадках, коли інтерметалід утворює з металами-компонентами тверді розчини, на діаграмі стану виникають області α і β, які свідчать про наявність твердих розчинів (рис.13.23в).
Більшість інтерметалідів є міцними тільки у твердому стані. Для них характерні хімічна стійкість, крихкість за звичайних температур і виникнення помірної пластичності при температурах, близьких до точки плавлення, а також менші значення теплопровідності та електричної провідності, ніж для вихідних металів. Деякі інтерметаліди мають напівпровідникові властивості.
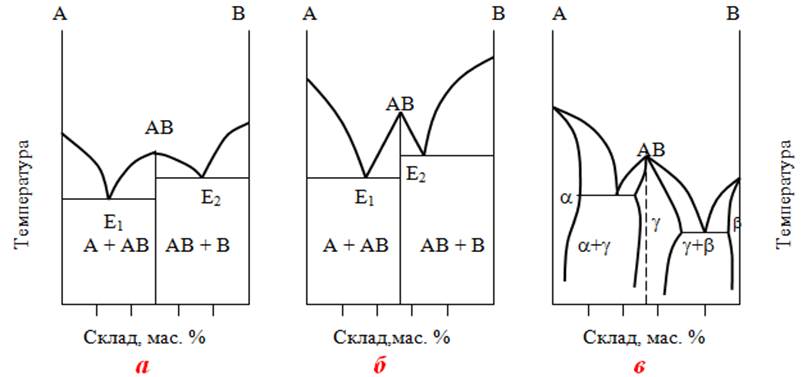
Рисунок 13.23 – Діаграма стану сплавів: а) інтерметалід сталого складу; б) інтерметалід з утворенням твердих розчинів; в)інтерметалід, що не розкладається у розплавленому стані
13.7 Добування металів
Одержання металів є головною метою металургії – однієї з найдавнішніх галузей хімічної промисловості. Світове виробництво металів у даний час досягає міліарда тонн у рік, причому на частку Fe припадає 700 млн. тонн, Cr, Al, Cu, Mn, – ще приблизно по 107 тонн, а виробництво таких металів, як Ni, Zn, Pb, Mo, Mg, Sn, Na, коливається від 105 до 107 тонн. Решту металів добувають у значно меншому обсязі.
Кількість металів, що виробляється, не відповідає ні їх вмісту в земній корі, ні розвіданим запасам, із яких метали практично можуть бути вилучені. Наприклад, загальні світові запаси міді теоретично оцінюються у 1015 тонн, а розвідані – тільки 102 тонн. При збереженні існуючих темпів зростання мідноливарного виробництва розвідані та доступні для добування запаси міді будуть виснажені ще в цьому столітті. Тому з метою економії та збереження природничих ресурсів необхідно терміново впровадити комплекс невідкладних заходів:
- створення економічних технологій переробки сировини;
- розробка принципово нових машин, механізмів і агрегатів з мінімальною металоємністю;
- заміна металів на полімерні, композиційні та керамічні матеріали;
- вторинне використання металів, які відпрацювали свій термін, одержання металів із донних океанічних відкладень, в яких вміст нікелю, кобальту і міді складає близько 30 млрд. тонн.
13.7.1 Збагачення руди
У рудах містяться не тільки металовмісні мінерали, але й пуста порода, яка найчастіше буває представлена тугоплавкими глинами, пісками і вапняками. Тому в процесі виплавлення металу до руди вводять спеціальні добавки – флюси, що утворюють з пустою породою легкоплавкі речовини – шлаки, які накопичуються на поверхні розплаву і час від часу видаляються звідти.
Однак деякі руди настільки забруднені пустою породою, що безпосереднє виплавлення металів із них стає економічно невигідним. У такому випадку руду піддають збагаченню, яке полягає у відділенні від неї пустої породи і одержанні концентрату, що має підвищений вміст рудного мінералу.
Збагачення руди проводять із застосуванням різних способів:
- флотаційний, заснований на різному змочуванні водою поверхонь мінералів і пустої породи; для цього тонкоподрібнену руду обробляють водою з невеликою кількістю флотаційного реагенту-піноутворювача, який посилює змочування рудного мінералу і пустої породи, а потім продувають крізь одержану суспензію стисле повітря, бульбашки якого налипають на частинки з поганою змочуваністю і виносять їх на поверхню (рис.13.24);
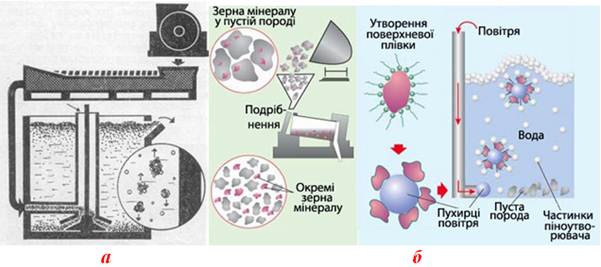
Рисунок 13.24 – Флотаційне збагачення руди: а) флотаційна машина; б) механізм збагачення
- гравітаційний, який базується на відмінності густин і відповідно швидкостей осідання у рідині зерен рудного мінералу і пустої породи;
- магнітний, сутність якого полягає у розділенні мінералів за їх магнітними властивостями. При магнітному збагаченні руду спочатку подрібнюють, потім сортують на магнітному сепараторі (рис.13.25). При цьому пуста порода відразу опускається униз, напівмагнітна фракція на короткий час прилипає до барабану, але дуже швидко під дією відцентрової сили відкидається і падає у бункер, а магнітна – залишається на барабані, звідки її знімають за допомогою спеціальних пристроїв.
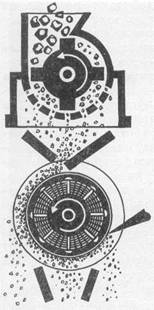
Рисунок 13.25 – Схема магнітного сепаратору
Збагачені руди піддають попередній обробці. При цьому метали із рудних мінералів переводять у сполуки, з яких зручно виділяти метал тим чи іншим способом. Наприклад, сульфідні руди майже неможливо відновити хімічними способами, тому їх спочатку обпалюють до більш активної оксидної форми:
- [TEX]2ZnS+3O_2\rightarrow{2ZnO+2SO_2}[/TEX].
Деякі руди хлорують, оскільки окремі метали утворюють добре розчинні хлориди, які потім відновлюють із розчинів за допомогою певних відновників, найчастіше – більш активними металами. Іноді застосовують гідрометалургійну переробку руди при дії на неї водними розчинами кислот, лугів чи солей, внаслідок чого метали переходять у розчин.
13.7.2 Вилучення металів із руд
Метал у збагаченому рудному концентраті входить до складу хімічних сполук, тобто перебуває в окисненій формі. Для відновлення металів із таких сполук використовують декілька основних методів.
І. Пірометалургійні методи – відновлення металів із безводних сполук за умов високих температур. При цьому відновниками можуть бути як метали (металотермія), так і неметали.
1. У металотермічних процесах для відновлення металів використовують інші, більш активні метали, залежно від природи яких металотермічні методи мають ще і спеціальні назви:
-
алюмотермія – відновлення металів із їх сполук порошкоподібним алюмінієм; алюмотермію найчастіше застосовують для одержання порівняно дорогих металів (V, Cr, Mo, Mn ) із їх оксидів:
- [TEX]Cr_2O_3+2Al\rightarrow{2Cr+Al_2O_3}[/TEX].
-
магнієтермія та натрієтермія – одержання Ti, Zr, Nb, Ta та інших металів із хлоридів чи флуоридів при відновлюванні їх за допомогою магнію чи натрію:
- [TEX]TiCl_4+2Mg\rightarrow{Ti+2MgCl_2}[/TEX],
- [TEX]BeF_2+2Na\rightarrow{Be+2NaF}[/TEX].
2. Відновники-неметали (графіт, вугілля, водень) використовуються при одержанні металів помірної активності: Fe, Cu, Zn, Pb.
Карбон (II) оксид, який утворюється на початковій стадії, у свою чергу, також відновлює метали із їх оксидів:
Як приклад карботермічного процесу можна розглянути добування чавуну (рис.13.26).
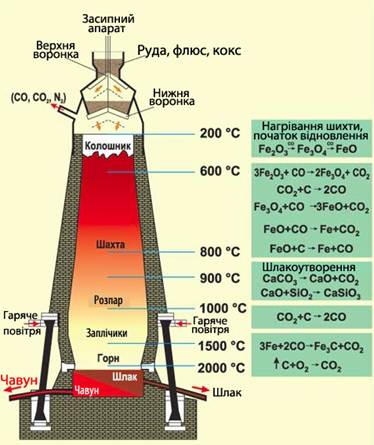
Рисунок 13.26 – Схема виплавки чавуну
-
Карботермія – відновлення металів при високих температурах вуглецем, який звичайно використовують у вигляді коксу
- [TEX]Fe_2O_3+C\rightarrow{2FeO+CO}[/TEX].
- [TEX]Fe_3O_4+CO\rightarrow{3FeO+CO_2}[/TEX],
- [TEX]Fe_2O_3+3CO\rightarrow{2Fe+3CO_2}[/TEX].
-
Водень застосовують у металургії для відновлення деяких кольорових металів, наприклад:
- [TEX]CuO+H_2\rightarrow{Cu+H_2O}[/TEX],
- [TEX]WO_3+3H_2\rightarrow{W+3H_2O}[/TEX].
ІІ. Гідрометалургійні методи – відновлення малоактивних і благородних металів із водних розчинів їх солей, наприклад:
- [TEX]2K[Au(CN)_2]+Zn\rightarrow{Au+K_2[Zn(CN)_4]}[/TEX].
ІІІ. Електрометалургійні методи – відновлення металів при електролізі розплавів чи розчинів їх сполук.
- Електролізом розплавів одержують активні метали, що розміщуються ближче до початку ряду напруг і мають дуже від’ємні значення стандартних електродних потенціалів: Al, Mg, Na, Be, Ca і Li. Для добування найактивніших металів (K, Ba, Rb і Cs), які добре розчиняються у розплавлених солях, електроліз розплавів майже не застосовують. Останнім часом знайдена можливість добування електролізом із розплавів і деяких тугоплавких металів, таких, як W, Mo, Ti, Zr, V, Ta, Nb.
- Електроекстракція – електролітичне виділення металів із розчинів, за допомогою якої одержують головним чином Zn, Cu і Cd.
13.7.3 Одержання чистих металів
Для успішного розвитку багатьох сучасних галузей промисловості часто бувають необхідними особливо чисті метали. За ступенем очищення розрізняють 10 класів металів. Для кожного класу встановлені гранично допустимі кількості (ГДК) тих чи інших домішок, величина яких зазначається у відсотках атомної частки. Наприклад, у цирконії, що використовується як конструкційний матеріал для атомних реакторів, вміст бору, гафнію та кадмію не повинен перебільшувати 10–5-10–6 %. У германію, який застосовується при виготовленні напівпровідників, також допускається не більше 10–6 % фосфору, миш’яку і сурми. А деякі жароміцні сплави для ракетобудування повинні бути повністю очищені навіть від мікроскопічних домішок свинцю і сірки.
Розроблено і впроваджено багато методів очищення металів.
І. Хімічні методи засновані на хімічних реакціях, у результаті яких відбувається виділення металів.
- Карбонільні процеси застосовуються для одержання надчистого заліза, нікелю, марганцю та деяких інших металів. Сутність методу полягає в розкладанні леткої карбонільної сполуки, яку одержують при нагріванні металу в атмосфері карбон (II) оксиду під тиском 20 МПа, причому домішки, наявні у вихідному металі, з карбон (II) оксидом не взаємодіють. Наприклад, залізо і нікель за зазначених умов вступають у реакцію:
[TEX]Ni+4CO\rightarrow{Ni(CO)_4}[/TEX],
[TEX]Fe+5CO\rightarrow{Fe(CO)_5}[/TEX].
Одержані при цьому рідини тетракарбонілнікелю (Ткип = 42оС) і пентакарбонілферуму (Ткип = 105оС) нагрівають до більш високої температури, внаслідок чого відбувається їх розкладання та виділення надчистого металу
[TEX]Ni(CO)_4\rightarrow{Ni+4CO}[/TEX],
[TEX]Fe(CO)_5\rightarrow{Fe+5CO}[/TEX].
-
Йодидний спосіб базується на термічному розкладі летких сполук, які легко відділяються від домішок. У такий спосіб одержують цирконій, титан і гафній високого ступеня чистоти. Для цього грубо очищений метал, подрібнений до порошкоподібного стану, нагрівають з йодом при 100-200оС у герметичному апараті. Наприклад, у випадку титану утворюється леткий титан (IV) йодид:
- [TEX]Ti_{(забруднений)}+2I_2\rightarrow{TiI_{4(рідкий)}}[/TEX],
-
який потім при наступному нагріванні до 1200-1300оС розкладається:
- [TEX]TiI_{4(рідкий)}\rightarrow{Ti_{(очищений)}+2I_2}[/TEX].
ІІ. Фізико-хімічні методи включають декілька різних способів очищення металів.
- Електролітичне рафінування використовується для очищення забруднених металів – міді, срібла, золота, нікелю, свинцю та олова. Пластини, відлиті із металу, який необхідно піддати очищенню, поміщають в електролізер як анод. При пропусканні електричного струму анод поступово розчиняється і переходить у розчин у вигляді позитивно заряджених йонів – катіонів. Катіони переміщуються до катода – тонкої пластини чи стержня із чистого металу і відновлюється на ньому. Домішки більш активних металів, які мають менше значення стандартного електродного потенціалу, розчиняються разом із основним металом, однак на катоді не відновлюються, а накопичуються в електроліті, який періодично оновлюють. Менш активні домішки, які мають більше значення стандартного електродного потенціалу, не піддаються анодному розчиненню, тому в ході процесу осідають на дно, утворюючи шлам, який час від часу видаляють із електролізера.
- Перегонка у вакуумі (дистиляційний метод) базується на різниці у леткості розплавленого металу і домішок. Забруднений метал розплавляють у спеціальному апараті, з якого постійно відкачують повітря, щоб уникнути окиснення металу і знизити температуру плавлення. У процесі перегонки на вузлах апарата, які весь час охолоджуються, відбувається конденсація більш леткого компонента – домішок чи металу.
- Кристалізаційний метод, або зонне плавлення, засновується на різній розчинності домішок у твердому і розплавленому металі. Метод полягає у повільному пересуванні зони високотемпературного нагрівання вздовж стержня чи бруска, відлитого із забрудненого металу. У міру переміщення металу в ньому утворюється вузька розплавлена полоса, яка рухається у протилежному напрямку. Біля передньої межі зони нагрівання відбувається плавлення металу, а біля задньої – його кристалізація. Одні домішки, концентруючись у розплавленій зоні, зміщуються разом із нею до кінця бруска, а інші залишаються поза зоною нагрівання та накопичуються на початковій частині бруска, де проходить кристалізація. При неодноразовому повторюванні процесу всі домішки поступово збираються на обох кінцях бруска, а середня його частина стає найбільш чистою.
Очищені метали відрізняються від забруднених за своїми фізико-хімічними властивостями. Вони мають кращу пластичність, більш високу електричну провідність, теплопровідність та інші характеристики.



