- 6.1. Тепловые эффекты химических реакций
- Закон Гесса
- 2.3. Термохимические расчёты
- 6.4. Зависимость теплового эффекта реакции от температуры
Ключові терміни:
закон Гесса, стандартное состояние, тепловой эффект, уравнение Кирхгофа, энтальпия образования, энтальпия сгорания6.1. Тепловые эффекты химических реакций
Термохимией называется раздел химической термодинамики, в котором рассматривается применение первого закона для вычисления тепловых эффектов различных физико-химических процессов: химических реакций, фазовых переходов, процессов кристаллизации, растворения и др. Для практики наибольший интерес имеют термохимические расчёты тепловых эффектов химических реакций.
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется (экзотермические реакций) или поглощается (эндотермические реакции) при необратимом протекании реакции, когда единственной работой является только работа расширения.
Следовательно, для химических реакций справедливо соотношение первого закона термодинамики
- [TEX]\delta{Q}=dU+PdV[/TEX],(6.1)
- здесь [TEX]Q[/TEX] - тепловой эффект химической реакции,
- [TEX]\delta{A}=PdV[/TEX] - работа, совершаемая системой в ходе реакции.
Тепловой эффект химической реакции, протекающей при постоянном объёме, называется изохорическим тепловым эффектом и обозначается [TEX]Q_{V} [/TEX]. Так как в этом случае [TEX] PdV=0[/TEX], то
- [TEX]Q_{V}=U_{2}-U_{1}=\Delta{U}[/TEX](6.2)
Следовательно, тепловой эффект химической реакции, протекающей при постоянном объёме, равен изменению внутренней энергии системы.
Изобарический тепловой эффект реакции [TEX]\left(Q_{P}\right) [/TEX] можно найти, интегрируя уравнение (6.1):
- [TEX]Q_{P}=\Delta U+\int_{V_{1}}^{V_{2}}PdV=U_{2}-U_{1}+PV_{2}-PV_{1}=H_{2}-H_{1}[/TEX]
- [TEX]Q_{P}=\Delta{H}.[/TEX](6.3)
Изобарический тепловой эффект химической реакции равен изменению энтальпии системы.
Таким образом, изохорический и изобарический тепловые эффекты равны изменениям функций состояния. Следовательно, они не зависят от пути процесса, а определяются только начальным и конечным состояниями системы. Независимость тепловых эффектов реакций от их пути была установлена русским учёным академиком Г.И. Гессом в 1840 году на основании экспериментальных данных.
Закон Гесса
Закон Гесса устанавливает, что если из данных исходных веществ можно различными путями получить заданные конечные продукты, то независимо от пути получения, т.е. от числа и вида промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же.
Другими словами, тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути перехода.
Уясним смысл закона Гесса на примерах. Так как чаще всего химические реакции протекают при постоянном давлении, будем их тепловой эффект характеризовать изменением энтальпии [TEX]\Delta{H}[/TEX]. Представим себе процесс превращения исходных веществ [TEX]A_{1}[/TEX],[TEX]A_{2}[/TEX],[TEX]A_{3}[/TEX] ... в продукты ,[TEX]B_{1}[/TEX],[TEX]B_{2}[/TEX],[TEX]B_{3}[/TEX]... причём превращение это может быть совершено различными путями:
- Прямой реакцией превращения веществ А в вещества В с тепловым эффектом [TEX]\Delta{H_{1}}[/TEX].
- Реакцией, состоящей из двух стадий с тепловыми эффектами [TEX]\Delta{H_{2}}[/TEX]и[TEX]\Delta{H_{3}}[/TEX] .
- Совокупностью реакций с тепловыми эффектами [TEX]\Delta{H_{4}}[/TEX],[TEX]\Delta{H_{5}}[/TEX],[TEX]\Delta{H_{6}}[/TEX],[TEX]\Delta{H_{7}}[/TEX].
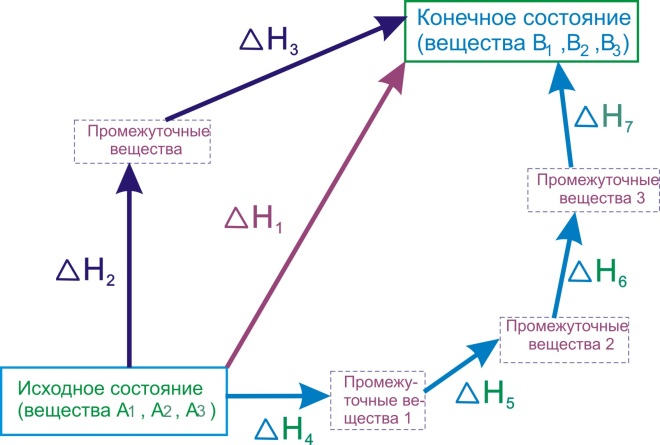
Рисунок 6.1 - Иллюстрация закона Гесса
Закон Гесса утверждает, что эти тепловые эффекты связаны между собой соотношением:
- [TEX]\Delta{H_{1}}=\Delta{H_{2}}+\Delta{H_{3}}=\Delta{H_{4}}+\Delta{H_{5}}+\Delta{H_{6}}+\Delta{H_{7}}[/TEX]
Практическое значение закона Гесса состоит в том, что он позволяет вычислить тепловые эффекты таких реакций, для которых они непосредственно не могут быть измерены. Например, тепловой эффект[TEX]\Delta H_{x} [/TEX]реакции [TEX]C+1/2 O_{2}=CO[/TEX]нельзя определить непосредственным измерением, так как одновременно с этой реакцией всегда имеет место реакция образования[TEX]CO_{2} [/TEX]. Для определения[TEX]\Delta{H_{x}} [/TEX]используем тепловые эффекты следующих реакций:
- [TEX]CO+1/2O_{2}=CO_{2}[/TEX][TEX]\Delta{H_{1}}=-282,98к{Д}ж/моль[/TEX]
- [TEX]C+O_{2}=CO_{2}[/TEX][TEX]\Delta{H_{2}}=-393,51к{Д}ж/моль[/TEX]
В соответствии с законом Гесса
- [TEX]\Delta{H}_{2}=\Delta{H}_{1}+\Delta{H}_{x}[/TEX]или[TEX]\Delta{H}_{x}=\Delta{H}_{2}-\Delta{H}_{1}=-393,51-(-282,98)=-110,53к{Д}ж/моль.[/TEX]
Тепловые эффекты химических реакций могут быть измерены и экспериментально в специальных приборах, называемых калориметрами. Точные калориметрические измерения достаточно трудоёмки и требуют много времени. Поэтому их проводят только в случае невозможности использования закона Гесса.
При написании термохимических уравнений реакций указывают агрегатное состояние реагентов и тепловой эффект реакции :
[TEX]C_{3}H_{6}O_{2(г)}+4O_{2(г)}=3CO_{2(г)}+3H_{2}O_{(ж)}[/TEX],[TEX]\Delta{H}=-1817,0к{Д}ж/моль.[/TEX]
Такая запись означает, что при реакции 1 моль газообразного ацетона[TEX]C_{3}H_{6}O[/TEX] с 4 моль газообразного кислорода получается 3 моль газообразного [TEX]CO_{2}[/TEX]и 3 моль жидкой воды. При этом выделяется 1817,0 кДж теплоты на 1 моль ацетона.
Так как тепловые эффекты зависят от физического состояния реагирующих веществ и условий, при которых протекает реакция, то для проведения термохимических расчётов, тепловые эффекты, вводимые в термохимические уравнения, должны быть отнесены к каким-то одинаковым условиям, в противном случае они несопоставимы. За такие условия принимают условия, при которых реакция осуществляется между веществами, находящимися в стандартных состояниях.
За стандартное состояние индивидуальных жидких и твёрдых веществ принимают их устойчивое состояние при температуре 298,15 К ([TEX]25{^{\circ }}C;[/TEX]) и давлений 101325 Па, а для газов - такое их состояние, когда при давлении 101325 Па и температуре 298,15 К они подчиняются уравнению состояния идеального газа. Поэтому, тепловые эффекты реакций при стандартных условиях обозначают[TEX]\Delta{U}_{298}^0[/TEX]и[TEX]\Delta{H}_{298}^0[/TEX].
Из закона Гесса вытекают следствия, имеющие большое практическое значение.
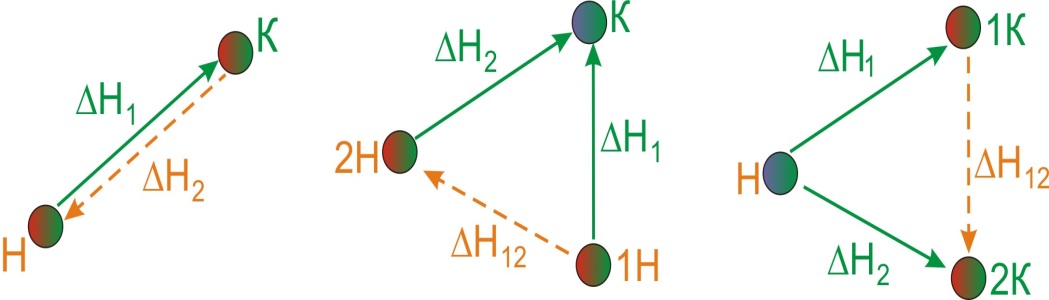 |
||
| а | б | в |
Рисунок 6.2 - Иллюстрация первого (а), второго (б) и третьего (в) следствий из закона Гесса.
- Тепловой эффект прямой реакции[TEX]\Delta{H_1}[/TEX]равен по величине и противоположен по знаку тепловому эффекту обратной реакции[TEX]\Delta{H_1}[/TEX], т.е.[TEX]\Delta{H_1}=-\Delta{H_2}[/TEX](рис. 6.2,а).
-
Если совершаются две реакции, приводящие из различных начальных состояний к одинаковому конечному состоянию, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое (рис. 6.2,б).
Рассмотрим классический пример определения теплового эффекта превращения графита в алмаз при стандартных условиях путём анализа реакций их горения:
[TEX]С_{(графит)}+O_{2}=CO_{2}[/TEX][TEX]\Delta{H}=-393,51к{Д}ж/моль[/TEX]
[TEX]С_{(алмаз)}+O_{2}=CO_{2}[/TEX][TEX]\Delta{H}=-395,34к{Д}ж/моль[/TEX]
[TEX]С_{(графит)}\rightarrow С_{(алмаз)}[/TEX][TEX]\Delta{H}=+1,83к{Д}ж/моль[/TEX]
- Если совершаются две реакции, приводящие из одного начального состояния к различным конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое (рис. 6.2,в).
В качестве примера приведём реакцию горения водорода с образованием одного моля воды:
[TEX]H_{2}+1/2O_{2}=H_{2}O_{(г)}[/TEX][TEX]\Delta{H}=-241,83к{Д}ж/моль[/TEX]
[TEX]H_{2}+1/2O_{2}=H_{2}O_{(ж)}[/TEX][TEX]\Delta{H}=-285,84к{Д}ж/моль[/TEX]
[TEX]H_{2}+1/2O_{2}=H_{2}O_{(т)}[/TEX][TEX]\Delta{H}=-291,67к{Д}ж/моль[/TEX].
Следовательно,
- [TEX]H_{2}O_{(т)}\rightarrow H_{2}O_{(ж)}[/TEX] [TEX]\Delta{H}=+5,83к{Д}ж/моль[/TEX]
- [TEX]H_{2}O_{(ж)}\rightarrow H_{2}O_{(г)}[/TEX] [TEX]\Delta{H}=+44,01к{Д}ж/моль[/TEX]
- [TEX]H_{2}O_{(т)}\rightarrow H_{2}O_{(г)}[/TEX] [TEX]\Delta{H}=+49,84к{Д}ж/моль[/TEX].
Мы получим значения энтальпий плавления, испарения и сублимации воды.
2.3. Термохимические расчёты
Закон Гесса позволяет вычислять тепловые эффекты процессов, для которых отсутствуют экспериментальные данные. Это относится не только к химическим реакциям, но и к процессам растворения, испарения, сублимации, кристаллизации и др. При термохимических расчётах особое значение имеют два вида тепловых эффектов: энтальпии образования и энтальпии сгорания соединений.
Энтальпия образования соединения есть тепловой эффект реакции образования одного моля данного соединения из простых веществ при стандартных условиях. Например, стандартная энтальпия образования [TEX]\Delta_{f}H[/TEX] карбоната кальция - это тепловой эффект реакции
- [TEX]Ca_{т}+C_{(графит)}+3/2CO_{2(г)}=CaCO_{3(т)}[/TEX][TEX]\Delta_{f}H=-1206к{Д}ж[/TEX]
При этом стандартные энтальпии образования простых веществ (Н2,[TEX]O_{2}[/TEX], Ca, C и др.) принимаются равными нулю, стандартные энтальпии образования большинства известных веществ можно найти в справочниках.
По очень небольшому числу стандартных энтальпий образования можно вычислить тепловые эффекты многих химических реакций. При этом пользуются правилом, которое вытекает из закона Гесса:
Пусть химическая реакция протекает в соответствии с уравнением
- [TEX]aA+bB=cC+dD[/TEX] [TEX]\Delta{H}-?[/TEX]
Здесь a, b, c, d - коэффициенты перед веществами A, B, C и D. Тогда
- [TEX]\Delta{Н}=(с\Delta_{f}Н_{C}+d\Delta_{f}Н_{D})-(a\Delta_{f}Н_{A}+b\Delta_{f}Н_{B}).[/TEX](6.4)
Для наглядности рассмотрим конкретный пример. Реакция горения этана [TEX]C_{2}H_{6}[/TEX] выражается термохимическим уравнением:
- [TEX]C_{2}H_{6(г)}+3CO_{2(г)}=2CO_{2(г)}+3H_{2}O_{(ж)}[/TEX] [TEX]\Delta{H}_{298}=-1559,87к{Д}ж/моль[/TEX]
Вычислить энтальпию образования этана, если известны энтальпии образования углекислого газа и воды:
- [TEX]\Delta_{f}H_{298}(CO_{2})=-393,51к{Д}ж/моль[/TEX], [TEX]\Delta_{f}H_{298}(H_{2}O)=-285,84к{Д}ж/моль.[/TEX]
В соответствии с законом Гесса имеем:
- [TEX]\Delta Н_{298}=2\Delta_{f}Н(СО_{2})+3\Delta_{f}Н(Н_{2}О)-\Delta_{f}Н(С_{2}Н_{6})[/TEX]. Отсюда
- [TEX]\Delta_{f}Н_{298}(С_2Н_6)=2\Delta_{f}Н_{298}(СО_2)+3\Delta_{f}Н_{298}(Н_2О)-\Delta{Н_{298}}=2(-393,51)+3(-285,84)-(-1559,87)=-84,67к{Д}ж/моль.[/TEX]
Энтальпией сгорания соединения называют тепловой эффект реакции окисления данного соединения кислородом при стандартных условиях с образованием высших оксидов входящих в это соединение элементов. Например, стандартная энтальпия сгорания [TEX]\Delta_CH[/TEX] этилового спирта - это тепловой эффект реакции
- [TEX]C_2H_5OH_{(ж)}+3O_2=2CO_{2(г)}+3H_2O_{(ж)}[/TEX]
Продуктами сгорания чаще всего являются[TEX]CO_2[/TEX],[TEX]H_2O_{(г)}[/TEX]или[TEX]H_2O_{(ж)}[/TEX],[TEX]SO_3[/TEX]и другие. Если среди продуктов реакции помимо оксидов присутствуют другие вещества (например,[TEX]N_2[/TEX],[TEX]HCl[/TEX]),это специально оговаривается. Энтальпии сгорания высших оксидов и других продуктов сгорания, а также кислорода, принимаются равными нулю. С помощью энтальпий сгорания можно также рассчитывать тепловые эффекты химических реакций, пользуясь следующим правилом:
Для приведённой в данном разделе абстрактной реакции
- [TEX]\Delta{H}=(a\Delta_CH_A+b\Delta_CH_B)-(c\Delta_CH_C+d\Delta_CH_D)[/TEX](6.5)
Рассчитаем тепловой эффект реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению
- [TEX](COOH)_{2(т)}+2CH_3OH_{(ж)}=(COOCH_3)_{2(ж)}+2H_2O_{(ж)}[/TEX]
В справочнике находим значения энтальпий сгорания веществ:
- [TEX]\Delta_CH_{(COOH)_2}=-251,8к{Д}ж/моль[/TEX], [TEX]\Delta_CH_{CH_3OH}=-727,6к{Д}ж/моль[/TEX],
- [TEX]\Delta_CH_{(COOCH_3)_2}=-1680,2к{Д}ж/моль[/TEX], [TEX]\Delta_CH_{H_2O}=0[/TEX].
- Отсюда [TEX]\Delta{H}=-251,8+2(-726,6)-(-1680,2)=-26,8к{Д}ж/моль.[/TEX]
6.4. Зависимость теплового эффекта реакции от температуры
Рассмотрим химическую реакцию
- [TEX]nN+mM=kK+dD[/TEX]
Тепловой эффект этой реакции при постоянном давлении[TEX]\Delta{H}[/TEX]равен разности энтальпий образования продуктов реакции и исходных веществ:
- [TEX]\Delta{H}=[k\Delta{H}(K)+d\Delta{H}(D)]-[n\Delta{N}+m\Delta{M}].[/TEX](6.6)
Дифференцируя это равенство по температуре Т, получим
- [TEX]\frac{\partial{\Delta{H}}}{\partial{T}}=[k\frac{\partial{\Delta{H(K)}}}{\partial{T}}+d\frac{\partial{\Delta{H(D)}}}{\partial{T}}]-[n\frac{\partial{\Delta{H(N)}}}{\partial{T}}+m\frac{\partial{\Delta{H(M)}}}{\partial{T}}].[/TEX](6.7)
Учитывая, что
- [TEX]\partial{H}/\partial{T}=C_{p},[/TEX](6.8)
имеем
- [TEX](\partial{\Delta{H}}/\partial{T})_P=[k{C_P(K)}+d{C_P(D)}]-[n{C_P(N)}+m{C_P(M)}].[/TEX](6.9)
Обозначая[TEX]\Delta{C_p}[/TEX]разность теплоёмкостей конечных и исходных веществ, взятых с соответствующими коэффициентами, получаем
- [TEX](\partial{\Delta}{H}/\partial{T})_P=\Delta{C}_{P}[/TEX](6.10)
Рассматривая реакцию, протекающую при постоянном объёме, можно аналогичным образом получить
- [TEX](\partial{\Delta}{U}/\partial{T})_V=\Delta{C}_{V}[/TEX](6.11)
Найденные соотношения представляют собой уравнения Кирхгофа в дифференциальной форме. Решим первое из этих уравнений (решения обоих уравнений одинаковы). Разделяем переменные и интегрируем по температуре
- [TEX]\int_{Т_1}^{Т_2}{d\Delta{H}}=\int_{T_1}^{T_2}{\Delta{C_PdT}}[/TEX](6.12)
Получаем
- [TEX]\Delta{H_{T_2}}-\Delta{H_{T_1}}=\int_{T_1}^{T_2}{\Delta{C_PdT}}[/TEX]или
- [TEX]\Delta{H_{T_2}}=\Delta{H_{T_1}}+\int_{T_1}^{T_2}{\Delta{C_PdT}}[/TEX](6.13)
Для расчёта[TEX]\Delta{H_{T_2}}[/TEX]- теплового эффекта при температуре[TEX]T_2[/TEX]- надо знать[TEX]\Delta{H_{T_1}}[/TEX]и иметь данные по теплоёмкостям всех участников реакции в интервале температур от>[TEX]T_1[/TEX]до[TEX]T_2[/TEX].
В качестве температуры[TEX]T_1[/TEX]удобно принять температуру 298 К, т.к. для этой температуры имеется большое количество справочных данных. В таком случае можно записать
- [TEX]\Delta{H_T}=\Delta{H_{298}}+\int_{T_1}^{T_2}{\Delta{C_PdT}}[/TEX](6.14)
Полученное в интегральной форме уравнение Кирхгофа позволяет рассчитывать тепловые эффекты реакций при различных температурах. В зависимости от того, какие данные по теплоёмкостям имеются в справочной литературе, полученное уравнение применяют, используя три приближения.
В первом, наиболее грубом приближении, полагают[TEX]\Delta{C_P}=0[/TEX]. В этом случае оказывается, что[TEX]\Delta{H_T}=\Delta{H_{298}}[/TEX], т.е. тепловой эффект от температуры не зависит.
Во втором, более точном приближении, считают разность теплоёмкостей постоянной величиной -[TEX]\Delta{C_P}=const [/TEX]. Поэтому получают
- [TEX]\Delta{H_T}=\Delta{H_{298}}+\Delta{C_P}(T-298)[/TEX](6.15)
В третьем, наиболее точном приближении, учитывают зависимость теплоёмкости от температуры. Как уже упоминалось в данном курсе наиболее точно зависимость теплоёмкости от температуры можно описать степенной функцией типа[TEX]\Delta{C_P}=a+bT+cT^{2}+c`/T^{2}[/TEX]. Если известны коэффициенты этого уравнения для всех участников реакции, то
- [TEX]\Delta{C_P}=\Delta{a}+\Delta{b}T+\Delta{c}T^{2}+\Delta{c'}/T^{2}[/TEX](6.16)
где
- [TEX]\Delta{a}=[k\cdot{a(K)}+d\cdot{a(D)}]-[n\cdot{a(N)}+m\cdot{a(M)}][/TEX](6.17)
Аналогично рассчитываются[TEX]\Delta{b}[/TEX],[TEX]\Delta{c}[/TEX],[TEX]\Delta{c'}[/TEX]. Решение уравнения Кирхгофа приводит в этом случае к соотношению
- [TEX]\Delta{H_T}=\Delta{H_{298}}+\Delta{a(T-298)}+\frac{\Delta{b}}{2}(T^2-298^{2})+\frac{\Delta{c}}{3}(T^3-298^{3})-\Delta{c'(\frac{1}{T}-\frac{1}{298})}[/TEX](6.18)
Для термохимических расчётов необходимы табличные данные. В табл.6.1 приведены некоторые термодинамические свойства небольшого количества химических веществ.
Расчеты по формуле 6.18 рассмотрим на примере реакции [TEX]C_6H_6(г)+3H_2=C_6H_{12}(г)[/TEX] для T=800K
Сначала вычислим[TEX]\Delta{H_{298}^0}[/TEX]. Для проведения расчёта в табл.6.1 необходимо взять энтальпии образования всех веществ и подставить их в формулу (6.4).
- [TEX]\Delta{H_{298}^0}=\Delta_fH_{298}^0(C_6H_{12})-[\Delta_fH_{298}^0(C_6H_6)+3\Delta_fH_{298}^0(H_2)]=-123,14-(82,93+3\cdot{0})=-206,07к{Д}ж/моль=-206070{Д}ж/моль[/TEX]
Интегральное уравнение Кирхгофа для температуры 800 К имеет вид:
- [TEX]\Delta{H_{800}}=\Delta{H_{298}^0}+\Delta{a}(800-298)+\Delta{b/2}(800^2-298^2)+\Delta{c/3}(800^3-298^3)-\Delta{c'}(1/800-1/298)[/TEX]
[TEX]\Delta{a}[/TEX],[TEX]\Delta{b}[/TEX],[TEX]\Delta{c}[/TEX]и[TEX]\Delta{c'}[/TEX]следует рассчитать по закону Гесса, т.е. из значения соответствующей величины для продуктов реакции нужно вычесть значение этой же величины для исходных веществ. Данные для такого расчёта берём в таблице 6.1. Например, расчёт[TEX]\Delta{a}[/TEX]проводим так:
- [TEX]\Delta{a}=a(C_6H_{12})-[a(C_6H_6)+3a(H_2)]=-51,71-[-21,09+3\cdot{27,28}]=-112,46к{Д}ж/моль[/TEX]
При расчёте[TEX]\Delta{b}[/TEX],[TEX]\Delta{c}[/TEX],[TEX]\Delta{c'}[/TEX]следует обращать внимание на то, что в табл. 6.1 значения[TEX]b[/TEX],[TEX]c[/TEX]и[TEX]c'[/TEX]умножены на величину[TEX]10^{-x}(10^{+x})[/TEX]. Реальные значения этих величин должны быть умножены на [TEX]10^{+x}(10^{-x})[/TEX]
Таблица 6.1 – Термодинамические свойства веществ.
| Вещество | [TEX]\Delta_f{H_{298}^0}, к{Д}ж/моль[/TEX] |
[TEX]S_{298}^0, к{Д}ж/моль[/TEX] |
[TEX]C_{p 298}^0, к{Д}ж/моль[/TEX] |
[TEX]C_p=f(T),к{Д}ж/моль[/TEX] | |||
| a | [TEX]b\times{10^3}[/TEX] | [TEX]c'\times{10^{-5}}[/TEX] | [TEX]c\times{10^6}[/TEX] | ||||
| [TEX]Br_2(ж)[/TEX] | 0 | 152,21 | 75,69 | 75,69 | 0 | 0 | 0 |
| [TEX]Br_2(г)[/TEX] | 30,91 | 245,37 | 36,07 | 37,32 | 0,50 | -1,26 | 0 |
| [TEX]C(алмаз)[/TEX] | 1,83 | 2,37 | 6,11 | 9,12 | 13,22 | -6,19 | 0 |
| [TEX]С(графит)[/TEX] | 0 | 5,74 | 8,54 | 16,86 | 4,77 | -8,54 | 0 |
| [TEX]Cl_2(г)[/TEX] | 0 | 222,98 | 33,93 | 37,03 | 0,67 | -2,85 | 0 |
| [TEX]H_2(г)[/TEX] | 0 | 130,52 | 28,83 | 27,28 | 3,26 | 0,50 | 0 |
| [TEX]N_2(г)[/TEX] | 0 | 191,50 | 29,12 | 27,88 | 4,27 | 0 | 0 |
| [TEX]O_2(г)[/TEX] | 0 | 205,04 | 29,37 | 31,46 | 3,39 | -3,77 | 0 |
| [TEX]S(монокл)[/TEX] | 0,38 | 32,55 | 23,64 | 23,64 | 0 | 0 | 0 |
| [TEX]S(ромбич)[/TEX] | 0 | 31,92 | 22,68 | 22,68 | 0 | 0 | 0 |
| [TEX]S_2(г)[/TEX] | 128,37 | 228,03 | 32,51 | 36,11 | 1,09 | -3,51 | 0 |
| [TEX]CO(г)[/TEX] | -110,53 | 197,55 | 29,14 | 28,41 | 4,10 | -0,46 | 0 |
| [TEX]CO_2(г)[/TEX] | -393,51 | 213,66 | 37,11 | 44,14 | 9,04 | -8,54 | 0 |
| [TEX]COCl_2(г)[/TEX] | -219,50 | 283,64 | 57,76 | 67,15 | 12,03 | -9,04 | 0 |
| [TEX]CaCo_3(т) [/TEX] | -1206,83 | 91,71 | 83,47 | 104,52 | 21,92 | -25,94 | 0 |
| [TEX]CaO(т)[/TEX] | -635,09 | 38,07 | 42,05 | 49,62 | 4,52 | -6,95 | 0 |
| [TEX]Ca(OH)_2(г)[/TEX] | -985,12 | 83,39 | 87,49 | 105,19 | 12,01 | -19,00 | 0 |
| [TEX]HCl(г)[/TEX] | -92,31 | 186,79 | 29,14 | 26,53 | 4,60 | 1,09 | 0 |
| [TEX]H_2O(т)[/TEX] | -291,85 | 39,33 | 0 | 4,41 | 109,50 | 46,47 | 0 |
| [TEX]H_2O(ж) [/TEX] | -285,83 | 69,95 | 75,30 | 39,02 | 76,64 | 11,96 | 0 |
| [TEX]H_2O(г)[/TEX] | -241,81 | 188,72 | 33,61 | 30,00 | 10,71 | 0,33 | 0 |
| [TEX]MgO(т)[/TEX] | -601,49 | 27,07 | 37,20 | 48,98 | 3,14 | -11,44 | 0 |
| [TEX]Mg(OH)_2(т)[/TEX] | -924,66 | 63,18 | 76,99 | 46,99 | 102,85 | 0 | 0 |
| [TEX]NH_3(г)[/TEX] | –45,94 | 192,66 | 35,16 | 29,80 | 25,48 | -1,67 | 0 |
| [TEX]NH_4Cl(т)[/TEX] | –314,22 | 95,81 | 84,10 | 0 | 0 | 0 | 0 |
| [TEX]NO(г)[/TEX] | 91,26 | 210,64 | 29,86 | 29,58 | 3,85 | –0,59 | 0 |
| [TEX]NOCl(г)[/TEX] | 52,59 | 263,50 | 39,37 | 44,89 | 7,70 | –6,95 | 0 |
| [TEX]NO_2(г)[/TEX] | 34,19 | 240,06 | 36,66 | 41,16 | 11,33 | –7,02 | 0 |
| [TEX]N_2O_4(г)[/TEX] | 11,11 | 304,35 | 79,16 | 83,89 | 39,75 | –14,90 | 0 |
| [TEX]SO_2(г)[/TEX] | –296,90 | 248,07 | 39,87 | 46,19 | 7,87 | –7,70 | 0 |
| [TEX]SO_2Cl_2(г)[/TEX] | –363,17 | 311,29 | 77,40 | 87,91 | 16,15 | -14,23 | 0 |
| [TEX]SO_3(г)[/TEX] | –395,85 | 256,69 | 50,09 | 64,98 | 11,75 | -16,37 | 0 |
| [TEX]CH_4(г)[/TEX] | –74,85 | 186,27 | 35,71 | 14,32 | 74,66 | 0 | -17,43 |
| [TEX]C_2H_4(г)[/TEX] | 52,30 | 219,45 | 43,56 | 11,32 | 122,01 | 0 | -37,90 |
| [TEX]C_2H_6(г)[/TEX] | –84,67 | 229,49 | 52,64 | 5,75 | 175,11 | 0 | -57,85 |
| [TEX]C_6H_6(г)[/TEX] | 82,93 | 269,20 | 81,67 | -21,09 | 400,12 | 0 | -169,87 |
| [TEX]C_6H_12(г)[/TEX] | -123,14 | 298,24 | 106,27 | -51,71 | 598,77 | 0 | -230,00 |
| [TEX]CH_3OH(г)[/TEX] | –201,00 | 239,76 | 44,13 | 15,28 | 105,20 | 0 | -31,04 |
| [TEX]CH_3CHO(г)[/TEX] | –166,00 | 264,20 | 54,64 | 13,00 | 153,50 | 0 | -53,70 |
| [TEX]C_2H_5OH(г)[/TEX] | –234,80 | 281,38 | 65,75 | 10,99 | 204,70 | 0 | -74,20 |
| [TEX]C_2H_5OH(ж)[/TEX] | –276,98 | 160,67 | 111,96 | 0 | 0 | 0 | 0 |
Результаты расчётов:
| [TEX]\Delta{a}[/TEX] | [TEX]\Delta{b}[/TEX] | [TEX]\Delta{c'}[/TEX] | [TEX]\Delta{c}[/TEX] | [TEX]\Delta{H_{800}},{Д}ж/моль[/TEX] |
| [TEX]-112,46[/TEX] | [TEX]188,87\cdot{10^3}[/TEX] | [TEX]-1,50\cdot{10^5}[/TEX] | [TEX]-60,13\cdot{10^{-6}}[/TEX] | [TEX]-220520[/TEX] |



